锌含量的测定方法
锌粉—金属锌的测定EDTA 滴定法

FCL YSZn0004锌粉金属锌的测定EDTA 滴定法F_CL_YS_Zn_0004锌粉—金属锌的测定EDTA 滴定法1范围本方法适用于锌粉中90%~99%的金属锌含量的测定。
2原理试样用盐酸、氢氟酸溶解,在pH5~6乙酸-乙酸钠缓冲溶液中,以二甲酚橙为指示剂,用EDTA 标准滴定溶液直接滴定锌。
由所消耗的EDTA 标准滴定溶液的体积计算锌的含量。
3试剂3.1抗坏血酸。
3.2盐酸,?C约1.19g/mL 。
3.3盐酸,1+1。
3.4氨水,?5约0.90g/mL 。
3.5氨水,1+1。
3.6过氧化氢,质量分数约30%。
3.7硫代硫酸钠溶液,100g/L 。
3.8氟化钾溶液,200g/L 。
3.9乙酸-乙酸钠缓冲溶液,pH5~6称取180g 无水乙酸钠,溶解于200mL 水中,加入15mL 冰乙酸,用水稀至1000mL ,混匀。
3.10甲基橙指示剂,1g/L 。
3.11二甲酚橙指示剂溶液,5g/L 。
3.12EDTA 标准滴定溶液,0.5mol/L3.12.1配制称取18.6gEDTA 溶于少量水中,用水移入1000mL 容量瓶中并稀释至刻度,混匀。
放置三天后标定。
3.12.2标定称取三份0.1000g 金属锌(质量分数≥99.99%,预先用酸洗去表面氧化物,水洗净,低温干燥1h)于500mL 烧杯中,缓缓加入10mL 盐酸(1+1),盖上表皿,低温加热至完全溶解。
冷却后,稀释至50mL 左右,加入1滴甲基橙指示剂(1g/L ),用氨水(1+1)和盐酸(1+1)调节至溶液为红色,再加入10mL 乙酸乙酸钠缓冲溶液,加入2滴二甲酚橙指示剂(5g/L ),用EDTA 标准滴定溶液滴定至亮黄色即为终点。
取三次标定结果的平均值。
三次结果极差值不应大于0.05mL 。
同时作空白试验。
按下式计算单位体积EDTA 标准滴定溶液相当于锌的质量。
T Zn =01V V m −式中∶T Zn ——单位体积EDTA 标准滴定溶液相当于锌的质量,g/mLm——标定时称取锌的质量,g ;中国分析网V 1——滴定锌时消耗的EDTA 标准滴定溶液的体积,mL ;V 0——滴定空白溶液消耗的EDTA 标准滴定溶液的体积,mL 。
金属锌的测定

金属锌的测定1、 范围本方法适用于锌粉中金属锌含量的测定。
测定范围:88%~99%。
2、 方法提要在二氧化碳保护气的条件下,试样中的金属锌与硫酸铁作用(铜盐做催化剂)生成相当量的硫酸亚铁,用高锰酸钾标准溶液滴定,间接计算试样中的金属锌量。
3、 试剂3.1 二氧化碳(瓶装,临时制备见4.1)3.2磷酸(密度1.69g/mL ).3.3硫酸(1+19)3.4甲基红指示剂(1g/L ):称取0.10g 甲基红溶于100mL 的乙醇(1+1)溶液中。
3.5硫酸铜溶液(200g/L ) :称取200gCuSO 4·5H 2O 溶于1L 的水中。
3.6硫酸铁溶液(330g/l ),称取330gFe(SO 4)3,溶于1L 的水中,加热至完全溶解。
3.7高锰酸钾标准溶液3.7.1配制:称取20g 的高锰酸钾置于3L 的烧杯中,加入2L 蒸馏水,煮沸1h ,冷却,静置至次日。
移入2L 容量瓶中。
用煮沸并冷却的蒸馏水稀释至刻度,充分摇匀。
放置至沉淀下降,经玻璃丝或瓷过滤器过滤于棕色瓶中,盖上玻璃塞。
3.7.2标定:称取0.72g ±0.0002g 无水草酸钠(在105℃±5℃烘箱中干燥1h )置于500mL 的锥形瓶中,将其溶解于200mL 的硫酸(3.3)溶液中,加热至70~80℃,立即用高锰酸钾溶液标定至出现淡红色为终点。
高锰酸钾对锌元素的测定系数计算如下式 F=04879.0V V m -⨯ 式中:F------高锰酸钾标准溶液对Zn 元素的滴定系数,g/mL ;m------称取草酸钾的质量,g ;V------标定时消耗高锰酸钾溶液的体积,mL ;V0------空白消耗高锰酸钾溶液的体积,mL ;0.4879------草酸钾转化为对Zn 元素系数。
当三次测定的极差值不大于0.00001g/mL ,取其平均值。
否则重新标定。
4、 分析步骤4.1二氧化碳的制备4.1.1在一个干燥的750mL锥形瓶中充满二氧化碳,塞好胶塞,若无二氧化碳,按4.1.2执行。
双硫腙分光光度法测定锌含量
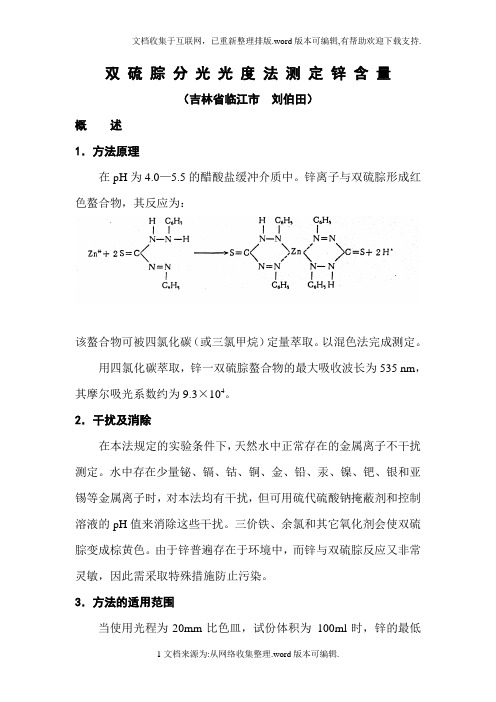
双硫腙分光光度法测定锌含量(吉林省临江市刘伯田)概述1.方法原理在pH为4.0—5.5的醋酸盐缓冲介质中。
锌离子与双硫腙形成红色螯合物,其反应为:该螯合物可被四氯化碳(或三氯甲烷)定量萃取。
以混色法完成测定。
用四氯化碳萃取,锌一双硫腙螯合物的最大吸收波长为535 nm,其摩尔吸光系数约为9.3×104。
2.干扰及消除在本法规定的实验条件下,天然水中正常存在的金属离子不干扰测定。
水中存在少量铋、镉、钴、铜、金、铅、汞、镍、钯、银和亚锡等金属离子时,对本法均有干扰,但可用硫代硫酸钠掩蔽剂和控制溶液的pH值来消除这些干扰。
三价铁、余氯和其它氧化剂会使双硫腙变成棕黄色。
由于锌普遍存在于环境中,而锌与双硫腙反应又非常灵敏,因此需采取特殊措施防止污染。
3.方法的适用范围当使用光程为20mm比色皿,试份体积为100ml时,锌的最低检出浓度为0.005mg/L。
本法适用于测定天然水和轻度污染的地表水中的锌。
4. 仪器(l)分光光度计,应用10 mm或更长光程的比色皿。
(2)分液漏斗:容量为125和150ml,最好配有聚四氟乙烯活塞。
(3)玻璃器皿:所有玻璃器皿均先后用1+l硝酸浸泡和无锌水清洗。
5. 试剂(1)无锌水:将普通蒸馏水通过阴阳离子交换柱以除去水中痕量锌,用于配制试剂。
(2)四氯化碳(CCl4)。
(3)高氯酸(ρ=1.75g/ml)。
(4)盐酸(ρ=1.18g/ml)。
(5)6mol/L盐酸:取500ml浓盐酸用水稀释至1000ml。
(6)2mol/L盐酸:取100ml浓盐酸用水稀释至600ml。
(7)0.02mol/L盐酸:取2mol/L盐酸10ml用水稀释到1000ml。
(8)乙酸(含量36%)。
(9)氨水(ρ=0.90g/ml)。
(10)1+100氨溶液:取氨水10ml用水稀释至1000ml。
(11) 硝酸(ρ=1.4g/ml)。
(12) 2%(V/V)硝酸溶液:取硝酸20ml 用水稀释至1000 ml。
测定锌实验报告

一、实验目的1. 了解锌的化学性质及其与酸反应的原理。
2. 学习使用酸碱滴定法测定锌含量的方法。
3. 培养实验操作技能,提高实验数据的准确性。
二、实验原理锌是一种常见的金属元素,能与酸反应生成相应的盐和氢气。
在本实验中,我们采用EDTA滴定法测定锌含量。
EDTA(乙二胺四乙酸)是一种常用的络合剂,能与锌离子形成稳定的络合物。
在滴定过程中,EDTA与锌离子反应,使溶液中锌离子的浓度逐渐降低,直至锌离子完全被络合。
通过滴定过程中消耗的EDTA溶液的体积,可以计算出样品中锌的含量。
三、实验用品1. 实验仪器:滴定管、锥形瓶、移液管、烧杯、电子天平、滤纸等。
2. 实验药品:锌标准溶液、EDTA标准溶液、盐酸、氨水、硫酸锌等。
四、实验步骤1. 标准溶液的配制(1)准确称取0.1000g硫酸锌,溶解于100mL去离子水中。
(2)将溶液转移至1000mL容量瓶中,用去离子水定容至刻度线,配制成1mg/mL的锌标准溶液。
2. 样品的处理(1)准确称取0.2000g粗锌样品,溶解于10mL盐酸中。
(2)将溶液转移至50mL容量瓶中,用去离子水定容至刻度线,配制成4mg/mL的锌样品溶液。
3. 滴定实验(1)在锥形瓶中加入10.0mL锌样品溶液,加入适量氨水和盐酸,调节pH值为5.0。
(2)用移液管准确移取20.0mL锌标准溶液于锥形瓶中。
(3)加入适量指示剂,用EDTA标准溶液滴定至溶液颜色由红色变为无色。
(4)记录消耗的EDTA标准溶液体积。
五、数据处理1. 计算锌标准溶液的浓度:c(Zn)= m(Zn)/V(溶液)2. 计算样品中锌的含量:m(Zn)= c(Zn)× V(样品溶液)× M(Zn)3. 计算样品的纯度:纯度 = m(Zn)/m(样品)× 100%六、实验结果与分析1. 实验数据| 锌标准溶液浓度(mg/mL) | 消耗EDTA标准溶液体积(mL) | 样品中锌含量(mg) | 样品纯度(%) || ------------------------ | --------------------------- | ------------------ | ------------ || 1.0000 | 20.00 | 20.00 | 100.00 |2. 结果分析根据实验数据,样品中锌的含量为20.00mg,样品纯度为100.00%。
锌测定方法详述

总锌锌(Zn)是人体必不可少的有益元素。
碱性水中锌的浓度超过5mg/L时,水有苦涩味。
并出现乳白色。
水中含锌lmg/L时,对水体的生物氧化过程有轻微抑制作用。
锌对白鲢鱼的安全浓度为0.lmg /L。
农灌水中含锌量低于10mg/L时,对水稻、小麦的生长无影响。
美国天然水中的平均含锌量为64µg/L,海水中的最高含锌量为10µg /L。
锌的主要污染源是电镀、冶金、颜料及化工等部门的排放废水。
方法的选择直接吸入火焰原子吸收分光光度法测定锌,具有较高的灵敏度,干扰少,适合测定各类水中的锌。
不具备原子吸收光谱仪的单位,可选用双硫腙比色法、阳极溶出伏安法或示波极谱法。
一、原子吸收分光光度法(一)直接吸入火焰原子吸收分光光度法GB7475--87 概述1、方法原理将样品或消解处理好的试样直接吸入火焰,火焰中形成的原子蒸气对光源发射的特征电磁辐射产生吸收。
将测得的样品吸光度和标准溶液的吸光度进行比较,确定样品中被测元素的含量。
2、干扰及消除地下水和地面水中的共存离子和化合物,在常见浓度下不干扰测定。
样品中溶解硅的含量超过20mg/L时干扰锌的测定,使测定结果偏低,加入200mg/L钙可消除。
铁的含量超过100mg/L时,抑制锌的吸收。
基于上述原因,分析样品前需要检验是否存在基体干扰或背景吸收。
一般通过测定加标回收率,判断背景吸收的大小。
根据下表选择与选用分析线相对应的非特征吸收谱线。
背景校正用的邻近线波长根据检验的结果, 如存在基体干扰,可加入干扰抑制剂,或用标准加入法测定并计算结果.如果存在背景吸收,用自动背景校正装置或邻近非特征吸收谱线法进行校正。
后一种方法是从分析线处测得的吸收中扣除邻近非特征吸收谱线处的吸收, 得到被测元素原子的真正吸收。
此外, 也可通过萃取或样品稀释、分离或降低产生基体干扰或背景吸收的组分。
3、方法的适用范围本法适用于测定地下水、地面水和废水中的锌。
适用浓度范围与仪器的特性有关,下表列出一般仪器的适用浓度范围。
锌含量的测定

原子吸收分光光度法对锌含量测定
一、仪器:原子吸收分光光度计锌空心阴极灯烘箱坩
埚25ml和10ml容量瓶10个,吸量管,
电子天枰
试剂:锌标准溶液1mg/ml 硝酸溶液实验实用均为二级蒸馏水及分析纯试剂
二、样品预处理:将样品用自来水冲洗干净,再用二次蒸
馏水冲洗,置于烘箱中烘干(温度不超过120度,
可用通风控制)后,粉碎成粉末至无烟,保存于干燥
器中备用。
三、样品处理:准确称取样品5.0000g,至于坩埚中,先
在电炉上炭化至无烟,再移入电阻炉中在560度下灰
化5h。
灰化完全、制冷后,加入1:4 HNO3溶液8ml
溶解灰分,将溶液和残渣全部移入25ml容量瓶中,
稀释至刻度,过滤除去残渣,待测。
四、绘制标准曲线:将锌元素国家标准物质,用0.10mol/l
HNO3溶液经多次稀释定容后,配置锌浓度分别为:
0.00、0.20、0.40、0.60、0.80、1.00、1.20、1.40、1.60、
1.80ug/ml的标准系列,将标准系列依次喷入火焰,
测定吸光度,绘制一张标准曲线。
五、样品的测定:用移液管取样品溶液1ml到10ml容量
瓶,稀释至刻度,测定锌的吸光度,然后根据吸光度,样品稀释倍数,测定锌含量。
双硫腙分光光度法测定锌含量

双硫腙四氯化碳溶液10ml萃取,直到双硫腙溶液呈绿色不变为止。然后再用四氯化碳萃取以除去多余的双硫腙。 (16)0.05%(m,V)双硫腙四氯化碳贮储溶液: 称取0.10g双硫腙(CHNNCSNHNH?CH)溶解于200ml四氯化碳,6565
(7)0.02mol/L盐酸:取2mol,L盐酸10ml用水稀释到1000ml。
(8)乙酸(含量36%))1,100氨溶液:取氨水10ml用水稀释至1000ml。
(11) 硝酸(ρ,1.4g,ml)。
(12) 2,(V,V)硝酸溶液:取硝酸20ml 用水稀释至1000 ml。
贮于棕色瓶中,放置在冰箱内,如双硫腙试剂不纯,可按下述步骤提纯:
将上述双硫腙四氯化碳溶液滤去不溶物,滤液置分液漏斗中,每次用1+100氨水20ml提取,共提取 5次,此时双硫腙进入水层,合并水层。然后用6 mol,L盐酸中和,再用200ml四氯化碳分三次提取,合并四氯化碳层。将此双硫腙四氯化碳溶液放入棕色瓶中,保存于冰箱内备用。
此时溶液的pH为2.8,备作测定用。
试 样
如果水样中锌的含量太高而不在测定范围,可将试样作适当的稀释或减少取样量。如锌的含量太低,也可取较大量试样置于石英皿中进行浓缩。如果取加酸保存的试样,则要取一份试样放在石英皿中,蒸发至干,以除去过量酸(注意:不要用氢氧化物中和,因为此类试剂中的含锌量往往过高)。然后加无锌水,加热煮沸5min,用稀盐酸或经提纯的氨水调节试样的pH在2—3之间,最后以无锌水定容。 样 品 测 定
(17)0.01%(m,V)双硫腙四氯化碳中间溶液:临用前将0.05,(m,V)双硫腙四氯化碳溶液用四氯化碳稀释5倍。 (18)0.0004%(m,V)双硫腙四氯化碳溶液:量取0.01%(m/V)双硫腙四氯化碳溶液10m1,用四氯化碳稀释至250ml(此溶液
锌的测定

锌的测定(一)锌试剂比色法1、方法提要:在PH8.5-9.5的碱性溶液中,锌与锌试剂生成兰色络合物。
最大吸收峰在620nm出,在50mL水溶液中含0-120微克锌,符合皮尔定律。
用铜试剂分离Cu、Pb、Mn、Ni等干扰元素,残留Mn加入抗坏血酸钠盐掩蔽。
2、试剂(1)锌试剂溶液—0.2%:称取0.2g锌试剂,溶于1mL1N的氢氧化钠中,用水稀释至100mL,置于暗处,配制后可稳定1星期。
(2)抗坏血酸钠盐溶液:取25g抗坏血酸,溶于含有5.7g的氢氧化钠溶液中,用水稀释至100mL。
(3)硼酸盐缓冲溶液(PH8.8-9):取8.3g氢氧化钠溶于水中,加入37.3g氯化钾,31g硼酸,溶解后用水稀释至1000mL。
(4)锌标准溶液:称取纯金属锌0.2500g置于烧杯中,加盐酸10mL,低温溶解,移入250mL 容量瓶中,用水稀释至个度,此溶液每1mL相当于1mg锌。
使用时稀释50倍,每mL相当于20微克锌。
3、分析步骤:称取试样0.2000g置于250mL的是锥型瓶中,加1+1盐酸10mL。
浓硝酸5mL,加热溶解至干,加盐酸5mL及少量水(约30mL)温热溶解,滴加氢氧化铵至生成氢氧化铁沉淀,并过量5mL,加铜试剂2g,振摇锥形瓶至沉淀凝聚。
过滤于250mL烧杯中,加热至无氨味,稍冷后加硫酸2-3mL,加热冒烟取下,再加硫酸、硝酸数滴,高氯酸1-2滴,加热蒸发至近干,加水5mL,温热使盐类溶解,加甲基橙指示剂1滴,用1N氢氧化钠溶液中和至刚呈黄色,将溶液移入50mL容量瓶中。
加抗坏血酸钠盐2mL,加硼酸缓冲溶液10mL摇匀,加锌试剂5mL,用水稀释至刻度,摇匀。
放置10min,以72型或721型分光光度计,用1cm比色皿,于波长625nm 处测消光度。
4、标准曲线:吸取相当于10、20、30、40微克锌的溶液于50mL容量瓶红忠,以下操作与试样铜绘制曲线。
5、计算:Zn%=mG×1000×1000×100m----曲线上查得锌量(微克);G----样重;也可用标准比较法计算结果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
锌含量的测定方法
锌是一种化学元素,也是一种浅灰色的过渡金属。
那么在生活中,该如何检测金属中锌的含量呢?下面店铺就和大家介绍锌含量测定的相关知识,希望对各位有所帮助!
锌含量的测定方法一
本方法适用于测定转窑渣、铜镉渣、焙砂浸出渣、锌灰及氧化锌等锌的测定。
试剂:硫代硫酸钠10% 二甲酚橙0.5% 盐酸1+1 氨水1+1
缓冲液—400g六次甲基四胺加水1000ml加100ml盐酸摇匀。
称取0.1—0.5g试样于250ml烧杯中,用水润湿,加10—15ml 盐酸加热溶解完全,加3—5ml硝酸蒸发至试样分解完全,加入5ml(1+1)硫酸,蒸发至冒硫酸浓白烟并近干,取下冷却,加水冲洗杯壁至40ml左右(如铁含量低应加补硫酸铁溶液使铁含量在20—30mg 左右),加3—4g氯化铵加热使氯化铵溶解,加氟化钠0.1g加热溶解取下冷却,加25ml氨水加热加5滴过氧化氢加热至过氧化氢气泡消失,取下冷却。
将溶液移入预先盛有10ml氨水的100ml容量瓶中,用水洗净烧杯稀释至刻度,摇匀。
过滤于干烧杯中,取50ml滤液于250ml烧杯中于电炉上低温处干氨至无氨味或微氨味。
取下冷却。
加1—5ml硫代硫酸钠溶液,0.1g抗坏血酸 2—4 滴二甲酚橙,用(1+1)盐酸调至黄色,再用(1+1)氨水调至微红色,加20ml缓冲液,用EDTA标准溶液滴至亮黄色为终点。
锌含量的测定方法二
本方法适用于测定锌精矿、铅锌矿、铁厂烟灰及锰含量高样品等锌的测定。
试剂:硫酸1+1 硫酸铁100g/L 过硫酸铵20% 缓冲液—同方法1
称取约0.2g试样,精确至0.0001g,于400ml烧杯中,加少量水润湿,加入10ml—15ml盐酸,加上表皿,低温溶解驱赶硫化氢5~
10min,加入5—8ml硝酸至试样分解完全,加入5ml(1+1)硫酸,继续加热至呈湿盐状(如试样含碳较高,可在蒸至冒白烟时取下,放冷,加入1~2ml高氯酸,继续加热至近干),取下放冷,用水冲洗表皿及杯壁,稀释体积至60ml左右加热溶解盐类,(如溶液中含铁较低,应当补加硫酸铁溶液(100g/L)使溶液中含铁在20~30mg)。
向试液中加3—5g氯化铵、10ml(200g/L)过硫酸铵溶液,加25ml氨水加热微沸1~2min,取下冷却,将溶液移入预先盛有10ml氨水的100ml容量瓶中,用水洗净烧杯稀释至刻度,摇匀。
过滤于干烧杯中,取50ml滤液于250ml烧杯中于电炉上低温处赶氨至无氨味或微氨味。
取下冷却。
加1—5ml硫代硫酸钠溶液,0.1g抗坏血酸 2—4 滴二甲酚橙,用(1+1)盐酸调至黄色,再用(1+1)氨水调至微红色,加20ml缓冲液,用EDTA标准溶液滴至亮黄色为终点。
锌含量的测定方法三
本法适用于铜铅锌矿石中锌的质量分数在1%以上时锌的测定。
试剂配制
乙酸-乙酸钠缓冲溶液(pH值为5.5~6):称取200g结晶乙酸钠,用水溶解后,加入10mL冰乙酸,用水稀释至1L,摇匀。
用精密pH 试纸检验。
分析步骤: 称取0.2000~0.5000g试样于300 mL烧杯中,加15~20 mL硝酸,低温加热5~6min,稍冷加1~2g氯酸钾继续加热蒸发至溶液体积为5~6 mL,取下加水使溶液体积保持在100 mL左右,加入10 mL300g/L硫酸铵溶液,加热煮沸,用氨水中和并过量15 mL,加10mL200g/L氟化钾溶液,加热煮沸约1min,取下加5 mL 氨水、10 mL乙醇,冷却后移入250 mL容量瓶中,用水定容。
干过滤,弃去最初流下的15~20 mL滤液,吸取100 mL或50 mL溶液于250 mL锥形瓶中(试样中锌的质量分数小于20%时吸取100 mL,大于20%时吸取50 mL)。
加热煮沸以驱除大部分氨(但勿使氢氧化锌白色沉淀析出),冷却,加1滴1g/L甲基橙指示剂,用盐酸(1+1)中和至甲基橙变红色,然后
加1滴氨水(1+1),使其变黄,加入15 mL乙酸-乙酸钠缓冲溶液,加2~3 mL100g/L硫代硫酸钠溶液,混匀。
加入2~3滴5g/L二甲酚橙指示剂,用EDTA标准溶液滴定至溶液由酒红色至黄色,即为终点。
溶液消耗的EDTA标准溶液体积之差,mL。
m0——称取试样量,g。
注意事项:
(1)本法基于使锌呈锌氨络离子状态与干扰元素分离,如氨的含量不足,锌不能完全形成锌氨络离子,会使结果偏低。
(2)当试样中铅的质量分数大于40%时,应在用氨水中和
大量酸后,加20 mL饱和碳酸铵,以下操作与分析步骤相同。
