物态变化与热量计算
物态变化与相变的热量

物态变化与相变的热量物质在不同的状态下,其性质和特征会有所不同。
物质的状态变化主要包括物态变化和相变两种类型。
而在这些状态变化过程中,热量的转移起着至关重要的作用。
本文将探讨物态变化与相变的热量问题。
一、物态变化物态变化是指物质在保持其化学组成不变的情况下,从一个状态转变为另一个状态的过程。
常见的物态变化包括固体向液体的熔化、液体向气体的汽化、气体向液体的凝结、液体向固体的凝固等。
这些物态变化的过程中,热量的转移起着重要的作用。
以固体向液体的熔化为例,当固体物质受到外界加热时,分子的内部结构会发生改变,从而使得物质的密度和分子间力发生变化。
在这个过程中,固体吸收了热量,使得分子的动力学能量增加,分子之间的引力减弱,从而使得固体逐渐熔化成液体。
根据热力学第一定律,能量由高温区向低温区流动,即热量会从高温热源传递到低温物体。
在固体向液体的熔化过程中,热量从外界传递到固体物质中,使其温度逐渐上升。
当达到熔点时,继续加热固体,其温度将保持不变,而热量被用于物质内部的相变过程,即固体向液体的转变。
物态变化的热量转移过程可以通过热容(C)来描述。
热容是指物质单位质量在单位温度变化下吸收或放出的热量。
不同物质的热容是不同的,通过对物质的热容的测量可以了解物质在不同状态下的热量吸收或释放情况。
二、相变相变是指物质在一定条件下,由某一相转变为另一相的过程。
常见的相变包括液态蒸发为气态、气态凝结为液态、液态冰冻为固态等。
在相变过程中,同样需要热量的转移来完成。
以液态蒸发为气态为例,当液体物质受到外界热源的加热时,分子的能量会增加,分子间引力会减弱,液体分子逐渐脱离液面进入气相。
这个过程中,液体会吸收热量。
然而,相变过程中的热量转移又与物质的状态转变有所不同。
在固体向液体的熔化过程中,当达到熔点时,其温度将保持不变,直到物质完全熔化为止。
而在液态蒸发为气态的相变过程中,即使在达到沸点后,继续加热液体,其温度仍然会继续升高。
物态变化过程中的热量变化

物态变化过程中的热量变化物态变化是物质从一个物态转变为另一个物态的过程。
在这个过程中,热量的变化起着重要的作用。
下面将从固态到液态、液态到气态,以及气态到液态、液态到固态这四个物态变化过程中的热量变化进行探讨。
首先,让我们来看一下从固态到液态的物态变化过程。
当物质从固态变为液态时,需要吸收一定的热量。
这是因为在固态中,分子之间相互排列紧密,并以固定的位置振动,形成了比较稳定的结构。
当外界加热时,分子的振动幅度增大,使得结构变得不稳定,分子之间的相互作用减弱,这样就克服了分子间的相互吸引力,从而使物质变为液态。
而吸收的热量则被用于打破固态结构,使分子自由运动。
接下来,我们来讨论液态到气态的物态变化过程。
当物质从液态变为气态时,同样需要吸收热量。
这是因为在液态中,分子之间的吸引力比较强,分子之间相对固定地排列。
当外界加热时,分子的动能增加,分子振动加剧,从而克服液体表面的张力,并且克服分子之间的相互作用力,使分子能够逃离液体表面,进入气相。
在这个过程中,液态物质需要吸收热量以克服分子间的相互作用力,从而转变为气态。
然而,当物质从气态转变为液态时,反应则完全相反。
在这个过程中,物质需要释放热量。
当气态分子失去能量,温度下降时,分子的动能减小,分子之间的吸引力逐渐增强,直到分子能够重新排列成为液体。
在这个过程中,气态物质释放出热量,因为分子重新排列成为液态时,重新形成了更紧密的结构。
最后,我们来看液态到固态的物态变化过程。
当物质从液态转变为固态时,同样需要释放热量。
在液态中,分子之间的吸引力相当大,分子有比较自由的运动能力。
但随着温度的下降,分子的动能减小,而分子之间的吸引力逐渐增加。
当分子的振动幅度减小到一定程度时,分子将重新排列成为固态结构。
在这个过程中,液态物质释放出热量,使得分子重新排列成为固体。
总结起来,固态到液态和液态到气态的物态变化过程需要吸收热量,而气态到液态和液态到固态的物态变化过程则需要释放热量。
化学反应中的焓变和焓变计算

化学反应中的焓变和焓变计算化学反应中的焓变是指在化学反应过程中发生的能量变化。
焓变可以分为两种类型:吸热反应和放热反应。
吸热反应是指在反应过程中吸收了热量,使其系统温度升高;而放热反应则是反应过程中释放出了热量,使系统温度降低。
焓变的计算可以通过热量计算或者物态变化计算来实现。
下面将分别介绍两种方法来计算焓变。
一、热量计算法热量计算法是通过测定反应过程中放出或吸收的热量来计算焓变。
这种方法需要使用到热量计或者热容器等仪器来测量。
以AB反应生成CD为例,假设反应发生在恒压条件下,焓变的计算方式为:ΔH = q / n其中,ΔH表示焓变的变化量,q表示反应过程中吸收或者放出的热量,n表示摩尔物质的量。
在实际操作时,首先需要将实验装置恢复到常温下,然后测量装置的初始温度。
随后,将反应物AB加入装置中,观察反应过程中温度的变化。
测量并记录最终温度。
根据测得的温度变化以及热容器的热匹配关系,可以计算出反应过程中的热量变化。
最后,通过已知物质的量来计算焓变。
二、物态变化计算法物态变化计算法是通过分析反应过程中涉及到的物质的物态变化来计算焓变。
这种方法可以通过利用化学方程式和物质的标准焓变来计算。
化学方程式提供了反应物之间的比例关系。
通过化学方程式,我们可以知道在特定反应条件下的反应物的物质的量比例。
标准焓变则是指在标准状况下,单位物质的焓变值。
通过标准状况下元素与化合物的标准焓变,我们可以计算出反应物在反应过程中的焓变。
具体的计算方法可以通过以下步骤来实现:1. 根据给定的化学方程式,确定反应物和生成物的物质的量比例。
2. 根据已知物质的摩尔焓和物质的量比例,计算反应物和生成物的摩尔焓的总和。
3. 根据已知反应物的总量和生成物的总量,计算出反应物和生成物的总摩尔焓。
4. 反应物的总摩尔焓减去生成物的总摩尔焓,即可计算出焓变的变化量。
综上所述,化学反应中的焓变和焓变计算能够通过热量计算法和物态变化计算法来实现。
热量计算正式版Microsoft Word 文档

关于比热容、热值、热量的计算一、关于比热容1.根据某种物质的比热,可以计算质量不是1kg 的某种物质,温度升高或降低不是1℃时吸收或放出的热量。
2.物体的比热用c 表示,质量用m 表示,初温用t 0表示,末温用t 表示,物体吸收或放出的热量分别用Q 吸和Q 放表示,则物体升高的温度为(t -t o ),吸收热量可表示为Q 吸=cm (t -t o )降低温度为(t o -t ),放出热量可表示为Q 放=cm(t 0-t)3.物体温度改变的多少也常常表示为△t ,即△t=t —t 0或△t =t 0-t ,物体温度改变时吸收或放出的热量计算公式也可以写成Q 放=cm △t4.Q=cm △t ,它只适用于物体温度改变时(升温或降温)物体吸收或放出热量的计算,对有物态变化的过程不能适用,如若不考虑,就会出错误。
例:质量为1kg 的水,初温为20℃,当它完全吸收3.696 × 105J 的热量,水的温度升高到多少摄氏度(1标准大气压)?根据Q 吸=cm (t -t o )水的末温t=1kg)·/(102.410696.3350⨯⨯⨯=+℃kg J J t cmQ +20℃=108℃,这个答案肯定是错误,因为水在标准大气压下的最高温度为100℃,如果不继续加热,就不会沸腾,若继续加热,水就会沸腾,但不升温,吸收的热量用来进行物态变化,所以水的末温只能升高到100℃。
5.应用热量公式中的有关温度的文字叙述应特别谨慎,不可乱套。
“升高”、“升高了”、“升高的”、“降低”、“降低了”、“降低的”对应的都是温度的改变量△t ,而不是t ;而“升高到”、“降低到”对应的是物体的末温t6.应用热量公式代入各物理量的单位必须统一为国际单位。
7.热平衡:两个温度不同的物体放在一起时,高温物体将放出热量,温度降低;低温物体吸收热量,温度升高,最后两物体温度相同,称为达到了热平衡。
因此热平衡的唯一标志是末温度相同。
热学基础知识

热学基础知识 一、物态变化一、温度 (一)温度:1. 温度:温度是用来表示物体冷热程度的物理量; 注:热的物体我们说它的温度高,冷的物体我们说它的温度低,若两个物体冷热程度一样,它们的温度亦相同;我们凭感觉判断物体的冷热程度一般不可靠; 2、摄氏温度:(1)温度常用的单位是摄氏度,用符号“C ”表示; (2)摄氏温度的规定:把一个大气压下,冰水混合物的温度规定为0℃;把一个标准大气压下沸水的温度规定为100℃;然后把0℃和100℃之间分成100等份,每一等份代表1℃。
(3)摄氏温度的读法:如“5℃”读作“5摄氏度”;“-20℃”读作“零下20摄氏度”或“负20摄氏度” (二)温度计1、常用的温度计是利用液体的热胀冷缩的原理制造的;2、 温度计的构成:玻璃泡、均匀的玻璃管、玻璃泡总装适量的液体(如酒精、煤油或水银)、刻度;3、 温度计的使用:(1)使用前要:观察温度计的量程、分度值(每个小刻度表示多少温度),并估测液体的温度,不能超过温度计的量程(否则会损坏温度计)(2)测量时,要将温度计的玻璃泡与被测液体充分接触,不能紧靠容器壁和容器底部;(3)读数时,玻璃泡不能离开被测液、要待温度计的示数稳定后读数,且视线要与温度计中夜柱的上表面相平。
(三)体温计:1、 用途:专门用来测量人体温的;2、 测量范围:35℃~42℃;分度值为0.1℃;3、 体温计读数时可以离开人体;4、 体温计的特殊构成:玻璃泡和直的玻璃管之间有极细的、弯的细管(缩口); 二、熔化和凝固(一).物态变化:物质在固、液、气三种状态之间的变化;固态、液态、气态在一定条件下可以相互转化。
物质以什么状态存在跟物体的温度有关。
(二)熔化和凝固:物质从固态变为液态叫熔化;从液态变为固态叫凝固。
1、 物质熔化时要吸热;凝固时要放热;2、 熔化和凝固是可逆的两物态变化过程;3、 固体可分为晶体和非晶体;(1)晶体:熔化时有固定温度(熔点)的物质;非晶体:熔化时没有固定温度的物质;(2)晶体和非晶体的根本区别是:晶体有熔点(熔化时温度不变继续吸热),非晶体没有熔点(熔化时温度升高,继续吸热);(熔点:晶体熔化时的温度); 4、晶体熔化的特点:吸热,温度保持不变。
初中物理热学知识
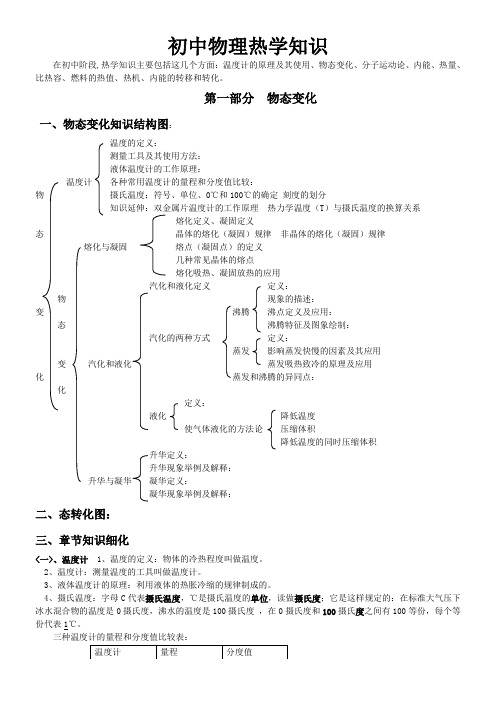
初中物理热学知识在初中阶段,热学知识主要包括这几个方面:温度计的原理及其使用、物态变化、分子运动论、内能、热量、比热容、燃料的热值、热机、内能的转移和转化。
第一部分物态变化一、物态变化知识结构图:温度的定义:测量工具及其使用方法:液体温度计的工作原理:温度计各种常用温度计的量程和分度值比较:物摄氏温度:符号、单位、0℃和100℃的确定刻度的划分知识延伸:双金属片温度计的工作原理热力学温度(T)与摄氏温度的换算关系熔化定义、凝固定义态晶体的熔化(凝固)规律非晶体的熔化(凝固)规律熔化与凝固熔点(凝固点)的定义几种常见晶体的熔点熔化吸热、凝固放热的应用汽化和液化定义定义:物现象的描述:变沸腾沸点定义及应用:态沸腾特征及图象绘制:汽化的两种方式定义:蒸发影响蒸发快慢的因素及其应用变汽化和液化蒸发吸热致冷的原理及应用化蒸发和沸腾的异同点:化定义:液化降低温度使气体液化的方法论压缩体积降低温度的同时压缩体积升华定义:升华现象举例及解释:升华与凝华凝华定义:凝华现象举例及解释:二、态转化图:三、章节知识细化<一>、温度计1、温度的定义:物体的冷热程度叫做温度。
2、温度计:测量温度的工具叫做温度计。
3、液体温度计的原理:利用液体的热胀冷缩的规律制成的。
4、摄氏温度:字母C代表摄氏温度,℃是摄氏温度的单位,读做摄氏度;它是这样规定的:在标准大气压下冰水混合物的温度是0摄氏度,沸水的温度是100摄氏度,在0摄氏度和100摄氏度之间有100等份,每个等份代表1℃。
三种温度计的量程和分度值比较表:5、温度计的使用:使用前,①观察量程②观察分度值;使用方法:浸、稳、留、平浸:.玻璃泡要全部浸入液体中,不要碰到容器底或壁稳:.要等温度计的示数稳定后再读数留:读数时玻璃泡要留在被测液体中平:视线与温度计中液柱的上表面相平6、双金属片温度计的工作原理:根据铜片和铁片膨胀系数不同,在受热相同的情况下,铜片膨胀较快而向铁片方向弯曲。
物理九年级全一册第十三章内能-----热量的计算

时该金属的比热是_88_0J_/(_㎏_·℃_)___
3.铁的比热大于铜的比热, 质量相等的铁块 和铜块, 吸收相等热量(不发生物态变化) 那么( B )
A、铁块温度升高得多.
B、铜块温度升高得多.
C、铁块和铜块升高相同温度.
D、由于初温不知道, 无法判断.
表示:1kg水,温度升高1℃吸 收的热量是4.2×103J
2、影响物体吸收热量的多 少的因素:
质量 升高的温度
物质的比热容
二、热量的计算公式
Q = c m Δt
Q:物质吸收或放出的热量 c: 物质的比热容
m:物体的质量 吸热:Δt=t-t0
Δt:变化的温度
放热:Δt =t0-t
小结:
•吸热公式 Q吸=cm(t-t0)
学习进步!
身体健康, 君子喻于义,小人喻于利。——《论语·里仁》
最孤独的时光,会塑造最坚强的自己。 严酷的纪律不应当用在与功课或文学练习有关曲事情上面,只能逢到道德问题感受危险的时候才施用。——夸美纽斯 人的成长需要接受四个方面的教育:父母、老师、书本、社会,有趣的是,社会似乎总是与前面三种教给你的背道而驰。
例题2 有一根烧红的铁钉,温度是80℃,质量
是1.5克,温度降低到20℃时,放出的 热量是多少焦耳?
例题3: 2千克某物质吸收4.2×104焦耳的热量后, 温度升高5℃,则该物质的比热为多少?
5.一质量为800克的冰块, 温度为-20℃, 放出8400J的热量后的温度为多少度? 【冰比热为2100 J /(kg·℃)】
6.一个质量是20克的铝块,放出了 176J的热量后,温度降低到18℃,
这个铝块原来的温度是多少摄氏度?
初中物理物态变化,热和能

一、本节知识【知识点一】物态变化一、温度1、定义:温度表示物体的冷热程度。
2、单位:①国际单位制中采用热力学温度。
②常用单位是摄氏度(℃)规定:在一个标准大气压下冰水混合物的温度为0度,沸水的温度为100度,它们之间分成100等份,每一等份叫1摄氏度某地气温-3℃读做:零下3摄氏度或负3摄氏度③换算关系T=t + 273K3、测量——温度计(常用液体温度计)①温度计构造:下有玻璃泡,里盛水银、煤油、酒精等液体;内有粗细均匀的细玻璃管,在外面的玻璃管上均匀地刻有刻度。
②温度计的原理:利用液体的热胀冷缩进行工作。
③分类及比较:使用前:观察它的量程,判断是否适合待测物体的温度;并认清温度计的分度值,以便准确读数。
使用时:温度计的玻璃泡全部浸入被测液体中,不要碰到容器底或容器壁;温度计玻璃泡浸入被测液体中稍候一会儿,待温度计的示数稳定后再读数;读数时玻璃泡要继续留在被测液体中,视线与温度计中液柱的上表面相平。
二、物态变化填物态变化的名称及吸热放热情况: 1、熔化和凝固 ① 熔化: 定义:物体从固态变成液态叫熔化。
晶体物质:海波、冰、石英水晶、 非晶体物质:松香、石蜡玻璃、沥青、蜂蜡 食盐、明矾、奈、各种金属 熔化图象: 熔化特点:固液共存,吸热,温度不变 熔化特点:吸热,先变软变稀,最后变为液态,温度不断上升。
熔点 :晶体熔化时的温度。
熔化的条件:⑴ 达到熔点。
⑵ 继续吸热。
② 凝固 :定义 :物质从液态变成固态 叫凝固。
凝固图象:凝固特点:固液共存,放热,温度不变 凝固特点:放热,逐渐变稠、变黏、变硬、最后凝固点 :晶体熔化时的温度。
成固体,温度不断降低。
同种物质的熔点凝固点相同。
凝固的条件:⑴ 达到凝固点。
⑵ 继续放热。
2、汽化和液化:① 汽化:定义:物质从液态变为气态叫汽化。
定义:液体在任何温度下都能发生的,并且只在液体表面发生的汽化现象 叫蒸发。
影响因素:⑴液体的温度;⑵液体的表面积 ⑶液体表面空气的流动。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物态变化与热量计算
物态变化是指物质在不同温度下经历固态、液态和气态之间的转变
过程。
这种变化伴随着热量的吸收或释放,因此在计算物态变化时需
要考虑热量变化的量。
本文将介绍物态变化的基本概念和热量计算的
方法。
一、固态到液态的熔化
当物质从固态转变为液态时,需要吸收一定的热量,这个过程称为
熔化。
熔化时吸收的热量与物质的熔点和质量有关。
根据热力学定律,熔化时吸收的热量Q可以通过以下公式计算:
Q = mLf
其中,m是物质的质量,Lf是物质的熔化热,是物质单位质量熔化
所吸收或释放的热量。
二、液态到气态的汽化
当物质从液态转变为气态时,需要吸收一定的热量,这个过程称为
汽化。
汽化时吸收的热量与物质的沸点和质量有关。
根据热力学定律,汽化时吸收的热量Q可以通过以下公式计算:
Q = mLv
其中,m是物质的质量,Lv是物质的汽化热,是物质单位质量汽化所吸收或释放的热量。
三、固态到气态的升华
在一些特殊情况下,物质可以直接从固态转变为气态,不经过液态的过程,这个过程称为升华。
升华时吸收的热量与物质的升华点和质量有关。
根据热力学定律,升华时吸收的热量Q可以通过以下公式计算:
Q = mLs
其中,m是物质的质量,Ls是物质的升华热,是物质单位质量升华所吸收或释放的热量。
四、热量计算的实例
现假设将100g的水从0摄氏度加热至100摄氏度,然后将其汽化为水蒸气。
已知水的比热容为4.18 J/g·℃,熔化热为334 J/g,汽化热为2260 J/g。
首先,将水加热至100摄氏度的过程中,需要吸收的热量可以通过以下公式计算:
Q1 = mCΔT
其中,m是水的质量,C是水的比热容,ΔT是温度变化。
将数值代入公式,可得:
Q1 = 100g × 4.18 J/g·℃ × (100℃ - 0℃) = 41800 J
接下来,将100摄氏度的水汽化为水蒸气所需要吸收的热量可以通过以下公式计算:
Q2 = mLv
将数值代入公式,可得:
Q2 = 100g × 2260 J/g = 226000 J
最后,将水从0摄氏度加热至100摄氏度并汽化为水蒸气所需要吸
收的总热量为:
Q总 = Q1 + Q2 = 41800 J + 226000 J = 267800 J
以上就是物态变化与热量计算的基本原理和方法,并以水的加热和
汽化为例进行了计算实例。
通过对物态变化中热量的计算,我们可以
更好地理解物质的相变过程,为相关领域的研究提供重要的理论依据。
同时,这也为工程实践和日常生活中与热相关的问题的解决提供了参考。
