N-甲氧基-N-[2-(1,6-2H-1-取代-6-羰基-哒嗪-3-氧甲基)苯基]氨基甲酸甲酯的合成及生物活性研究
大学无机化学 第十二章 杂环化合物总结
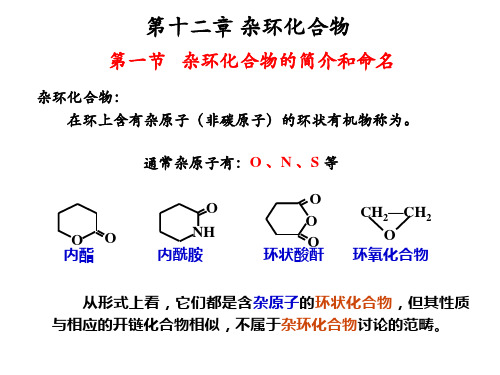
O
O
O O
(环氧乙烷) (β-丙内酯)
H N
O NH
(氮杂环丙烷) (β-丙内酰胺)
(顺丁烯二酸酐) (氧杂桌)
N H
(1H-氮杂桌)
多杂原子环 或多杂环
O N H N
1-氧-4-氮杂环己烷
奎宁环
1.2 芳香杂环化合物的分类
杂化化合物特指: 环状化合物具有芳香结构(闭合共轭体系),一定程度的 稳定性。
吡 咯 N( 孤 电 子 对参与共轭,所 以碱性较弱)
N O
<
N S
N
N H 吡咯N(孤电子对参与 共轭,所以碱性较弱)
<
1,2-唑与1,3-唑都有未成键孤电子对,所以都有碱性。
2 唑类杂化的反应--亲电取代反应
唑的反应性比呋喃、噻吩、吡咯差,这是因为分子中多了一个 吡啶N,使共轭体系的电子云密度降低,所以亲电反应活性降低。
CH3
4
3 O 2 1
Br Br
2-甲基-5-硝基-1-(2’-羟 乙基)吡咯
5
2,3-二溴呋喃
(2) 五元杂环苯并体系
4 5 6 7 O 1 3 2
5 6 7 S 1 4 3 2
5 6 7 N H1 4 3 2
苯并呋喃 (benzofuran)
苯并噻吩 (benzothiophene)
苯并吡咯 吲哚 (indole)
磺化须强烈条件下进行反应
HO3S S
N S
S O3 + 浓 H2S O4
N
S
发烟 H 2S O4 , HgS O 4
N
N
(90 %)
250℃
HO3S
药典溶剂残留标准

0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
0.5
二甲苯
限度%
0.041
0.036
0.006
0.3880Biblioteka 1870.060.01
0.109
0.088
0.038
0.016
0.062
0.022
0.029
0.3
0.005
0.005
0.118
0.053
0.005
0.02
0.016
0.01
0.072
0.089
0.008
0.217
第三类溶剂(药品GMP或者其他质量要求限制使用)
溶剂名称
限度%
溶剂名称
限度%
第一类溶剂(应该避免使用)
苯
四氯化碳
1,2-二氯乙烷
1,1-二氯乙烯
1,1,1-三氯乙烷
0.0002
0.0004
0.0005
0.0008
0.15
第四类溶剂(尚无足够毒理学资料)
1,1-二异氧基丙烷
1,1-二甲氧基甲烷
2,2-二甲氧基丙烷
异辛烷
异丙醚
甲氧异丙基酮
甲氧四氢呋喃
醋酸
丙酮
甲氧基苯
正丁醇
仲丁醇
乙酸丁酯
叔丁基甲基醚
异丙基苯
二甲亚砜
乙醇
乙酸乙酯
乙醚
甲酸乙酯
甲酸
正庚烷
乙酸异丁酯
乙酸异丙酯
乙酸甲酯
3-甲基-1-丁醇
丁酮
甲基异丁基酮
异丁酮
异丁醇
关于哒嗪酮类中间体药物及其合成进展

关于哒嗪酮类中间体药物及其合成进展哒嗪酮类药物是一类具有广泛应用的化合物,包括被广泛使用的心血管疾病药物、抗癫痫药物以及其他药物。
哒嗪酮类化合物的核心结构是哒嗪环,通常包括一个三元环和一个二元环。
这种结构可以调节药物对不同受体的选择性,从而使得哒嗪酮类药物具有多种药理学特性。
此外,哒嗪酮类药物也可以通过改变哒嗪环中的不同官能团和氨基酸取代基来调节药物的活性。
哒嗪酮类药物的合成一直受到化学家们的关注,因为这些化合物的合成不但可以促进新药发现,还可以改进现有药物的研究。
哒嗪酮类药物的合成通常需要耗费大量时间和精力,因为这些化合物的光学纯度和特异性对药物疗效至关重要。
以下是哒嗪酮类中间体药物及其合成的一些进展:1. 1-(2-苯乙酰胺基)哒嗪(1-Phenylacetamido-pyrrolidin-2-one)1-(2-苯乙酰胺基)哒嗪是哒嗪酮类药物的中间体之一,可以用于合成众多药物,例如拉帕替尼等。
传统的合成方法采用市场上易得的化合物苯乙酰苯胺作为前体,通过一系列反应制备,但这种方法效率低下,且化合物含杂质较多。
近年来的研究表明,可以采用苯乙酰氯和吡咯烷来合成1-(2-苯乙酰胺基)哒嗪,反应条件温和,产率高且有高纯度的产物。
此外,该合成方法也可以通过在反应中加入脱水剂来增加产率。
1-(2-笨乙酰胺基)哒嗪是另一种哒嗪酮类药物的中间体,可以用来合成抗癫痫药物。
(S)-3-羟基黄嘌呤等。
传统的合成方法中,采用了两步反应,包括一个格氏反应和一个邻位取代反应。
这种方法效率低下且步骤繁琐。
近年来的研究表明,可以采用一步反应合成1-(2-笨乙酰胺基)哒嗪。
具体来说,合成方法是采用嵌二胺作为起始物,与笨酸酐反应,再通过氨解反应生成1-(2-笨乙酰胺基)哒嗪。
这种方法简单高效,产率高。
2-甲基哒嗪也是哒嗪酮类药物中的一个重要中间体,在合成各种哒嗪酮类药物时经常被用到。
传统的合成方法需要使用高压反应器、高温及碳酸钠等强碱性条件,制备出的产品含有大量杂质,难以纯化。
α-卤代酮的合成及在杂环合成中的应用

2.2、含一个杂原子的五元环的合成
α-卤代酮与邻羟基羰基化合物反应生成多种取代苯并呋喃。苯并呋喃类化合物由α卤代酮与邻羟基二苯甲酮和水杨醛环合而成。
芳香胺与α-溴酮的反应是一条合成吲哚的有吸引力的路线
13/20
邻羟基苯腈与α-卤代酮反应得到3-氨基苯并呋喃衍生物
N-芳基和N-烷基氨基亚甲基氰基乙酸衍生物与α卤代羰基化合物在碳酸钾或乙醇钠 存在下反应合成多种取代的3-氨基吡咯。
酯与氯乙酸的双负离子反应制备α-氯代酮
酯与氯碘甲烷负离子反应制备α-氯代酮
8/20
1.4、从Weinreb 酰胺制备
若以N-甲氧基-N-甲基-2-卤乙酰胺与有机金属试剂作用就可以 良好收率得到α-卤代酮。N-甲氧基-N-甲基-2-卤乙酰胺很容易由 相应的卤乙酰卤与N-甲氧基-N-甲基氯化铵反应得到。
10/20
2、α-卤代酮在杂环合成中的应用
在用不同的亲核剂处理α-卤代酮时,攻击可能发生在六个可能的亲电位点:亲核 剂能够攻击羰基上的碳(位置1)、携带卤素原子的碳原子(位置2)和卤素原子(位置3)。此 外,由于两个极性吸电子基团的存在,α-,α‘和β-位上的氢原子也容易受到亲核剂或 碱基(位置4、5和6)的氮杂环化合物的反应完全不同,在大多数情况下导致季铵化。该反应已 用于Chichibabin季铵化,然后将所得叶立德与烯烃或炔烃环加成,得到相应的稠合吡 咯衍生物,由吡啶,哒嗪,嘧啶,吡嗪,咪唑,噻唑和三唑开始。
15/20
2.3、含两个杂原子的五元环的合成
用α-卤代酮与硫脲或硫酰胺缩合合成Hantzsch噻唑的研究始于一个世纪前。众所 周知,在Hantzsch噻唑合成过程中形成中间体或环羟基异构体
3、小结
1、α-卤代酮的合成
常用有机试剂缩写

%de % diasteromeric excess 非对映体过量百分比(不对称合成术语)%ee % enantiomeric excess 对映体过量百分比(不对称合成术语)1,5-HD 1,5-hexadienyl 1,5-己二烯9-BBN 9-borabicyclononane 9-硼二环壬烷Ac Acetyl 乙酰基acac Acetylacetonate 乙酰丙酮基AIBN Azo-bis-isobutryonitrile 2,2'-二偶氮异丁腈aq. Aqueous 水溶液BINAP (2R,3S)-2,2’-bis (diphenylphosphino)-1,1’-binaphthyl (2R,3S)-2.2'-二苯膦-1.1'-联萘亦简称为联二萘磷BINAP是日本名古屋大学的Noyori(2001年诺贝尔奖)发展的一类不对称合成催化剂Bn Benzyl 苄基BOC t-butoxycarbonyl 叔丁氧羰基(常用于氨基酸氨基的保护)Bpy (Bipy) 2,2’-bipyridyl 2,2'-联吡啶Bu n-butyl 正丁基Bz Benzoyl 苯甲酰基c- Cyclo 环-CAN Ceric ammonium nitrate 硝酸铈铵<BR< p>Cat. Catalytic 催化CBz Carbobenzyloxy 苄氧羰基COT 1,3,5-cyclooctatrienyl 1,3,5-环辛四烯Cp Cyclopentadienyl 环戊二烯基CSA 10-camphorsulfonic acid 樟脑磺酸CTAB Cetyltrimethylammonium bromide 十六烷基三甲基溴化铵(相转移催化剂)Cy Cyclohexyl 环己基dba Dibenzylidene acetone 苄叉丙酮DBE 1,2-dibromoethane 1,2-二溴乙烷DBN 1,8-diazabicycloundec-7-ene 二环-1,8-二氮-7-壬烯DBU 1,5-diazabicyclonon-5-ene 二环-1,5-二氮-5-十一烯DCC 1,3-dicyclohexylcarbodiimide 1,3-二环己基碳化二亚胺DCE 1,2-dichloroethane 1,2-二氯乙烷DDQ 2,3-dichloro-5,6-dicyano-1,4-benzoquinone 2,3-二氯-5,6-二氰-1,4-苯醌DEA Diethylamine 二乙胺DEAD Diethyl azodicarboxylate 偶氮二甲酸二乙酯Dibal-H Diisobutylaluminum hydride 二异丁基氢化铝diphos (dppe) 1,2-bis (diphenylphosphino)ethane 1,2-双(二苯基膦)乙烷diphos-4 (dppb) 1,4-bis (diphenylphosphino)butane 1,2-双(二苯基膦)丁烷DMAP 4-dimethylaminopyridine 4-二甲氨基吡啶DME dimethoxyethane 二甲醚DMF N,N'-dimethylformamide 二甲基甲酰胺dppf bis (diphenylphosphino)ferrocene 双(二苯基膦基)二茂铁dppp 1,3-bis (diphenylphosphino)propane 1,3-双(二苯基膦基)丙烷dvb Divinylbenzene 二乙烯苯e- Electrolysis 电解EDA (en) ethylenediamine 乙二胺<BR< p>EDTA Ethylenediaminetetraacetic acid 乙二胺四乙酸二钠EE 1-ethoxyethyl 乙氧基乙基Et Ethyl 乙基FMN Flavin mononucleotide 黄素单核苷酸Fp flash point 闪点FVP Flash vacuum pyrolysis 闪式真实热解法h hours 小时HMPA Hexamethylphosphoramide 六甲基磷酸三胺HMPT Hexamethylphosphorus triamide 六甲基磷酰胺hv Irradiation with light 光照iPr isopropyl 异丙基LAH Lithium aluminum hydride 氢化铝锂(LiAlH4)LDA Lithium diisopropylamide 二异丙基氨基锂(有机中最重要一种大体积强碱)LHMDS Lithium hexamethyldisilazideLTBA Lithium tri-tert-butoxyaluminum hydridemCPBA meta-cholorperoxybenzoic acid 间氯过苯酸Me Methyl 甲基MEM b-methoxyethoxymethyl 甲氧基乙氧基甲基-<BR< p>Min Minute 分钟MOM methoxymethyl 甲氧甲基Ms Methanesulfonyl 甲基磺酰基(保护羟基用)MS Molecular sieves (3 or 4 ) 分子筛MTM Methylthiomethyl 二甲硫醚Naphth Naphthyl 萘基NBD Norbornadiene 二环庚二烯(别名:降冰片二烯)NBS N-Bromosuccinimide N-溴代丁二酰亚胺别名:N-溴代琥珀酰亚胺NCS N-chlorosuccinimide N-氯代丁二酰亚胺. 别名:N-氯代琥珀酰亚胺Ni(R) Raney Nickel 雷尼镍(氢活性催化还原剂)NMO N-methyl morpholine-n-oxide N-甲基氧化吗啉PCC Pyridinium chlorochromate 吡啶氯铬酸盐PDC Pyridinium dichromate 是什么东西?PEG Polyethylene glycol 聚乙二醇Ph Phenyl 苯基PhH Benzene 苯PhMe Toluene 甲苯(亦称toluol;methylbenzene)Phth Phthaloyl 邻苯二甲酰Pip Piperidyl 哌啶基Py Pyridine 吡啶<BR< p>quant. quantitative yield 定量产率(对否?)Red-Al Na 直接看分子式就是了sBu sec-butyl 仲丁基sBuLi sec-butyllithium 仲丁基锂Siamyl DiisoamylTASF Tris(diethylamino)sulfonium difluorotrimethyl silicateTBAF Tetrabutylammonium fluoride 氟化四丁基铵TBDMS, TBS t-butyldimethylsilyl 叔丁基二甲基硅烷基(羟基保护基)TBHP t-butylhydroperoxide 过氧叔丁醇<BR< p>t-Bu Tert-butyl 叔丁基TEBA Triethylbenzylammonium 三乙基苄基胺TEMPO Tetramethylpiperdinyloxy free radicalTf or OTf TriflateTFA Trifluoroacetic acid 三氟乙酸TFAA Trifluoroacetic anhydride 三氟乙酸酐THF Tetrahydrofuran 四氢呋喃THP Tetrahydropyranyl 四氢吡喃基TMEDA Tetramethylethylenediamine 四甲基乙二胺TMP 2,2,6,6-tetramethylpiperidine 2,2,6,6-四甲基哌啶TMS Trimethylsilyl 三甲基硅烷基Tol Tolyl 甲苯基Tr Trityl 三苯基TRIS TriisopropylphenylsulfonylTs (Tos) Tosyl (p-toluenesulfonyl) 对甲苯磺酰基。
关于哒嗪酮类中间体药物及其合成进展

关于哒嗪酮类中间体药物及其合成进展哒嗪酮(Dazopirone)是一种潜在的多效性抗抑郁和抗焦虑药物,属于哒嗪衍生物,具有较好的生物活性和良好的安全性。
它在中枢神经系统中的作用机制包括5-羟色胺受体和5-羟色胺转运蛋白的调节,以及对γ-氨基丁酸(GABA)和谷氨酸(GLU)系统的影响。
由于其独特的药理特性,哒嗪酮成为目前嗜睡药中的一种新的发展方向。
哒嗪酮的合成方法主要通过N-pivaloyloxyphthalimide(PvPI)法、Vilsmeier-Haack 反应法、过氧化铴法和环化反应法等来制备。
PvPI法是一个基于羧酸酐与样品的反应而形成N-酰极化物的方法,这种方法通过溶液中的光敏引发剂诱导的自由基引发氮杂底物的氧化来实现。
Vilsmeier-Haack反应是由亮氨酸和二碳酰胺(DMFDMA)与二级胺之间的反应转化而来,该方法具有高产率和可靠性的特点。
过氧化铴法则是集成了氧化过程和铵化过程的一种方法,采用过氧化铴为氧化剂,在氧气环境中将结合物氧化成相应的羰基化合物。
环化反应法是指通过环化反应合成哒嗪衍生物,在反应中引入合适的底物和反应条件,可得到哒嗪酮及其结构类似物。
哒嗪酮的合成研究主要集中在其中间体药物的合成以及合成路线的改进等方面。
通过改进合成方法,减少副反应的产生,提高产率和纯度,以提高哒嗪酮的合成效果。
研究人员还通过改变结构,引入新的官能团,以增强其活性和选择性。
近年来,许多研究中心和制药公司都在开展哒嗪酮类中间体药物及其合成的研究。
目前,哒嗪酮已被用于治疗抑郁症和焦虑症等疾病的临床试验,并取得了一定的治疗效果。
虽然还有一些挑战存在,如药物代谢和毒理学研究等,但哒嗪酮在精神药理学领域的合成研究仍然具有重要的意义。
哒嗪酮类中间体药物的合成研究已经取得了一定的进展,但仍需要进一步的研究以实现其在临床上的应用。
随着对该类药物机制的深入研究以及合成方法的不断改进,相信哒嗪酮类中间体药物会在抗抑郁和抗焦虑疗法中发挥重要作用,并为神经科学和药物学领域的发展做出贡献。
氨基的保护与脱保护_药明康德

要对所有的反应官能团作出评估,确定哪些在所设定的反应 条件下是不稳定并需要加以保护的,选择能和反应条件相匹 配的氨基保护基。
还要从电子和立体的因素去考虑对保护的生成和去除速率的 选择性
如果难以找到合适的保护基,要么适当调整反应路线使官能 团不再需要保护或使原来在反应中会起反应的保护基成为稳 定的;要么重新设计路线,看是否有可能应用前体官能团 (如硝基等);或者设计出新的不需要保护基的合成路线。 3
O O
O
HN
O
O
O H O O NH2H
Monatsh. Chem., 1997, 128( 6-7), 725-732
BocHN
ON H WO2004092166
H
O
N
N
N
N
Cl
Cl
O O
Et3SiH
PdCl2
74%
Cl
H
O
N
N
N
NH
Cl
化学合成部培训材料, 药明康德版权所有,
US20030144297
9
9
1.1.4 苄氧羰基的脱去示例(二)
Cl
N EtOOC
S
HN N
N
N
N
NHCbz
H
Me3SiI Cl
Et3N, CH3CN
56%
N HN N
N
N
N H
NH2
US20050203078
O
N
N
H
O
NHCbz 33% HBr
N
EtOOC
AcOH, 91%
S
O
N
N
H
O
NH2.HBr
Heterocycles, 2002, 58, 521
哒嗪合成方法

哒嗪合成方法一、引言哒嗪是一种重要的有机合成中间体,在药物合成和农药合成中有着广泛的应用。
本文将介绍哒嗪的合成方法,包括哒嗪的合成原理、反应条件和反应步骤。
二、哒嗪的合成原理哒嗪的合成主要依靠氨基化合物和酮类化合物之间的反应。
具体来说,哒嗪的合成是通过环状化合物的形成实现的。
在反应中,氨基化合物中的氨基与酮类化合物中的羰基发生加成反应,形成一个新的碳-氮键。
随后,通过脱水反应,生成哒嗪的环状结构。
三、哒嗪的合成方法1. Von Pechmann反应Von Pechmann反应是一种常用的哒嗪合成方法。
该方法的反应物包括酮类化合物和氨基化合物,反应在酸性条件下进行。
首先,氨基化合物在酸性条件下被质子化,然后与酮类化合物发生加成反应,生成一个中间产物。
接下来,中间产物经过脱水反应,生成哒嗪的环状结构。
2. Bischler-Napieralski反应Bischler-Napieralski反应也是一种常用的哒嗪合成方法。
该方法的反应物包括酮类化合物和氨基化合物,反应在酸性条件下进行。
首先,氨基化合物在酸性条件下被质子化,然后与酮类化合物发生加成反应,生成一个中间产物。
接下来,中间产物经过内酰胺化反应,生成哒嗪的环状结构。
3. Dötz反应Dötz反应是一种较为复杂的哒嗪合成方法。
该方法的反应物包括酮类化合物、氨基化合物和亲电试剂,反应在酸性条件下进行。
首先,氨基化合物在酸性条件下被质子化,然后与酮类化合物发生加成反应,生成一个中间产物。
接下来,中间产物与亲电试剂发生反应,生成哒嗪的环状结构。
四、哒嗪的应用哒嗪作为一种重要的有机合成中间体,具有广泛的应用。
在药物合成领域,哒嗪可以作为抗癌药物和抗菌药物的合成中间体。
在农药合成领域,哒嗪可以作为杀虫剂和除草剂的合成中间体。
此外,哒嗪还可以用于有机光电器件和有机光催化等领域。
五、总结本文介绍了哒嗪的合成方法,包括Von Pechmann反应、Bischler-Napieralski反应和Dötz反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2005年第25卷有机化学V ol. 25, 2005第4期, 445~448 Chinese Journal of Organic Chemistry No. 4, 445~448liuweidonghn@*E-mail:Received July 12, 2004; revised September 20, 2004; accepted October 28, 2004.国家十五科技攻关(No. 2004BA308A22)、湖南省杰出青年科学基金(No. 04JJ1009)资助项目.446有机化学V ol. 25, 2005有生物活性的N-甲氧基氨基甲酸酯衍生物, 更好研究此类化合物的构效关系, 我们利用活性基团拼接原理, 在唑菌胺酯(pyraclostrobin)的化学结构基础上, 引入具有生物活性的哒嗪酮结构, 设计、合成了11个具有新型分子结构的目标化合物3a~3k, 其结构经IR, 1H NMR, LC/MS和元素分析确认. 生物活性测定表明, 部分化合物具有良好的杀菌活性. 目标化合物的合成路线如Scheme 1.R=a, C6H5; b, 4-ClC6H4; c, 4-FC6H4; d, 2-CH3C6H4; e, 4-CF3OC6H4; f, 2-CH3OC6H4; g, 3,5-Cl2C6H3; h, 3,4-Cl2C6H3; i, 2-F-4-BrC6H3; j, 3,4- (CH3)2C6H3; k, C6H5CH2Scheme 11 实验部分1.1 仪器与试剂WPS-1型数字熔点仪(未校正); Varian INOVA-300型核磁共振仪, CDCl3为溶剂, TMS为内标; PE System 2000 FTIR型红外光谱仪(溴化钾压片或液膜法); Agilent 1100 Series LC-MSD; Perkin Elmek Series II 2400元素分析仪; 柱层析用200~300目青岛产硅胶, 其他药品均为市售分析纯试剂, 使用前做常规处理.N-甲氧基-N-2-溴甲苯氨基甲酸甲酯(2)参照文献[7]方法制得.1.2 2-取代-6-羟基-3(2H)-哒嗪酮(1a~1k)的合成以2-苯基-6-羟基-3(2H)-哒嗪酮(1a)为例, 参照文献[8]的方法, 在配有磁力搅拌器、温度计和冷凝管的100 mL三口瓶中, 加入1.08 g (0.01 mol)苯肼, 滴加2.0 mL 盐酸, 再加入8.0 mL水, 慢慢升温到95 ℃时加入顺丁烯二酸酐1.07 g (0.011 mol), 反应约5 h, 冷却, 过滤. 固体物用10%的Na2CO3溶液溶解, 过滤除去不溶物, 滤液用盐酸酸化至PH=2~3, 析出固体, 过滤得到黄色固体1.68 g. 收率75.8%, m.p. 268~271 ℃(文献值[8]: 270~273 ℃). 同法合成了1b~1k, 收率为50%~80%. 1.3 N-甲氧基-N-[2-(1,6-2H-1-取代-6-羰基-哒嗪-3-氧甲基)苯基]氨基甲酸甲酯(3a~3k)的合成以化合物3a为例, 在50 mL反应瓶中加入0.95 g (5.0 mmol)化合物1a, 15 mL DMF, 0.76 g (6.0 mmol) K2CO3和1.50 g (5.5 mmol)化合物2, 在室温下搅拌反应5 h后将体系倒入冰盐水中, 分出有机层, 水层用20 mL×3的乙酸乙酯萃取, 合并有机相, 无水MgSO4干燥, 脱溶得到粗产品. 粗产品经减压柱层析[硅胶200~300目, 石油醚∶乙酸乙酯=5∶1~1∶1 (V∶V)梯度洗脱], 得到目标化合物.3a: 淡黄色晶体, 收率78.7%. m.p. 151.5~152.3 ℃; 1H NMR (CDCl3, 300 MHz) δ: 3.62 (s, 3H, NOCH3), 3.75 (s, 3H, CO2CH3), 5.27 (s, 2H, CH2O), 7.04 (d, J=9.6 Hz, 1H, PyH), 7.05 (d, J=9.6 Hz, 1H, PyH), 7.26~7.57 (m, 9H, ArH); IR (KBr) ν: 1702, 1676 (C=O), 1289 (ArNR1R2), 1245 (C—O—C), 3043 (ArH). Anal. calcd for C20H19N3O5: C 62.99, H 5.02, N 11.02; found C 63.12, H 5.13, N 11.09.3b:白色晶体, 收率79.2%. m.p. 95.4~96.3 ℃; 1H NMR (CDCl3, 300 MHz) δ: 3.65 (s, 3H, NOCH3), 3.76 (s, 3H, CO2CH3), 5.27 (s, 2H, CH2O), 7.03 (d, J=9.9 Hz, 1H, PyH), 7.04 (d, J=9.9 Hz, 1H, PyH), 7.26~7.56 (m, 8H ArH); IR (KBr) ν: 1706, 1672 (C=O), 1289 (ArNR1R2), 1244 (C—O—C), 3072 (ArH). Anal. calcd for C20H18Cl- N3O5: C 57.77, H 4.36, N 10.11; found C 57.54, H 4.50, N 10.01.3c: 白色晶体, 收率78.4%. m.p. 128.6~130.1 ℃; 1H NMR (CDCl3300 MHz) δ: 3.64 (s, 3H, NOCH3), 3.76 (s, 3H, CO2CH3), 5.31 (s, 2H, CH2O), 7.08 (d, J=9.6 Hz, 1H, PyH), 7.11 (d, J=9.6 Hz, 1H, PyH), 7.27~7.65 (m, 8H, ArH); IR (KBr) ν: 1706, 1677 (C=O), 1295 (ArNR1R2), 1259 (C—O—C), 3072 (ArH). Anal. calcd for C20H18FN3O5: C 60.15, H 4.54, N 10.52; found C 60.24, H 4.56, N 10.45.3d:黄色晶体, 收率61.2%. m.p. 117.2~119.0 ℃;1H NMR (CDCl3, 300 MHz) δ: 2.03 (s, 3H, CH3), 3.57 (s, 3H, NOCH3), 3.72 (s, 3H, CO2CH3), 5.19 (s, 2H, CH2O), 7.05 (d, J=9.6 Hz, 1H, PyH), 7.07 (d, J=9.6 Hz, 1H, PyH), 7.20~7.50 (m, 8H, ArH); IR (KBr) ν: 1696, 1674 (C=O), 1286 (ArNR1R2), 1260 (C—O—C), 3033 (ArH). Anal. calcd for C21H21N3O5: C 63.79, H 5.35, N 10.63; found C 63.90, H 5.21, N 10.53.3e:黄色液体, 收率71.0%. 1H NMR (CDCl3, 300 MHz)δ: 3.73 (s, 3H, NOCH3), 3.79 (s, 3H, CO2CH3), 5.19 (s, 2H, CH2O), 7.04 (d, J=9.9 Hz, 1H, PyH), 7.05 (d, J=No. 4 刘卫东等:N-甲氧基-N-[2-(1,6-2H-1-取代-6-羰基-哒嗪-3-氧甲基)苯基]氨基甲酸甲酯的合成及生物活性研究4479.9 Hz, 1H, PyH), 7.21~7.40 (m, 8H, ArH); IR (KBr) ν: 1708, 1677 (C=O), 1292 (ArNR1R2), 1258(C—O—C), 3084 (ArH). Anal. calcd for C21H18F3N3O6: C 54.20, H 3.90, N 9.03; found C 54.38, H 3.99, N 8.85.3f:黄色晶体, 收率63.1%. m.p. 138.5~142.0 ℃;1H NMR (CDCl3, 300 MHz)δ: 3.55 (s, 3H, OCH3), 3.67 (s, 3H, NOCH3), 3.79 (s, 3H, CO2CH3), 5.28 (s, 2H, CH2O), 7.02 (d, J=9.6 Hz, 1H, PyH), 7.06 (d, J=9.6 Hz, 1H, PyH), 7.27~7.57 (m, 8H, ArH); IR (KBr) ν: 1698, 1676 (C=O), 1294 (ArNR1R2), 1242 (C—O—C), 3076 (ArH). Anal. calcd for C21H21N3O6: C 61.31, H 5.14, N 10.21; found C 61.34, H 5.19, N 10.18.3g: 白色晶体, 收率60.4%. m.p. 128.3~128.9 ℃;1H NMR (CDCl3, 300 MHz)δ: 3.63 (s, 3H, NOCH3), 3.75 (s, 3H, CO2CH3), 5.20 (s, 2H, CH2O), 7.02 (d, J=9.9 Hz, 1H, PyH), 7.03 (d, J=9.9 Hz, 1H, PyH), 7.25~7.51 (m, 7H, ArH); IR (KBr) ν: 1702, 1688 (C=O), 1301 (ArNR1R2), 1246 (C—O—C), 3069 (ArH). Anal. calcd for C20H17Cl2N3O5: C 53.35, H 3.81, N 9.33; found C 53.21, H 3.82, N 9.35.3h: 浅黄色晶体, 收率70.0%. m.p. 114.1~116.0 ℃; 1H NMR (CDCl3, 300 MHz)δ: 3.61 (s, 3H, NOCH3), 3.75 (s, 3H, CO2CH3), 5.25 (s, 2H, CH2O), 7.02 (d, J=9.9 Hz, 1H, PyH), 7.04 (d, J=9.9 Hz, 1H, PyH), 7.17~7.52 (m, 7H, ArH); IR (KBr) ν: 1711, 1677 (C=O), 1286 (ArNR1R2), 1246 (C—O—C), 3039 (ArH). Anal. calcd for C20H17Cl2N3O5: C 53.35, H 3.81, N 9.33; found C 53.46, H 3.92, N 9.21.3i:白色晶体, 收率72.3%. m.p. 136.6~136.9 ℃;1H NMR(CDCl3, 300 MHz) δ: 3.64 (s, 3H, NOCH3), 3.75 (s, 3H, CO2CH3), 5.26 (s, 2H, CH2O), 7.04 (d, J=9.9 Hz, 1H, PyH), 7.06 (d, J=9.9Hz, 1H, PyH), 7.26~7.57 (m, 7H, ArH); IR (KBr) ν: 1704, 1682 (C=O), 1292 (ArNR1R2), 1242 (C—O—C), 3047 (ArH). Anal.calcd for C20H17FBrN3O5: C 50.23, H 3.58, N 8.79; found C 50.12, H 3.50, N 8.91.3j:黄色晶体, 收率80.1%, m.p. 112.5~114.2 ℃.1H NMR (CDCl3, 300 MHz) δ: 2.28 (2s, 6H, 2×CH3, 3.68 (s, 3H, NOCH3), 3.74 (s, 3H, CO2CH3), 5.29 (s, 2H, CH2O), 7.01 (d, J=9.9 Hz, 1H, PyH), 7.02 (d, J=9.9 Hz, 1H, PyH), 7.27~7.57 (m, 7H, ArH); IR (KBr) ν: 1709, 1677 (C=O), 1290 (ArNR1R2), 1250 (C—O—C), 3066 (ArH). Anal. calcd for C22H23N3O5: C 64.54, H 5.66, N 10.26; found C 64.50, H 5.80, N 10.32.3k: 黄色液体, 收率75.8%. 1H NMR (CDCl3, 300 MHz) δ: 3.72 (s, 3H, NOCH3), 3.78 (s, 3H, CO2CH3), 5.16 (s, 2H PhCH2), 5.23 (s, 2H, CH2O), 6.93 (d, J=9.6 Hz, 1H, PyH), 6.94 (d, J=9.6 Hz, 1H, PyH), 7.27~7.46 (m, 9H, ArH); IR (KBr) ν: 1708, 1670 (C=O), 1297 (ArNR1R2), 1280 (C—O—C), 3030 (ArH). Anal. calcd for C21H21N3O5: C 63.79, H 5.35, N 10.63; found C 63.91, H 5.38, N 10.72.2 结果与讨论2.1合成方法在合成中间体1时, 苯环上取代基对反应影响很大. 当取代基为给电子基时, 反应容易进行, 中间体1的收率和纯度较高; 当取代基为吸电子基时, 反应较难进行, 收率较低; 当苯环邻位有取代基时, 由于受空间效应的影响, 反应收率也较低.碱的强弱和温度对化合物3合成影响很大. 用NaH 等强碱作傅酸剂时, 很难得到目标化合物; 后改用K2CO3等弱碱, 目标化合物的收率和选择性明显提高. 温度过高不利于化合物3的合成, 温度高于50 ℃时, 副产物明显增多.2.2 目标化合物波谱特性IR光谱中, 在3030~3080 cm-1有νArH 尖而弱的伸缩振动吸收; 1280~1300 cm-1间有典型的叔胺的吸收; 1240~1280 cm-1为νC—O—C的较强吸收; 酯羰基的吸收在1.700~1.710 cm-1, 哒嗪酮上羰基的吸收因为与双键共轭而降低至1670~1680. 1H NMR谱图更有效地确定了目标化合物结构, 芳香环上氢的化学位移在δ7.20~7.60; 哒嗪酮环上氢的化学位移在δ7.00~7.10之间; 受羰基的影响, 亚甲基上的氢在δ 5.20~5.30, 比正常的苄基亚甲基高; 毒杀基团上的甲基的氢由于氧原子的影响偏向低场, 分别在δ 3.62和3.78附近.3 生物活性采用菌丝生长速率法对化合物3进行了离体杀菌筛选实验, 结果见表1. 在50 mg/L下, 大部分化合物对小麦赤霉病菌(Gibberella zeae)、稻瘟病菌(Pyricularia oryzae)和黄瓜灰霉病菌(Botrytis cinerea)的有较好的抑菌活性, 其中3c, 3e对小麦赤霉病的抑菌活性大于80%, 3e对稻瘟病的抑菌活性达到100%. 大部分化合物对辣椒疫霉病菌(Phytophthora infestans)活性较低. 结构和活性的关系表明, 不同的R取代基对活性有一定影响, 其中氟原子的引入可以提高杀菌活性. 目标化合物的杀菌448有 机 化 学 V ol. 25, 2005活性与商品化品种唑菌胺酯相比有一定的差距, 但是发现部分化合物有较好的除草活性, 采用茎叶喷洒方法,3a 在75 g a.i./ha 的用量下对藜、龙葵、刺苋等双子叶除草活性大于90%; 3c 对藜、龙葵、刺苋等双子叶除草活性大于80%. 这类化合物的结构优化工作还在进行之中.表1 目标化合物3的杀菌活性(抑菌率/%, 浓度50 mg/L)Table 1 Fungicidal activity of compounds 3 (inhibitory ratio/%,conc. 50 mg/L)Compd. Gibberella zeae Phytophthora infestans Pyricularia oryzae Botrytis cinerea3a 61.1 0 61.9 56.1 3b 45.8 11.7 50.8 76.3 3c 97.9 0 61.9 44.9 3d 66.2 0 31.0 33.6 3e 80.1 18.3 100 58.83f 20.7 0 5.1 24.6 3g 8.9 0 20.4 21.23h 50.9 0 85.2 22.53i 0 0 54.2 47.23j 10.2 0 0 13.53k 23.6 15.0 23.5 59.5References1 Liu, W.-D.; Wang, X.-G.; Gao, B.-D. In Research Progressin Plant Protection and Pesticid Sciences , Eds.: Wang, G.-P.;He, H.-W.; Liu, J.-H.; Liu, W.-D., China Agriculture Press, Beijing, 2004, p. 77 (in Chinese). (刘卫东, 王晓光, 高必达, 植物保护和农药学研究进展,主编: 王国平, 贺红武, 刘建华, 刘卫东, 中国农业出版社, 北京, 2004, p. 77.) 2 Clough, J. M.; Godfrey, C. R. A. In The Strobilurin Fungi-cides , in Fungicidal Activity , Chemical and Biological Ap-proaches to Plant Protection , Eds.: Hutson, D. H.; Miya-moto, J., Wiley Series in Agrochemical and Plant Protec-tion, John Wiley & Sons, 1998, pp. 109~148.3 Ziegler, H. WO 0041476, 2000 [Chem . Abstr . 2000, 133,104885]. 4 Miyahara, O.; Miyazawa, M.; Hamamura, H.; Sugiura, T.JP 200155304, 2001 [Chem . Abstr . 2001, 134, 178468]. 5 Ammermann, E.; Lorenz, G.; Schelberger, K. In The British Crop Protection Council Conference Pest & Diseases , British Crop Protection Council, Brighton UK, 2000, pp.541~548. 6 Zou, X.-J.; Jin, G.-Y . Chin . J . Org . Chem . 2003, 23(1), 62(in Chinese). (邹霞娟, 金桂玉, 有机化学, 2003, 23(1), 62.) 7 Li, Z.-Y .; Li, J.-S., Liu, W.-D. J. Hunan. Univ . (Nat . Sci .Ed .) 2004, 31(1) , 4 (in Chinese).(李仲英, 李江胜, 刘卫东, 湖南大学学报(自然科学版),2004, 31(1), 4.)8 Li, Z.-G.; Wang, Q.-M. Synthesis of Organic Intermediate,2nd ed., Ed.: Li, Z.-G., Chemical Industry Pres, Beijing, 2001, p. 177 (in Chinese).(李在国, 汪清民, 有机中间体制备(第二版), 主编: 李在国, 化学工业出版社, 北京, 2001, p. 177.)(Y0407122 QIN, X. Q.)。
