第一节有机化学概述
第十章有机化学基础第一节 有机物的分类、结构与命名

第十章有机化学基础第一节有机物的分类、结构与命名大家好,今天我们来聊聊有机化学的基础知识,主要是关于有机物的分类、结构与命名。
别看这个话题有点枯燥,但其实它就像我们生活中的调料,让生活变得更加美好。
我们先来了解一下什么是有机物吧。
有机物,顾名思义,就是含有碳元素的物质。
碳元素是生命的基础,没有碳就没有生命。
有机物在我们的日常生活中无处不在,比如水果、蔬菜、衣服、房子等等。
它们就像是我们生活中的小精灵,给我们带来了无尽的惊喜和欢乐。
我们来谈谈有机物的分类。
有机物可以分为两大类:烃和烃的衍生物。
烃是指只含有碳氢化合物的有机物,比如甲烷、乙烷、丙烷等等。
烃的衍生物则是指含有其他元素的有机物,比如醇、醚、醛、酮等等。
这些衍生物都有一个共同的特点,那就是它们都含有碳氢氧三种元素。
现在我们来说说有机物的结构。
有机物的结构非常复杂,但是我们可以用一个简单的模型来表示,那就是一个碳原子周围有若干个氢原子和若干个侧链基团。
这个模型被称为共价键模型。
在这个模型中,每个碳原子都可以与其他原子形成共价键,而这些键的类型和数量决定了有机物的结构和性质。
我们来谈谈有机物的命名。
有机物的命名非常复杂,但是我们可以通过一些规律来进行简化。
我们需要为有机物找到一个母体,也就是一个已经存在的具有相同或相似结构的有机物。
我们需要根据这个母体的名称来为新发现的有机物命名。
这个过程叫做系统命名法。
有机化学是一门非常有趣的学科,它就像是一部生命的百科全书,记录着生命中的点点滴滴。
希望大家在学习有机化学的过程中,能够感受到它的魅力和趣味性。
今天的课就到这里,希望大家能够喜欢这节课的内容,也希望大家能够在今后的学习中取得更好的成绩!谢谢大家!。
有机化学基础第1章第一节

所有有机物命名:选主链-定编号-写名称
作业: 基础训练P1-8
练习:命名下列烯烃或炔烃
CH3—CH = C—CH2—CH3 CH3 CH 2=CH—CH—CH—CH3 CH3 C2H5
3-甲基-2-戊烯
CH3—CH—CH2—C =CH2 C 2 H5 CH3
3,4-二甲基-1-己烯
CH3—CH2—CH—CH—CH2—CH3 CH3 C CH
2,4-二甲基-1-己烯
性质,被称为官能团。
类型 烷烃 烯烃
C C
官能团
类型 醚 醛
官能团 R—O—R(醚键) —CHO(醛基) >C=O (羰基)
无
(碳碳双键)
炔烃
卤代烃 醇(酚)
—C≡C—(碳碳三键) 酮 —X (卤素原子) 羧酸
—COOH (羧基)
—COOR(酯基)
—OH(羟基)
酯
代表物 H2C=CH2 HC≡CH CH3CH2Br CH3CH2OH OH CH3CHO
1.选主链:主链有几个碳就叫“某烷”
最长原则:应选最长的碳链做主链
最多原则:如存在多条最长碳链时,选择含支链最多的 碳链为主链 2.编号: 最近原则:从距离支链最近一端给主链上的碳原子编号 最小原则:两端距离第一个支链一样近时,编号要让所 有支链的位序之和最小
3. 写名称:取代基的位号-取代基数目及名称某烷
(1)取代基的位号必须用阿拉伯数字“1、2、3等”表示。 (2)相同取代基的个数.必须用中文数字“二、三等”表示 (3)位号2,3,4等相邻时,必须用逗号“,”隔开。 (4)名称凡阿拉伯字与汉字相邻时.必须用短线“—”隔开。
(5)如有多种取代基,不管其位号大小如何,都必须把
农学考研之有机化学 第一章 绪论

第一节有机化合物和有机化学有机化学是化学的一个分支,它是研究有机化合物的来源、制备、结构、性能、应用以及有关理论和方法学的科学。
有机化合物的主要特征是含有碳原子,即都是含碳化合物,因此有机化学就是研究碳化合物的化学。
但少数碳的氧化物(如二氧化碳、碳酸盐等)和氰化合物(如氢氰酸、硫氰酸等),仍归属无机化合物范畴。
一、有机化学的发展有机化学作为一门科学是在十九世纪产生的,但有机化合物在生活中和生产中的应用由来已久。
最初是从天然产物中提取有效成分。
例如:从植物中提取染料、药物、香料等。
在十八世纪末,已经得到了许多纯粹的化合物如酒石酸、柠檬酸、乳酸、尿素等。
这些化合物有许多共同性质,但与当时从矿物来源得到的化合物相比,则有明显的区别。
在十九世纪初曾认为这些化合物是在生命力的作用下生成的,有别于从无生命中的矿物中得到的化合物。
因此叫做有机化合物,后者叫做无机物。
有机化合物早期的定义是“来自有生命机体的物质内”简称“有机物”。
这是因为,在化学发展的前期,无机物被大量合成,而有机物只能从动植物体获得。
如1769年从葡萄汁中取得纯的酒石酸;1773年从尿中取得尿素;1780年从酸奶中取得乳酸;1805年从鸦片中取得吗啡等。
因此,人们认为有机物是与生命现象密切相关的,是生物体内一种特殊的、神秘的“生命力”作用下产生的,只能从生物体内得到,不能人工合成。
这就是瑞典化学权威Berzelius为代表的“生命力”学说的观点。
由于人们认识局限性和对权威的迷信,“生命力”学说统治化学界达半个世纪之久,严重阻碍了有机化学的发展。
1828年德国化学家韦勒(F.W hler)将氰酸铵的水溶液加热得到了尿素:氰酸铵可以从无机物NH4Cl和氰酸钾(或银)反应生成。
此后,许多化学家也在实验室用简单的无机物做为原料,成功地合成了许多其他有机物。
如1845年colbe合成了醋酸;1854年Berthelot合成了油脂类物质等。
在大量的科学事实面前,化学家摒弃了“生命力”学说,加强了有机化合物的人工合成实践,促进了这门科学的发展。
第一章 有机化学绪论

Organic Chemistry
主讲:王红梅
有机化学绪论
一、有机化合物和有机化学
二、共价键
三、酸碱理论 四、有机化合物的分类 五、有机化合物构造式的表达方式 六、有机化合物共价键的断裂方式和反应类型
有机化合物命名 同分异构现象 各类化合物结构(杂化形式) 有机化合物性质(特别是化学性质) 各类化合物的制备方法 各类有机化合物之间的转化 立体化学概念 有机反应的机理
实际上碳原子并不直接以激发态的原子轨道参与形成共价键, 而是先杂化,再成键。形成烷烃时,碳原子取 sp3 杂化。
z
四面体结构, 轨道间夹角 为 109.5o.
x
sp3杂化
y
激发态: 2s 1 + 2px1 + 2py1 + 2pz1
1s22(sp3)12(sp3)12 (sp3)12(sp3)1
杂化轨道电子排布
1931年,鲍林(Pauling L)提出原子 轨道杂化理论。
C: 1s22s22px12py1
相互影响、相互混合 2px 2s 2py 2pz
C:1s22s22px12py1
碳原子轨道的这种转化过程成为碳原子的杂化。
杂化轨道(hybrid orbital):
在成键的过程中,由于原子间的相互影响,
上页 下页 首页
sp3杂化
乙烷 (CH3CH3)
σ键: 旋转不影响轨道重叠程度, 即σ 键可沿键轴“自由”转动; 重叠程度 大, 稳定性高; 键的极化度小.
头碰头重叠形成 C-Cσ键
分子中所有键角约为 109.5oC(四面体构型)
H
0p m
bond 154pm
H H H
上页 下页 首页
《有机化学》第一章 绪论

Sp3杂化
2P
2S 6C
2P 跃迁 2S
杂化
Sp3杂化轨道
Sp2杂化
2P 2S 6C
2P 跃迁 2S
杂化
Sp2杂化轨道
Sp2和sp3杂化轨道的形状大体相似,只是由于s成分的 逐渐增多,形状较胖,电负性较大。
Sp杂化
2P 2S 6C
2P 跃迁 2S
杂化
Sp杂化轨道
判断杂化类型的方法(第2和3章重点讲)
第一节 有机化学(Organic chemistry)发展概况
Organic一词的意思是有机的、有生命的 , 因此,有机化合物的最初定义是指来源于 动、植物体的物质 。
甘蔗------制取蔗糖; 大米或果汁----酿制酒精 植物油和草木灰共融--------制成肥皂 米醋------乙酸等称为有机物,形成“生命力论”
共价键 C--C C=C C—O C—N C--Br
键能 347.3 611 359.8 305. 4 284.5
3、键角(bond angle) 有机分子中二个共价键之间的夹角,称为键角。
4、键的极性和分子的极性
当两个相同的原子或原子团形成共价键时,由 于其电负性相同,因此成键电子云对称地分布 在两个原子周围,分子的正、负电荷中心重合, 这种键称为非极性共价键。
=dq 偶极矩的单位为德拜(Debye, Debye.Peter 荷兰物理学家), 简写为D。1D=10-8cm 10-10静电单位。
双原子分子的极性就是其键的极性,多原子分子 的极性是各个价键极性的矢量和。偶极矩是矢量,方向 从正电荷中心指向负电荷中心,可书写如下:
δ+
H
-
Cl
偶极矩 u=q•d
由于青霉素的发现和大量生产,拯救了千百万 肺炎、脑膜炎、脓肿、败血症患者的生命,及时 抢救了许多的伤病员。青霉素的出现,当时曾轰 动世界。为了表彰这一造福人类的贡献,弗莱明、 钱恩、弗罗里于1945年共同获得诺贝尔医学和生 理学奖。
有机化学知识的基本概念第一节有机化合物的组成和结构
强极性键:如C—O、O—H、C—X等键,一般性质活泼, 较易断裂而发生化学反应。
三、结构与性质的关系:
1、结构与物理性质: (1)熔、沸点:分子量越大;分子中支链越少;分子极
性越大的熔沸点越高。 (2)、溶—解C性H:O只等有官分能子团中的含低有级—化O合H物、可—溶N于H2水、。—其CO余O的H
反应基团:C=C、C=O、C≡C、苯环上的键等
C=O + H—H → H—C—O—H (加氢)
C=C + H—CN → H—C—C—CN (加氢氰酸)
C=C + H—X → H—C—C—X (加卤化氢) C=C + H—OH → H—C—C—OH (加水)
加成反应的规律
. 1mol双键需1molH2 ; 1mol叁键需2molH2 .加成反应发生后,碳链结构不变,一般碳原子数目不 变,但加氢氰酸(HCN)后,碳原子数增加一个。
单体分子中一般应含有至少两个可以发
缩
生缩合反应的官能团
聚 特 反应通常发生在官能团上
反 点 高分子链中一般要通过氧、氮等原子相
·能发生银镜反应的物质有:醛、甲酸、甲酸酯、甲酸盐
有机物燃烧的规律: ⑴ N→有N机2、物X燃→烧H时X,各元素的最终产物:C→CO2、H→H2O、 ⑵烃和烃的含氧衍生物完全燃烧后,产物均为CO2和H2O ⑶烃的含氧衍生物燃烧的耗氧量可转化为烃燃烧的耗氧量
⑷1molC消耗1molO2,4molH消耗1molO2 ⑸ Cn符H2合nO通z的式有C机nH物2nO完z全的燃有烧机,物其完产全物燃C烧O规2和律H:2O(符g)合的通体式积相等。 ⑹100℃以上,有机物完全燃烧前后气体体积不变化的规律。
有机化学基础

有机化合物中的氢原子被其他原子或基团 取代的反应,如烷烃的卤代、醇的酯化等 。
04
有机化合物的合成与分离
有机化合物的合成方法
烃类化合物的烷基化
通过卤代烃与醇、酚等烃类化合物进行烷基化反应,合成相应的 烃类化合物。
烃类化合物的酰基化
通过酰卤、酸酐等酰基化试剂与烃类化合物进行酰基化反应,合成 相应的酰基化合物。
有机化学面临的挑战与机遇
01
理论预测与实验的结合
尽管有机化学已有许多经典的 理论,但在解释复杂体系时仍 存在困难。未来的研究将更加 注重理论预测与实验的结合, 提高对分子结构和性质的预
随着新材料和新技术的发展, 有机化学将有更多的可能性。 例如,有机场效应晶体管、有 机太阳能电池等新型器件为有 机功能材料的研究提供了广阔
食品领域
食品添加剂、调味品等也是有机化合物 ,对改善食品口感和品质有着重要作用 。
02
有机化合物的分类与命名
有机化合物的分类
烃类:包括脂肪烃、芳香烃 等。
烃的衍生物:如醇、醛、酮 、羧酸等。
02
01
含氮化合物:如胺、腈等。
03
含氧有机化合物:如醚、酮 、酯等。
04
05
含硫有机化合物:如硫醇、 硫醚等。
有机化合物的命名规则
选择主链
选择最长的碳链为主链。
命名取代基
根据取代基的名称和位置进行命名。
编号
从离取代基近的一端开始编号。
官能团
根据官能团的名称和位置进行命名。
常见有机化合物的命名示例
01
甲烷:CH4
02
乙醇:CH3CH2OH
03
乙醛:CH3CHO
常见有机化合物的命名示例
化学基础有机

化学基础有机一、有机化学简介有机化学,又称为碳化合物化学,是化学科学的一个重要分支。
它主要研究含碳元素的化合物的合成、结构、性质、反应机理以及相互转化的规律。
有机化学不仅是合成具有重要实用价值的有机化合物的基础学科,同时也是化学工业的重要组成部分。
二、有机化学发展历程有机化学的发展可以追溯到古代,人类在生产和生活实践中就已经开始接触和利用有机化合物。
然而,真正意义上的有机化学的研究是从18世纪后半叶开始的。
这一时期的化学家们开始对有机化合物的结构、性质和反应机理进行系统的研究。
进入20世纪后,随着科技的不断进步,有机化学的发展取得了巨大的突破。
特别是在20世纪70年代以后,随着计算机技术和谱学分析方法的快速发展,有机化学的研究进入了分子设计和功能化的新阶段。
三、有机化学基本概念1.有机化合物:通常是指含有碳元素的化合物,但不包括碳的氧化物、碳酸盐、碳酸等无机化合物。
2.有机化学反应:是指碳与碳原子之间进行的各种化学反应,主要包括取代反应、加成反应、消除反应、重排反应等。
3.共价键:原子之间通过共享电子而形成的化学键,是有机化合物结构的基础。
4.官能团:是指一种或多种活性原子的组合,可以决定有机化合物的性质。
5.手性:是指一个物体不能与其镜像相重合的性质。
在有机化合物中,手性通常是指分子中存在手性碳原子。
四、有机化学反应类型1.取代反应:有机化合物分子中的某一原子或基团被其他原子或基团取代的反应。
2.加成反应:有机化合物分子中碳碳双键或三键发生断裂,与其它原子或基团结合生成新的化合物的反应。
3.消除反应:在一定的条件下,一分子有机物脱去一分子水或卤化氢等小分子的反应。
4.重排反应:由于基团之间的迁移或交换,使得分子的原有结构发生改变的反应。
5.聚合反应:由小分子重复生成高分子化合物的反应。
6.水解反应:水分子与有机化合物反应,使其分解成两部分或更多部分的反应。
7.氧化还原反应:涉及电子传递的氧化和还原的有机反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳之间的结合方式有单键、双键或叁键;多个碳原子之间可 以相互形成长短不一的碳链和碳环,碳链和碳环也可以相互 结合,所以有机物结构复杂,数量庞大。
二、有机化合物的同分异构现象
1.同分异构现象的概念 化合物具有相同的分子式,但具有不同的结构的现象叫 做同分异构现象。具有同分异构现象的化合物互称为同分异 构体。它是有机物种类繁多的重要原因之一。同分异构体之 间的转化是化学变化。同分异构体的特点是分子式相同,结 构不同,性质不同。 2.同分异构现象的类别 (1)碳链异构:由于碳碳骨架不同产生的异构现象。 (2)位置异构:由于官能团位置不同产生的异构现象,如 CH3CH=CHCH3和CH2=CH—CH2—CH3。 (3)官能团异构:由于具有不同的官能团而产生的异构现
2、物理性质方面:难溶于水、易溶于有机溶剂;熔点
低,水溶液不导电。(大多是非电解质)
3、易燃烧,热不稳定。大多含有碳、氢元素。受热分解
生成会生成碳、氢等单质。
4、反应复杂、副反应多。(共价化合物,涉及到共价
键断裂和形成)。
有机物的以上性质特点与其 结构密切相关。
?
有机物中碳原子成键特征
1、碳原子含有4个价电子,可以跟其它原子形成
▪
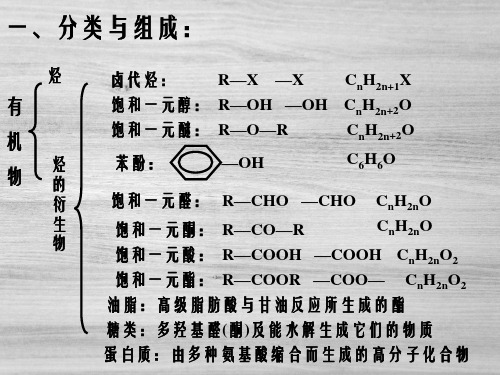
一、按碳的骨架分类
二、按官能团分类
1.烃的衍生物是指烃分子里的氢原子被其他原子或原子团所取代而
形成的一系列新的化合物。烃的衍生物的定义只是针对结构而言,并非
一定是烃衍变而来的。
2.官能团是指决定化合物特殊性质的原子或原子团。
乙烯的官能团为
,乙醇的官能团为—OH,乙酸的官能
团为— COOH,一氯甲烷的官能团为—Cl。
__________________。 (3) 其 中 能 跟 C2H5 + 结 合 生 成 有 机 物 分 子 的 微 粒 有
__________________。
解析:(1)官能团属于基,而基不一定是官能团,容易判断② ⑤⑥是官能团,要注意的是烷基、苯环都不是官能团。
(2)—C2H5是基,根据“基与基之间能直接结合成共价分 子”的原则可知:能跟—C2H5结合生成有机物分子的微粒有 ②⑤⑥⑨。
3.有机物的主要类别、官能团和典型代表物
类别 烷烃 烯烃 炔烃 芳香烃
官能团和名称 典型代表物的名称
和结构简式
7
卤代烃 醇 酚 醚 醛 酮 羧酸 酯
8
3.有机物的主要类别、官能团和典型代表物
类别 烷烃
官能团和名称 —
典型代表物的名称和 结构简式
甲烷 CH4
烯烃
炔烃 芳香烃 卤代烃
醇 酚
双键 —C≡C— 三键
CH2CH2CH2CH3、
、
、
四种烃基,由此可
得同系物结构简式。
答案:
跟踪练习2:
某化合物A的化学式为 C5H11Cl,分析数据表明,分子中有两
个“—CH2—”、两个“—CH3”、一个“—CH3
”
和一个“—Cl”,试写出它的同分异构体的结构简式。 答案
“相同”的内容 “不同”的内容 适用范围
同系物
醛基(
)、羧基(
)则可进一步简
写为—CHO、—COOH。
知识点1:有机化合物中碳原子的成键特点
例1:大多数有机物分子中的碳原子与碳原子或碳原子与
其他原子相结合的化学键是( )
A.只有非极性键
B.只有极性键
C.有非极性键和极性键 D.只有离子键
解析:碳原子最外层有4个电子,不易失去或得到电子而
形成阳离子或阴离子。碳原子通过共价键与H、O、N、S、P
结构相似、化学性质相 分子式不同、物理性质不完 似、分子通式相同 全相同
有机物(化合物)
同分异构体
分子式相同
结构不同,物理性质不完全 相同,不同类时化学性 质不同
有机物(化合物)
同素异形体
组成元素相同
分子内原子个数不同、结构 不同
无机单质
同位素
质子数相同,化学性质 中子数不同,质量数不同,
相同
物理性质有差别
知识点2:官能团、根和基的区别 例2:有9种微粒:①NH2-;②—NH2;③Br-;④OH
-;⑤—NO2;⑥—OH;⑦NO2;⑧CH3+;⑨—CH3。 (1)上述9种微粒中,属于官能团的有______________(填
序号,下同)。 (2) 其 中 能 跟 —C2H5 结 合 生 成 有 机 物 分 子 的 微 粒 有
解析:此题是按官能团的不同来进行分类的,所以
找准有机化合物所含有的官能团是正确答题的关
键。
答案: (1)⑨
(2)③⑥
(3)① (4)⑤ (5)⑦
(6)② (7)⑧⑩ (8)④
跟踪(练1)习属1于芳下香列族有化机合物物中的:是__①__②___⑤__⑥__⑦___⑧__⑨。 (2)属于芳香烃的是____②__⑤__⑦__⑨______。 (3)属于苯的同系物的是____⑦___⑨_________。
电中性 有机化合物
带一个单位负电荷 无机化合物
知识点1:有机化合物的分类
例1、请同学们根据官能团的不同对下列有机物进 行分类。
①CH3CH2OH ②
④
⑤
③CH3CH2Br ⑥
⑦
⑧
⑨
⑩
(1)芳香烃:____________。 (2)卤代烃:____________。 (3)醇:________________。 (4)酚:________________。 (5)醛:________________。 (6)酮:________________。 (7)羧酸:______________。 (8)酯:________________
3、醇和酚的区别 4、一些官能团的写法
11
*官能团和根(离子)、基的区别
(1)基与官能团 基:有机物分子里含有的原子或原子团。 官能团:决定化合物特殊性质的原子或原子团。 两者的关系:“官能团”属于“基”, 但“基”不一定是 “官能团”。 (2)基与根
类别 实例
基 羟基
根 氢氧根
电子式
区
别
电性
存在
C原子的成键方式,决定了分子的空间构型
1. 四键C原子跟它周围的原子形成四面体结 构;
2. 三键C原子跟它周围的原子形成平面结构; 3. 二键C原子跟它周围的原子(链状分子中)
形成直线型结构。
结构式的简便写法,着重突出结 构的特点(官能团),与结构式相比 能够删繁就简有利于把握有机化 合物的结构特征
能够表示有机化合物分子的结 构,只要求表示出碳碳键以及与 碳原子相连的基团,图式中的每 个拐点和终点均表示一个碳原 子,比结构简式更为简单明了
书写结构简式时要注意:①表示原子间形成单键的“—”可以省 略; ②C=C、C≡C中的“=”、“≡”不能省略,但是
象,如
和
。
二、有机化合物分子结构的表示方法
种类 化学式
最简式 (实验式)
电子式
实例 乙烯C2H4、 戊烷C5H12
乙烷CH3、 烯烃CH2 乙烯
球棍模型 乙烯
含义
用元素符号表示物质分子组 成的式子,可反映出一个分 子中原子的种类和数目
表示物质组成的各元素原子 最简整数比的式子,由最简 式可求最简式量
4个共价键;
H :CH.... :原子形成共价键;碳原子间易
形成单键、双键、叁键、碳链、碳环等多种复杂的结
构单元。
C CCC
CC CC
C CCC
有机物的分类
▪ 有机化合物从结构上有两种分类方法:一是按照 构成有机化合物分子的碳的骨架来分类;二是按 照反映有机化合物特性的特定原子团来分类。
(3)C2H5+带正电荷,根据“带异性电荷的微粒相互吸引 结合成化合物”的原则可知:能跟C2H5+结合生成有机物分 子的微粒有①③④。 答案:(1)②⑤⑥
(2)②⑤⑥⑨ (3)①③④
思考:由O、H两种元素构成的化合物只发现了H2O
和H2O2两种,而由C、H构成的有机物目前却超过了 几百万种,你知道其中的原因吗?分子式为C5H12的 物质一定是纯净物吗?
原子
同种物质
组成、结构、性质都相 分子式、结构式的形式及状
同
态可能不同
无机物或有机物
常见异类异构
具有相同C原子数的异类异构有: ①烯烃与环烷烃(CnH2n) ②炔烃、二烯烃和环烯烃(CnH2n-2) ③苯的同系物、二炔烃和四烯烃等(CnH2n-6) ④饱和一元醇和醚、烯醇和烯醚等(CnH2n+2O) ⑤饱和一元醛和酮、烯醛和烯酮等(CnH2nO) ⑥饱和一元羧酸、饱和一元酯和饱和一元羟醛等(CnH2nO2) ⑦苯酚同系物、芳香醇和芳香醚(CnH2n-6O) ⑧氨基酸和硝基化合物(CnH2n+1NO2)
用“·”或“×”表示电子, 表示分子中各原子最外层电 子成键情况的式子
小球表示原子,短棍表示共 价键,用于表示分子的空间 结构(立体形状)
种类 比例模型
实例 乙烯
结构式
乙烯
结构简式
乙醇 CH3CH2OH
键线式
乙酸
含义
用不同体积的小球表示不同的原 子大小,用于表示分子中各原子 的相对大小及结合顺序
具有化学式所能表示的意义,能 反映物质的结构;能完整地表示 出有机物分子中每个原子的成键 情况的式子,但不表示空间结构
— —X(X 表示卤素原子)
—OH 羟基 —OH 羟基
乙烯 CH2=CH2
乙炔 HC≡CH 苯
溴乙烷 CH3CH2Br 乙醇 CH3CH2OH 苯酚
类别
官能团和名称
醚
醚键
醛 醛基
酮 羰基
羧酸 羧基
酯 酯基
