专题:工艺流程题
高考化学工艺流程题目专项练习

高考化学工艺流程题目专项练习1.废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。
湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。
某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是________。
循环使用的NH4Cl 在反应Ⅰ中的主要作用是_________________________________________。
【答案】H2SO4防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀【解析】操作④得到的H2SO4可以利用到反应Ⅲ中,所以第三处循环的试剂为H2SO4;NH4Cl水解溶液呈酸性,可以中和溶液中的OH―,防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀。
2.毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:pH pHCa2+Mg2+Fe3+开始沉淀时的pH 11.9 9.1 1.9完全沉淀时的pH 13.9 11.1 3.2加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。
加入H2C2O4时应避免过量,原因是_____________________________________________________________。
已知:K sp(BaC2O4)=1.6×10-7,K sp(CaC2O4)=2.3×10-9。
【答案】Fe3+Mg(OH)2、Ca(OH)2H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少【解析】根据流程图及表格中数据可知,加入NH3·H2O调节pH=8时,只有Fe3+完全沉淀而除去。
加入NaOH,调pH=12.5,对比表格中数据可知,此时Mg2+完全沉淀,Ca2+部分沉淀,所以滤渣Ⅱ中含Mg(OH)2、Ca(OH)2。
专题10 化学工艺流程(题型突破)(测试)-2024年高考化学二轮复习讲练测(新教材(0002)

专题10 化学工艺流程(题型突破)(考试时间:90分钟试卷满分:100分)一、选择题(本题共15小题,每小题3分,共45分。
每小题只有一项是符合题目要求的)1.工业上常用软锰矿生产纯净的MnO2,工艺流程如图所示,已知软锰矿的主要成分为MnO2,还含有少量SiO2、Al2O3。
下列说法错误的是( )A.“溶解”过程中有氢气生成B.“过滤”得到的滤渣中含有H2SiO3C.“纯化”过程中应先加MnO2,再调pH=5,过滤D.“电解”时MnO2在电解池阳极生成,溶液pH值降低【答案】B【解析】软锰矿的主要成分为MnO2,还含有少量SiO2、Al2O3,加入较浓的硫酸和铁屑后MnO2被还原为Mn2+,Al2O3溶解为AlCl3,SiO2不反应,为过滤后的滤渣,再加入二氧化锰氧化Fe2+生成Fe3+后,调节pH=5,除去杂质铁和铝元素生成沉淀,电解Mn2+生成MnO2。
A项,“溶解”过程中硫酸变稀硫酸后会与铁屑反应生成氢气,故A正确;B项,根据分析可得,“过滤”得到的滤渣中含有SiO2,故B错误;C项,“纯化”过程中应先加MnO2氧化Fe2+生成Fe3+后,再调pH=5,过滤,故C正确;D项,“电解”时Mn2+失电子生成MnO2,故在电解池阳极生成,发生反应Mn2+-2e-+2H2O=MnO2+4H+,故溶液pH值降低,故D正确;故选B。
2.聚合硫酸铁[Fe2(OH)m((SO4)p]n是一种新型絮凝剂,其处理污水能力比FeCl3强,且腐蚀性小。
工业上利用废铁屑为原料制备聚合硫酸铁的工艺流程如图。
下列说法正确的是( )A.聚合硫酸铁[Fe2(OH)m((SO4)p]n中m=6-2pB.酸浸槽中加入的酸液可用稀硝酸C.反应釜中发生的离子反应为H2O2+Fe2++H+=Fe3++H2OD .聚合釜中控制溶液的pH 越大越好【答案】A【解析】A 项,化学式[Fe 2(OH)m ((SO 4)p ]n 中:()()()32120m p +⨯+-⨯+-⨯=,即62m p =-,A 正确;B 项,酸浸槽中加入的酸液是硫酸,如果加入硝酸,一方面会生成有毒气体,另一方面会引入NO 3-杂质,B错误;C 项,反应釜中加入的H 2O 2将Fe 2+氧化为Fe 3+,正确的离子方程式为H 2O 2+2Fe 2++2H +=2Fe 3++2H 2O ,C 错误;D 项,如果聚合釜中溶液的pH 控制过大,会生成氢氧化铁沉淀,达不到制取聚合硫酸铁的目的,D 错误;故选A 。
工艺流程题技巧

化学工艺流程题一、考点归纳A、对反应速率的影响B、对平衡转化率的影响C、对综合生产效益的影响(能源成本,对设备的要求,环境保护)二、考点问题A、滤渣、滤液的主要成分B、化学方程式书写C、循环利用与回收利用的物质(循环利用是作为原料投入了,回收利用是指副产品)D、特定步骤中加某物质的作用。
(一般题干会有隐含信息。
比如一些物质易挥发,高温易分解等等;加NaCl可以提高PbCl2的溶解度,加NaCl可以降低过碳酸钠的溶解度等等)三、答题逻辑和思路1、“浸出”步骤中,为提高镁的浸出率,可采取的措施有:答:适当提高反应温度、增加浸出时间,搅拌,加入过量硫酸2、如何提高吸收液和SO2反应速率:答:适当提高温度、增大吸收液浓度、增大SO2与吸收液的接触面积、搅拌、粉粹3、加热目的:加快反应速率或促进平衡向某个方向(一般是有利于生成物生成的方向)移动。
4、温度不高于××℃的原因:温度过高会造成(如浓硝酸)挥发、(如H2O2、NH4HCO3)分解、(如Na2SO3)氧化或促进(如AlCl3)水解等,影响产品的生成,副产品产生,催化剂失活。
5、从溶液中得到晶体蒸发结晶、趁热过滤(如果温度下降,杂质也会以晶体的形式析出来)、洗涤、干燥。
蒸发浓缩、冷却结晶、过滤、洗涤(冰水洗、热水洗、乙醇洗)、干燥。
6、趁热过滤的原因即操作:防止杂质析出;操作:已预热的布氏漏斗趁热抽滤7、冰(热)水洗涤的目的:防止晶体损失。
8、乙醇洗涤的目的:降低被洗涤物质的溶解度,得到较干燥的产物,防止晶体损失。
9、沉淀洗涤操作:答:沿玻璃棒往漏斗中加蒸馏水至液面浸没沉淀,待水自然流下后,重复操作2~3次。
10、洗涤的目的:①除掉附着在沉淀表面的可溶性杂质。
②提高可溶性物质的产率11、过滤后滤液仍然浑浊的可能的操作原因:答:玻璃棒下端靠在滤纸的单层处,导致滤纸破损;漏斗中液面高于滤纸边缘12、检验沉淀Fe(OH)3是否洗涤干净(含SO42-):答:取最后一次洗涤液,加入BaCl2溶液,若无白色沉淀则说明洗涤干净。
2024高考化学工艺流程专题
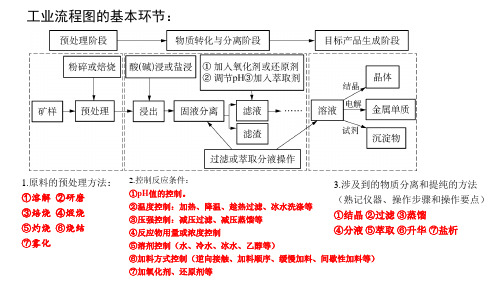
②还原焙烧:指在低于炉料熔点和还原气氛条件下,使矿石中的金属氧化物转变为相应 低价金属氧化物或金属的焙烧过程。 该焙烧过程中,一般要在矿石中附加细小的炭粒作还原剂。 还原焙烧目前主要用于处理难选的铁、锰、镍、铜、锡、锑等矿物原料。
产物 ②控制反应速率 ③控制反应物转化率和产品产率 ④控制环境温度 ⑤抑制(促进)离子 的水解 ⑥降低生产成本酸浸时酸过量的目的:为了提高矿石中某金属元素的浸取率;抑制**离 子的水解等。对有多种反应物的体系,增大便宜、易得的反应物的浓度目的是:提高其他物质 的利用率,使反应充分进行;降低生产成本等。如:增大浓度可以加快反应速率,使平衡发生 移动等。(应结合具体问题进行具体分析)。(2)控制加料的方法:逆向接触、加料顺序、缓 慢加料、间歇性加料等。
(2023·全国甲卷第26题)BaTiO3是一种压电材料。以BaSO4为原料,采用下 列路线可制备粉状BaTiO3。
回答下列问题:(1)“焙烧”步骤中碳粉的主要作用是_______。(2)“焙烧”后固体产物 有BaCl2、易溶于水的BaS和微溶于水的CaS。
“浸取”时主要反应的离子方程式为_______。 (1)“焙烧”步骤中,BaSO4与过量的碳粉及过量的氯化钙在高温下焙烧得到CO、BaCl2、BaS 和CaS,BaSO4被还原为BaS,因此,碳粉的主要作用是做还原剂,将BaSO4还原。(2)S2-易发生 水解生成HS-,
4.研磨:增大固体样品与溶液的接触面积,加快反应(浸取)速率或使反应更充分。
真题思演维练模型和方法模型
pcb工艺流程考试试题

pcb工艺流程考试试题一、单选题(每题3分,共30分)1. PCB的中文名称是()A. 印刷电路板。
B. 集成电路板。
C. 电子线路板。
D. 以上都不对。
答案:A。
解析:PCB就是Printed Circuit Board的缩写,直接翻译过来就是印刷电路板,这是在电子行业中最常用的名称哦。
2. PCB制作的第一步通常是()A. 图形转移。
B. 开料。
C. 钻孔。
D. 沉铜。
答案:B。
解析:就像盖房子要先准备材料一样,PCB制作首先得把大块的原材料进行开料,切成合适的尺寸,这样才能进行后续的加工呀。
3. 在PCB钻孔工序中,主要目的是()A. 安装元器件。
B. 连接不同层的线路。
C. 美观。
D. 减轻重量。
答案:A、B。
解析:钻孔一方面是为了安装像电阻、电容这些元器件,把它们的引脚通过孔固定在PCB板上;另一方面呢,对于多层板来说,钻孔还能连接不同层之间的线路,就像在楼层之间打通楼梯一样的道理。
4. 沉铜的作用是()A. 在孔壁上沉积一层铜。
B. 去除铜箔表面的杂质。
C. 给PCB板镀上一层厚厚的铜。
D. 改变PCB板的颜色。
答案:A。
解析:沉铜就是在钻孔后的孔壁上沉积一层薄薄的铜,这样才能保证孔壁导电,方便后续的线路连接哦。
5. 图形转移过程中,常用的方法不包括()A. 丝网印刷。
B. 光刻。
C. 手工绘制。
D. 电镀。
答案:D。
解析:图形转移就是把设计好的电路图形弄到PCB板上嘛。
丝网印刷、光刻都是常用的方法,以前还有手工绘制的呢,但是电镀是在已有图形的基础上进行金属沉积的,不属于图形转移的方法哦。
6. PCB板进行表面处理的目的不包括()A. 防止铜箔氧化。
B. 提高可焊性。
C. 增加PCB板的硬度。
D. 改善电气性能。
答案:C。
解析:表面处理主要是为了不让铜箔生锈(氧化),让焊接元器件的时候更容易(提高可焊性),还有改善电气性能。
但是一般不会为了增加PCB板的硬度而进行表面处理呢。
7. 多层PCB板中,层与层之间的绝缘材料通常是()A. 铜箔。
专题16工艺流程题——三年(2020-2022)高考真题化学分项汇编(全国通用)(原卷版)

专题16 工艺流程题1.(2022·全国甲卷)硫酸锌(4ZnSO )是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。
硫酸锌可由菱锌矿制备。
菱锌矿的主要成分为3ZnCO ,杂质为2SiO 以及Ca 、Mg 、Fe 、Cu 等的化合物。
其制备流程如下:本题中所涉及离子的氯氧化物溶度积常数如下表: 离子3+Fe2+Zn 2+Cu 2+Fe 2+MgspK384.010-⨯ 176.710-⨯ 202.210-⨯168.010-⨯ 111.810-⨯回答下列问题:(1)菱锌矿焙烧生成氧化锌的化学方程式为_______。
(2)为了提高锌的浸取效果,可采取的措施有_______、_______。
(3)加入物质X 调溶液pH=5,最适宜使用的X 是_______(填标号)。
A .32NH H O ⋅ B .2Ca(OH) C .NaOH 滤渣①的主要成分是_______、_______、_______。
(4)向80~90℃的滤液①中分批加入适量4KMnO 溶液充分反应后过滤,滤渣②中有2MnO ,该步反应的离子方程式为_______。
(5)滤液②中加入锌粉的目的是_______。
(6)滤渣④与浓24H SO 反应可以释放HF 并循环利用,同时得到的副产物是_______、_______。
2.(2022·全国乙卷)废旧铅蓄电池的铅膏中主要含有4PbSO 、2PbO 、PbO 和Pb 。
还有少量Ba 、Fe 、Al 的盐或氧化物等。
为了保护环境、充分利用铅资源,通过下图流程实现铅的回收。
一些难溶电解质的溶度积常数如下表: 难溶电解质4PbSO3PbCO4BaSO3BaCOspK82.510-⨯ 147.410-⨯ 101.110-⨯ 92.610-⨯一定条件下,一些金属氢氧化物沉淀时的pH 如下表: 金属氢氧化物 3Fe(OH)2Fe(OH)3Al(OH)2Pb(OH)开始沉淀的pH 2.3 6.8 3.5 7.2 完全沉淀的pH 3.28.34.69.1回答下列问题:(1)在“脱硫”中4PbSO 转化反应的离子方程式为________,用沉淀溶解平衡原理解释选择23Na CO 的原因________。
高考化学专题复习《化学工艺流程》真题练习题

高考化学专题复习《化学工艺流程》真题练习1.(2022•河北省选择性考试)LiBr溶液可作为替代氟利昂的绿色制冷剂。
合成LiBr工艺流程如下:下列说法错误的是( )A.还原工序逸出的Br2用NaOH溶液吸收,吸收液直接返回还原工序B.除杂工序中产生的滤渣可用煤油进行组分分离C.中和工序中的化学反应为Li2CO3+2HBr=CO2↑ +2LiBr +H2OD.参与反应的n(Br2):n(BaS):n(H2SO4)为1:1:1【答案】A【解析】由流程可知,氢溴酸中含有少量的溴,加入硫化钡将溴还原生成溴化钡和硫,再加入硫酸除杂,得到的滤渣为硫酸钡和硫;加入碳酸锂进行中和,得到的溴化锂溶液经浓缩等操作后得到产品溴化锂。
A 项,还原工序逸出的Br2用NaOH溶液吸收,吸收液中含有溴化钠和次溴酸钠等物质,若直接返回还原工序,则产品中会有一定量的溴化钠,导致产品的纯度降低,A错误;B项,除杂工序中产生的滤渣为硫酸钡和硫,硫属于非极性分子形成的分子晶体,而硫酸钡属于离子晶体,根据相似相溶原理可知,硫可溶于煤油,而硫酸钡不溶于煤油,因此可用煤油进行组分分离,B正确;C项,中和工序中,碳酸锂和氢溴酸发生反应生成溴化锂、二氧化碳和水,该反应的化学方程式为Li2CO3+2HBr=CO2↑ +2LiBr +H2O,C正确;D项,根据电子转化守恒可知,溴和硫化钡反应时物质的量之比为1:1;根据硫酸钡的化学组成及钡元素守恒可知,n(BaS):n(H2SO4)为1:1,因此,参与反应的n(Br2):n(BaS):n(H2SO4)为1:1:1,D正确;故选A。
2.(2022•山东卷)已知苯胺(液体)、苯甲酸(固体)微溶于水,苯胺盐酸盐易溶于水。
实验室初步分离甲苯、苯胺、苯甲酸混合溶液的流程如下。
下列说法正确的是( )A.苯胺既可与盐酸也可与NaOH溶液反应B .由①、③分别获取相应粗品时可采用相同的操作方法C .苯胺、甲苯、苯甲酸粗品依次由①、②、③获得D .①、②、③均为两相混合体系【答案】C【解析】根据题给流程可知,向甲苯、苯胺、苯甲酸的混合溶液中加入盐酸,盐酸将微溶于水的苯胺转化为易溶于水的苯胺盐酸盐,分液得到水相Ⅰ和有机相Ⅰ;向水相中加入氢氧化钠溶液将苯胺盐酸盐转化为苯胺,分液得到苯胺粗品①;向有机相中加入水洗涤除去混有的盐酸,分液得到废液和有机相Ⅰ,向有机相Ⅰ中加入碳酸钠溶液将微溶于水的苯甲酸转化为易溶于水的苯甲酸钠,分液得到甲苯粗品②和水相Ⅰ;向水相Ⅰ中加入盐酸,将苯甲酸钠转化为苯甲酸,经结晶或重结晶、过滤、洗涤得到苯甲酸粗品③。
高考化学专题-工艺流程题(含答案)

高考专题练习—-工艺流程题1.(15分)聚合氯化铝晶体的化学式为[Al 2(OH)n Cl 6—n ·xH 2O]m ,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl 3溶液的pH ,通过促进其水解而结晶析出。
其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al 2O 3、Al ,还有SiO 2等杂质。
聚合氯化铝生产的工艺流程如下:(1)搅拌加热操作过程中发生反应的离子方程式; 。
(2)生产过程中操作B 和D 的名称均为(B 和D 为简单操作)。
(3)生产过程中可循环使用的物质是(用化学式表示)。
(4)调节pH 至4。
0~4。
5的目的是.(5)实验室要测定水处理剂产品中n 和x 的值。
为使测定结果更准确,需得到的晶体较纯净。
生产过程中C 物质可选用。
A .NaOHB .AlC .氨水D .Al 2O 32.(16分)将磷肥生产中形成的副产物石膏(CaSO 4·2H 2O )转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图。
(1)本工艺中所用的原料除CaSO 4·2H 2O 、(NH 4)2CO 3外,还需要_______________等原料; (2)石膏悬浊液中加入碳酸铵溶液后反应的化学方程式为:______________________________________________________________________________;(3)过滤Ⅰ操作所得固体有______________________(填化学式)等物质,该固体可用作生产水泥的原料; (4)过滤Ⅰ操作所得滤液是(NH 4)2SO 4溶液。
检验滤液中含有NH 4+的方法是:_____________________________________________________________________________;(5)氯化钙结晶水合物(CaCl 2·6H 2O )是目前常用的无机储热材料,选择的依据除熔点较低和熔化的热效应高外,还因为其____________________________________________,举出该晶体的无水物在实验室的一种用途____________________________________________ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高三化学工艺流程题专题
1、亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为。
(2)发生器中鼓入空气的作用可能是(选填序号)。
a.将SO2氧化成SO3,增强酸性;b.稀释ClO2以防止爆炸;c.将NaClO3氧化成ClO2(3)吸收塔内的反应的化学方程式为。
吸收塔的温度不能超过20℃,其目的是。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。
除H2O2外,还可
以选择的还原剂是(选填序号)。
a.Na2O2b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是(选填序号)。
a.蒸馏b.蒸发c.灼烧d.过滤e.冷却结晶要得到更纯的NaClO2•3H2O晶体必须进行的操作是(填操作名称)。
2、工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)工业生产时,制取氢气的一个反应为:CO+H 2O CO 2+H 2
①t ℃时,往1L 密闭容器中充入0.2mol CO 和0.3mol 水蒸气。
反应建立平衡后, 体系中c (H 2)=0.12mol·L -
1。
该温度下此反应的平衡常数K = 。
②保持温度不变,向上述平衡体系中再加入0.1molCO ,当反应重新建立平衡时, 水蒸气的总转化率α (H 2O)= 。
(2)合成塔中发生反应为:N 2(g)+3H 2(g)
2NH 3(g);△H<0。
下表为不同温度下
该反应的平衡常数。
由此可推知,表中T 1 573K (填“>”、“<”或“=”)。
T/K T 1 573 T 2 K
1.00×107
2.45×105
1.88×103
(3)NH 3和O 2在铂系催化剂作用下从145℃就开始反应: 4NH 3+5O 2
4NO+6H 2O △H=-905kJ·mol -
1
不同温度下NO 产率如图所示。
温度高于900℃时,NO 产
率下降的原因 。
(4)吸收塔中反应为:3NO 2+H 2O
2HNO 3+NO 。
从生产流程看,吸收塔中需要补
充空气,其原因是 。
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。
目前科学家探索利 用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH 4(g)+4NO 2(g)=4NO(g)+CO 2(g)+2H 2O(g); △H=-574kJ·mol
-1
CH 4(g)+4NO(g)=2N 2(g)+CO 2(g)+2H 2O(g); △H=-1160kJ·mol -
1
则甲烷直接将NO 2还原为N 2的热化学方程式为:__________________________。
空气
氧化炉 N 2、H 2
合成塔 氨气 吸收塔 水
尾气
硝酸镁
蒸馏塔
浓硝酸
产率
NO
3、红矾钠(重铬酸钠:Na 2Cr 2O 7·2H 2O )是重要的基本化工原料,在印染工业、电镀工业和 皮革工业中作助剂,在化学工业和制药工业中也用作氧化剂,应用领域十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr 2O 3)利用以下过程来制取。
①步骤I 中反应的化学方程式为:
4FeO ·Cr 2O 3(s) + 8Na 2CO 3(s) + 7O 2 = 8Na 2CrO 4(s) + 2Fe 2O 3(s) + 8CO 2
该反应的化学平衡常数的表达式为 ,在常温下该反应速度极慢, 下列措施中能使反应速率增大的是 。
A .升高温度
B .通入过量的空气
C .将原料粉碎
D .增加纯碱的用量 ②步骤Ⅱ中所得溶液显碱性,其中除含有Na 2CrO 4外还含有铝、硅元素的化合物,它们 的化学式可能是 、 。
③步骤Ⅲ需将溶液的pH 调至7~8并煮沸,其目的是 。
④步骤Ⅳ中发生反应的离子方程式为: 。
(2)将红矾钠与KCl 固体按1:2(物质的量比)混合溶于水后经适当操作可得到K 2Cr 2O 7 晶体。
请填写表中空格,完成上述过程。
(已知:在室温下重铬酸钾溶解度很小,而在 升高温度时,其溶解度大大增加)。
Ⅱ浸取
I 氧化
Ⅲ
Ⅳ加H 2SO 4酸化
Ⅴ
产品:Na 2Cr 2O 7·2H 2O
铬渣(含硫酸钠)
铬铁矿等原料 Na 2CrO 4溶液
4、由磷矿石、石英、氯化氢等为原料生产白炭黑(SiO2·nH2O)、磷及甲醇,下列工艺过程原料综合利用率高,废弃物少。
(1)上述反应中,属于置换反应的是(选填:Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ)。
(2)已知SiHCl3的沸点为33.0℃,提纯SiHCl3适宜的方法是。
(3)高温下进行的反应Ⅱ的化学方程式为:;
固体废弃物CaSiO3可用于。
(4)反应Ⅲ需在高温、隔绝氧气和无水条件下进行,其原因是。
(5)CH3OH可用作燃料电池的燃料,在强酸性介质中,负极的电极反应式为。
5、高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。
某研究小组设计了用工业废铁屑(含铜、碳、硅等)制取高铁酸钠的工艺流程,其中X、Y、Z是含铁化合物。
(1)废铁屑中加入碳酸钠热溶液的目的是。
(2)试写出上述过程中X转化为Y的离子方程式。
(3)写出Cl2将Z氧化为Na2FeO4的化学方程式。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理。
(5)高铁酸钠还可以用电解法:Fe+2NaOH+2H2O=Na2FeO4+2H2↑,写出电解时阳极的电极
反应式。
