什么叫原子晶体
离子晶体、分子晶体、原子晶体

2、物理特性:
(1)较低的熔点和沸点,易升华; (2)较小的硬度; (3)一般都是绝缘体,熔融状态也不导电。
原因:分子间作用力较弱
3、典型的分子晶体:
–非金属氢化物:H2O,H2S,NH3,CH4,HX –酸:H2SO4,HNO3,H3PO4 –部分非金属单质:X2,O2,H2, S8,P4, C60 –部分非金属氧化物: CO2, SO2, NO2, P4O6, P4O10 –大多数有机物:乙醇,冰醋酸,蔗糖
思考1 原子晶体的化学式是否可以代表其分子式?
不能。因为原子晶体是一个三维的网状结构,无 小分子存在。
思考2 以金刚石为例,说明原子晶体的微观结构与分 子晶体有哪些不同? (1)组成微粒不同,原子晶体中只存在原子,没有
分子。 (2)相互作用不同,原子晶体中存在的是共价键。
4、原子晶体熔、沸点比较规律
①二氧化硅中Si原子均以sp3杂化,分别 与4个O原子成键,每个O原子与2个Si原子 成键; ②晶体中的最小环为十二元环,其中有6 个Si原子和6个O原子,含有12个Si-O键; 每个Si原子被12个十二元环共有,每个O原 子被6个十二元环共有,每个Si-O键被6个 十二元环共有;每个十二元环所拥有的Si 原子数为6×1/12=1/2,拥有的O原子数为 6×1/6=1,拥有的Si-O键数为12×1/6=2, 则Si原子数与O原子数之比为1:2。
Na+
(1)NaCl的晶体结构
立方结构(基本结构单元是立方体)
晶胞:
讨论:
晶体中最小的重复单元
6 1、每个Na 离子周围有____个Cl-离子,每 个Cl- 离子周围有____个Na+ 离子。 6
+
2、每个Na+离子周围与Na+最近且等距离的 Na+有____个,每个Cl- 离子周围与Cl-最近且 12 12 等距离的Cl-有____个。
3.3 原子晶体

拓展练习
碳化硅和立方氮化硼的结构与金刚石类似,碳化硅硬度仅次于金刚石,立方氮 化硼硬度与金刚石相当,其晶胞结构如图所示。
4
拓展练习
4
4
拓展练习 现有两组物质的熔点数据如表所示 :
根据表中数据回答下列问题: (1)A组属于__原___子___晶体,其熔化时克服的微粒间的作用力是 __共___价__键___。
:
Si
O
共价键 实际上就是在晶体硅的Si—Si 键上插入O原子。
金刚石和二氧化硅
SiO2的晶体结构分析 :(1)1个Si原子周围结合_4___个O原子;同时 ,每个O原子跟2____个Si原子相结合。实际 上,SiO2晶体是由Si、O原子1:按2 _____的比例 所构成的立体网状晶体。 (2)晶体中最小的环是由__6___个Si原子和__6___个O原子构成的 _1_2__元环。
原子晶体
教学目标
知道原子晶体的概念,能够从原子晶体的结构特点理解 其物理特性。
了解原子晶体的特征,能以典型物质为例描述原子晶体 结构与性质的关系。
学会晶体熔、沸点比较的方法 。
教学重点
原子晶体的概念;原子晶体的结构和性质 。
教学难点
原子晶体的结构特点 。
分子晶体 什么是分子晶体?举例说明 。分子间通过分子间作用力结合而成的晶体。例如干冰( CO2晶体)和晶体碘等。
金刚石和二氧化硅
②正四面体向空间延伸成立体网状 ③。所有的C—C键长、键角相等 ④。最小的碳环由6个C组成,不在同一平面内 ⑤。每个C参与了4条C—C键的形成,在每条键中的贡献只有一 半,故C与C—C键数之比为1:(4×½)= 1:2。 ⑥晶体硅结构与金刚石相似,只是键长不同
金刚石和二氧化硅
无机化学——原子晶体与分子晶体
B
B
C A
A
面心立方 紧密堆积
六方紧密堆积
Body-centered cubic cell (BCC)
体心立方紧密堆积 CN=12,利用率 =68% K、Rb、Cs、Li、 Na A B
A
体心立方 紧密堆积
7.4.2 金属键 金属键:金属原子的价电子可以完全失去成为自由电子,并在 晶格中运动,自由电子把金属阳离子胶合成金属晶体,这种胶 合作用就叫金属键。金属键无饱和性和方向性。
氯化氢、氨、三氯化磷、冰等由极性键构成的极性分子,晶体 中分子间存在色散力、取向力、诱导力,有的还有氢键,所以 它们的结点上的粒子间作用力大于分子量相近的非极性分子之 间的引力。
分子晶体的特性 分子晶体是以独立的分子出现的 ,化学式就是分子式。
分子晶体可以是非金属单质,如卤素、H2、N2、O2; 非金属化合物,如CO2、H2S、HCl、HN3等 绝大多数有机化合物,稀有气体的晶体
7.6.3 离子极化对物质性质的影响 一、离子的电子构型
外层电子结构 电子构型 阳离子实例
ns2np6
8
Na+, Mg2+,Al3+,Ti4+
ns2np6 nd1-9
9-17
Cr3+,Mn2+,Fe3+,Cu2+
ns2np6 nd10
18
Ag+,Zn2+,Cd2+,Hg2+
s2p6d10ns2
18+2
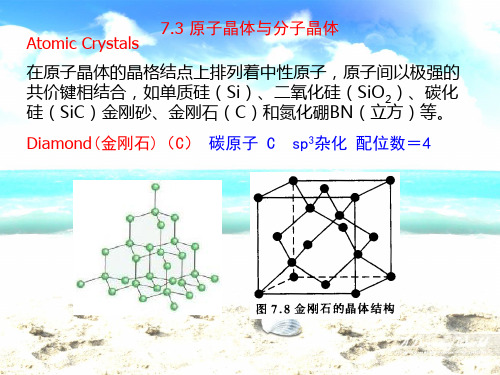
7.3 原子晶体与分子晶体 Atomic Crystals
在原子晶体的晶格结点上排列着中性原子,原子间以极强的 共价键相结合,如单质硅(Si)、二氧化硅(SiO2)、碳化 硅(SiC)金刚砂、金刚石(C)和氮化硼BN(立方)等。
n原子晶体 -回复

n原子晶体-回复什么是原子晶体?原子晶体是由原子通过某种排列方式形成的固态结构。
原子晶体中的原子具有良好的周期性排列,形成了一种有序的、重复单位的结构。
原子晶体的形成过程涉及到原子的各种相互作用,包括相邻原子之间的化学键和非共价相互作用等。
这些相互作用导致原子选择性地排列,形成不同的结构。
原子晶体的晶格结构对其性质和行为产生重要影响。
原子晶体的形成可以通过几种不同的方式实现。
其中最常见的是通过固态晶体生长技术来培养单晶。
固态晶体生长技术使用溶液中溶解的原子来沉积晶体,并通过控制温度、压力和其他条件来控制晶体的生长速率和方向。
通过这种方式,可以获得高质量、大尺寸的单晶。
另一种方式是通过固态相变来形成原子晶体。
在固态相变中,原子通过改变其排列方式或结合状态来形成不同的晶体结构。
这种相变可以在材料被加热或冷却时发生,取决于材料的特性和条件。
通过控制相变条件,可以调节晶体结构和性质。
原子晶体的结构可以通过X射线衍射、电子显微镜等技术来确定。
这些技术利用原子对射线的散射特性,从而确定晶格结构和原子排列方式。
通过这些技术,科学家可以研究并解释原子晶体的性质和行为。
原子晶体的结构类型非常多样,具有不同的对称性和性质。
最简单的原子晶体结构是立方晶系,其中原子按照正方体的方式排列。
其他常见的结构类型包括六方晶系、四方晶系、正交晶系和三斜晶系等。
每种结构类型都具有不同的特点,决定了材料的性质和应用。
原子晶体的应用非常广泛。
它们被用于制备材料、器件和电子元件等。
例如,硅晶体广泛应用于半导体材料和光电子学,铁磁晶体被用于磁性材料和存储器件,超导晶体用于制备超导电器件等。
通过理解和控制原子晶体的结构和性质,科学家和工程师可以设计和开发具有特定功能和性能的材料和器件。
总之,原子晶体是由原子按照一定的规律排列而形成的固态结构。
它们的形成过程涉及到原子的相互作用和排列方式。
原子晶体的结构和性质可以通过多种技术来确定和研究。
它们具有广泛的应用前景,对于材料科学和工程领域具有重要意义。
分子晶体与原子晶体

一、分子晶体
回顾:分子间作用力(分子与分子之间的相互作用),存在于分子之间。
分子间作用力
范德华力 氢键
分子间作用力大小的影响因素:
①相对分子质量:同类型分子,相对分子质量越大, 分子间作用力越大。
②分子的极性:分子的极性影响分子间作用力,极性>非极性。
分子通常指的是小分子,不是指高分子。
• 典型的分子晶体:
对于组成和结构相似、晶体中又不含氢键的物质来说,相对分子质量增大, 分子间作用力增强,熔沸点升高。
对于分子间不含氢键的物质来说,由于分子间的作用力无方向性也使得分子 在堆积时会尽可能利用空间并采取紧密堆积方式,这一点与金属晶体和离子晶体 相似,分子的形状、极性以及氢键的存在都会影响分子的堆积方式。
思考与交流
小结:怎么比较晶体的熔点呢?
三、晶体熔、沸点的比较 (1)不同类型晶体熔、沸点的比较: ①不同类型晶体的熔、沸点高低的一般规律:
原__子__晶__体_____>_离__子__晶__体____>_分__子__晶__体____。 ②金属晶体的熔、沸点差别很大,如钨、铂等熔、沸点
很高,汞、铯等熔、沸点很低。
晶胞
金刚石中 每个C原子都以SP3杂化轨道与周围4个碳原子以共价键结合,构成正四面体。 C—C键间的夹角为109.5°。因为中心原子周围排列的原子的数目是有限的,所以这 种比较松散的排列与金属晶体和离子晶体中的紧密堆积排列有很大的不同。
(1)每个碳与①________以共价键结合,形成正四面体结构 (2)键角均为②________ (3)最小碳环由③____个C组成且六原子不在同一平面内 (4)每个C参与4条C—C键的形成,C原子数与C—C键之比为④______
阴离子,如金属晶体。 (4)易误认为金属晶体的熔点比分子晶体的熔点高,其实不一定,如Na
四大晶体结构与性质

阴离子③复杂阳离子+ 惰性气体及常温
活泼金属阴离子④复杂 阳离子+复杂阴离子
下为气态的物质
不溶于一般溶剂
金刚石、 晶体硅、 二氧化硅、 碳化硅
不溶于一般溶剂
各种金属及 一些合金
四种基本晶体类型的判断方法:
(1)从概念判断 由金属元素组成,通过自由电子和金属阳离子间强烈相互作用 而形成的晶体为金属晶体;构成晶体微粒为分子,微粒间通过分 子间作用力而形成的晶体为分子晶体;共价化合物一般为分子晶 体,但SiO2、SiC等为原子晶体;离子化合物一定为离子晶体。 (2)由晶体的物理性质判断 ①根据导电性判断
层内:每个C原子以共价键 连接3个C原子 层间:分子间作用力
(2).金属晶体结构与金属的导热性的关系
金属容易导热,是由于自由电子运动时与金属离子碰撞 把能量从温度高的部分传到温度低的部分,从而使整块金 属达到相同的温度。
(3).金属晶体结构与金属的延展性的关系
金属晶体中由于金属离子与自由电子间的相互作用没有 方向性,各原子层之间发生相对滑动以后,仍可保持这种相 互作用,因而即使在外力作用下,发生形变也不易断裂。
四、金属晶体
• 1、金属键的本质是什么?
金属键的本质是“电子气理论”,成键粒子:金属阳离子 与自由电子之间。 • 2、影响金属键强弱有哪些因素?
影响金属键强弱的主要因素有金属阳离子半径、所带电 荷数等。一般而言,金属阳离子半径越小,所带电荷数 越多,金属键越强,金属晶体的硬度越大,熔沸点越高。
• 3、应用“电子气理论”解释金属材料的有关性质,如延 展性和导电性?
按密置层的堆积方式的第一种:六方密堆积
3、镁型 [六方密堆积]
镁型[六方密堆积](Be Mg ⅢB ⅣB ⅦB )
原子晶体定义

原子晶体定义
嘿,朋友们!今天咱来聊聊原子晶体呀!你说这原子晶体,就像是一群小伙伴紧紧地抱在一起,不离不弃。
想象一下,原子们就像是一个个有个性的小朋友,它们通过很强很强的作用力,手牵手、肩并肩地站成了整齐的队伍。
这可不是一般的牵手哦,那是相当牢固的!就好比是用胶水粘得死死的,怎么都分不开。
金刚石,大家都知道吧!那可是原子晶体的典型代表呢。
它里面的碳原子啊,那排列得叫一个规整,就跟阅兵式上的士兵方阵似的。
正因为这样,金刚石才那么硬,硬到可以用来切玻璃、划石头。
你说神奇不神奇?这要是碳原子们不这么紧紧抱在一起,能有这硬度吗?肯定不能啊!
再说说硅,它也是原子晶体家族的重要成员哟。
硅在我们的生活中可重要啦,那些电子设备里可都有它的身影呢。
它就像是一个低调的幕后英雄,默默地为我们的科技发展贡献着力量。
原子晶体还有个特点,就是熔点特别高。
你想想啊,它们之间的联系那么紧密,要想把它们分开,那可得费好大的劲,得用很高很高的温度才行。
这就像是拆一堵坚固的墙,没点大力气可不行。
你看那石英,也是原子晶体呢,它漂亮吧!那晶莹剔透的样子,让人忍不住想要摸一摸。
可别小瞧了它,它也是很坚强的哟。
哎呀,这原子晶体啊,真的是很奇妙的存在。
它们虽然小小的,但是团结起来力量可大了呢!它们用自己独特的方式存在着,为我们的世界增添了许多奇妙的色彩和可能性。
所以啊,我们可不能小看这些小小的原子们,它们组成的原子晶体可是有着大大的能量呢!它们在我们的生活中无处不在,默默地发挥着自己的作用。
我们应该好好去了解它们,感受它们的神奇和魅力。
你说是不是呢?。
晶体结构(3, 原子晶体与分子晶体)
金刚石晶体
金刚石晶体
①每个碳 原子与 4 个碳原子 相连; 相连;
基本单元: 基本单元: 六元环
6 个碳
原子形成一 个六 元 环
金刚石晶体
②晶体中碳原子与C-C键数 晶体中碳原子与C 目比 1:2 。
SiO2晶体
①构成SiO2晶体的微粒是什么? 构成SiO 晶体的微粒是什么? Si原子和 原子和O Si原子和O原子
CO2
SiO2
课堂练习
° 1、 白磷分子中的键角为 60° ,分子的空间结 、 每个P原子与 构为正四面体 ,每个 原子与 3 个P原子结合成共 原子结合成共 价键。若将1分子白磷中的所有 分子白磷中的所有P-P键打开并各插 价键。若将 分子白磷中的所有 键打开并各插 个氧原子, 若每个P 入一个氧原子, 入一个氧原子,共可结合 6 个氧原子, 若每个P 原子上的孤对电子再与氧原子配位, 原子上的孤对电子再与氧原子配位,就可以得到 填分子式)。 磷的另一种氧化物 P4O10 (填分子式)。
SiO2晶体
④晶体中最小的环有 12 个 原子。 原子。
小结: 小结:三种化学键的比较
化学键 成键本质
由电子静电作用 键的方 影响键强弱 的因素 向性和 饱和性
金属键 金属阳离子和自 离子键 阴阳离子间的 静电作用 共价键 共用电子对
无 无 有
原子半径和 价电子数 离子半径和 离子电荷 键长
课堂练习 1、下列物质属于原子晶体的 化合物是 ( C ) A.金刚石 A.金刚石 B.NaOH C.二氧化硅 D.干冰 C.二氧化硅 D.干冰
小试牛刀】 【小试牛刀】
下列物质在变化过程中, 例1.下列物质在变化过程中,只需克服分子 下列物质在变化过程中 间作用力的是 ( C ) A.食盐溶解 食盐溶解 C.干冰升华 干冰升华 B.铁的熔化 铁的熔化 D.氯化铵的“升华” 氯化铵的“ 氯化铵的 升华”
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
①石墨为什么很软?
石墨为层状结构,各层之间是范德 华力结合,容易滑动,所以石墨很 软。
②石墨的熔沸点为什么很高?
石墨各层均为平面网状结构,碳原 子之间存在很强的共价键,故熔沸 点很高。
小结:
1、离子晶体、分子晶体、原子晶体比较
离子晶体
组成微粒 阴、阳离子 离子键
分子晶体
分 子
原子晶体
原 子
微粒间作用力
熔沸点 硬度 导电性
分子间作用力 共价键
较高
较大
低
小
高
大 一般为 非导体
水溶液、 非导体,水 熔融态导电 溶液可能导电
2、晶体的熔沸点的比较 (1)不同类型晶体
原子晶体>离子晶体>分子晶体
(2)相同类型晶体 由晶体内微粒间作用力大小来确定
①离子晶体 组成相似的离子晶体,看离子键的强度。 ②分子晶体
复习巩固
1、离子晶体、分子晶体的构成粒子 及 粒子间作用各是什么? 2、影响离子晶体、分子晶体熔沸点、
硬度大小的因素各是什么?
阅读思考:
1、什么叫原子晶体? 2、原子晶体的特点?
3、哪些物质属于原子晶体?
一、原子晶体
1、定义:原子间通过共价键结合 而成的晶体叫原子晶体。 ① 构成粒子:原子
② 粒子间作用:共价键
金刚石、单晶硅、碳化硅、二氧化硅等。
石墨 —混合型晶体
石墨晶体由碳原子构成,是层状结构,层内每 个碳原子与周围三个碳原子以共价键结合,形 成以正六边形排列成平面网状结构,层与层之 间以范德华力相结合,且有自由移动的电子。 构成微粒:原子; 微粒间作用力:共价键和分子间作用力; 石墨晶体具有原子晶体结构特点,又有分子晶 体结构特点,所以属混合晶体过渡型晶体。
5、有下列八种晶体:①水晶②冰醋酸③氧化镁 ④白磷⑤晶体氩⑥氯化铵⑦铝⑧金刚石。用序号 回答下列问题: (1)、属于原子晶体的化合物是 ,直接 由原子构成的晶体是 ,直接由原子构成的 的分子晶体是 。 (2)、由极性分子构成的晶体是 ,含有 共价键的离子晶体是 ,属于分子晶体的 单质是 。 (3)、在一定条件下能导电而不发生化学变化 的是 ,受热熔化后化学键不发生变化的 是 ,受热熔化需克服共价键的是 。
开拓思考题:仔细观 察左边的示意图后, 回答下列问题: 金刚石与石墨的熔点 均很高,那么二者熔 点是否相同?为什么? 若不相同,哪种更高 一些?
金 刚 石 晶 体 结 构
每个碳原子与 个 六员碳环共用。源自思考:金刚石晶体中,最小环上有几个碳原子?
答:6个
每个碳原子由几个六元环共用?
答:12个
每个环上占用几个碳原子?
组成和结构相似的分子晶体,看分子间作
用力的大小(相对分子质量的大小)。
③原子晶体
看构成晶体的共价键的键能。
3、晶体类型的判断
①从组成上判断(仅限于中学范围)
有无金属离子(有:离子晶体) 是否属于“四种原子晶体” 以上皆否定,则多数是分子晶体
②从性质上判断
熔沸点和硬度 (高:原子晶体;中:离子晶体;低:分子晶体 ) 导电性 (熔融态导电:离子晶体; 熔融态不导电但水溶液可能导电:分子晶体 )
练习: 1、下列不存在化学键的晶体是 ( ) A.硝酸钾 B.干冰 C.石墨 D.固体氩 2、常温常压下的分子晶体是 ( ) A.碘 B.水 C. 硫酸铵 D.干冰 3、晶体中的一个微粒周围有6个微粒,这 种晶体是 ( ) A.金刚石 B.石墨 C.干冰 D.氯化钠
4.碳化硅这种结构类似于金刚石的 晶体,其中碳原子和硅原子的位置 是交替的。在下列三种晶体①金刚 石 ②晶体硅 ③碳化硅中,它们 的熔点从高到低的顺序是 ( ) A.①③② B.②③① C.③①② D.②①③
2、原子晶体的特点
(1)结构特点:
A、在晶体中,不存在单个分子
B、原子通过共价键形成空间网状结构
(2)物理性质
A、熔沸点很高,硬度很大
原子晶体中存在着较强的共价键,而且形 成空间网状结构,要破坏它需要很大的能 量,故原子晶体硬度大、熔沸点高。 B、不导电
C、难溶于常见溶剂
3、属于原子晶体的物质:
答:1/2个
晶 体 硅 结 构
碳 化 硅 晶 体 结 构
二 氧 化 硅 晶 体 结 构
思考:
石墨晶体中,最小环上有几个碳原子?
答:6个
每个碳原子由几个六元环共用?
答:3个
每个环上占用几个碳原子?
答:2个
三种典型立方晶体结构
简单立方
体心立方
面心立方
