平板菌落计数法操作步骤
菌落总数计数方法

菌落总数计数方法菌落总数计数是一种常见且重要的实验方法,用于评估菌落的数量和密度。
菌落总数计数方法有多种,常见的包括平板计数法、薄层计数法、过滤膜计数法等。
下面将详细介绍这几种方法的原理和步骤。
平板计数法是最常见的菌落总数计数方法之一。
它的原理是将待测菌液均匀涂布在含有固体营养培养基的平板上,通过菌落的生长扩散形成可见的单个菌落,再通过对菌落进行计数并乘以稀释倍数,最后得到待测菌液的菌落总数。
具体步骤如下:1. 准备固体培养基。
根据所要检测菌落的要求,选择适当的培养基并准备好。
固体培养基一般含有琼脂或明胶等物质,可以提供营养物质和支持菌落的生长。
2. 制备合适浓度的菌液。
将待测菌种培养在含有适宜营养物质的液体培养基中,利用培养箱或摇床进行恒温、恒湿的培养,待菌液呈现合适浓度时即可使用。
3. 稀释菌液。
根据待测菌液的预估浓度,将适量的菌液和无菌生理盐水按一定比例进行稀释,以获得合适浓度的菌液。
4. 涂布菌落。
取一定数量的稀释后的菌液,利用灌注器或鱼鳞划线法将菌液均匀涂布在固体培养基的平板上。
为了保证菌液的均匀分布,可以采取旋转、摇动等方法。
5. 培养菌落。
将涂布好的平板置于恒温、恒湿的培养箱中进行培养。
根据菌种的不同,一般在30-37的温度下培养24-48小时。
6. 计数菌落。
在培养好的平板上,通过肉眼或借助显微镜仔细观察菌落的形态、大小、颜色等特征,并使用菌落计数器或放大镜进行计数。
根据菌落的密度和分布情况,可以选择在整个平板上计数,或者在特定区域计数后进行推算。
7. 乘以稀释倍数。
由于菌液在进行稀释时常用不同倍数的生理盐水进行稀释,所以在计算菌落总数时需要将计数结果乘以稀释倍数,以获得准确的结果。
薄层计数法是另一种常见的菌落总数计数方法。
它的原理是将含有待测菌液的液体培养基均匀地倒入培养基皿中,使其能够覆盖整个底面。
待液体凝固后,菌落会在培养基表面生长,并且可以通过视觉或显微镜观察和计数菌落。
大肠菌群平板计数法方法学验证报告

大肠菌群平板计数法方法学验证报告实验步骤如下:1.准备培养基:将大肠杆菌选择培养基加入培养基瓶中,并用自来水洗净外面的杂质,随后用蒸馏水冲洗内表面。
将瓶口用无菌布覆盖,用锡箔纸包好,然后高温高压灭菌,储存在无菌环境中备用。
2.取少量待检样品:将待检食品样品(例如牛奶、蔬菜、饮用水等)取一适量,在无菌的条件下进行操作。
先将样品摇匀使其均匀分布,然后用无菌吸管取1毫升待检样品。
3.稀释样品:用无菌吸管将1毫升待检样品转移至无菌试管中,再向试管分别加入9毫升无菌生理盐水,摇匀使其均匀混合。
此时的样品为10倍稀释样品,将试管中的液体倒入下一个试管中,再加入9毫升无菌生理盐水,以此类推,制备出一系列浓度递减的稀释样品。
4.接种培养基:将每个稀释样品分别倒入标记好的平板培养基上,倒入后轻轻晃动,使其均匀分布在培养基上,然后在无菌工作台上用无菌铂丝铲取纱球大小的韧带状菌液涂抹在固体培养基表面,使细菌均匀生长。
5.培养和计数:将培养基板反面朝上,放入37°C恒温培养箱中进行培养,培养的时间一般为24小时。
待培养结束后,观察培养基表面是否出现典型的大肠菌群菌落。
使用菌落计数器对每个平板上的菌落进行计数。
根据以上实验步骤进行大肠菌群平板计数法的实验后,得出以下结论:1.适用性验证:通过本实验,我们可以验证大肠菌群平板计数法的适用性。
在我们的实验中,使用该方法对不同类型的食品样品进行了检测,并得出了相应的菌落计数。
这表明该方法适用于不同类型的样品,可以准确地测定大肠菌群数量。
2.优点:大肠菌群平板计数法具有以下优点:简单易行,操作方便;可定量测定大肠菌群数量,结果可靠;适用于不同类型的食品样品。
3.缺点:大肠菌群平板计数法也存在一些局限性:菌落计数需要较长时间,一般需要24小时才能观察到菌落;该方法只能测定培养基中能够生长的细菌,无法对其他微生物进行定量测定。
综上所述,大肠菌群平板计数法是一种能够准确测定大肠菌群数量的方法。
平板菌落计数法操作步骤

平板菌落计数法一、目的要求学习平板菌落计数的基本原理和方法。
二、基本原理平板菌落计数法是将等测样品经适当稀释后,其中的微生物充分分散为单个细胞,取一定量的稀释液接种到平板上,经过培养,由每个单细胞生长繁殖而形成的肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可能来自样品中的2~3或更多个细胞。
因此平板菌落计数的结果往往偏低。
现在常使用菌落形成单位。
该计数法的缺点是操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是这种计数方法最大的优点是可以获得活菌的信息,所以被广泛用于生物制品检验,以及食品、饮料和水等含菌指数或污染度的检测。
三、器材大肠杆菌悬液,LB琼脂培养基,1mL、5mL无菌吸管,无菌平皿,无菌水,无菌试管,试管架和记号笔等。
四、操作步骤1、编号取无菌平皿9套,分别标明为10-4、10-5、10-6各三套,另取6支无菌试管分别标记为10-1、10-2、10-3、10-4、10-5、10-6。
2、稀释用1mL无菌吸管吸取1mL已充分混匀的大肠杆菌菌悬液,精确地放0.5mL至10-1的试管中,此即为10倍稀释,将多余的菌液放回原菌液中。
将10-1试管充分振荡、混匀。
另取一支1ml吸管插入10-1试管中来回吹吸菌液三次,进一步将菌体分散、混匀。
动作不要太猛太快,吸时插入,吹时提出,再用此吸管吸取10-1菌液1mL,精确地放0.5mL至10-2试管中,此即为100倍稀释,依次类推,3、取样用三支1ml无菌吸定分别吸取10-4、10-5、10-6的稀释菌悬液各1mL,对号放入编好号的无菌平皿中,每个平皿放0.2mL4、倒平板尽快向上述盛有不同稀释菌液的平皿中倒入融化后冷却至45度的LB培养基约15-20ml,置水平位置迅速旋动平皿,使培养基与菌液混合均匀。
稀释平板计数法

实验原理平板菌落计数法是将待测样品经适当稀释之后,其中的微生物充分分散成单个细胞,取一定量的稀释样液接种到平板上,经过培养,由每个单细胞生长繁殖而形成肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可能来自样品中的2—3或更多个细胞。
因此平板菌落计数的结果往往偏低。
为了清楚地阐述平板菌落计数的结果,现在已倾向使用菌落形成单位(cfu)而不以绝对菌落数来表示样品的活菌含量。
平板菌落计数法虽然操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是,由于该计数方法的最大优点是可以获得活菌的信息,所以被广泛用于生物制品检验(如活菌制剂),以及食品、饮料和水〔包括水源水〕等的含菌指数或污染程度的检测。
实验器材LB液体、固体培养基1m1移液器,平皿,试管,试管架,恒温培养箱等。
实验步骤1.无菌器材的准备(1) 无菌培养皿:取培养皿9套,包扎、灭菌。
(2) 无菌水:取6支试管,分别装入4.5m1蒸馏水,加棉塞,灭菌。
2.样品稀释液的制备(1) 编号取无菌平皿9套,分别用记号笔标明10-4、10-5、10-6(稀释度)各3套。
另取6支盛有4.5m1无菌水的试管,依次标是10-1、10-2、10-3、10-4、10-5、10-6。
(2) 稀释用1m1移液器吸取0.5m1己充分混匀的菌悬液(待测样品),至10-1的试管中,此即为10倍稀释。
将10-1试管置试管振荡器上振荡,使菌液充分混匀。
用1m1移液器在10-1试管中来回吹吸菌悬液三次,进一步将菌体分散、混匀。
吹吸菌液时不要太猛太快,吸时吸管伸入管底,吹时离开液面。
混匀后吸取至10-2试管中,此即为100倍稀释。
……其余依次类推,整个过程如图所示。
3.平板接种培养平板接种培养有浇注平板培养法和涂布平板培养法两种方法。
枯草芽孢杆菌平板法菌落计数操作记录
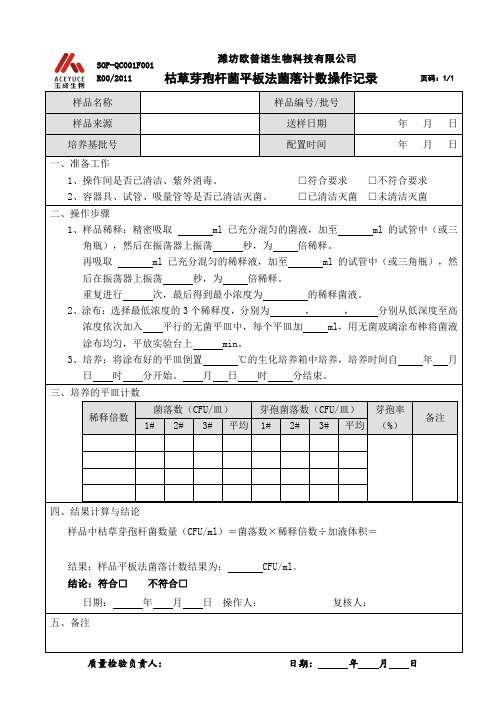
三、培养的平皿计数
稀释倍数
菌落数(CFU/皿)
芽孢菌落数(CFU/皿)
芽孢率
(%)
备注
1#
2#
3#
平均
1#
2#
3#
平均
四、结果计算与结论
样品中枯草芽孢杆菌数量(CFU/ml)=菌落数×稀释倍数÷加液体积=
结果:样品平板法菌落计数结果为:CFU/ml。
二、操作步骤
1、样品稀释:精密吸取ml已充分混匀的菌液,加至ml的试管中(或三角瓶),然后在振荡器上振荡秒,为倍稀释。
再吸取ml已充分混匀的稀释液,加至ml的试管中(或三角瓶),然后在振荡器上振荡秒,为倍稀释。
重复进行次,最后得到最小浓度为的稀释菌液。
2、涂布:选择最低浓度的3个稀释度,分别为,,分别从低深度至高浓度依次加入平行的无菌平皿中,每个平皿加ml,用无菌玻璃涂布棒将菌液涂布均匀,平放实验台上min。
SOP-QC001F001
R00/2011
潍坊欧普诺生物科技有限公司
枯草芽孢杆菌平板法菌落计数操作记录
页码:1/1
样品名称
样品编号/批号
样品来源
送样日期
年月日
培养基批号
配置时间
年月日
一、准备工作
1、操作间是否已清洁、紫外消毒。□符合要求□不符合要求
2、容器具、试管、吸量管等是否已清洁灭菌。□已清洁灭菌□未清洁灭菌
结论:符合□不符合□
日期:年月日操作人:复核人
xxxx4-菌落、酵母、霉菌检验(混合平板培养法)标准操作规程

编制: 核准:
分别加12-15ml平板计数琼脂(约45℃左右)到平皿内。立即将平皿内的样品液和琼脂培养基充分混合。要防止把混合物溅到平皿壁和盖上。同时将平板计数琼脂倾入加有1ml稀释剂的另一灭菌平皿作空白对照。将样品液加入平皿后应立即倾注琼脂培养基。
培养
待琼脂凝固后将平皿翻转,菌落培养立即放进36±1℃的恒温培养箱培养48±2h;霉菌酵母培养立即放入26±1℃恒温培养箱内培养3天并观察培养5天。培养箱应保持一定的湿度。
目的
规范菌落、酵母、霉菌检验过程
范围
适用于菌落、霉菌、酵母等采用混合平板培养法的检验
职责
Lab tech
个人防护要求
物料/工具需求
无菌操作间、恒温培养箱(36±1℃)、振荡器、吸管(1ml、10ml)、平皿、试管、天平、平板计数琼脂。
编号
主要步骤
描述
图片显示
步骤要点
要以无菌操作取25g/ml
菌落计数
培养后,立即计数每个平板上的菌落数。25-250个菌落为合适范围。
操作者对同一平板复核自己的计数结果,其差异应在5%之内
计算和记录数字
适宜稀释度的两个平板的菌落数平均值或两个稀释度的平板菌落数平均值乘以相应稀释度倍数计算出每g/ml样品中平板菌落数。
记录时,在换算到每g/ml样品中平板菌落数时,定下两位有效数字。也可将样品的平板菌落数记录为10的指数形式。
样品,放入装有225ml稀释剂的灭菌三角瓶中迅速振摇,将样品混匀,制成1:10的样品匀液
用1ml灭菌吸管准确吸取1:10的样品匀液10ml,放入装有9ml稀释剂试管中。迅速振摇,将样品混匀,制成1:100的样品匀液
平板接种
分别用灭菌吸管吸取1ml样品液放入作了适宜标志的平皿内。每个稀释度的样品液用两个平皿。
菌落总数测定实验步骤
菌落总数测定实验步骤
菌落总数测定实验的步骤如下:
1. 准备所需材料和试剂:琼脂培养基、试管、乳酸菌平板、移液器、消毒液等。
2. 将琼脂培养基溶解并熔化,待稍微冷却至37℃左右。
3. 取一定量的菌液,一般可采用10倍稀释法,将菌液加入含有适量琼脂培养基的试管中,彻底混合均匀。
4. 将加有菌液的琼脂培养基倒入乳酸菌平板中,待凝固。
5. 将已经凝固的乳酸菌平板倒置,放入孵化箱中,以37℃恒温培养。
6. 培养时间通常为24-48小时,视具体菌种而定。
7. 从孵化箱中取出培养好的乳酸菌平板,将菌落数目较多且分散的平板选取,以避免菌落过于密集而无法清楚计数。
8. 使用显微镜或肉眼观察,使用计数板或计数器,对菌落进行计数,记录下每个平板上的菌落总数。
9. 根据实验设计的需要,可以进行平均数的计算和数据的统计分析。
10. 实验结束后,用消毒液彻底清洗实验器材,并正确处置菌
液和培养平板。
注意事项:
- 操作过程中应注意无菌操作,避免外部污染。
- 实验室内需要保持清洁卫生,定期消毒工作台和实验室器材。
- 孵化过程中需要注意温度和时间的控制,避免过渡时间或温
度过高导致菌落生长异常。
- 菌落计数时需要仔细观察,避免漏计或重复计数。
- 实验结束后,遵守实验室规定的废弃物处理要求,确保安全
环保。
霉菌和酵母计数检验原始记录平板计数法
霉菌和酵母计数检验原始记录(平板计数法)
1.菌落数按“四舍五入”原则修约。
菌落数在10以内时,采用一位有效数字报告;菌落数在10T00之间时,采用两位有效数字报告。
2.菌落数大于或等于100时,前第3位数字采用“四舍五人”原则修约后,取前2位数字,后面用。
代替位数来表示结果;也可用10的指数形式来表示,此时也按“四舍五入”原则修约,采用两位有救数字。
3.若空白对照平板上有菌落出现,则此次检测结果无效。
4.称重取样以CFU/g为单位报告,体积取样以CFU/m1为单位报告,报告或分别报告霉菌和/或酵母数。
复核日期
报告人报告日期复核人。
平板菌落计数法操作步骤(精)
平板菌落计数法操作步骤(精)
平板菌落计数法是一种可以用来测定悬浮液中的菌落总数以及形成菌落的种类的微生物学分析方法。
它通常被用来评估牛奶、酒精发酵物、汤、和其它类似的系统的微生物活性的估计。
平板菌落计数法的步骤一般为:
1、准备样品:将根据样品的类型,制定合适浓度、保存适宜的培养基;
2、消耗样品:根据下联试验结果,将样品消耗在培养基中;
3、载体准备:准备一个混合培养剂载体,在此载体上种植样品,以便能够有效进行培养;
4、培养:将种植好的平板载体放入带有适宜温度的培养箱中培养,按照适定的培养时间培养;
5、观察计数:将培养好的载体放入显微镜底座下进行显微观察,根据观察结果,对形成的菌落进行计数;
6、计算:根据样品的量,和所观察的菌落总数,对每升份的大菌落进行计算,以求出平板菌落总数。
7、结果分析:根据测得的平板菌落总数,进行比较测试及结果分析,从而判断样品微生物活性情况。
平板菌落计数法和显微镜直接计数法
步骤
1. 制备酵母菌的菌悬液:酿酒酵母菌PDA斜面菌种一支,用无菌生理盐水,将菌苔洗
下,倒入装有玻璃珠的无菌三角瓶中,制成50 mL菌悬液。震荡,混匀。
2. 清洁血球计数板:镜检计数板,计数室内干净后才可以使用。如果有污物,先用自来
水冲洗血球计数板(切勿用硬毛刷刷洗),再用95%的酒精棉球轻轻擦拭,晾干后再次镜检。 盖玻片同样清洗和检查。
10-2
10-3
稀释度 菌落数之比
结果(菌落总 数,CFU/mL)
备注
1
1 365
164
2
2 760
295
3
2 890
271
4
150
30
5 多不可计 1 650
6
27ቤተ መጻሕፍቲ ባይዱ
11
7 多不可计 305
20
—
1.6 ˣ 104(或
)
46 1.6(460/295)<2 3.8 ˣ 104(或16 400) 两位以
思考题
1.测定时,融化后的固体培养基如果在40 ℃、45 ℃、55 ℃和60 ℃保温,测定结果和 50 ℃保温有何区别? 2.本实验测定方法是十倍稀释,各梯度分别取样1 mL进行测定。如果只稀释至10-1,取 样1 mL、0.1 mL和0.01 mL进行测定,对结果有哪些影响?
原理
显微镜直接计数法:借助显微镜
谢谢
步骤
3. 加菌悬液:将盖玻片盖在计数室的上面,用细口滴管吹打菌悬液,充分混匀。然后吸
菌悬液,滴在计数室和盖玻片的边缘上,菌悬液自然渗入盖玻片和计数板间缝隙中。再用镊 子或接种环柄等轻压盖玻片,去除过多的菌悬液,以免实际的计数室体积变大。静置片刻, 待菌体自然沉降后,计数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
平板菌落计数法
一、目的要求
学习平板菌落计数的基本原理和方法。
二、基本原理
平板菌落计数法是将等测样品经适当稀释后,其中的微生物充分分散为单个细胞,取一定量的稀释液接种到平板上,经过培养,由每个单细胞生长繁殖而形成的肉眼可见的菌落,即一个单菌落应代表原样品中的一个单细胞。
统计菌落数,根据其稀释倍数和取样接种量即可换算出样品中的含菌数。
但是,由于待测样品往往不易完全分散成单个细胞,所以,长成的一个单菌落也可能来自样品中的2~3或更多个细胞。
因此平板菌落计数的结果往往偏低。
现在常使用菌落形成单位。
该计数法的缺点是操作较繁,结果需要培养一段时间才能取得,而且测定结果易受多种因素的影响,但是这种计数方法最大的优点是可以获得活菌的信息,所以被广泛用于生物制品检验,以及食品、饮料和水等含菌指数或污染度的检测。
三、器材
大肠杆菌悬液,LB琼脂培养基,1mL、5mL无菌吸管,无菌平皿,无菌水,无菌试管,试管架和记号笔等。
四、操作步骤
1、编号
取无菌平皿9套,分别标明为10-4、10-5、10-6各三套,另取6支无菌试管分别标记为10-1、10-2、10-3、10-4、10-5、10-6。
2、稀释
用1mL无菌吸管吸取1mL已充分混匀的大肠杆菌菌悬液,精确地放0.5mL至10-1的试管中,此即为10倍稀释,将多余的菌液放回原菌液中。
将10-1试管充分振荡、混匀。
另取一支1ml吸管插入10-1试管中来回吹吸菌液三次,进一步将菌体分散、混匀。
动作不要太猛太快,吸时插入,吹时提出,再用此吸管吸取10-1菌液1mL,精确地放0.5mL至10-2试管中,此即为100倍稀释,依次类推,
3、取样
用三支1ml无菌吸定分别吸取10-4、10-5、10-6的稀释菌悬液各1mL,对号放入编好号的无菌平皿中,每个平皿放0.2mL
4、倒平板
尽快向上述盛有不同稀释菌液的平皿中倒入融化后冷却至45度的LB培养基约15-20ml,置水平位置迅速旋动平皿,使培养基与菌液混合均匀。
5、培养
倒置于37度培养箱中培养48小时,
6、计数
算出同一稀释度三个平板上的菌落平均数,并按下列公式进行计算;
每毫升中菌落形成单位(cfu)= 同一稀释度三次重复的平均菌落数×稀释倍数×5
五、实验报告
1、结果
将培养后菌落计数结果填入下表:
2、思考题
(1)为什么溶化后的培养基要冷却至45℃左右才能倒平板?
(2)要使平板菌落计数准确,需要掌握哪几个关键?为什么?
(3)同一种菌液用血球计数板和平板菌落计数法同时计数,所得结果是否一样?为什么?
(4)试比较平板菌落计数法和显微镜下直接计数法的优缺点。
