第三章大气化学反应动力学
化工原理第二版下册答案

化工原理第二版下册答案化工原理是化学工程专业的基础课程,它包括了化学工程领域内的基本原理和基础知识。
本文档将围绕《化工原理第二版下册》中的答案进行详细解析和讲解,希望能够帮助学习者更好地理解和掌握化工原理的相关知识。
第一章,化工原理概述。
在化工原理概述部分,主要介绍了化工原理的基本概念、发展历程以及其在化学工程领域中的重要性。
学习者需要深入理解化工原理的内涵和外延,明确其在工程实践中的应用价值和意义。
此外,还需要了解化工原理与其他相关学科的关系,以及其在工程实践中的具体应用。
第二章,物质的基本性质。
物质的基本性质是化工原理中的重要内容之一,它包括了物质的组成、结构、性质以及相互转化规律等方面的内容。
学习者需要掌握物质的基本分类、性质参数的测定方法以及物质在化学工程过程中的应用。
此外,还需要了解物质的相变规律、热力学性质以及其在工程实践中的具体应用。
第三章,化学反应动力学。
化学反应动力学是化工原理中的重要内容之一,它包括了化学反应速率、反应机理以及影响反应速率的因素等方面的内容。
学习者需要掌握化学反应速率的表达式、反应速率常数的计算方法以及影响反应速率的因素。
此外,还需要了解反应动力学模型的建立方法、反应速率控制步骤以及其在工程实践中的具体应用。
第四章,流体力学。
流体力学是化工原理中的重要内容之一,它包括了流体的基本性质、流体流动规律以及流体在工程实践中的应用等方面的内容。
学习者需要掌握流体的基本性质参数、流体流动的基本方程以及流体在管道、泵站、阀门等设备中的流动规律。
此外,还需要了解流体的黏性、湍流、层流等特性以及其在工程实践中的具体应用。
第五章,传热学。
传热学是化工原理中的重要内容之一,它包括了传热的基本规律、传热方式以及传热设备的设计与应用等方面的内容。
学习者需要掌握传热的基本参数、传热方式的传热系数计算方法以及传热设备的设计原理。
此外,还需要了解传热的对流、辐射、传导等方式以及其在工程实践中的具体应用。
第三章 化学动力学2

设零级反应式为
A
B
重排后,得 积分
c
dcA 0 kcA k dt dcA kdt
dc
c0
A
k dt
0
t
t c A |c kt | c 0
0
得 或写成
c c0 kt c c0 kt
c0 t1 2k 2
(3 - 15) (3 - 16)
H2
N H NH 1 1 0.1mol L s 1 3 2
2 2 3
见例题3-1。
影响化学反应速度的因素。 3.4 浓度对反应速率的影响
3.4.1 基元反应和非基元反应 基元反应:反应物分子一步作用直接 转化成产物的反应。
非基元反应:反应物分子由两步或两步以上 作用转化成产物的反应。
【例】已知某反应的Ea = 70kJ· mol-1, 300 K时的k=0.1 s -1。试计算(1)400K时反应速
பைடு நூலகம்
率为原来的多少倍?(2)温度由1000K升到
1100K时,反应速率为1000K时的多少倍? 解:(1)
k 400 70 1000 400 300 lg ( ) 3.05 k 300 8.314 2.303 400 300 k 400 1115( 倍 ) k 300
= J /V = Δn/(V×ν×Δt) = ΔC/(ν×Δt)
瞬时反应速率 V
:
= lim (ΔC/ν×Δt)
=(1/ν) ×dc/dt
一般的化学反应: a A + dD = gG
+ hH
CG C A CD CH a t d t g t h t
第三章 化学反应动力学的计算
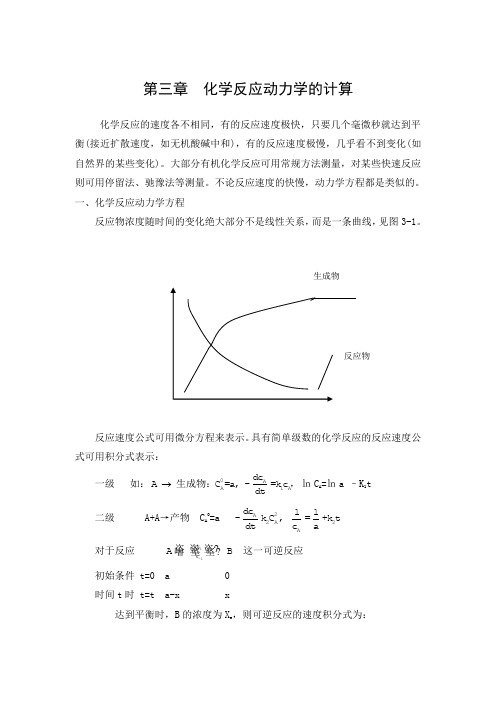
第三章 化学反应动力学的计算化学反应的速度各不相同,有的反应速度极快,只要几个毫微秒就达到平衡(接近扩散速度,如无机酸碱中和),有的反应速度极慢,几乎看不到变化(如自然界的某些变化)。
大部分有机化学反应可用常规方法测量,对某些快速反应则可用停留法、驰豫法等测量。
不论反应速度的快慢,动力学方程都是类似的。
一、化学反应动力学方程反应物浓度随时间的变化绝大部分不是线性关系,而是一条曲线,见图3-1。
反应速度公式可用微分方程来表示。
具有简单级数的化学反应的反应速度公式可用积分式表示:一级 如:0AA1Adc A C =a, -=k c dt 生成物:,㏑C A =㏑a –K 1t 二级 A+A →产物 C A 0=a 2A 2A 2A d c 11-k C , =+k t d t c a对于反应 1-1k k A B 这一可逆反应初始条件 t=0 a 0 时间t 时 t=t a-x x达到平衡时,B 的浓度为X e ,则可逆反应的速度积分式为: 级数:1-1 1-10k A A e e 1A -1B k 0e 0C =a dc x xA B=-k C +k C : =kt dt a x -xC =0ln 1-21-10Ak0A e e e B 1A -1B C k e e 0CC =a dc x ax +x(a-x )A B+C C =0=-k C +k C C : =kt dt 2a-x a(x -x)C =0ln 二、常微分方程的解化学反应动力学方程是用微分方程表示的,对于简单的反应,可直接求得微分方程的解。
微分方程:()(1)(,,,......)......(1)n n y f x y y y -'=在区间a<x<b 的解,是指()y x ϕ=,这样一个函数,在所述区间内存在导数()(),(),......()n x x x ϕϕϕ'''。
且对于区间a<x<b 内的每一个x ,等式(1)都成立。
化学反应动力学-3

k f [ A ] e [ B ] e k r [ C ] e [ D ] e
dd [A]tkf[A]B []kr[C]D []
= [A] - [A]e = [B] - [B]e = [C]e - [C] = [D]e- [D]
脉冲式:
阶跃式:
0 0
t0
0 0
t0
三、闪光光解和激光闪光光解 (Flash photolysis and laser flash photolysis )
闪光光解:一种利用强闪光使分子发生光解 产生自由原子或自由基碎片,然后用光谱或 其它方法测定产生的碎片的浓度,并监测它 们随时间的衰变行为。
ddnitirdV ud[Ai] 达稳态时: dn i 0
dt
即: ird Vu[dAi]
dz
u [Ai] [Ai]+d[i]A
进一步写为:
dV VAdz
故有:
A
z
dz
d[A] [Ai](z)
i
u0
r [Ai](0)
i
即:
AZ
i1
0 s
b
N
2 (yi abxi)xi
i1
解上述代数方程可得:
_
_
a yb x
_ 1 N
x N i1 xi
_ 1 N
y N i1 yi
N
N
N
N xi yi xi yi
b
i1 N
i1 i1 N
N xi2 ( xi )2
温度突跃 1106 s-1
第三章 化学动力学基础

1 d pB υ ν B dt
(4)单位为mol· L-1· s-1
7
影响化学反应速率的内因是:反应物的本性。 影响化学反应速率的外因是:反应的各种条件, 主要包括反应物浓度、温度和催化剂
8
3.2浓度对反应速率的影响——速率方程式
3.2.1 化学反应速率方程 对于一般反应:aA+bByY+zZ 反应速率与反应物浓度间的定量关系为: =kc (A) c (B) 称为化学反应的速率定律或反应的速率方程式
1 k υ α β c Ac B
单位由反应级数而定: 零级反应k的单位为mol· L -1 · s-1, 一级反应k的单位为s-1, 二级反应k的单位为mol -1· L ·s-1 。 它是表征化学反应速率相对大小的物理量。大小 11 与浓度无关,但与温度有关。
2.反应级数 、——c (A)、 c(B)的指数,称为反应级数。 一般有, ≠a、 ≠b 如果=1,表示该反应对A物质为一级反应。 =2 表示该反应对B物质是二级反应。 +——反应总级数。 ★注意: 反应级数由实验确定。可以是零、正整数、分 数和负数。
35
活化络合物:指运动着的两种(或多种)反应物 分子逐渐接近并落入对方的影响范围之内而 形成的处于反应物与产物之间的一种结合状 态。例如下列反应中 NO+ O3─→O2+NO2 NO+ O3─→[O—NOO—O] ─→ O2+NO2 反应物转化为生成物的过程中,分子构型发生 连续变化,生成了活化络合物,它所处的状态 称为过渡状态。
15
3.2.3 确定化学反应速率方程的方法 ------初始速率法
其基本要点为: ①将反应物按不同的组成配制一系列混合物 ②先只改变一种反应物A的浓度,保持其它反 应物浓度不变 ③反应在某一温度下开始进行,记录一定时间间隔内 A的浓度变化,作出图cA-t,确定t=0时的瞬时速率。 若能得到至少两个不同cA条件下瞬时速率,就可确 定A的反应级数。 ④同样的方法,确定其它反应物的反应级数。 这种由反应物初始浓度的变化确定反应速率和 速率方程式的方法,称为初始速率法。
化学动力学

化学动力学化学动力学的概述化学反应动力学主要研究两方面的内容,一是化学反应进行的快慢即反应速率的研究,包括反应快慢的描述,影响反应速率的各种因素。
二是对反应机理的阐述,确定反应的历程,用所建立起来的理论来解释实验得到的结论。
化学反应进行的动力学描述 一、反应速率我们如何对一个反应进行的快慢进行描述呢,注意到反应进度ξ是描述一个反应进行程度的物理量,如果建立起来ξ与时间t 的关系,我们就可以确定出一个反应进行的快慢。
那么t∂∂ξ就可以用来衡量一个反应的快慢,称之为化学反应的转化速率。
我们常用的描述反应快慢的物理量是化学反应速率r=tV ∂∂ξ1,即单位体积内反应进度随时间的变化率。
对于上式,若V 不是t 的函,那么则可以放入微分号内,写成r=tc t V n t V BB B B ∂∂=∂∂=∂∂ννξ1)()(其中νB 表示化学计量数。
对于不同的物质来说νB 是不同的,若有反应αA →βB+γC ,我们定义r A = -tc A∂∂α1为A 的消耗速率,或r B = t c B ∂∂β1的生成速率。
需要注意的是,对于一个反应来说不同物质的化学反应速率是相同的,但是各自的生成(消耗)速率是不同的,与化学计量数成正比。
对于气相反应,我们还可以通过理想气体状态方程来写出它的用压力表示的速率表达式,以及换算关系。
二、速率方程我们确定了描述反应快慢的物理量——化学反应速率,那么这个速率与什么有关,具体的关系又是什么呢?这个关系就是速率方程。
对于反应αA+βB=γC+…来说,其速率方程为,r=k[c A ]a [c B ]b ,其中的r 为整个反应的化学反应速率,若针对某一具体的物质应为r A =k A [c A ]a [c B ]b ,其他物质的表达形式与之类似。
其中,k 称为速率常数,只与温度有关,a 和b 为对应浓度的指数,与α和β一般不等。
只有在基元反应中,才相等。
a+b 称为反应级数,对于任何一个能写成上述简单速率方程的表达式,都是成立的,无论基元反应还是非基元反应。
北大考研-环境科学与工程学院研究生导师简介-陈忠明

feedbackonPAN-NOxcycleandimplicationonradicalchemistry.AtmosphericChemistryandPhysics,1
0(2):737-748,2010
10.ChenZ.M.,JieC.Y.,LiS.,etal.Heterogeneousreactionsofmethacroleinandmethylvinylketone:kineti
PRIDE-PRD
’
爱考机构 中国高端考研第一品牌(保过 保录 限额)
06,China:theirconcentration,formationmechanismandcontributiontosecondaryaerosols.Atmospheri cChemistryandPhysics,8(22):6755-6773,2008 12.ChenZ.M.,WangH.L.,ZhuL.H.,etal.Aqueousphaseozonolysisofmethacroleinandmethylvinylketo ne:apotentiallyimportantsourceofatmosphericaqueousoxidants.AtmosphericChemistryandPhysics, 8(8):2255-2265,2008 主要专著
ricChemistryandPhysics,12(19):8951-8962,2012
2.WangH.L.,HuangD.,ZhangX.,etal.Understandingtheaqueousphaseozonolysisofisoprene:distinctp
roductdistributionandmechanismfromthegasphasereaction.AtmosphericChemistryandPhysics,12(1
化学反应工程第三章

流入=流出+反应消耗
m ol 时间
dCA dCA 2 r D( ) r D( )出 K s C A (2 r x) dx dx
2
整理后:
2K S dCA dCA ( )出 ( )入 CA 0 dx dx Dr
当x 0 时
d 2 C A 2K S CA 0 2 Dr dx
dC A 0 dx
C AS M 1 M 2
dCA mx mx M1 m e M 2 m e dx
x 0 xL
m0
M 1e
;
mL1
M 2e
mL 2
M1 e 2 mL M2 C AS M2 M1 2 mL m2 ( 1) M 2 (e 1) M2 C AS e mL mL e e mL C AS e mL mL mL e e
解之:
1 K B PB 1 K B PB K A PA 1 b A 1 K B PB 1 K A PA 1 K A PA K B PB 1 ab 1 K B PB K A PA
K B PB 同理, B 1 K A PA K B PB
R S Kr A B
U KU V PU
V PS Ks s
1 A B R S V U
V PR V PS
KR KS V PR PS 1 K K B PB V A K B K R K S PB A
1 1 V 1 A B 1 K A PA K B PB 1 K i Pi
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学法
化学法的要点:当取出样品后,必须立即冻结 反应,即要使反应不再继续进行,并尽可能快 地测定浓度。
冻结的方法:骤冷、冲稀、加阻化剂、移走催 化剂等。
优点:设备简单,可直接测得浓度
缺点:在没有合适的冻结反应的方法时,很 难测得指定时刻的浓度,因而往往误差很大。
12
物理法
可利用的物理性质有:压力、体积、旋光度、折 光率、电导、电容率、颜色、光谱等。
依据反应分子数的不同,基元反应可区分为单分子反应、双 分子反应和三分子反应。
基元反应
A P
反应分子数 单分子反应
A B P
双分子反应
2A B P
三分子反应
反应分子数是针对基元反应而言的,表示反应微观过程的特
征。简单反应和复合反应是针对宏观总反应而言的。
16
§3.2 反应速率式
一、反应速率的经验表达式 二、反应级数 三、质量作用定律 四、速率常数
反应机理:反应机理又称为反应历程。组成宏观总反应的基 元反应的总合。在有些情况下,反应机理还要给出所经历的 每一步的立体化学结构图。
简单反应:仅由一种基元反应组成的总反应。
复合反应:由两种或两种以上的基元反应组成的总反应。
15
反应分子数
反应分子数:对于基元反应,直接作用所必需的反应物微观 粒子(分子、原子、离子、自由基)数。
化学动力学的目的:为了能控制反应的进行,使反应按人 们所希望的速率进行,并得到人们所希望得到的产品。
7
二、反应速率的表示法
反应速率:化学反应进行的快慢程度。目前,国际上 普遍采用以反应进度随时间的变化率来定义反应速率J
dξ J = dt
按照反应进度的定义
1
dξ= νi dni
1
J = νi
dni dt
a dt b dt g dt h dt
[i]=Ci=ni/V 参加反应的物质的浓度
在参加反应的物质中,选用任何一种,反应速率的值都
是相同的。
9
三、反应速率的实验测定
反应速率的实验测定实际上就是测定不同时刻反应物或产 物的浓度。
在浓度随时间变化的图上,在
时间t 时,作交点的切线,就 得到 t 时刻的瞬时速率。显
解决变化的方向、限度及变 学:
化过程的能量转化。
解决变化的速率及分析变
化的具体过程。
5
一、化学动力学的目的和任务
化学热力学的研究对象:研究化学变化的方向和限度问题
以及外界条件对平衡的影响。化学热力学只能预测反应的
可能性,但无法预料反应能否发生?反应的速率如何?反
应的机理如何?
1 2
N2
3 2
H2
NH3 (g)
例如:H2 + Cl2 → 2HCl总反应要经历四个反应才 能实现。
Cl2 M 2Cl M Cl H2 HCl H H Cl2 HCl Cl 2Cl M Cl2 M
14
基本概念
总反应:计量方程式仅表示反应的总效果,称为总反应。 基元反应:由反应物分子(或离子、原子、自由基等)直接 作用而生成新产物的反应。基元反应不仅是反应物分子直接 作用,而且必须是生成新产物的过程。
4
对化学变化
H2(g) + 1/2 O2(g) = H2O(l); ΔrGm°(298.15K)= -237.13kJ·mol-1
NO(g) + 1/2 O2(g) = NO2(g); ΔrGm°(298.15K)= - 35.25kJ·mol-1
变化的可能性-化学热力学: 变化的现实性-化学动力
优点:迅速而且方便,特别是可以不中止反应、 不需取样,可进行连续测定,便于自动记录。
缺点:由于测量浓度时通过间接关系,如果反 应系统由副反应或少量杂质对所测量的物理性质 有较灵敏的影响时,易造成较大的误差。
13
四、反应机理的概念
许多化学反应并不是按照计量方程式一步完成的, 而是要经历一系列具体步骤才能实现。
第三章 大气化学反应动力学
• 大气化学反应的主要特征? • 大气化学反应的分类?
1
第三章 大气化学反应动力学
• 主要特征:由于太阳辐射和大气的氧化性,各种 反应主要以光解和自由基氧化的形式进行
• 大气化学反应可分为:气相、液相和颗粒物表面 反应
• 意义:判断关键反应,有效控制大气污染
2
§3.1 引言
该定义的反应速率与物质的选择无关,而且无论反应进行
的条件如何,总是严格的、正确的。
8
反应速率的表示法
对于体积一定的密闭体系,常用单位体积的反应速率r
表示 。
r
=
J V
=
1 V
dξ dt
=
1
Vνi
dni dt
=
1
νi
dci dt
=
1
νi
d[i] dt
对于任意化学反应
r 1 dA 1 dB 1 dG 1 dH
17
一、反应速率的经验表达式
反应速率方程又称动力学方程,它表明了反应速率与浓度 等参数之间的函数关系或浓度等参数与时间的函数关系。 速率方程可表示为微分式或积分式。
微分形式 r = f (ci) 积分形式 ci=f ( t )
由实验确定的速率公式都是经验公式。经验公式有很重 要的作用
一、化学动力学的任务和目的 二、反应速率的表示法 三、反应速率的实验测定 四、反应机理的概念
3
动力学与热力学联系
• 热力学:研究反应过程的可能性 • 动力学:研究反应过程的现实性
热力学上不能发生的过程,在现实中一定不能发生, 研究其动力学没有意义。 热力学研究无限缓慢的可逆过程,故不考虑时间因素, 所以热力学上可以发生的过程只是现实可能发生的过 程,不是必然发生的。
H2பைடு நூலகம்
1 2
O2
H2O(l)
rGm$ / kJ mol1 16.63 237.19
化学热力学解决反应的可能性问题,能否实现反应还需由
化学动力学来解决。
6
化学动力学的目的和任务
化学动力学是研究化学反应速率的科学。
化学动力学的基本任务:研究各种因素(如反应系统中各 物质的浓度、温度、催化剂、光、介质……)对反应速率 的影响,揭示化学反应如何进行的机理;研究物质的结构 与反应性能的关系。
然,反应刚开始,速率大,然 后不断减小,体现了反应速率 变化的实际情况。
R P
rR
d[R] dt
rp
d[P] dt
10
反应速率的实验测定
测定不同时刻各物质浓度的方法有两种: 化学法。用化学分析法来测定不同时刻反应物
或产物的浓度,一般用于液相反应。
物理法。这种方法的基点在于测量与某种物质浓 度呈单值关系的一些物理性质随时间的变化,然后 换算成不同时刻的浓度值。
