氧化还原反应第一课时
氧化还原反应(第一课时)

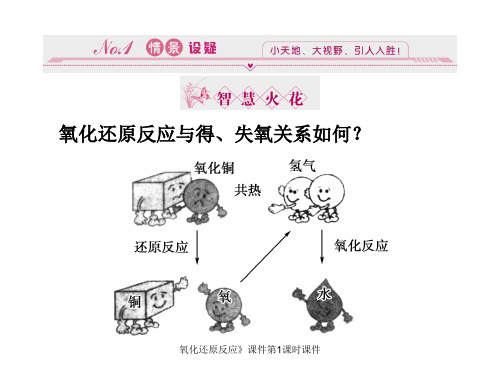
氧化还原反应(第一课时)---以探究脱氧剂作用原理为例【引入】通过一组食物图片引出食品脱氧剂。
给出资料卡片,了解脱氧剂的主要成分及作用原理。
设问:在室温条件下,食品脱氧剂中的铁真的能与氧气发生反应吗?【实验探究】教师演示试验:利用简易的原电池装置,借助电流计指针偏转这一现象,来证明铁的确能在室温下与氧气发生反应。
设置问题组,小组内讨论完成,学生分享结果,教师做好评价及分析。
难点在于电子转移的情况。
【微观探析】化学变化中的最小微粒是原子,原子包括原子核和核外电子,所以要研究电子的转移情况还要从原子结构出发。
(结构决定性质)高一学生对稳定结构的认识是原子最外层达2电子或8电子,并不了解铁的结构,所以直接给出铁的原子结构示意图,及资料卡片(Fe失去最外层2电子可形成一种稳定结构)。
设置问题组,学生先讨论完成前两个问题,明确微观上电子的得失会带来宏观上化合价的变化。
进而追问问题3:不借助仪器,如何判断发生了电子转移?将抽象的电子转移过渡到直观地化合价的变化,明确电子转移是化合价变化的本质,而化合价的变化是电子转移的宏观表现。
追问问题4:如何直观地表示电子转移的方向和数目?学生讨论给出结果,教师纠正总结分析模型,生成氧化还原反应的定义。
最后依照铁的吸氧腐蚀的化学方程式,分别从得氧失氧,化合价升降和得失电子三个角度定义氧化反应和还原反应,明确氧化还原反应的实质及特征,总结氧化还原反应的分析模型(双线桥分析及单线桥分析)。
【学以致用】本部分设计目的考察三个方面:一、如何判断氧化还原反应。
二、氧化还原反应与四大反应类型之间的关系。
三、如何分析氧化还原反应。
通过价类二维图呈现,旨在提醒学生认识物质化学性质的角度。
【重温发现之旅】体会事物的认识过程,从现象到本质。
氧化还原反应也不例外,首先从形式上的认识,到化合价,再到本质的电子转移。
氧化还原反应第一课时省名师优质课赛课获奖课件市赛课一等奖课件

17
(2)常见旳还原剂
①金属单质,如: Al、Fe、Zn 等。 ②某些非金属单质,如_H__2、__C___等。 ③低价态金属阳离子,如_F_e_2_+____等。 ④元素处于低价态时旳氧化物,如_C_O______等。
<H2O2<I-<SO2,则下列反应不能发生旳是 ( A
) A.H2O2+H2SO4=SO2↑+O2↑+22 H2O B.2Fe3++SO2+2H2O=2Fe2++4 SO +4H+ C.SO2+I2+2H2O=H2SO4+2HI D.Cl2+SO2+2H2O=H2SO4+2HCl
14
判断正误
(1)在反应 KIO3+6HI===KI+3I2+3H2O 中,每生成
HCl 被氧化,K2Cr2O7被还原。
氧化还原反应表达措施: 标电子转移方向和数目——双线桥法
1.箭头由反应物指向生成物旳同种元素
2.箭头上注明得失字样及电子数目
• 在黑火药旳爆炸反应
2KNO3+S+3C=K2S+N2↑+3CO2↑中, 化合价升高旳元素是 ,得C 电子旳原子
是
,N被、S还原旳元素是 ,N、发S 生氧
化反应旳物质是
C。
氢化钠(NaH)是一种生氢剂,可发生如下反应:NaH +H2O=NaOH+H2↑对这一反应旳描述正确旳是
A.NaH是氧化剂 B.NaH是氧化产物 C.NaOH是还原产物 D.氧化产物与还原产物旳质量比是1:1 答案:D
9
下列物质转化需要加入还原剂才干实现旳是
A.SO32- →SO2 C.Na→Na+
第三节 第一课时 氧化还原反应

1.判断正误(正确的打“√”,错误的打“×”)。
(1)氧化还原反应中一定有氧元素参加
(×)
(2)Fe→FeSO4的过程是被氧化的过程
(√)
(3)在氧化还原反应中可能只有元素化合价的升高,而无化
合价的降低
(×)
(4)置换反应一定是氧化还原反应
答案:B
高温 5.Fe2O3+2Al ===== Al2O3+2Fe所属基本反应类型是_______。
在该反应中________元素的化合价升高,该元素的原子
________电子,被________;而________元素的化合价降
低,该元素的原子________电子,被________。该反应中,
Fe2O3发生了________反应,Al发生了________反应, ________是氧化产物,________是还原产物。 解析:从反应类型上看该反应是置换反应,分析物质中元 素化合价的变化知:Fe的化合价由+3价降到0价,被还 原,得到的铁是还原产物;Al的化合价由0价升到+3价, 发生氧化反应,得到的Al2O3是氧化产物。 答案:置换反应 铝 失去 氧化 铁 得到 还原 还 原 氧化 Al2O3 Fe
1.判断氧化还原反应的依据是什么?如何记忆常见元 素的化合价?
提示:氧化还原反应的判断依据是看反应前后是否有元 素化合价的变化。记忆常见元素的化合价可利用如下口诀:
钾钠氢银正一价,钙镁钡锌正二价, 氟氯溴碘负一价,通常氧是负二价, 铜正一二铝正三,铁有正二和正三, 碳有正二和正四,硫有负二正四六。
合价升高
C.在氧化还原反应中肯定有一种元素被氧化,另一种元
素被还原
D.在氧化还原反应中不一定所有元素的化合价都发生变
高一【化学(人教版)】氧化还原反应(第一、二课时)-课件-(含实验视频)

高中化学
任务二 认识氧化还原反应的本质
活动2 利用图中装置 进行铁与硫酸铜溶液 反应的实验,实验现 象之一是电流计的指 针发生偏转。请你根 铁片 据这一实验现象对该 反应的原理做进一步 思考。
指针偏转
石墨 硫酸铜溶液
高中化学
任务二 认识氧化还原反应的本质
小结2
1. 所有的氧化还原反应中都存在电子转 移,电子转移是氧化还原反应的本质。
2CuO
+2
高温 0
2CuO + C
2Cu + CO2 ↑
氧化还原反应
+2
0
CuSO4 + Fe +2
Cu + FeSO4 +2
CuSO4 + 2NaOH
Cu(OH)2 ↓ + Na2SO4
非氧化还原反应
高中化学
任务一 认识氧化还原反应的特征
小结2
氧化还原反应的重要特征是反应前后有 元素的化合价变化。
氧化还原反应(第一课时)
年 级:高一
学 科:化学(人教版)
高中化学
高中化学
任务一 认识氧化还原反应的特征
1774年,法国化学家拉瓦锡提出燃烧的氧化学 说后,人们把物质与氧结合的反应叫做氧化反应, 把氧化物失去氧的反应叫做还原反应。
《九年级化学》 物质与氧发生的反应属于氧化反应。 含氧化合物里的氧被夺去的反应叫做还原反应。
2. 元素化合价的变化是电子转移的外在 表现,可以通过分析反应中是否有元素的 化合价发生变化来判断某个反应是否属于 氧化还原反应。
高中化学
任务三 巩固提升
活动1 请你为下列反应分类,说明你的分类依据。
2Na + Cl2
第三节 氧化还原反应第一课时(公开课)

MnO2
△
氧化还原反应与四种基本反应类型之间的关系
化合反应
分解反应
氧化还原反应
置换反应 非氧化还原反应
复分解反应
感受氧化还原反应的存在
联系实际,应用认识
赤铁矿 磁铁矿 菱铁矿 黄铁矿
Text in
Fe2O3 Fe3O4 FeCO3 h FeS2 ere
铁 矿 石
铁
高温
Fe2O3+ 3CO 2Fe + 3CO2
氧化还原反应
第一课时
△
1. 2Cu + O2=2CuO
2.CuO+H2
△
=Cu
+H2O
在这些反应中, 铜元素发生了 哪些变化?
类别和化合价
3.Fe + CuSO4 =FeSO4 + Cu
4.2NaOH+CuSO4=Cu(OH)2 ↓+Na2SO4
一、氧化还原反应
1. 特征:有化合价升降
物质所含元素化合价升高的反应是氧 化反应。
2. 本质:电子转移
【问题2】能不能通过实验证明氧化还原反应中 发生了电子转移?
Fe + CuSO4 =FeSO4 + Cu
电子转移的表示方法:
双线桥法
化合价升高,失去2e-,被氧化,氧化反应
0
+2
+2
0
Fe + CuSO4 =FeSO4 + Cu
化合价降低,得到2e-,被还原,还原反应
MnO2
高温
2Fe2O3+3C
4Fe + 3CO2↑
Fe3O4 +4CO高温 3Fe + 4CO2
如何从铁矿石中冶炼铁呢?
氧化还原反应课件第1课时课件
(2)分析下列反应的化学方程式,是氧化还原 反应的用单线桥法标出电子转移的方向和数 目。 ①BaCl2+Na2SO4===BaSO4↓+2NaCl ________________________________, ②Fe+2HCl===FeCl2+H2↑ ____________________________________。
失去
6×2e-↑
答案: C
氧化还原反应》课件第1课时课件
热点实验 探究氧化还原反应在生活中的应用
[探究举例] (1)人体血红蛋白中含有Fe2+,如
果误食亚硝酸盐,会使人中毒,因为亚硝酸盐 会使Fe2+转变成Fe3+,生成高铁血红蛋白而丧 失与O2结合的能力,服用维生素C可缓解亚硝 酸盐的中毒,这说明维生素C具有________。
氧化还原反应》课件第1课时课件
氧化还原反应中电子转移的表示 (1)分析下列反应的化学方程式,是 氧化还原反应的用双线桥法标出电子转移的方 向和数目,指出被氧化和被还原的元素。 ① 2Na+Cl2=点==燃==2NaCl ______________________________________, ②NaOH+HCl===NaCl+H2O ___________________________________。
氧化还原反应》课件第1课时课件
得氧和
化合价 电子转移观
失氧观点 升降观点
点
反 氧 化 应
得氧的反应
化合价升高 的反应
失去(或偏 离)电子的
反应
还 原 反 应
失氧的反应
化合价降低 的反应
得到(或偏 向)电子的
反应
氧化还原反应》课件第1课时课件
得失(或偏
人教版高中化学必修一-氧化还原反应第一课时ppt课件全省公开课一等奖
原反应
反应
复分解 反应置换 反应来自化合 反应分解反应
相关概念:
得到2e-,化合价降低, 被还原
氧化剂:得到电子(或电子对偏向)的 物质
+2
0
CuO+H2
0 +1
Cu+H2O
失去2×e-,化合价 升高,被氧化
还原剂:失去电子(或电子对偏离 的物质)
氧化产物:还原剂失电子(被氧化)后 的生成物
还原产物:氧化剂得电子(被还原)后 的生成物
氧化反应:原子失去(或偏离)电子,化合价升高的过程
还原反应:原子得到(或偏向)电子,化合价降低的过程
双线桥法:这种用箭头表示同一元素原子的电子转移
的情况的表示方法称 “双线桥法”。
得到1×2e-,化合价 降低,被还原
+2
0
CuO+H2
0 +1
Cu+H2O
方法:
失去2×e-,化合价 升高,被氧化
a 找出反应前后化合价发生变化的元素
b 从反应物中被氧化(或被还原)的元素指向产物中对 应的价态变化的元素 c 用e- 表示电子,注明电子得失数
d 查得失电子数是否相等
单线桥法:这种用箭头表示反应前后不同元素原子的
电子转移的情况的表示方法称 “单线桥法”。
2e-
+2
0
CuO+H2
0 +1
Cu+H2O
方法:
a 找出反应前后化合价发生变化的元素 b 还原剂中化合价升高的元素指向氧化剂中化合 价降低的元素 c 用e- 表示电子,标出转移电子的总数
第三节 氧化还原反应
第一课时 氧化还原反应
C+O2 点燃 CO2
人教版化学必修一2.3氧化还原反应优秀课件PPT
(7)1molFeS参加反应,转移电子____3___mol。
勤学勤练:
2S2- + SO32- + 6H+ = 3S↓+ 3H2O
氧化剂:__S_O_3_2_-
还原剂:__S_2_- ___
氧化产物:_S______ 还原产物:_S______
每生成1molS转移电子__1_._3_3___mol
(三)常见的氧化剂和还原剂
元素的化合价分成最高价,最低价和中间价态,元 素的最高价只有: 氧化性 最低价只有:还原性 中 间价态: 既有氧化性又有还原性 金属的化合价只 有: 正价 所以金属单质只有: 还原 性。非金属 的最高化合价一般等于 最外层电子数 最低化合价一 般等于:最高化合价-8 但是氟元素的化合价一般只 有:负一价 所以F2只有: 氧化性。
重要的氧化剂、还原剂
氧化剂
具体物质
(1)活泼非金属单质 O3、Cl2、Br2、O2
(2)高价的氧化物 NO2、CO2、MnO2
(3)高价的含氧酸 HClO、浓H2SO4、HNO3
(4)高价的盐
KMnO4、KClO3、FeCl3
(5)过氧化物
Na2O2、H2O2等
还原剂
具体物质
(1)活泼金属单质 Na、Al、Zn、Fe
记忆方法:失高氧、得低还,若说“剂” 两相反。 氧化剂本身被还原,还原剂本身被氧化。
(二)氧化还原反应中电子转移的表示方法
双线桥法 线上标出得失电子的情况及价的升降、被氧
化或被还原等内容。
1氧、化M剂nO是2:+4MHnCO2l(浓) 还原剂Cl是2↑:+MHnCCll2+2H2O 氧化产物是:Cl2 还原产物是:MnCl2 氧化剂和还原剂的物质的量之比是:_1_:__2__。 每生成2.24LCl2(标况),转移__0_._2_mol电子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
板书设计
一、氧化还原反应 1、概念: 2、特征:元素化合价升降(可作为氧化还原反应的 判断依据) 3、本质:电子转移(电子的得失或电子对的偏移) 4、氧化还原反应与四种基本反应类型的关系
课堂小结
你知道了什么? 你还想知道什么?
小结
失电子 (或电子对偏离)
得电子 (或电子对偏向)
→ →
化合价 升高 化合价 降低
→ 氧化反应
→ 还原反应
↓
本质
↓
特征
规律:升、失、氧;降、得、还
作业: 1、教材P38,1、5、6 2、预习氧化剂和还原剂部分知识
实践活动:通过报纸、杂志、书籍 或互联网等,查阅有关氧化还原反 应在日常生活、工农业生产和科学 技术中应用的几个具体事例,讨论 并交流你对氧化还原反应的认识。
学习目标: 1、氧化还原反应的特征与本质 2、氧化还原反应的判断 3、氧化还原反应与四种基本类型反应的关系 重点:用化合价升降和电子转移的观点来理解 氧化还原反应。
复习引入:
思考1:在初中阶段我们学过哪 四种基本反应类型?各举一个 反应实例。 思考2:这四种基本反应类型分 类的依据是什么?
让我 想一想?
问题探究2:在氧化还原反应中,元素化合价发 生改变的本质原因是什么?
观察实验:锌铜原电池(观察电流表指针) Zn + H2SO4 = Zn SO4 + H2 ↑
化合价变化本质原因的分析:2Na+Cl2 = 2NaCl
Na
+11
Cl
2 8 1
7 8 2 +17
Na+
Cl+11 2 8
8 8 2 +17
3、下列叙述正确的是(
D
)
A、在氧化还原反应中,失去电子的物质,所含 元素化合价降低 B、有元素化合价升降的化学反应不一定是 氧化还原反应 C、在氧化还原反应中一定所有的元素化合 价都发生变化 D、氧化还原反应的本质是电子的转移(得 失或偏移)
分层训练2:
1.下列变化属于氧化反应的是( BD) A.Fe2O3 Fe B.Zn ZnCl2 C.Na2CO3 CO2 D.Al Al2O3 2.自然界中的铁多以(+3)Fe2O3的形式存 在,可生产生活中需要大量单质铁,你认 为应该如何获得单质铁?
△
【分组讨论】:氧化反应和还原反应是分别 独立进行的吗?为什么?
结论1:在同一个反应中:氧化反应和还原反 应是同时发生的。这一类反应统称为------氧化还原反应。 问题探究1:怎样判断一个反应是不是氧化 还原反应?
思考与交流2
请分析下列3个氧化还原反应中各种元素的化合价在反 应前后有无变化,讨论氧化还原反应与元素化合价的升降 有什么关系?
Na+
Cl失去电子,化合价升高,发生氧 化反应
结论:电子得失导致元素化合价升降。
2Na + Cl2 == 2NaCl
得到电子,化合价降低, 发生还原反应
H2+Cl2=2HCl
+1
● ● ●● ● ● ● ●
-1
结论:电子对偏移导致元素化合价升降.
小结:经过大量实践证明化合价变化的实质是电子的转移
问题探究3:氧化还原反应与四种基本类型反应 有什么联系 ? 〖练习〗判断下列哪些是氧化还原反应?属 于哪种基本反应类型?尝试画出它们的交叉分 类示意图。 △
类型的关系:
氧化还原反应
置换反应 复分解反应
分层训练1:
1.下列反应属于氧化还原反应的是( BC )
A.CuO+2HCl=CuCl2+H2O
B.2Na+2H2O=2NaOH+H2
C.Zn+CuSO4=H)2+CO2=CaCO3 + H2O
2、下列四种基本类型的反应中,一定是氧化还 原反应的是( C ) A.化合反应 B.分解反应 C.置换反应 D.复分解反应
思考3:
Fe2O3 + 3CO
高温
==
2 Fe+3CO2
属于哪种基本反应类型?
思考与交流1:
1.请举几个氧化反应和还原反应的实例,指出 这类化学反应的分类标准是什么?
氧化反应: 还原反应:
C + O2 == CO2
△ CuO + H2 = Cu + H2O
点燃
分类标准:得氧失氧
分析反应: CuO + H2 == Cu + H2O
+2 -2 0 0 +4-2 高温 2CuO + C == 2Cu + CO2↑ +1 -2 0 高温 0 +2-2 H2O + C == H2 + CO +2 -2 0 △ 0 +1 -2 CuO + H2 == Cu + H2O
结论2:
物质所含元素化合价升高的反应是氧化反应
物质所含元素化合价降低的反应是还原反应
Cu+Cl2 === CuCl2 CaO + H2O === Ca(OH) 2
CaCO3===CaO+CO2 ↑
高温
√ × × √ √ ×
化合 反应
2KClO3===2KCl+3O2 ↑
△
分解反应 置换反应
Fe+CuSO4 == Cu+FeSO4
NaOH+HCl==NaCl+H2O 复分解反应
结论3:氧化还原反应和四大基本反应
有元素化合价升降的化学反应是氧化还原反应
氧化还原反应的判断依据:是否有元素化合价升降
【学以致用】分析反应: H2+Cl2 = 2HCl
Zn + H2SO4 = Zn SO4 + H2 ↑ 2Na+Cl2 = 2NaCl 是不是氧化还原反应,为什么?
思考:原有的氧化还原反应和现在的, 哪个涵义更广泛更有概括性?
