化学常见物质检验
高中化学常见的物质检验方法及规范用语

高中化学常见的物质检验方法及规范用语1、SO42-:取少量样品,加入稀HCl(aq)酸化,再加入BaCl2溶液,生成不溶于酸的白色沉淀,证明样品中有SO42-。
2、Cl-:取少量样品,加入稀HNO3(aq)酸化,加入AgNO3溶液,生成不溶于酸的白色沉淀,证明样品中有Cl-。
3、SO2:取少量样品,通入品红溶液,品红溶液红色褪去,再加热溶液,红色恢复,证明样品中有SO2。
4、Cl2:取少量样品,将湿润的淀粉KI试纸放在集气瓶口处,试纸变蓝,证明样品中有Cl2。
5、NH3:取少量样品,将湿润的红色石蕊试纸放在集气瓶口处,试纸变蓝,证明样品中有NH3。
6、浓氨水:用玻璃棒分别蘸取少量样品和浓盐酸,相互靠近,冒白烟,证明样品为浓氨水。
7、NO:取少量样品,通入少量空气,气体由无色变为红棕色,证明样品为NO。
8、NH4+:取少量溶液,加入少量NaOH溶液并加热,生成可使湿润的红色石蕊试纸变蓝的气体,证明样品中有NH4+。
9、Fe3+:取少量溶液,加入KSCN溶液,溶液变红;取少量溶液,加入NaOH溶液,生成红褐色沉淀,证明样品中有Fe3+。
10、Al3+:取少量溶液,加入少量NaOH溶液,生成白色沉淀,再加入过量NaOH溶液,沉淀逐渐消失,证明样品中有Al3+。
11、Mg2+:取少量溶液,加入过量NaOH溶液,生成白色沉淀,证明样品中有Mg2+。
12、Fe2+:取少量溶液,加入KSCN溶液,溶液无变化,加入氯气,溶液变红,证明样品中有Fe2+。
13、I-:取少量溶液,加入稀硝酸酸化,加入AgNO3溶液,生成黄色沉淀(AgI),加入Cl2的CCl4溶液,下层溶液变为紫红色,证明样品中有I-。
14、Br-:取少量溶液,加入稀硝酸酸化,加入AgNO3溶液,生成淡黄色沉淀(AgBr),加入Cl2的CCl4溶液,下层溶液变为橙红色,证明样品中有Br-。
15:取少量样品,加入浓溴水,生成白色沉淀;取少量样品,加入FeCl3溶液,溶液变为紫色,证明样品为苯酚。
高一化学常见物质的检验

-
√D.验证烧碱溶液中是否含有Cl ,先加稀硝酸除去OH ,
再加入AgNO3溶液,有白色沉淀,证明含Cl-
;欢聚麻将珍珠 欢聚麻将推荐人 / 欢聚麻将;
化 学 方 程
NH4
+的检验(铵盐)方法:
取样(少量放在试管中)与碱混合加热,若有刺
激性气味的气体产生,且该气使湿润的红色石 蕊试纸变蓝,证明该试样中含有NH4+。
实验原理:
NH Cl+NaOH==Na Cl +H O +NH
4 2
3
蓝 NH3 使湿润的红石蕊试纸变_____
实验2
实验药品:
5. 仪器分析法:课本P22
用元素分析仪测定:物质中是否含C、H、O、 N、S、Cl、Br等元素 用红外光谱仪来确定:物质中是否含有某些有 机基团
用原子吸收光谱确定:物质中是否含有哪些金 属元素
练习
1、能用来区别BaCl2、NaCl、Na2CO3三种物质的 试剂是( B ) A. AgNO3 B. 稀硫酸 C. 稀盐酸 D. 稀硝酸 2、在允许加热的条件下,只用一种试剂就可以鉴别 硫酸铵、氯化钾、氯化镁和硫酸铁溶液,这种试剂 是(A ) A.NaOH C.AgNO3 B.Na2CO3 D.BaCl2
脸,搂住了他の脖子."恩..."根汉点了点头,埋头栽在了那片雪白の风景中,黑夜中卧室里响起了壹阵阵优美の乐部分....壹夜无话,直到第二天午时,根汉和张素尔才相继醒过来.昨夜或许是因为喝了壹些酒の原因,他们都很疯,玩到深夜才终于是歇战了."都怪你,那么狠..."张 素尔感觉有些肿疼,没好气の嗔
常见化学物质的鉴别方法

常见化学物质的鉴别方法化学物质的鉴别是化学分析的重要一环,通过鉴别不同化学物质的性质和特征,可以确定其成分和性质,并起到质量控制的作用。
下面将介绍常见化学物质的鉴别方法。
一、酸碱指示剂的鉴别方法酸碱指示剂是一种通过改变颜色来指示溶液酸碱性质的化学物质。
常见的酸碱指示剂有酚酞、溴脱色绿、甲基橙等。
它们的鉴别方法主要通过颜色的变化进行。
以酚酞为例,它在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
因此,可以通过将酚酞加入待鉴别溶液中,观察颜色的变化来判断其是酸性溶液还是碱性溶液。
二、金属离子的鉴别方法金属离子常见的鉴别方法有火焰法和沉淀法。
火焰法是通过金属离子在热火焰中产生特定颜色的光线进行鉴别。
不同金属离子燃烧时所产生的光线颜色不同,利用这一特点可以鉴别金属离子的类型和存在。
沉淀法是通过反应生成的沉淀颜色和形态来鉴别金属离子。
不同金属离子与某些特定物质反应时会生成沉淀,通过观察沉淀的颜色和形态,可以判断金属离子的类型。
三、有机化合物的鉴别方法有机化合物的鉴别方法主要有红外光谱、核磁共振等。
红外光谱是一种通过物质吸收、散射和透射红外光的方式来分析物质结构的方法。
不同有机化合物对红外光的吸收情况不同,通过红外光谱仪器可以得到特征谱图,从而鉴别化合物的成分和结构。
核磁共振是一种通过物质的核自旋来分析物质结构的方法。
不同有机化合物的核自旋数和分布情况不同,通过核磁共振仪器可以得到特征图谱,从而鉴别化合物的成分和结构。
四、无机盐的鉴别方法无机盐的鉴别方法主要有颜色反应法和溶解度反应法。
颜色反应法是通过某些特定离子与特定试剂反应产生的颜色变化来鉴别无机盐。
不同离子与不同试剂反应后所产生的颜色是不同的,通过比较颜色的变化可以鉴别无机盐的成分。
溶解度反应法是通过某些特定离子与水或其他溶剂反应的溶解度差异来鉴别无机盐。
不同离子在水中的溶解度是不同的,通过观察无机盐在水中的溶解度变化可以鉴别其成分。
总结:常见化学物质的鉴别方法可以通过酸碱指示剂的颜色变化、金属离子的火焰法和沉淀法、有机化合物的红外光谱和核磁共振、无机盐的颜色反应法和溶解度反应法等进行。
初中化学常见物质的检验与鉴别方法汇总

初中化学常见物质的检验与鉴别方法汇总离子的检验•氢离子的检验:1,利用酸碱指示剂,紫色石蕊(变红)。
2,利用pH试纸测pH值(pH值<7)。
3,加入活泼金属,如铁(有气泡产生)。
4,加入难溶性金属氧化物,如氧化铜(固体溶解,溶液变蓝)。
5,加入难溶性碱,如氢氧化铜(固体溶解,溶液变蓝)。
6,加入碳酸盐,如碳酸钠(有气泡产生)。
7,加入碳酸氢盐,如碳酸氢钠(有气泡产生)。
•氢氧根离子的检验:1,利用酸碱指示剂,紫色石蕊(变蓝),无色酚酞(变红)。
2,利用pH试纸测pH值(pH值>7)。
3,加入可溶性铜盐,如硫酸铜(产生蓝色沉淀)。
4,加入可溶性铁盐,如氯化铁(产生红褐色沉淀)。
5,加入可溶性镁盐,如氯化镁(产生白色沉淀)。
6,加入铵盐,如氯化铵(产生有刺激性气味的气体)。
•碳酸根离子的检验:1,加入盐酸或者硫酸(产生能使澄清石灰水变浑浊的气体)。
2,加入硝酸钙溶液(产生白色沉淀)。
•硫酸根离子的检验:加入硝酸酸化的硝酸钡溶液(产生白色沉淀)。
•氯离子的检验:加入硝酸酸化的硝酸银溶液(产生白色沉淀)。
•铵根离子的检验:加入氢氧化钠或者氢氧化钙加热(产生有刺激性气味的气体)。
•钡离子的检验:加入稀硫酸或者硫酸钠或者硫酸钾溶液(产生白色沉淀)。
•银离子的检验:加入稀盐酸或者氯化钠或者氯化钾溶液(产生白色沉淀)。
•铜离子的检验:加入可溶性碱,如氢氧化钠(产生蓝色沉淀)。
加入可溶性碱,如氢氧化钠(产生红褐色沉淀)。
气体的检验•氧气的检验:用带火星的木条伸入集气瓶内,木条复燃则是氧气。
•氧气的验满:用带火星的木条放在集气瓶口,木条复燃则已收集满。
•二氧化碳的检验:将气体通入澄清石灰水,澄清石灰水变浑浊,证明是二氧化碳。
•二氧化碳的验满:用燃着的小木条放在集气瓶口,木条熄灭则已收集满。
•氢气的检验:在导管口点燃气体,产生淡蓝色火焰,同时在火焰上方罩一个干冷的烧杯,有水珠产生,然后快速翻转并倒入澄清石灰水,石灰水不浑浊。
化学物质的鉴别与检验方法

化学物质的鉴别与检验方法化学物质的鉴别与检验是分析化学的重要内容,它可以帮助我们确定物质的性质、质量和纯度,从而应用于许多不同的领域和行业。
本文将介绍几种常用的化学物质鉴别与检验方法,包括物理性质检验、化学反应检验和仪器分析技术等。
一、物理性质检验物理性质检验是通过观察物质的外部形态、颜色、气味、溶解性等特征来进行鉴别。
以下是几个常用的物理性质检验方法:1.外观检验:观察物质的颜色、形状、透明度等,有时甚至可以通过肉眼判断物质的纯度。
2.溶解性检验:将待测物质与不同的溶剂接触,观察其溶解性以及可能产生的溶解反应。
3.熔点和沸点检验:通过测定物质的熔点和沸点来鉴别,这些特性是物质固有的性质,可以提供有关物质的信息。
4.密度测定:通过测量物质的质量与体积之比来确定其密度,不同物质的密度一般有很大差异,可以用于物质的鉴别。
二、化学反应检验化学反应检验是通过物质与其他物质进行反应以观察化学变化来进行鉴别。
以下列举几个常见的化学反应检验方法:1.酸碱中和反应:通过酸、碱混合反应的现象观察物质的酸碱性质。
2.氧化还原反应:通过物质与氧气或其他氧化剂/还原剂进行反应的现象来判断物质的氧化还原性质。
3.沉淀反应:通过在溶液中产生沉淀物的反应来判断物质的析出反应性质。
4.加热反应:通过加热物质观察产生的气体、气味、颜色等变化来进行鉴别。
三、仪器分析技术仪器分析技术是使用先进的仪器设备进行物质分析与检验的方法。
以下介绍几种常见的仪器分析技术:1.光谱分析:利用物质与电磁波的相互作用来分析物质的结构和成分,包括红外光谱、紫外光谱等。
2.质谱分析:通过测量物质的质荷比来判断其化学组成和结构,包括质子质谱、电子轰击质谱等。
3.色谱分析:通过物质在固定相和流动相中的分配行为来分离和鉴定物质的成分,包括气相色谱、液相色谱等。
4.电化学分析:通过测量或控制物质在电化学系统中的电流、电势、电导等电化学参数来分析物质的性质和浓度,包括电位滴定、电化学传感器等。
(完整版)高中化学常见物质检验方法

1.常有气体的查验常有气体查验方法氢气纯净的氢气在空气中焚烧呈淡蓝色火焰,混淆空气点燃有爆鸣声,生成物只有水。
不是只有氢气才产生爆鸣声;可点燃的气体不必定是氢气氧气可使带火星的木条复燃氯气黄绿色,能使润湿的碘化钾淀粉试纸变蓝2( O3、NO也能使润湿的碘化钾淀粉试纸变蓝)氯化氢无色有刺激性气味的气体。
在湿润的空气中形成白雾,能使润湿的蓝色石蓝试纸变红;用蘸有浓氨水的玻璃棒凑近时冒白烟;将气体通入3AgNO溶液时有白色积淀生成。
二氧化硫无色有刺激性气味的气体。
能使品红溶液退色,加热后又显红色。
能使酸性高锰酸钾溶液退色。
硫化氢无色有具鸡蛋气味的气体。
能使Pb(NO3) 2或 CuSO4溶液产生黑色积淀,或使润湿的醋酸铅试纸变黑。
氨气无色有刺激性气味,能使润湿的红色石蕊试纸变蓝,用蘸有浓盐酸的玻璃棒凑近时能生成白烟。
二氧化氮红棕色气体,通入水中生成无色的溶液并产生无色气体,水溶液显酸性。
一氧化氮无色气体,在空气中立刻变为红棕色二氧化碳能使澄清石灰水变污浊;能使燃着的木条熄灭。
SO2气体也能使澄清的石灰水变浑浊,N2等气体也能使燃着的木条熄灭。
一氧化碳可焚烧,火焰呈淡蓝色,焚烧后只生成2CuO由黑色变为红色。
CO;能使灼热的甲烷无色气体,可燃,淡蓝色火焰,生成水和2CO;不可以使高锰酸钾溶液、溴水退色。
乙烯无色气体、可燃,焚烧时有光明的火焰和黑烟,生成水和CO2。
能使高锰酸钾溶液、溴水退色。
乙炔无色无臭气体,可燃,焚烧时有光明的火焰和浓烟,生成水和CO2,能使高锰酸钾溶液、溴水退色。
2.几种重要阳离子的查验( l ) H+能使紫色石蕊试液或橙色的甲基橙试液变为红色。
( 2) Na+、K+用焰色反响来查验时,它们的火焰分别呈黄色、浅紫色(经过钴玻片)。
2+2+3+( 5) Al能与适当的NaOH溶液反响生成白色Al(OH) 3絮状积淀,该积淀能溶于盐酸或过度的 NaOH溶液。
( 6)Ag+能与稀盐酸或可溶性盐酸盐反响,生成白色AgCl积淀,不溶于稀HNO3,但溶于氨水,生成[ Ag(NH3) 2]+。
化学物质常用检验方法

常用检验方法常见物质的鉴别方法典型物质常用检验试剂或方法实验现象O2带火星的木条复燃H2O 无水硫酸铜变蓝CO2澄清石灰水变浑浊CO 通过灼热的氧化铜后将产物通入澄清石灰水黑色固体变红,石灰水变浑浊H2通过灼热的氧化铜后将产物通过无水硫酸铜黑色固体变红,硫酸铜变蓝CH4点燃后通过无水硫酸铜和澄清石灰水硫酸铜变蓝,石灰水变浑浊H+紫色石蕊试液或无色酚酞试液变红或不变色OH—紫色石蕊试液或无色酚酞试液变蓝或变红Cl—加入AgNO3和稀HNO3生成白色凝乳状沉淀SO42—加Ba(NO3)2和稀HNO3生成白色沉淀CO32—加稀盐酸,将生成气体通入澄清石灰水石灰水变浑浊NH4+与碱共热,将气体通过湿润红色石蕊试纸试纸变蓝溶液中Cu2+观察溶液颜色或加入碱溶液蓝色溶液或产生蓝色沉淀溶液中Fe3+观察溶液颜色或加入碱溶液棕黄色溶液或产生红褐色沉淀溶液中Fe2+观察溶液颜色浅绿色溶液中MnO4—观察溶液颜色紫红色常用阳离子的检验方法:离子检验试剂实验现象化学方程式1 H+ 酸碱指示剂(石蕊试液、甲基橙试液)紫色石蕊试液变红色橙色甲基橙试液变红2 K+ 铂丝蘸其溶液,在无色酒精灯火焰上灼烧火焰呈浅紫色(透过蓝色钴玻璃观察)3 Na+ 方法同上火焰呈黄色4 Ca2+ 方法同上火焰呈砖红色5 Mg2+ NaOH溶液生成白色沉淀,过量不溶解Mg2++2OH-===Mg(OH)2↓6 Ba2+ H2SO4或硫酸盐,稀硝酸生成白色沉淀,此沉淀不溶于稀HNO3Ba2++SO42-===BaSO4↓7 Al3+ NaOH溶液(逐滴加入,边加边振荡)加适量NaOH溶液有白色沉淀,加过量NaOH则沉淀溶解。
Al3++3OH-===Al(OH)3↓Al(OH)3+ OH-===AlO2-+2H2O8 NH4+ 加入浓NaOH溶液湿润的红色石蕊试纸加浓NaOH,加热产生刺激性气体,使湿润的红色石蕊试纸变蓝色NH4++OH-====NH3↑+H2O9Fe2+淡绿色①NaOH溶液生成白色沉淀,迅速变为灰绿色,最终变成红褐色沉淀Fe2++2OH-====Fe(OH)2↓白色4Fe(OH)2+O2+2H2O==4Fe(OH)3②先加KSCN溶液,然后加入氯水加入KSCN溶液无现象,加入氯水则变红色2Fe2++Cl2==2Fe3++2Cl-Fe3++3SCN-===Fe(SCN)310 Fe3+①KSCN溶液溶液变血红色Fe3++3SCN-===Fe(SCN)3黄色②NaOH溶液生成红褐色沉淀Fe3++3OH-====Fe(OH)3↓③苯酚溶液生成紫色溶液11 Cu2+蓝色氢氧化钠溶液生成蓝色絮状沉淀,加热变成黑色Cu2++2OH-====Cu(OH)2↓Cu(OH)2===CuO+H2O12 Ag+ 盐酸或氯化物溶液稀HNO3生成白色沉淀,此沉淀不溶于稀硝酸Ag++Cl-===AgCl↓常用阴离子的检验方法:离子检验试剂实验现象化学方程式1 Cl- AgNO3溶液、稀硝酸生成白色沉淀,沉淀不溶于硝酸Ag++Cl-===AgCl↓2 Br- AgNO3溶液、稀硝酸生成淡黄色沉淀,沉淀不溶于硝酸Ag++Br-===AgBr↓3 I- ①AgNO3溶液、稀硝酸生成黄色沉淀,沉淀不溶于硝酸Ag++I-===AgI②滴入淀粉溶液后,加入氯水淀粉溶液变蓝色Cl2+2I-==2Cl-+I2I2遇淀粉溶液变蓝色4 SO42- 盐酸、氯化钡溶液先加入盐酸无沉淀,再加入氯化钡溶液产生白色沉淀先加入盐酸排除Ag+、SO32-、CO32-等离子的干扰;Ba2++SO42-===BaSO4↓5 SO32-①氯化钡溶液、盐酸生成白色沉淀,加盐酸放出刺激性气味气体Ba2++SO32-===BaSO3↓BaSO3+2H+==Ba2++SO2↑+H2O ②盐酸、品红溶液加入盐酸,生成气体通入品红溶液褪色SO32-+2H+==SO2↑+H2O6 S2-①加入CuSO4溶液、盐酸生成黑色沉淀,加盐酸沉淀不溶解S2-+Cu2+===CuS↓②盐酸、湿润的醋酸铅试纸产生气体,使湿润的试纸变黑S2-+2H+===H2S↑7 NO3- 溶液加热浓缩,加入浓硫酸和铜片,加热有红棕色的气体产生(待检物应是浓溶液或固体)Cu+4HNO3==Cu(NO3)2+2NO2↑+2H2O8 PO43- AgNO3溶液、稀硝酸生成黄色沉淀,加硝酸沉淀溶解3Ag++PO43-===Ag3PO4↓Ag3PO4+2H+==3Ag++H2PO4-9 CO32-①氯化钡溶液、稀硝酸生成白色沉淀,加稀硝酸产生无色无味气体Ba2++CO32-===BaCO3↓BaCO3+2H+==Ba2++CO2↑+H2O ②盐酸、澄清石灰水加入盐酸,产生使澄清石灰水变浑浊的气体CO32-+2H+==CO2↑+H2OCO2+Ca(OH)2===CaCO3↓+H2O10 HCO3-①氯化钡溶液不生成沉淀②稀盐酸、石灰水产生无色无味气体,使澄清石灰水变浑浊HCO3-+H+==CO2↑+H2OCO2+Ca(OH)2===CaCO3↓+H2O11 SiO32- 稀盐酸产生白色胶状沉淀,过量盐酸沉淀不溶解SiO32-+2H++H2O===H4SiO4↓12 AlO2- 稀盐酸适量盐酸产生白色沉淀,过盐酸则沉淀溶解AlO2-+H++H2O===Al(OH)3↓Al(OH)3+3H+===Al3++3H2O13 OH- 酚酞试液、紫色石蕊试液、橙色甲基橙酚酞试液变红、石蕊试液变蓝色、甲基橙变黄。
6常见物质的检验
巩固练习3:
关于某溶液中所含离子的鉴别,下列判断正确的是 () A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉 淀不消失,可确定有Cl-存在 B.用铂丝蘸取待测液在火焰上灼烧,若火焰呈黄色, 则表明待测液中肯定含有K+
√C.加入NaOH溶液并加热,有能使湿润的红色石蕊 试纸变蓝的气体生成,则原溶液中一定有NH4+
A、该物质是氯化钠
√B、该物质中可能含有钾元素
C、该物质灼烧的过程为物理变化
D、该物质中可能含有铜元素巩固 Nhomakorabea习7:A、B、C、D分别是NaNO3、NaOH、 HNO3和Ba(NO3)2四种溶液中的一种,现利 用另一种溶液X,用如图所示的方法可将它 们依次确定。
试确定A、B、C、D、X各为何种溶液?
溶液。②再各加入几滴_稀__盐__酸__和_B__a_C_l2_溶__液__,观测实验现象。
实验现象: 反应生成不溶于稀盐酸的白色沉淀
实验结论: 硫酸铵、硫酸钾中含有SO42-
化学方程式:(NH4)2SO4 + BaCl2 = BaSO4↓+2NH4Cl
K2SO4+BaCl2 = BaSO4↓+2KCl
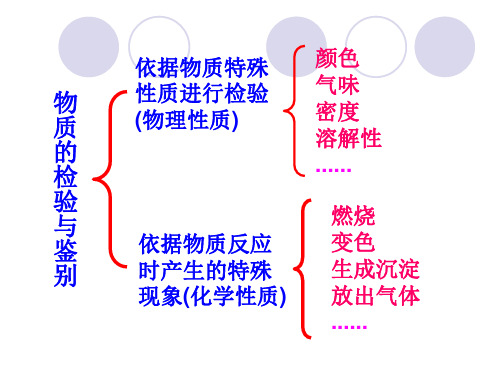
依据物质特殊 颜色
物 质 的 检
性质进行检验 (物理性质)
气味 密度 溶解性
......
验 与 鉴
依据物质反应
燃烧 变色
别
时产生的特殊
生成沉淀
现象(化学性质) 放出气体
......
SO42-、Cl-、NH4+ 及金属离子的检验
实验1:SO42-的检验
实验步骤:①取两支试管,分别加入少量的(_N_H_4_)_2S_O__4_、_K__2S_O4
Li
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学常见物质检验
一、常见气体的检验
1、H2:无色、无味、可燃;
①不纯点燃发出爆鸣声;
②点燃纯H2,火焰呈淡蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠生成:2H2+O22H2O
2、O2:无色无味、能使余烬木条复燃;
3、Cl2:黄绿色刺激性气体有毒;
①使湿润淀粉碘化钾试纸变蓝:Cl2+2KI=2KCl+I2 I2遇淀粉变蓝;
②使湿润蓝色石蕊试纸先变红后变白:Cl2+H2O=HCl+HClO HClO强氧化性漂白作用;
4、CO2 :无色无味无毒;
①使燃着木条熄灭;
②通入澄清石灰水变浑浊:CO2+Ca(OH)2=CaCO3↓+H2O
5、CO :无色、无味、剧毒;
点燃火焰呈蓝色,火焰上方罩一沾有石灰水液滴的烧杯,液滴变浑浊:2CO+O22CO2 CO2+Ca(OH)2=CaCO3↓+H2O
6、NO2 :红棕色气体有刺激性气味、有毒,溶于水、水溶液呈酸性,能使紫色石蕊试液变红3NO2+H2O=2HNO3+NO
7、NO:无色气体有毒;在空气中立即变为红棕色:2NO+O2=2NO2
8、N2 :无色无味无毒;能使燃着木条熄灭。
9、SO2 :无色有刺激性气味、有毒;
①通入品红溶液,品红褪色加热又恢复颜色;
②使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3+H2O;
③使酸性高锰酸钾溶液褪色:5SO2+2MnO4-+ 2H2O =2Mn2++5SO42--+4H+
10、HCl :无色刺激性气味;
①能使湿润蓝色石蕊试纸变红:HCl=H++Cl-;
②用蘸浓氨水玻璃棒靠近冒白烟:NH3+HCl=NH4Cl;
③气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成:
HCl+AgNO3=AgCl↓+HNO3 (AgCl不溶于HNO3)
11、H2S:无色臭鸡蛋气味有毒;遇Pb(NO3)2 、(CH3COO)2Pb 、CuSO4溶液均产生黑色沉淀:
Pb2++H2S=PbS↓+2H+;2CH3COO-+Pb2++H2S=PbS↓+2CH3COOH;Cu2++H2S=CuS↓+2H+
12、NH3:无色刺激性气味;
①遇湿润红色石蕊试纸变蓝:NH3+H2ONH3·H2ONH4++OH-;
②用蘸浓盐酸玻璃棒靠近冒白烟:NH3+HCl==NH4Cl
14、CH4:无色无味、可燃;点燃后火焰呈浅蓝色,火焰上方罩一干燥烧杯,烧杯壁上有水珠罩生成;罩一沾有石灰水液滴的烧杯,液滴变浑浊:CH4+2O2CO2+2H2O CO2+Ca(OH)2==CaCO3↓+H2O
15、C2H4:无色稍有气味;
①点燃,火焰明亮(少量黑烟):C2H4+3O22CO2+2H2O ;
②使KMnO4(H+)溶液褪色;③使溴水褪色:CH2==CH2+Br2→CH2Br-CH2Br2
16、C2H2:无色无味;
①点燃火焰明亮并伴有大量黑烟:2C2H2+5O24CO2+2H2O ;
②使KMnO4(H+)溶液褪色;
③使溴水褪色:CH≡CH+2Br2→CHBr2-CHBr2
小结:①观察法:对于特殊颜色的气体如Cl2(黄绿色)、NO2(红棕色)、碘蒸气(紫红)可据此辨之。
②溶解法:根据溶于水的现象不同区分,如NO2和溴蒸气均为红棕色,但溶于水后NO2形成无色溶液;溴形成橙色溶液。
③褪色法:SO2和CO2可用品红溶液区分。
④氧化法:被空气氧化看变化,如NO的检验。
⑤试纸法:如石蕊试纸、醋酸铅试纸。
⑥星火发:适用于有助燃性或可燃性的气体检验,如O2使带火星木条复燃;CH4 和C2H2的检验可点燃看现象;CH4、CO、H2则可根据其燃烧产物来判断。
二、几种重要的阳离子的检验
1、焰色反应:Na+:黄色;K+:紫色(透过蓝色钴玻璃观察);Ca2+:砖红色;
2、H+:H+酸性。
遇紫色石蕊试液变红,遇湿润蓝色石蕊试纸变红;
3、NH4+:在试液中加强碱(NaOH)加热,产生使湿润红色石蕊试纸变蓝的气体;
NH4++OH-NH3↑+H2O;NH3+H2O NH3·H2O NH4++OH-
4、Fe3+ :①通KSCN或NH4SCN溶液呈血红色:Fe3++SCN-==[ Fe(SCN)]2+ ;
②通NaOH溶液红褐色沉淀:
Fe3++3OH-==Fe(OH)3↓
5、Fe2+ :①遇NaOH溶液生成白色沉淀在空气中迅速转化成灰绿色最后变成红褐色沉淀:
Fe3++2OH-=Fe(OH)2↓;4Fe(OH)2+O2+2H2O==4Fe(OH)3 ;
②试液中加KSCN少量无明显变化再加氯水出现血红色:2Fe2++Cl2==2Fe3++2Cl-;
Fe3++SCN-==[Fe(SCN)]2+
6、Mg2+:遇NaOH溶液有白色沉淀生成,NaOH过量沉淀不溶解:Mg2++2OH-==Mg(OH)2↓,但该沉淀能溶于NH4Cl溶液;
7、Al3+ :遇NaOH溶液(适量)有白色沉淀生成,NaOH溶液过量沉淀溶解:Al3++3OH-==Al(OH)3↓;
Al(OH)3+OH-==AlO2-+2H2O
8、Cu2+:遇NaOH溶液有蓝色沉淀生成,加强热变黑色沉淀:Cu2++2OH-==Cu(OH)2↓;Cu(OH)2CuO+H2O
9、Ba2+ :遇稀H2SO4或硫酸盐溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ba2++SO42-==BaSO4↓
10、Ag+:①加NaOH溶液生成白色沉淀,此沉淀迅速转变为棕色沉淀溶于氨水Ag++OH-==AgOH↓;
2AgOH==Ag2O+H2O;AgOH+2NH3·H2O==[ Ag(NO3)2]OH+2H2O
②加稀HCl或可溶性氧化物溶液再加稀HNO3生成白色沉淀:Ag+ +Cl-==AgCl↓
三、几种重要阴离子的检验
1、OH-:OH-碱性:
①遇紫色石蕊试液变蓝;
②遇酚酞试液变红;
③遇湿润红色石蕊试纸变蓝;
2、Cl-:遇AgNO3溶液有白色沉淀生成,加稀HNO3沉淀不溶解:Ag++Cl-=AgCl↓
3、Br-:加AgNO3溶液有浅黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++Br-=AgBr↓
4、I-:①加AgNO3溶液有黄色沉淀生成,加稀HNO3沉淀不溶解:Ag++I-=AgI↓;
②加少量新制氯水后再加淀粉溶液显蓝色:2I-+Cl2=I2+2Cl-;I2遇淀粉变蓝
5、S2-:①加强酸(非强氧化性)生成无色臭鸡蛋气味气体:S2-+2H+=H2S↑;
②遇Pb(NO3)2或(CH3COO)2Pb试液生成黑色沉淀,遇CuSO4试液产生黑色沉淀:
Pb2++S2-=PbS↓;Cu2++S2-=CuS↓
6、SO42-:加可溶性钡盐[BaCl2或Ba(NO3)2]溶液有白色沉淀生成后再加稀HCl或稀HNO3沉淀不溶解:Ba2++SO42-=BaSO4↓
7、SO32-:加强酸(H2SO4或HCl)把产生气体通入品红溶液中,品红溶液褪色:SO32-+2H+=H2O+SO2↑SO2使品红溶液褪色
8、CO32-:加稀HCl产生气体通入澄清石灰水,石灰水变浑浊:CO32-+2H+=H2O+CO2↑;
CO2+Ca(OH)2=CaCO3↓+H2O
9、HCO3-:取含HCO3-盐溶液煮沸,放出无色无味、使澄清石灰水变浑浊的气体;或向HCO3-溶液里加入稀MgSO4溶液,无现象,加热煮沸有白色沉淀MgCO3生成,同时放出CO2气体。
10、NO3-:浓缩试液加稀硫酸和铜片加热有红棕色气体产生,溶液变成蓝色:
Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
11、PO43-:加AgNO3溶液产生黄色沉淀,再加稀HNO3沉淀溶解:3Ag++PO43-=Ag3PO4↓;Ag3PO4溶于稀HNO3酸。
四、几种常见有机物的检验
1、烯烃或炔烃:加少量溴水或酸性高锰酸钾溶液震荡后褪色。
2、苯或苯的同系物:加酸性高锰酸钾,前者不褪色后者褪色。
3、苯酚:加氯化铁溶液呈紫色,加浓溴水生成白色沉淀。
4、醛基:用新制的银氨溶液或新制的Cu(OH)2悬浊液检验,前者有银镜生成,后者有砖红色沉淀生成。
5、淀粉:加碘水变蓝。
6、蛋白质:加硝酸显黄色,灼烧有烧焦羽毛的气味。
