铵盐中含氮量的测定分析
铵盐中含氮量的测定总结

4NH4+ +6HCHO
(CH2)6N4H+ +6H2O+3H+
反应所生成的H+和六次甲基四胺盐,可以用 酚酞为指示剂,用NaOH标准溶液滴定。 (CH2)6N4H++3H++4OHH2O+(CH2)6N4
N
OH-
(CV ) NaOH M N /1000 w( N ) 100% m
四.实验内容
准确称样品 100mL烧杯 0.65-0.75g 30mL 放置 容量瓶 水 100mL 定容摇匀
试样溶液 40%甲醛 250mL锥形瓶 20.00mL 5mL 酚酞 1-2d
1min-5min
NaOH 滴定 粉红色,30S不褪色,平行3次
四.注意事项
1.因是酸碱滴定,凡体系中引入或产生酸、碱的物 质或因素都能带来误差,必须予以处理。
六. 思考题:
1.实验中称取试样质量为0.13-0.15g,是如何确定 的? 2. 含氮量的计算公式是什么?如何推导得到? 3.铵盐中氮的测定为何不采用NaOH直接滴定法? 4. 为什么中和甲醛试剂中的甲酸以酚酞作指示剂; 而中和铵盐试样中的游离酸则以甲基红作指示剂? 5. NH4HCO3中含氮量的测定,能否用甲醛法?
三.实验原理
1.NaOH标准溶液的配制与标定 KHP + NaOH = KNaP + H2O • 化学计量点:溶液显碱性,酚酞为指示剂 • 计算公式: • mKHP/MKHP=CNaOHVNaOH/1000 •
• • •
2.甲醛法测定铵盐中氮的含量
铵盐NH4Cl、(NH4)2SO4是常用的无机化 肥,可用酸碱滴定法测定其含量 • NH4+的酸性太弱(Ka=5.6×10-10),不 能用碱直接滴定,生产和实验室中广泛采用 甲醛法测定铵盐中的含氮量。 • NH4+:Ka=5.6×10-10,不符合准确滴定 要求KaC>10-8,不能直接滴定,需强化。 • 加入甲醛定量生成酸(H+)和六次甲基四铵 盐(Ka=7.1×10-6),可直接滴定
实验3 铵盐中氮含量的测定(甲醛法)

实验3 铵盐中氮含量的测定(甲醛法)实验3 铵盐中氮含量的测定(甲醛法)一、实验原理本实验使用甲醛法进行铵盐中氮含量的测定。
该方法属于Kjeldahl法家族,是对非硫化氮物质(如氨基酸、蛋白质等)中氮含量的常用测定方法。
它利用研磨、加热和加酸反应,将氮从溶液中分离出来,形成氨气,并将其与甲醛反应生成甲醛胺,然后通过酸性滴定,最终计算出氮含量。
二、实验步骤1. 将所需样品(0.5~2.0 g),金属硫酸钠(Na2SO4)(40 ~ 90 g),95%酒精(ethanol)(50 mL)和混合剂(15 g)放入Kjeldahl瓶中,用混合剂混合,然后加入水(200 mL),将混合物煮沸,待混合物完全溶解,再将三滴硫酸钙(CaSO4)加入,将混合物再次煮沸,直至混合物呈浑浊状,冷却后滤过,将滤液装入Kjeldahl瓶中。
2. 将上述滤液加入Kjeldahl瓶中,将弱硝酸(HNO3)(25 mL)和K2S2O4(10 g)加入,将液体加热至沸点,轻度加热,使混合物彻底溶解,然后将液体加热至80℃,分离氮气,并将其通过硝酸钠(NaNO3)溶液转移到另一个Kjeldahl瓶中,并将硝酸钠(NaNO3)(75 g)加入,将液体加热至沸点,待液体变清,加热至80℃,待液体变蓝,加入甲醛(CH3CHO)(20 mL),轻度搅拌,冷却至室温,将液体滴定至pH=7,测定滴定量,然后将滤液滴定至pH=4,计算氮含量。
3. 计算氮含量:N = (V1-V2)×N×m / V×M,其中:V1、V2分别为pH=7和pH=4时滴定量,N为滴定剂的摩尔浓度,m为样品的质量,V为滤液体积,M为样品中氮的质量。
三、注意事项1. 样品要求:样品必须经过研磨、混合和溶解,以便在Kjeldahl瓶中形成完整的溶液,以保证测定结果的准确性。
2. 混合物的温度控制:混合物的温度对Kjeldahl法的准确性有很大的关系,因此要求混合物的温度不能过高或过低,以防止出现异常结果。
铵盐中含氮量的测定

2021/4/9
1
一、概述
现代农业常用氮肥有NH4Cl、(NH4)2SO4、NH4HCO3和 尿素等,测定其中的含氮量主要利用的性质,但由于 NH4+为弱酸(ka = 5.6×10-10),因此不能采用NaOH标 准溶液直接滴定。通常含氮量的测定主要采用强碱蒸氨 再用酸吸收后返滴定及加入甲醛后使NH4+酸性强化后直 接用NaOH标准溶液滴定的方法。
醇酚乙溶酞醇液指溶。示液剂,,0甲.2基%乙红醇指溶示液剂,,甲0基.2红%指水示溶剂液,,0.2甲%水
甲溶醛醛液溶溶。液液,,12:0%1,。硫(应酸先铵除试去样微,量固酸)体;氯化铵
硫甲试酸醛样铵溶,试液固样,体,1:固。1体。;氯化铵试样,固体。
硫酸铵试样,固体;氯化铵试样,固体。
甲醛
本实验采用甲醛法测定未知铵盐中含氮量。
2021/4/9
二、实验目的:
1.了解酸碱滴定法的应用。 2.掌握甲醛法测定铵盐中含氮量的方法和原理及注
意事项。 3.比较两种含氮量不同测定方法的特点及区别。
2021/4/9
3
三、实验原理:
铵盐中NH4+的酸性太弱,Ka=5.6×10-10,不能 用NaOH标准溶液直接滴定,但甲醛与NH4+作 用,生成一定量的酸和六次甲基四胺盐 (CH2)6N4H+(ka为7.1×10-6),所以生成的H+和 (CH2)6N4H+可直接用标准NaOH溶液滴定。
中和铵盐中的游离酸却要采用甲基红做指示剂? 在本方法的最后测定中为什么用酚酞做指示剂?是否可
以采用甲基红做指示剂?为什么?
2021/4/9
9
感谢您的阅读收藏,谢谢!
2021/4/9
实验四_铵盐中含氮量的测定(甲醛法)

实验四铵盐中氮含量的测定(甲醛法)重点:容量瓶的使用;NaOH标液的配制和标定;甲醛法测定氨态氮的原理和操作方法;试验结果的记录和铵盐的含氮量计算。
难点:弱酸强化的基本原理;酸碱指示剂的选择原理和指示剂突变的判断。
一、实验目的1、掌握甲醛法测定铵盐中氮含量的基本原理2、复习滴定及称量操作二、实验原理铵盐NH4Cl和(NH4)2SO4是常用的氮肥,系强酸弱碱盐,由于NH4+的酸性太弱(Ka=5.6×10-10),故无法用NaOH标准溶液直接滴定。
生产和实验室中广泛采用甲醛法测定铵盐中的含氮量。
甲醛法是基于如下反应:生成的H+和(CH2)6N4H+(K a=7.1×10-6)可用NaOH标准溶液滴定,计量点时产物为(CH2)N4,其水溶液显微碱性,可选用酚酞作指示剂。
6三、仪器和试剂邻苯二甲酸氢钾(KHP)分析纯;酚酞2g·L-1乙醇溶液;甲基橙1 g·L-1水溶液;(NH4)SO4;0.1mol·L-1NaOH标准溶液(同实验3);40%甲醛;甲基红2g·L-1乙醇溶液。
2四、实验内容1.配制0.1mol.L-1NaOH500mL(称取2gNaOH配制成500mL溶液)。
2.将称量瓶洗涤并烘干,称取0.4~0.5g邻苯二甲酸氢钾三份分别放于锥形瓶中。
3.将称量得到的邻苯二甲酸氢钾用20-30mL水温热溶解,冷却后,加入1-2滴酚酞,用0.1mol.L-1NaOH滴定至溶液呈微红色,半分钟内不褪色,即为终点。
4.称取0.10~0.20g(NH4)2SO4三份于锥形瓶中。
5.将称量得到的(NH4)2SO4用20-30mL水溶解后,加入5mL中性甲醛溶液,加入1-2滴酚酞,用0.1mol.L-1NaOH滴定至淡红色,半分钟内不变色,即为终点。
五、数据记录及处理1.数据记录表格2.含氮量的计算含氮量N%=C NaOH×V NaOH×M(N)×100%/m六、注意事项1.如果铵盐中含有游离酸,应事先中和除去,先加甲基红指示剂,用NaOH溶液滴定至溶液呈橙色,然后再加入甲醛溶液进行测定。
铵盐中氮含量的测定
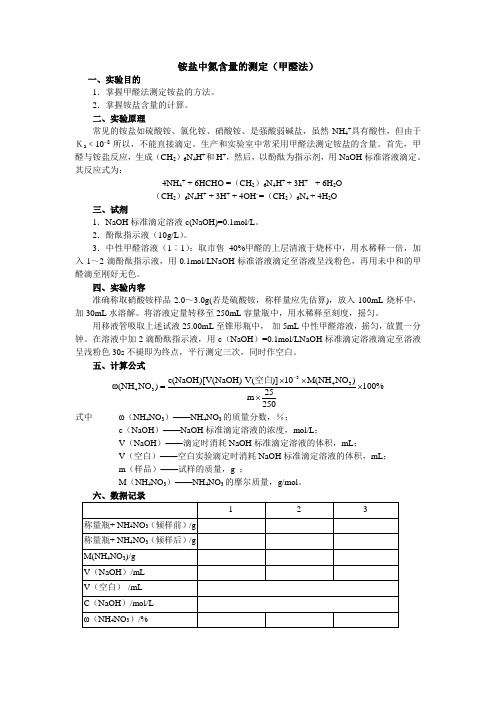
铵盐中氮含量的测定(甲醛法)一、实验目的1.掌握甲醛法测定铵盐的方法。
2.掌握铵盐含量的计算。
二、实验原理常见的铵盐如硫酸铵、氯化铵、硝酸铵、是强酸弱碱盐,虽然NH 4+具有酸性,但由于Ka ﹤10–8所以,不能直接滴定。
生产和实验室中常采用甲醛法测定铵盐的含量。
首先,甲醛与铵盐反应,生成(CH 2)6N 4H +和H +,然后,以酚酞为指示剂,用NaOH 标准溶液滴定。
其反应式为:4NH 4+ + 6HCHO =(CH 2)6N 4H + + 3H + + 6H 2O (CH 2)6N 4H + + 3H + + 4OH –=(CH 2)6N 4 + 4H 2O三、试剂1.NaOH 标准滴定溶液c(NaOH)=0.1mol/L 。
2.酚酞指示液(10g/L )。
3.中性甲醛溶液(1︰1):取市售40%甲醛的上层清液于烧杯中,用水稀释一倍,加入1~2滴酚酞指示液,用0.1mol/LNaOH 标准溶液滴定至溶液呈浅粉色,再用未中和的甲醛滴至刚好无色。
四、实验内容准确称取硝酸铵样品2.0~3.0g(若是硫酸铵,称样量应先估算),放入100mL 烧杯中,加30mL 水溶解。
将溶液定量转移至250mL 容量瓶中,用水稀释至刻度,摇匀。
用移液管吸取上述试液25.00mL 至锥形瓶中, 加5mL 中性甲醛溶液,摇匀,放置一分钟。
在溶液中加2滴酚酞指示液,用c (NaOH )=0.1mol/LNaOH 标准滴定溶液滴定至溶液呈浅粉色30s 不褪即为终点,平行测定三次,同时作空白。
五、计算公式34343c(NaOH)[V(NaOH)-V()]10M(NH NO )ω(NH NO )100%25m 250-⨯⨯=⨯⨯空白式中 ω(NH 4NO 3)——NH 4NO 3的质量分数,%;c (NaOH )——NaOH 标准滴定溶液的浓度,mol/L ;V (NaOH )——滴定时消耗NaOH 标准滴定溶液的体积,mL ;V (空白)——空白实验滴定时消耗NaOH 标准滴定溶液的体积,mL ; m (样品)——试样的质量,g ;M (NH 4NO 3)——NH 4NO 3的摩尔质量,g/mol 。
甲醛法测定铵盐中氮含量实验报告

甲醛法测定铵盐中氮含量实验报告甲醛法是一种实验室常用的测定有机物中氮含量的方法,本文以实验室测定铵盐中氮含量为例,描述了甲醛法的实验原理和实验方法,以及测得的结果。
1.甲醛法原理甲醛法(硝酸甲醛法)是一种测量有机物中氮含量的常用实验方法,其原理是用硝酸甲醛将有机物中的氮转化为氨,再用酸性分光光度法测定氨的浓度,从而得出有机物的氮含量。
2.实验材料和试剂从实验室储存室取出硝酸甲醛试剂(400毫克/毫升)、石蕊红试剂(250毫克/毫升)、甲醇(分析级)和氢氧化钠(分析级),并从外购获得本实验所用的铵盐样品。
3.实验流程(1)将铵盐样品(约20克)称入盖有重量标示的100毫升量瓶中,并加入50毫升纯甲醇和2毫升氢氧化钠溶液,然后摇匀,让样品完全溶解;(2)将所得溶液滴定至50毫升标定点,然后向滴定液中加入酸性石蕊红溶液2毫升;(3)将加入石蕊红溶液后的溶液滴定至100毫升,然后快速有序地加入硝酸甲醛溶液。
(4)当溶液发生反色时,按照实验程序,用分光光度计测定溶液的光度。
4.实验结果用甲醛法测定铵盐样品中氮含量结果如下:初始光度:1.055最终光度:3.674样品中氮含量:1.919%5.实验总结本实验证明,甲醛法可以用于测定铵盐样品中的氮含量,测得的结果为1.919%,结果比预期的结果稍低,说明实验方法正确,甲醛法是一种有效的测定有机物中氮含量的方法。
此外,在进行本实验的过程中,要注意严格控制溶液的温度,以及滴定时注意不要滴出被测液,以免误差偏大。
同时,也要注意样品量、试剂称量以及器具清洁度,以保证实验结果的准确性与可信度。
通过本次实验,我们可以熟练掌握甲醛法测定铵盐样品中氮含量的实验程序,并对实验方法有更深入的了解,从而为未来工作打下坚实基础。
铵盐中含氮量的测定

1 铵盐中含氮量的测定(甲醛法)一、实验目的1. 掌握用甲醛法测定铵盐中氮的原理和方法;2. 熟练滴定操作和滴定终点的判断。
二、基本原理铵盐是常见的无机化肥,是强酸弱碱盐,可用酸碱滴定法测定其含量,但由于NH 4+的酸性太弱(K a =5.6×10-10),直接用NaOH 标准溶液滴定有困难,生产和实验室中广泛采用甲醛法测定铵盐中的含氮量。
甲醛法是基于甲醛与一定量铵盐作用,生成相当量的酸(H +)和六次甲基四铵盐(K a =7.1×10-6)反应如下: 4NH 4+ + 6HCHO == (CH 2)6N 4 + 6H 2O + 4H + 1001000/)(%⨯=m M CV N N NaOH所生成的H +和六次甲基四胺盐,可以酚酞为指示剂,用NaOH 标准溶液滴定。
再按下式计算含量。
式中M N ――氮原子的摩尔质量(14.01 g/mol )。
三、主要试剂0.1 mol/L NaOH 溶液 0.2%酚酞溶液 0.2%甲基红指示剂 甲醛溶液四、实验步骤1.甲醛溶液的处理:甲醛中常含有微量甲酸是由甲醛受空气氧化所致,应除去,否则产生正误差。
处理方法如下:取原装甲醛的上层清液于烧杯中,用水稀释一倍,加入1~2滴0.2%酚酞指示剂,用0.1 mol/LNaOH 溶液中和至甲醛溶液呈淡红色。
2. 试样中含氮量的测定: 准确称取0.4~0.5 g 的NH 4Cl 或1.6~1.8 g 左右的(NH 4)2SO 4于烧杯中,用适量蒸馏水溶解, 然后定量地移至250 ml 溶量瓶中,最后用蒸馏水稀释至刻度,摇匀。
用移液管移取试液25 ml 于锥形瓶中,加1~2滴甲基红指示剂, 溶液呈红色,用0.1 mol/L NaOH 溶液中和至红色转为金黄色,然后加入8ml 已中和的1:1甲醛溶液,再加入1~2滴酚酞指示剂摇匀,静置一分钟后,用0.1 mol/L NaOH 标准溶液滴定至溶液淡红色持续半分钟不褪,即为终点。
实验3 铵盐中氮含量的测定(甲醛法)

一、实验目的
1. 掌握NaOH标准溶液的配制及标定方法; 掌握NaOH标准溶液的配制及标定方法; 2. 掌握用甲醛法测定氮含量的原理及方法 (间接滴定法)。
二、实验原理
1. NaOH溶液浓度的标定 NaOH溶液浓度的标定 大多数物质的标准溶液不宜用直接法配制, 可选用标定法。由于NaOH固体易吸收空气中的 可选用标定法。由于NaOH固体易吸收空气中的 CO2和水蒸气,且其中含有少量的硅酸盐、硫酸 CO2和水蒸气,且其中含有少量的硅酸盐、硫酸 盐和氯化物等,故只能选用标定法来配制。常用 标定碱标准溶液的基准物质有邻苯二甲酸氢钾、 草酸等。本实验选用邻苯二甲酸氢钾作基准物质, 其反应为:
COOH COOK + NaOH COONa COOK
+ H2O
2.甲醛法测定铵盐中氮含量
由于NH4+的酸性太弱(Ka=5.6× 由于NH4+的酸性太弱(Ka=5.6×10-10),因此 不能直接用NaOH标准溶液滴定(C 不能直接用NaOH标准溶液滴定(CspKa≥10-8为能 否进行准确滴定的界限判断),但用甲醛法可以 间接测定其含量。铵盐通过处理也可以用甲醛法 测定其含氮量。甲醛与NH4+作用,生成质子化的 测定其含氮量。甲醛与NH4+作用,生成质子化的 六次甲基四胺(Ka=7.1×10-6)和H+,其反应如下: 六次甲基四胺(Ka=7.1×10-6)和H+,其反应如下: 4 NH4+ + 6HCHO = (CH2)6N4H+ + 3 H+ + 6H2O 所生成的H+和(CH2)6N4H+可用NaOH标准 所生成的H+和(CH2)6N4H+可用NaOH标准 溶液滴定,采用酚酞作指示剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
4NH4+ +6HCHO
(CH2)6N4H+ +6H2O+ 3H+
5. NH4HCO3 中含氮量的测定,能否用甲醛法?
?样品中可能含有少量的游离酸,也需预先中和(空白实验) ?方法:加甲基红指示剂, 用氢氧化钠滴定至橙色,消耗NaOH 量扣除,然后再加入甲醛进行测定。
(实验不做,方法要求掌握)
?2. 如称取试样量较少(小于0.2g )或 试样不均匀
? 可考虑多称样品,溶解后定容100mL 或250mL,再取20.00mL-25.00mL 测定。
差减法KHP 水溶解 酚酞 250ml锥形瓶
0.40 ~0.45g 20-30mL 1-2d NaOH溶液
粉红色,30S不褪色 滴定
平行3次,由滴定剂体积和基准物质的质量计算 NaOH溶液的 准确浓度
3. 试样中含氮量的测定
100mL烧杯
准确称样品 水 0.65-0.75g 30mL
100mL 定容摇匀
三. 实验原理
1.NaOH标准溶液的配制与标定 KHP + NaOH = KNaP + H2O
? 化学计量点:溶液显碱性,酚酞为指示剂 ? 计算公式: ? mKHP/MKHP=CNaOHVNaOH/1000 ?
? ? ?
2. 甲醛法测定铵盐中氮的含量
铵盐NH4Cl 、(NH4) 2SO4是常用的无机化肥, 可用酸碱滴定法测定其含量 ? NH4+的酸性太弱(Ka=5.6 ×10-10 ),不
?五.数据记录和处理
?表1 NaOH标准溶液的标定 ?表2 硫酸铵中含氮量的测定
六. 思考题:
1. 实验中称取试样质量为 0.13-0.15g ,是如何确定 的?
2. 含氮量的计算公式是什么?如何推导得到? 3. 铵盐中氮的测定为何不采用 NaOH直接滴定法? 4. 为什么中和甲醛试剂中的甲酸以酚酞作指示剂; 而中和铵盐试样中的游离酸则以甲基红作指示剂?
实验三
铵盐中含氮量的测定 (甲醛法)
一、实验目的
1. 掌握用甲醛法测定铵盐中氮的原理和方法; 2. 掌握酸碱溶液的配制和标定 3. 掌握酸碱滴定的相关操作(滴定管使用和和滴 定终点的判断)。
二、仪器与试剂
电子天平;酸式滴定管;锥形瓶;量筒;烧杯等。 NaO溶H 液( 0.1 mol/L ); 酚酞溶液( 0.2 %) 甲醛溶液, 20% 。(应先除去微量酸,为什么 )
反应所生成的 H+和六次甲基四胺盐,可以用 酚酞为指示剂 ,用NaOH 标准溶液滴定。
(CH2)6N4H++3H++4OH -
H2O+ (CH2)6N4
N
OH-
w(N) ? (CV)NaOH MN /1000? 100%
m
四. 实验内容
1. 0.1mol.L -1 NaOH溶液的配制 2. 0.1mol.L -1 NaOH溶液的标定
容量瓶
试样溶液 250mL锥形瓶
20.00mL
40%甲醛
放置
5mL 1min-5min
酚酞 1-2d
NaOH 滴定
粉红色,30S不褪色,行3次
四. 注意事项
1. 因是酸碱滴定,凡体系中引入或产生酸、碱的物 质或因素都能带来误差,必须予以处理。
甲醛中含有少量被氧化而生成的甲酸需预先中和
方法:以酚酞为指示剂,用NaOH标准溶液中和至溶液显淡红 色以除去
