铵盐中氮含量的测定
实验六铵盐中氮的测定(甲醛法)

实验六铵盐中氮的测定(甲醛法)一、实验目的1.了解甲醛法测定铵盐中含氮量的原理和方法。
2.进一步练习滴定分析操作。
二、实验原理NH4+的酸性太弱,K(NH4+)=5.6×10-10,不能用NaOH标准溶液直接滴定。
生产和实验中广泛采用甲醛法测定铵盐中的含氮量。
甲醛和铵离子的反应如下:4 NH4+ + 6 HCHO ====(CH2)6 N4 H+ + 3 H+ + 6 H2O生成质子化的六次甲基四胺酸(CH2)6 N4 H+(Ka==7.1×10-6)和游离的H+,均可用NaOH 标准溶液滴定,计量点时产物为(CH2)6 N4,水溶液显微碱性,可选用酚酞为指示剂。
三、实验试剂硫酸铵(s) ,40%甲醛溶液,0.10mol·L-1 NaOH标准溶液,酚酞指示剂(2g/L 乙醇溶液)四、实验仪器称量瓶,锥形瓶,分析天平,量筒,碱式滴定管。
五、实验步骤1.甲醛溶液的处理:甲醛中常含有微量甲酸,应事先除去。
可取原瓶装甲醛上层清液于烧杯中,加入1滴酚酞指示剂,用0.10mol/LNaOH溶液中和至溶液呈淡红色。
2.试样中含氮量的测定:(1)准确称取硫酸铵盐试样(0.13 g)于锥形瓶中,用少量去离子水溶解。
(2)加入5mL 40%甲醛溶液,再加1~2滴酚酞指示剂,静置1分钟。
(3)用0.10mol·L-1NaOH标准溶液滴至呈微红色,即为终点。
(4)按上述过程再做两次平行实验。
(5)计算出试样中氮的百分含量。
六、实验数据处理记录表格自拟。
注意:计算过程可以省略,只写出计算公式即可,但实验结果必须明确。
七、注意事项1.如果试样中含有游离酸,则加甲醛之前先以甲基红为指示剂,用NaOH溶液中和,以免影响滴定结果。
2.甲醛中常含有微量甲酸,应预先用NaOH溶液中和。
八、思考题1.为什么中和甲醛试剂中的游离酸以酚酞作指示剂,而中和铵盐试样中的游离酸则以甲基红为指示剂?。
实验3 铵盐中氮含量的测定(甲醛法)

实验3 铵盐中氮含量的测定(甲醛法)实验3 铵盐中氮含量的测定(甲醛法)一、实验原理本实验使用甲醛法进行铵盐中氮含量的测定。
该方法属于Kjeldahl法家族,是对非硫化氮物质(如氨基酸、蛋白质等)中氮含量的常用测定方法。
它利用研磨、加热和加酸反应,将氮从溶液中分离出来,形成氨气,并将其与甲醛反应生成甲醛胺,然后通过酸性滴定,最终计算出氮含量。
二、实验步骤1. 将所需样品(0.5~2.0 g),金属硫酸钠(Na2SO4)(40 ~ 90 g),95%酒精(ethanol)(50 mL)和混合剂(15 g)放入Kjeldahl瓶中,用混合剂混合,然后加入水(200 mL),将混合物煮沸,待混合物完全溶解,再将三滴硫酸钙(CaSO4)加入,将混合物再次煮沸,直至混合物呈浑浊状,冷却后滤过,将滤液装入Kjeldahl瓶中。
2. 将上述滤液加入Kjeldahl瓶中,将弱硝酸(HNO3)(25 mL)和K2S2O4(10 g)加入,将液体加热至沸点,轻度加热,使混合物彻底溶解,然后将液体加热至80℃,分离氮气,并将其通过硝酸钠(NaNO3)溶液转移到另一个Kjeldahl瓶中,并将硝酸钠(NaNO3)(75 g)加入,将液体加热至沸点,待液体变清,加热至80℃,待液体变蓝,加入甲醛(CH3CHO)(20 mL),轻度搅拌,冷却至室温,将液体滴定至pH=7,测定滴定量,然后将滤液滴定至pH=4,计算氮含量。
3. 计算氮含量:N = (V1-V2)×N×m / V×M,其中:V1、V2分别为pH=7和pH=4时滴定量,N为滴定剂的摩尔浓度,m为样品的质量,V为滤液体积,M为样品中氮的质量。
三、注意事项1. 样品要求:样品必须经过研磨、混合和溶解,以便在Kjeldahl瓶中形成完整的溶液,以保证测定结果的准确性。
2. 混合物的温度控制:混合物的温度对Kjeldahl法的准确性有很大的关系,因此要求混合物的温度不能过高或过低,以防止出现异常结果。
铵盐中氮含量的测定

铵盐中氮含量的测定说起铵盐中氮含量的测定,这可真是个既科学又接地气的活儿。
咱们平时听到的铵盐,听起来好像挺高大上,其实它就在咱们生活的方方面面。
化肥里的氮元素,大多来自铵盐;还有那些食品防腐剂、炸药啥的,都离不开它。
这么重要的东西,氮含量到底有多少,咱们得好好测测,才能保证它安全可靠。
这事儿,咱们得从实验室里说起。
想象一下,你走进一间满是试管、烧杯的屋子,空气中弥漫着那种特有的化学试剂味道。
这时候,咱们的主角——铵盐,就静静地躺在某个角落里,等着咱们去“验明正身”。
咱们得准备点工具,比如那万能的滴定管、精准的电子天平,还有那些五颜六色的指示剂。
测氮含量,最常用的方法就是凯氏定氮法。
听起来挺复杂,其实原理挺简单,就是想办法把铵盐里的氮元素“哄”出来,再用点手段把它抓住,称称有多重。
具体操作起来,那可是有点技术含量。
你得先把铵盐磨得细细的,跟土豆泥似的,然后加点碱,煮它一锅开水浴。
这步骤啊,就像咱们炖肉的火候,得掌握好,不能急也不能慢。
煮完了,这氮元素就乖乖地变成氨气,飘到空气中了。
这时候,咱们得赶紧拿点硼酸溶液来“收留”它们。
硼酸就像个慈祥的老奶奶,氨气一来,它就张开怀抱,把它们都揽在怀里。
然后,咱们再用点标准酸,一滴一滴地往硼酸溶液里加,就像给老奶奶的孙子们分糖果,一直分到他们吃不下为止。
这时候,咱们看看用了多少酸,就能算出氮含量有多高了。
说起来,这测定过程,就像是一场精心策划的“捉迷藏”。
氮元素就像是个调皮的孩子,咱们得用各种手段,才能把它找出来。
有时候,它藏得挺深,你得有耐心,一步步地引诱它出来;有时候,它又特别活跃,你得眼疾手快,才能抓住它。
这个过程,既考验咱们的技术,又考验咱们的耐心。
当然了,测氮含量这事儿,可不是闹着玩的。
它关系到咱们用的化肥质量、食品安全,还有工业生产的安全。
如果氮含量不达标,那化肥就白施了,庄稼长不好;食品里氮含量超标,吃了对身体可不好;工业生产中,氮含量控制不好,那可是要出大事的。
分析化学实验铵盐中氮含量的测定实验报告

分析化学实验铵盐中氮含量的测定实验报告实验报告姓名:班级:同组⼈:项⽬铵盐中氮含量的测定课程:分析化学学号:⼀、实验⽬的1、掌握酸碱滴定法测定碱度的原理和⽅法。
2、学习⽤邻苯⼆甲酸氢钾标定氢氧化钠的⽅法。
3、了解甲醛法测定氮含量的原理。
4、了解酸碱滴定的实际应⽤。
⼆、实验原理氢氧化钠标准溶液和盐酸标准溶液⼀样,只能⽤间接法配配制,其浓度的确定也可以⽤基准物质来标定。
常⽤的有草酸和邻苯⼆甲酸氢钾等。
本实验采⽤邻苯⼆甲酸氢钾,它与氢氧化钠的反应为:达到化学计量点时,溶液呈弱碱性,可⽤酚酞作指⽰剂。
铵盐中氮含量的测定有蒸馏法和甲醛法两种,⽤甲醛法测定时,应⽤的是酸碱滴定中的间接滴定⽅法。
甲醛与铵盐作⽤后,可⽣成等物质的量的酸,例如:2(NH4)2SO4+6HCH O=(CH2)6 N4+2H2SO4+6H2O 反应⽣成的酸可⽤氢氧化钠标准溶液滴定,由于⽣成的另⼀种产物六次甲基四胺(CH2)6 N4是⼀个很弱的碱,化学计量点时PH约为8.8,因此⽤酚酞作指⽰剂。
w(N)=C(NaOH)×V(NaOH)×14.01/1000/ m [(NH4)2SO4] ×100% 式中质量单位为g,体积单位为mL,浓度单位为moI/L。
三、仪器和药品仪器:电⼦天平(3个)、称量瓶(3个)、50mL碱式滴定管(1个)、250mL锥形瓶(3个)250mL容量瓶(1个)、5mL刻度吸管(1个)。
药品:0.1moL/L NaOH溶液、邻苯⼆甲酸氢钾、酚酞指⽰剂、硫酸铵试样、40%中性甲醛溶液等。
四、内容及步骤准确称取纯净邻苯⼆甲酸氢钾⼀份,重约为3-3.5g,称⾄⼩数点后四位,置于⼩烧杯中,蒸馏⽔使之溶解、定容成250mL。
⽤25mL移液管准确移取此溶液三份,分别置于250mL锥形瓶中,再滴⼊酚酞指⽰剂2滴,⽤欲标定的0.1moL/L NaOH溶液滴定⾄恰好呈红⾊,在30秒内不褪⾊为⽌。
记录数据,计算氢氧化钠溶液的准确浓度。
铵盐中氮含量的测定
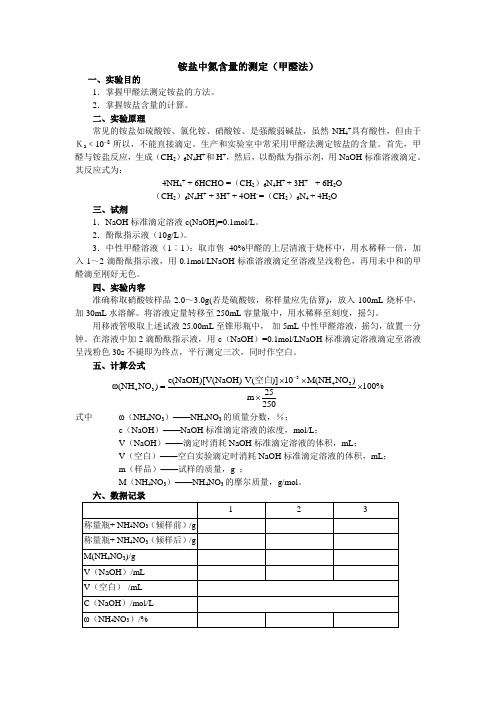
铵盐中氮含量的测定(甲醛法)一、实验目的1.掌握甲醛法测定铵盐的方法。
2.掌握铵盐含量的计算。
二、实验原理常见的铵盐如硫酸铵、氯化铵、硝酸铵、是强酸弱碱盐,虽然NH 4+具有酸性,但由于Ka ﹤10–8所以,不能直接滴定。
生产和实验室中常采用甲醛法测定铵盐的含量。
首先,甲醛与铵盐反应,生成(CH 2)6N 4H +和H +,然后,以酚酞为指示剂,用NaOH 标准溶液滴定。
其反应式为:4NH 4+ + 6HCHO =(CH 2)6N 4H + + 3H + + 6H 2O (CH 2)6N 4H + + 3H + + 4OH –=(CH 2)6N 4 + 4H 2O三、试剂1.NaOH 标准滴定溶液c(NaOH)=0.1mol/L 。
2.酚酞指示液(10g/L )。
3.中性甲醛溶液(1︰1):取市售40%甲醛的上层清液于烧杯中,用水稀释一倍,加入1~2滴酚酞指示液,用0.1mol/LNaOH 标准溶液滴定至溶液呈浅粉色,再用未中和的甲醛滴至刚好无色。
四、实验内容准确称取硝酸铵样品2.0~3.0g(若是硫酸铵,称样量应先估算),放入100mL 烧杯中,加30mL 水溶解。
将溶液定量转移至250mL 容量瓶中,用水稀释至刻度,摇匀。
用移液管吸取上述试液25.00mL 至锥形瓶中, 加5mL 中性甲醛溶液,摇匀,放置一分钟。
在溶液中加2滴酚酞指示液,用c (NaOH )=0.1mol/LNaOH 标准滴定溶液滴定至溶液呈浅粉色30s 不褪即为终点,平行测定三次,同时作空白。
五、计算公式34343c(NaOH)[V(NaOH)-V()]10M(NH NO )ω(NH NO )100%25m 250-⨯⨯=⨯⨯空白式中 ω(NH 4NO 3)——NH 4NO 3的质量分数,%;c (NaOH )——NaOH 标准滴定溶液的浓度,mol/L ;V (NaOH )——滴定时消耗NaOH 标准滴定溶液的体积,mL ;V (空白)——空白实验滴定时消耗NaOH 标准滴定溶液的体积,mL ; m (样品)——试样的质量,g ;M (NH 4NO 3)——NH 4NO 3的摩尔质量,g/mol 。
甲醛法测铵盐中的含氮量公式

甲醛法测铵盐中的含氮量公式甲醛法是经常用于测定铵盐中氮含量的常见实验方法。
大多数铵盐中的氮含量在0.2-0.8%之间,测量的精确度可达到0.05-0.10%。
这种方法的基本原理是将铵盐溶液中的氮以甲醛分解得到,再用酸性双氧水氧化反应得到氨氮,最后通过分光光度测定仪(或分光光度计)来测量甲醛法测定的氨氮的含量。
甲醛法测定氮含量的公式用甲醛法测量铵盐中的氮含量可以使用下面的公式:氮含量(N)= A B x W100其中:A:在测定过程中用于反应的液体体积(ml);B:甲醛的物质的重量(g);x:酸性双氧水用于反应的体积(ml);W:氨氮的质量(g)。
甲醛法的实验步骤1.铵盐溶液置于实验烧杯内,加入甲醛溶液至实验烧杯;2.电搅拌器搅拌反应液,使溶液完全混合;3.混合物放置20分钟,以便甲醛能够完全分解;4.入一定量的酸性双氧水至反应液中,搅拌均匀;5.混合物置于温控恒温水浴中加热至100°C,搅拌反应液;6.反应液冷却至室温,采用分光光度仪或分光光度计测定溶液的含氮量;7.仪器的测定结果换算成氮的质量,可以使用以上公式计算铵盐中的氮含量。
由于甲醛分解溶液中氮的步骤比较繁琐,因此这种方法的误差比较大,对实验结果也有一定影响。
甲醛法应用由于甲醛法测量铵盐中的氮含量精确,被广泛应用于工业、农业和医学领域等,尤其是测量养殖业中氮磷比例时,甲醛法可以更快捷准确地反映测定结果,从而提高生产效率。
比如,用甲醛法可以测定水质中的氨氮含量,以分析水污染的严重程度,对养殖业的水污染防治也有重要作用。
此外,在化学工业中,甲醛法也是经常用于测量氮含量的常见实验方法,可以用来检测燃料油、润滑油、汽油、柴油以及其它化工产品的氮含量,从而确定燃料质量。
总结甲醛法测定铵盐中的氮含量是一种简单有效的实验方法,其精确度高,实验步骤相对简单,可以较快捷准确地测定氮含量,多用于工业、农业和医学领域,特别是在水污染监测和燃料质量检测方面有重要的作用。
实验3 铵盐中氮含量的测定(甲醛法)
2.NaOH溶液浓度的标定
用递减称量法准确称取0.4~0.5g(精 确至0.0001g )已烘干的邻苯二甲酸氢钾三 份,分别放入三个已编号的250mL锥形瓶 中,加20~30mL水溶解(若不溶可稍加热, 冷却后),加入1~2滴酚酞指示剂,用 0.1mol·L-1 NaOH溶液滴定至呈微红色,半 分钟不褪色,即为终点。平行测定三次, 计算NaOH标准溶液的浓度(见下式)。
3.甲醛法测定铵盐中氮含量
准确称取0.13~0.16g(NH4)2SO4试样于 250mL锥形瓶中,加入20~30mL蒸馏水溶解,加 1~2滴甲基红指示剂,溶液呈红色,用已标定好 的NaOH溶液中和至红色转变成金黄色;再加入上 述已处理好的甲醛溶液5mL,1~2滴0.2%酚酞, 摇匀,静置2min后,用已标定好的NaOH标准溶 液滴定至溶液呈淡红色,半分钟不褪色即为终点, 记下读数,计算试样中氮的质量百分含量(,见 下式,以N%表示)。平行测定三次,计算三次测 定的相对平均偏差。
COOH + NaOH COOK
COONa ቤተ መጻሕፍቲ ባይዱOOK + H2O
2.甲醛法测定铵盐中氮含量
由于NH4+的酸性太弱(Ka=5.6×10-10),因此 不能直接用NaOH标准溶液滴定(CspKa≥10-8为能 否进行准确滴定的界限判断),但用甲醛法可以
间接测定其含量。铵盐通过处理也可以用甲醛法
测定其含氮量。甲醛与NH4+作用,生成质子化的 六次甲基四胺(Ka=7.1×10-6)和H+,其反应如下:
4 NH4+ + 6HCHO = (CH2)6N4H+ + 3 H+ + 6H2O 所生成的H+和(CH2)6N4H+可用NaOH标准
甲醛法测定铵盐中氮含量实验报告
甲醛法测定铵盐中氮含量实验报告甲醛法是一种实验室常用的测定有机物中氮含量的方法,本文以实验室测定铵盐中氮含量为例,描述了甲醛法的实验原理和实验方法,以及测得的结果。
1.甲醛法原理甲醛法(硝酸甲醛法)是一种测量有机物中氮含量的常用实验方法,其原理是用硝酸甲醛将有机物中的氮转化为氨,再用酸性分光光度法测定氨的浓度,从而得出有机物的氮含量。
2.实验材料和试剂从实验室储存室取出硝酸甲醛试剂(400毫克/毫升)、石蕊红试剂(250毫克/毫升)、甲醇(分析级)和氢氧化钠(分析级),并从外购获得本实验所用的铵盐样品。
3.实验流程(1)将铵盐样品(约20克)称入盖有重量标示的100毫升量瓶中,并加入50毫升纯甲醇和2毫升氢氧化钠溶液,然后摇匀,让样品完全溶解;(2)将所得溶液滴定至50毫升标定点,然后向滴定液中加入酸性石蕊红溶液2毫升;(3)将加入石蕊红溶液后的溶液滴定至100毫升,然后快速有序地加入硝酸甲醛溶液。
(4)当溶液发生反色时,按照实验程序,用分光光度计测定溶液的光度。
4.实验结果用甲醛法测定铵盐样品中氮含量结果如下:初始光度:1.055最终光度:3.674样品中氮含量:1.919%5.实验总结本实验证明,甲醛法可以用于测定铵盐样品中的氮含量,测得的结果为1.919%,结果比预期的结果稍低,说明实验方法正确,甲醛法是一种有效的测定有机物中氮含量的方法。
此外,在进行本实验的过程中,要注意严格控制溶液的温度,以及滴定时注意不要滴出被测液,以免误差偏大。
同时,也要注意样品量、试剂称量以及器具清洁度,以保证实验结果的准确性与可信度。
通过本次实验,我们可以熟练掌握甲醛法测定铵盐样品中氮含量的实验程序,并对实验方法有更深入的了解,从而为未来工作打下坚实基础。
实验3 铵盐中氮含量的测定(甲醛法)
一、实验目的
1. 掌握NaOH标准溶液的配制及标定方法; 掌握NaOH标准溶液的配制及标定方法; 2. 掌握用甲醛法测定氮含量的原理及方法 (间接滴定法)。
二、实验原理
1. NaOH溶液浓度的标定 NaOH溶液浓度的标定 大多数物质的标准溶液不宜用直接法配制, 可选用标定法。由于NaOH固体易吸收空气中的 可选用标定法。由于NaOH固体易吸收空气中的 CO2和水蒸气,且其中含有少量的硅酸盐、硫酸 CO2和水蒸气,且其中含有少量的硅酸盐、硫酸 盐和氯化物等,故只能选用标定法来配制。常用 标定碱标准溶液的基准物质有邻苯二甲酸氢钾、 草酸等。本实验选用邻苯二甲酸氢钾作基准物质, 其反应为:
COOH COOK + NaOH COONa COOK
+ H2O
2.甲醛法测定铵盐中氮含量
由于NH4+的酸性太弱(Ka=5.6× 由于NH4+的酸性太弱(Ka=5.6×10-10),因此 不能直接用NaOH标准溶液滴定(C 不能直接用NaOH标准溶液滴定(CspKa≥10-8为能 否进行准确滴定的界限判断),但用甲醛法可以 间接测定其含量。铵盐通过处理也可以用甲醛法 测定其含氮量。甲醛与NH4+作用,生成质子化的 测定其含氮量。甲醛与NH4+作用,生成质子化的 六次甲基四胺(Ka=7.1×10-6)和H+,其反应如下: 六次甲基四胺(Ka=7.1×10-6)和H+,其反应如下: 4 NH4+ + 6HCHO = (CH2)6N4H+ + 3 H+ + 6H2O 所生成的H+和(CH2)6N4H+可用NaOH标准 所生成的H+和(CH2)6N4H+可用NaOH标准 溶液滴定,采用酚酞作指示剂。
铵盐中含氮量的测定
•方法:加甲基红指示剂,用氢氧化钠滴定至橙色,消耗 NaOH量扣除,然后再加入甲醛进行测定。
(实验不做,方法要求掌握)
• 2.如称取试样量较少(小于0.2g)或 试样不均匀
• 可考虑多称样品,溶解后定容100mL 或250mL,再取20.00mL-25.00mL测 定。
差减法KHP 水溶解 酚酞 250ml锥形瓶
0.40~0.45g 20-30mL 1-2d NaOH溶液
粉红色,30S不褪色 滴定
平行3次,由滴定剂体积和基准物质的质量计算NaOH溶液 的准确浓度
3.试样中含氮量的测定
准确称样品 水
100mL
100mL烧杯
定容摇匀
0.65-0.75g 30mL 容量瓶
试样溶液 40%甲醛 250mL锥形瓶
20.00mL 5mL
放置 1min-5min
酚酞 NaOH 1-2d 滴定 粉红色,30S不褪色,平行3次
四.注意事项
1.因是酸碱滴定,凡体系中引入或产生酸、碱的物 质或因素都能带来误差,必须予以处理。
甲醛中含有少量被氧化而生成的甲酸需预先中和
方法:以酚酞为指示剂,用NaOH标准溶液中和至溶液显淡 红色以除去
三.实验原理
1.NaOH标准溶液的配制与标定 KHP + NaOH = KNaP + H2O
• 化学计量点:溶液显碱性,酚酞为指示剂 • 计算公式: • mKHP/MKHP=CNaOHVNaOH/1000 •
• • •
2.甲醛法测定铵盐中氮的含量
铵盐NH4Cl、(NH4)2SO4是常用的无机化 肥,可用酸碱滴定法测定其含量 • NH4+的酸性太弱(Ka=5.6×10-10),不
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铵盐中氮含量的测定(甲醛法)
一、实验目的
1.掌握甲醛法测定铵盐的方法。
2.掌握铵盐含量的计算。
二、实验原理
常见的铵盐如硫酸铵、氯化铵、硝酸铵、是强酸弱碱盐,虽然NH 4+
具有酸性,但由于K
a
﹤10
–8
所以,不能直接滴定。
生产和实验室中常采用甲醛法测定铵盐的含量。
首先,甲醛
与铵盐反应,生成(CH 2)6N 4H +
和H +
,然后,以酚酞为指示剂,用NaOH 标准溶液滴定。
其反应式为:
4NH 4+
+ 6HCHO =(CH 2)6N 4H +
+ 3H +
+ 6H 2O (CH 2)6N 4H +
+ 3H +
+ 4OH –
=(CH 2)6N 4 + 4H 2O
三、试剂
1.NaOH 标准滴定溶液c(NaOH)=L 。
2.酚酞指示液(10g/L )。
3.中性甲醛溶液(1︰1):取市售40%甲醛的上层清液于烧杯中,用水稀释一倍,加入1~2滴酚酞指示液,用LNaOH 标准溶液滴定至溶液呈浅粉色,再用未中和的甲醛滴至刚好无色。
四、实验内容
准确称取硝酸铵样品~3.0g(若是硫酸铵,称样量应先估算),放入100mL 烧杯中,加30mL 水溶解。
将溶液定量转移至250mL 容量瓶中,用水稀释至刻度,摇匀。
用移液管吸取上述试液至锥形瓶中, 加5mL 中性甲醛溶液,摇匀,放置一分钟。
在溶液中加2滴酚酞指示液,用c (NaOH )=LNaOH 标准滴定溶液滴定至溶液呈浅粉色30s 不褪即为终点,平行测定三次,同时作空白。
五、计算公式
34343c(NaOH)[V(NaOH)-V()]10M(NH NO )
ω(NH NO )100%25m 250
-⨯⨯=⨯⨯
空白
式中 ω(NH 4NO 3)——NH 4NO 3的质量分数,%;
c (NaOH )——NaOH 标准滴定溶液的浓度,mol/L ;
V (NaOH )——滴定时消耗NaOH 标准滴定溶液的体积,mL ; V (空白)——空白实验滴定时消耗NaOH 标准滴定溶液的体积,mL ; m (样品)——试样的质量,g ;
M (NH 4NO 3)——NH 4NO 3的摩尔质量,g/mol 。
六、数据记录
七、实验注意问题
1 实验中称取424(NH )SO 试样质量为-0.16g ,是如何确定的。
2 含氮量的计算公式为3
NaOH N N
S
(CV)10M 100%m ω-⋅⋅=⨯,是如何推导得到
的 八、思考题
1.铵盐中氮的测定为何不采用NaOH 直接滴定法
答:因NH 4+
的K a =×10-10
,酸性太弱,其Ck a <10-8
,所以不能用NaOH 直接滴定。
2. 为什么中和甲醛试剂中的甲酸以酚酞作指示剂;而中和铵盐试样中的游离酸则以甲基红作指示剂
答:甲醛试剂中的甲酸以酚酞为指示剂用NaOH 可完全将甲酸中和,若以甲基红为指示剂,用NaOH 滴定,指示剂变为红色时,溶液的pH 值为,而甲酸不能完全中和。
铵盐试样中的游
离酸若以酚酞为指示剂,用NaOH溶液滴定至粉红色时,铵盐就有少部分被滴定,使测定结果偏高。
3. NH4HCO3中含氮量的测定,能否用甲醛法
答:NH4HCO3中含氮量的测定不能用甲醛法,因用NaOH溶液滴定时,HCO3-中的H+同时被滴定,所以不能用甲醛法测定。
