高效毕赤酵母表达载体的改造与应用
毕赤酵母手册

毕赤酵母表达实验手册作者:Jnuxz 来源:丁香园时间:2007-9-5大肠杆菌表达系统最突出的优点是工艺简单、产量高、周期短、生产成本低。
然而,许多蛋白质在翻译后,需经过翻译后的修饰加工,如磷酸化、糖基化、酰胺化及蛋白酶水解等过程才能转化成活性形式。
大肠杆菌缺少上述加工机制,不适合用于表达结构复杂的蛋白质。
另外,蛋白质的活性还依赖于形成正确的二硫键并折叠成高级结构,在大肠杆菌中表达的蛋白质往往不能进行正确的折叠,是以包含体状态存在。
包含体的形成虽然简化了产物的纯化,但不利于产物的活性,为了得到有活性的蛋白,就需要进行变性溶解及复性等操作,这一过程比较繁琐,同时增加了成本。
大肠杆菌是用得最多、研究最成熟的基因工程表达系统,当前已商业化的基因工程产品大多是通过大肠杆菌表达的,其主要优点是成本低、产量高、易于操作。
但大肠杆菌是原核生物,不具有真核生物的基因表达调控机制和蛋白质的加工修饰能力,其产物往住形成没有活性的包涵体,需要经过变性、复性等处理,才能应用。
近年来,以酵母作为工程菌表达外源蛋白日益引起重视,原因是与大肠杆菌相比,酵母是低等真核生物,除了具有细胞生长快,易于培养,遗传操作简单等原核生物的特点外,又具有真核生物时表达的蛋白质进行正确加工,修饰,合理的空间折叠等功能,非常有利于真核基因的表达,能有效克服大肠杆菌系统缺乏蛋白翻译后加工、修饰的不足。
因此酵母表达系统受到越来越多的重视和利用。
[1]。
同时与大肠杆菌相比,作为单细胞真核生物的酵母菌具有比较完备的基因表达调控机制和对表达产物的加工修饰能力。
酿酒酵母(Saccharomyces.Cerevisiae)在分子遗传学方面被人们的认识最早,也是最先作为外源基因表达的酵母宿主。
1981年酿酒酵母表达了第一个外源基因----干扰素基因[2],随后又有一系列外源基因在该系统得到表达[3、4、5、6]。
干扰素和胰岛素虽然已经利用酿酒酵母大量生产并被广泛应用,当利用酿酒酵母制备时,实验室的结果很令人鼓舞,但由实验室扩展到工业规模时,其产量迅速下降。
毕赤酵母表达研究进展

利用强效可调控启动子AOX,已高效表达了HBsAg、TNF、EGF、破伤风毒素C片段、基因1工程抗体等多种外源基因[11、12、13],证实该系统为高效、实用、简便,以提高表达量并保持产物生物学活性为突出特征的外源基因表达系统,而且非常适宜扩大为工业规模[14]11. 彭毅,杨希才,康良仪。
影响甲醇酵母外源蛋白表达的因素。
生物技术通报2000,4:33-3612. 11 3 Cregg JM . Tschopp JF Stillman C, et al .High-level expression and efficient assembly of hepatitis B surface antigen in the methylotrophic yeast pichia.pastoris Bio/Technology,1987,5:479-48513. Sreekrishma K , Nelles L ,Potenz R,et al .High-level expression ,purification ,and characterization of recombinant human tumor necrosis factor synthesized and characterization in the methylotrophic yeast pichia .pastoris ,Biochemistry ,1989,28:4117-412514. Siegel RS , Buckholz RG, Thill GP , et al .Production of epider growth factor in methylotrophic yeast cells, International Patent Application ,1990 ,Publication No:WO90/10697毕赤酵母是甲醇营养型酵母,可利用甲醇作为其唯一碳源。
一种强化乳铁蛋白表达的毕赤酵母及其构建方法与应用

一、概述乳铁蛋白是一种存在于哺乳动物乳汁中的重要蛋白质,具有丰富的营养价值和生物活性。
其在免疫调节、抗氧化、抗菌、抗病毒等方面具有重要作用,因此受到了广泛的关注。
而毕赤酵母是一种常见的真菌微生物,可以被用于多种重要蛋白的表达和生产。
构建一种强化乳铁蛋白表达的毕赤酵母具有重要的研究意义和应用价值。
二、毕赤酵母的特点1. 毕赤酵母的生物学特性毕赤酵母(Pichia pastoris)是一种酵母,通过改良的形态和工程学技术,可以高效表达和分泌异源蛋白,其优点包括a. 生长速度快b. 表达异源蛋白能力强c. 分泌蛋白质的能力优秀2. 毕赤酵母在蛋白表达中的应用毕赤酵母在蛋白表达中应用广泛,主要包括医药、工业、生物学等领域。
通过毕赤酵母表达系统,可以实现对多种重要蛋白的高效表达和大规模生产。
三、强化乳铁蛋白表达的毕赤酵母构建方法1. 选择适合的毕赤酵母表达载体通过对不同毕赤酵母表达载体的筛选和比较,选取适合乳铁蛋白表达的载体。
2. 乳铁蛋白基因的克隆和插入通过PCR扩增、酶切、连接等分子生物学技术,得到乳铁蛋白基因的重组表达载体。
3. 转化和筛选将表达载体转化至毕赤酵母菌株中,进行筛选得到高效表达乳铁蛋白的毕赤酵母菌株。
4. 条件优化与表达通过调节培养基、温度、pH值等条件,优化乳铁蛋白的表达条件,提高其表达量和纯度。
四、强化乳铁蛋白表达的毕赤酵母的研究进展1. 表达量和纯度的提高通过使用不同的表达载体、优化表达条件等手段,可以显著提高乳铁蛋白的表达量和纯度,满足不同应用的需求。
2. 抗性因子的引入引入抗性因子可以提高毕赤酵母对特定抗生素的抗性,从而提高其在生产中的稳定性和可操作性。
3. 结构与功能分析通过结构生物学等技术手段对乳铁蛋白在毕赤酵母中的结构和功能进行深入研究,为其应用提供理论基础。
五、强化乳铁蛋白表达的毕赤酵母在食品、医药等领域的应用1. 食品领域强化乳铁蛋白表达的毕赤酵母可以用于生产高营养价值的乳制品,如乳粉、奶酪等,提高其抗菌、抗氧化等功能。
毕赤酵母表达蛋白步骤

毕赤酵母表达蛋白步骤一、引言毕赤酵母(Pichia pastoris)是一种常用的真菌表达系统,被广泛应用于蛋白质的表达和生物技术研究中。
其优势包括高表达水平、易于培养和操作、能够正确折叠复杂蛋白等。
本文将介绍毕赤酵母表达蛋白的步骤。
二、构建表达载体毕赤酵母表达系统的关键是表达载体的构建。
首先,需要选择适合的表达载体,常用的有pPIC6、pPICZα等。
然后,在载体上选择合适的启动子和信号序列,以确保蛋白质能够被正确表达和分泌。
同时,还需要在表达载体上加入选择标记,如His标签、FLAG标签等,以便后续的蛋白质纯化和检测。
三、转化毕赤酵母将构建好的表达载体转化入毕赤酵母中,使其成为表达宿主。
转化方法包括电击转化、化学转化等。
其中,电击转化是常用的方法,通过电击脉冲使毕赤酵母细胞膜发生破裂,使表达载体进入细胞内。
转化后,将细胞培养在选择性培养基上,筛选出带有表达载体的毕赤酵母克隆。
四、表达蛋白经过转化筛选后,得到含有目标蛋白表达载体的毕赤酵母克隆。
接下来,需要将克隆进行培养,在适当的条件下诱导蛋白的表达。
常用的诱导剂包括甲醇、巯基乙醇等,通过加入适量的诱导剂,可以使目标蛋白得到高效表达。
五、蛋白纯化在蛋白表达后,需要进行蛋白纯化,以获得纯度较高的目标蛋白。
常用的纯化方法包括亲和层析、离子交换层析、凝胶过滤层析等。
在选择纯化方法时,需要根据目标蛋白的性质和需求进行合理选择。
同时,可以利用加入的选择标记,如His标签,通过亲和层析纯化进行快速高效的纯化。
六、蛋白鉴定和功能分析蛋白纯化后,需要进行蛋白的鉴定和功能分析。
常用的鉴定方法包括SDS-PAGE、Western blot等,可以确定蛋白的分子量和纯度。
功能分析则可以通过生物学实验来进行,如酶活测定、结合实验等,以验证目标蛋白的功能。
七、应用和展望毕赤酵母表达系统在生物技术和蛋白质研究领域有着广泛的应用。
通过该系统,可以高效表达各种蛋白,包括抗体、酶和重组蛋白等。
一种通过过表达毕赤酵母翻译相关因子提高重组蛋白胞内表达的策略

A Strategy to Increase the Intracellular Overexpression of Recombinant
Proteins by Expressing Pichia pastoris Translation-related Factors
LIN Wen-yang, LIAO Xi-hao, CHEN Nan-zhu, HUANG Da-fu, CHEN Liang, ZHONG Bing-xu, LIANG Shu-li, LIN Ying
2021, Vol.37, No.7
this study. Among them, the eGFP unit cell expression of eIF4A, eEF1A, eEF3, Ded81, Bcy1, Ssb increased by 18.40%, 18.80%, 29.50%,
28.45% and 21.60%, respectively, and the mRFP unit cell expression increased by 20%, 8.00, 19.00%, 5.40% and 15.40%, respectively. Bcy1
进一步以红色荧光蛋白 mRFP 为报告蛋白进行验证。结果表明:本研究共筛选到了 6 个对毕赤酵母重组蛋白胞内表达有促进作用的
翻译相关因子 eIF4A、eEF1A、eEF3、Ded81、Bcy1、Ssb。其中 eIF4A、eEF1A、eEF3、Ded81、Bcy1、Ssb 的 eGFP 单位菌体表达
量分别增加了 18.40%、18.80%、29.50%、28.45%、21.60%,mRFP 单位菌体表达量分别增加了 20.00%、8.00%、19.00%、5.40%、
毕赤酵母常用表达载体

毕赤酵母常用培养基与载体一、毕赤酵母表达常用载体:典型的巴斯德毕赤酵母表达载体载体包含醇氧化酶-1(AOX1)基因的启动子和转录终止子(5'AOX1和3'AOX1),它们被多克隆位点(MCS)分开,外源基因可以在此插入。
此载体还包含组氨醇脱氢酶基因(HIS4)选择标记及3'AOX1区。
当整合型载体转化受体时,它的5'AOX1和3'AOX1能与染色体上的同源基因重组,从而使整个载体连同外源基因插入到受体染色体上,外源基因在5'AOX1启动子控制下表达。
毕赤酵母本身不分泌内源蛋白,而外源蛋白的分泌需要具有引导分泌的信号序列。
而由89个氨基酸组成的酿酒酵母的分泌信号—α交配因子(α-factor)引导序列已经成功地引导了几种外源蛋白的分泌。
分泌表达载体主要有:pPIC9,pPIC9K,pHIL-S1,pPICZα A,pYAM75P等。
胞内表达载体主要有:pHIL-D2,pA0815,pPIC3K,pPICZ,pHWO10,pGAPZ,pGAPZa(Invitrogen),pPIC3.5K等。
工程菌株Y11430,MG1003,GS115 (AOX1),KM71,SMD1168。
毕赤酵母宿主菌常用的有GS115和KM71两种,都具有HIS4营养缺陷标记。
其中,GS115茵株具有AOX1基因,是Mut+,即甲醇利用正常型;而KM71菌株的AOX1位点彼ARG4基因插入,表型为Muts,即甲醇利用缓慢型,两种菌株都适用于一般的酵母转化方法。
多拷贝表达菌株的获得方式:与自主复制的质粒型表达载体不同,整合型表达载体的拷贝数可以有很大的变化。
含多拷贝外源基因的表达菌株合成蛋白的量也较多。
体内整合可通过高遗传霉素抗性,筛选可能的多拷贝插入;而体外整合可通过连接产生外源基因的串联插入。
多拷贝表达菌株的获得方式有两种:一种是利用SDS-PAGE电泳、免疫杂交或菌落点杂交方法在大量的转化子中进行自然筛选。
毕赤酵母基因组编辑技术原理
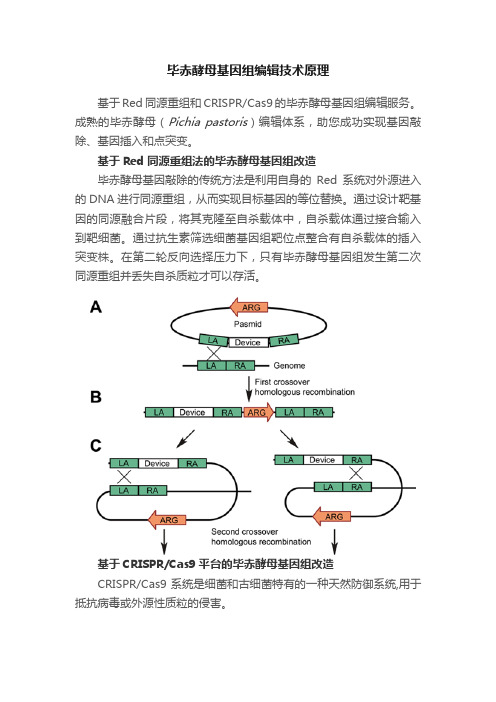
毕赤酵母基因组编辑技术原理基于Red同源重组和CRISPR/Cas9的毕赤酵母基因组编辑服务。
成熟的毕赤酵母(Pichia pastoris)编辑体系,助您成功实现基因敲除、基因插入和点突变。
基于Red同源重组法的毕赤酵母基因组改造毕赤酵母基因敲除的传统方法是利用自身的Red系统对外源进入的DNA进行同源重组,从而实现目标基因的等位替换。
通过设计靶基因的同源融合片段,将其克隆至自杀载体中,自杀载体通过接合输入到靶细菌。
通过抗生素筛选细菌基因组靶位点整合有自杀载体的插入突变株。
在第二轮反向选择压力下,只有毕赤酵母基因组发生第二次同源重组并丢失自杀质粒才可以存活。
基于CRISPR/Cas9平台的毕赤酵母基因组改造CRISPR/Cas9系统是细菌和古细菌特有的一种天然防御系统,用于抵抗病毒或外源性质粒的侵害。
研究内容•毕赤酵母基因敲除(Pichia pastoris gene knockout)•毕赤酵母基因敲入(Pichia pastoris gene knockin)•毕赤酵母基因点突变(Pichia pastoris gene point mutation)下游应用•抗生素及重要工业用酶•发现新的基因功能•优化代谢通路,提升代谢产物产量,实现工业化生产参考文献:•Selle K, Barrangou R. Harnessing CRISPR–Cas systems for bacterial genome editing[J]. Trends in microbiology, 2015, 23(4): 225-232.•Zerbini, F., Zanella, I., Fraccascia, D., König, E., Irene, C., & Frattini, L. F., et al. (2017). Large scale validation of an efficient CRISPR/Cas-based multi gene editing protocol in Escherichia coli.Microbial Cell Factories, 16(1), 68.。
毕赤酵母表达系统使用心得

毕⾚酵母表达系统使⽤⼼得Pichia酵母表达系统使⽤⼼得甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为⼈熟知,并⼴泛应⽤于外源蛋⽩的表达。
虽然说酵母表达操作简单表达量⾼,但是在实际操作中,并不是每个外源基因都能顺利得到⾼表达的。
不少⼈在操作中会遇到这样那样的问题,收集了部分⽤户在使⽤EasySelect Pichia Expression System这个被誉为最简单的毕⾚酵母表达的经典试剂盒过程中的⼼得体会。
其中Xiang Yang是来⾃美国乔治城⼤学(Georgetown University)Lombardi癌症中⼼(Lombardi Cancer Center),部分⽤户来⾃国内。
+ 表⽰优胜于;- 表⽰不如;= 表⽰差不多EasySelect Pichia Expression System产品性能:优点——使⽤简单,表达量⾼,His-tag便于纯化缺点——酵母表达蛋⽩有时会出现蛋⽩切割问题全⾯产品报告及⼼得体会:巴斯德毕⾚酵母(Pichia pastoris )是⼀种能⾼效表达重组蛋⽩的酵母品种,⼀⽅⾯由于其是属于真核⽣物,因此表达出来的蛋⽩可以进⾏糖基化修饰,另⼀⽅⾯毕⾚酵母⽣长速度快,可以将表达的蛋⽩分泌到培养基中,⽅便蛋⽩纯化。
毕⾚酵母表达载体pPICZ 在多克隆位点(MCR )3'端带有his-tag 和c-myc epitopes ,这些tag 有利于常规检测和纯化,⽽且在MCR5'端引⼊了alpha factor (α-factor )⽤以增加表达,并且在表达后α-factor 可以⾃动被切除。
在进⾏克隆的时候,如果你选择的是EcoRI ,那么只需在⽬标蛋⽩中增加两个氨基酸序列即可完成。
另外pPICZ 系列选⽤的是Zeocin 抗⽣素作为筛选标记,⽽诱导表达的载体需要甲醇——甲醇⽐⼀般⽤于⼤肠杆菌表达诱导使⽤的IPTG 便宜。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
随着生物技术的发展ꎬ利用基因工程技术来开发 重组蛋白已颇受人们青睐ꎮ 毕赤酵母表达系统是当前 流行的真核表达系统之一[1] ꎬ具有许多其他蛋白表达 系统所不具备的优点ꎬ有可诱导的强启动子ꎬ外源基因 能整合于染色体上ꎬ具有高表达、高稳定、高密度发酵、 适度糖基化、表达产物生物活性好、发酵纯化操作方法 简便及易于工业化生产等特点ꎬ已成功地表达了许多 极具价值的蛋白[2] ꎮ 但是不同的蛋白在毕赤酵母表达 过程中表现出不同的表达量ꎬ有的蛋白难以在毕赤酵 母中表达ꎬ而有的蛋白表达量可达 10 g / L 以上[3] ꎬ因 此ꎬ分泌表达量成为制约毕赤酵母表达的瓶颈ꎬ如何提
载体ꎬ可获得高表达ꎬ具有很好的工业前景ꎮ
关键词 YPS1 基因ꎻPDI 表达盒ꎻ毕赤酵母ꎻ人血清白蛋白ꎻ人生长激素
中图分类号 Q78
文献标识码 B
文章编号 2095 - 1736(2019)01 - 0107 - 05
Construction and application of a new Pichia pastoris expression vector
HOU Zeng ̄miaoꎬ LI Xiao ̄yingꎬ GAO Enꎬ YANG Xiao ̄linꎬ ZHAO Jin ̄li
( Shanxi Huikang Bio ̄tech Co Ltdꎬ Xi′an 710054ꎬ China)
Abstract To construct a vector for promoting the high expression of exogenous protein in Pichia pastorisꎬ the exogenous gene was co ̄ expressed with PDI in the same vectorꎬ and the YPS1 gene was inactivated simultaneously. Using pPICZαA as backbone vectorꎬ the C and N ̄terminal nonfunctional area sequence of YPS1 pichia gene was connected to pPICZαA vectorꎬ then the recombinant vector pPICZαA ̄YPSΔ was obtained. When pichia PDI gene sequence was connected to pPICZαA vectorꎬ recombinant vector pPICZαA ̄PDI was produced. Nextꎬ PDI expression cassette was gained using PCR method with recombinant vector pPICZαA ̄PDI as a template. Af ̄ ter connecting PDI expression cassette to recombinant vector pPICZαA ̄YPSΔꎬ the high expression vector pPICZαA ̄PDI ̄YPSΔ was ob ̄ tained via screening. Finallyꎬ the exogenous genes HSA and hGH were introduced to the vectorꎬ then converting to Pichia GS115 in or ̄ der to test the expression of HSA and hGH. The result implied that high expression vector pPICZαA ̄PDI ̄YPSΔ was built successfully. The exogenous gene HSA and hGH achieved high expression with this vector. High expression vector pPICZαA ̄PDI ̄YPSΔ could be ef ̄ fectively applied to industrial applications. Keywords YPS1 geneꎻ PDI expression cassetteꎻ Pichia pastorisꎻ HASꎻ hGH
第 36 卷第 1 期
生����� 1
2019 年 2 月
JOURNAL OF BIOLOGY
Feb. 2019
������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������������
PDIꎬ再以重组载体 pPICZαA ̄PDI 为模板通过 PCR 获得 PDI 表达盒ꎬ然后将 PDI 表达盒连接至重组载体 pPICZαA ̄
YPSΔꎬ筛选获得高效表达载体 pPICZαA ̄PDI ̄YPSΔꎮ 最后ꎬ将外源基因 HSA、hGH 导入此载体ꎬ转化毕赤酵母 GS115ꎬ
检测 HSA 和 hGH 蛋白的表达ꎮ 结果显示ꎬ高效表达载体 pPICZαA ̄PDI ̄YPSΔ 构建成功ꎬ外源蛋白 HSA、hGH 利用此
doi∶10. 3969 / j������ issn������ 2095 - 1736. 2019������ 01������ 107
高效毕赤酵母表达载体的改造与应用
侯增淼ꎬ 李晓颖ꎬ 高 恩ꎬ 杨小琳ꎬ 赵金礼
( 陕西慧康生物科技有限责任公司ꎬ 西安 710054)
摘 要 构建一种可促进外源蛋白在毕赤酵母中高表达的载体ꎬ实现在同一载体中外源基因与二硫键异构酶共表
达ꎬ同时失活 YPS1 基 因ꎮ 以 pPICZαA 载 体 为 骨 架 载 体ꎬ 将 酵 母 YPS1 基 因 C 端 和 N 端 非 功 能 区 序 列 连 接 至
pPICZαA 载体ꎬ获得重组载体 pPICZαA ̄YPSΔꎻ将酵母 PDI 基因序列连接至 pPICZαA 载体ꎬ获得重组载体 pPICZαA ̄
