毕赤酵母表达手册
毕赤酵母表达操作手册(PDF精译版)

版权声明:本站几乎所有资源均搜集于网络,仅供学习参考,不得进行任何商业用途,否则产生的一切后 果将由使用者本人承担! 本站仅仅提供一个观摩学习与交流的平台, 将不保证所提供资源的完 整性,也不对任何资源负法律责任。
所有资源请在下载后 24 小时内删除。
如果您觉得满意, 请购买正版,以便更好支持您所喜欢的软件或书籍!☆☆☆☆☆生物秀[]☆☆☆☆☆中国生物科学论坛[/bbs/]☆☆☆☆☆生物秀下载频道[/Soft/]生物秀——倾力打造最大最专业的生物资源下载平台!■■■ 选择生物秀,我秀我精彩!!■■■欢迎到生物秀论坛(中国生物科学论坛)的相关资源、软件版块参与讨论,共享您的资源,获 取更多资源或帮助。
毕赤酵母多拷贝表达载体试剂盒用于在含多拷贝基因的毕赤酵母菌中表达并分离重组蛋白综述:基本特征:作为真核生物,毕赤酵母具有高等真核表达系统的许多优点:如蛋白加工、折叠、翻译后修饰等。
不仅如此,操作时与E.coli及酿酒酵母同样简单。
它比杆状病毒或哺乳动物组织培养等其它真核表达系统更快捷、简单、廉价,且表达水平更高。
同为酵母,毕赤酵母具有与酿酒酵母相似的分子及遗传操作优点,且它的外源蛋白表达水平是后者的十倍以至百倍。
这些使得毕赤酵母成为非常有用的蛋白表达系统。
与酿酒酵母相似技术:许多技术可以通用:互补转化基因置换基因破坏另外,在酿酒酵母中应用的术语也可用于毕赤酵母。
例如:HIS4基因都编码组氨酸脱氢酶;两者中基因产物有交叉互补;酿酒酵母中的一些野生型基因与毕赤酵母中的突变基因相互补,如HIS4、LEU2、ARG4、TR11、URA3等基因在毕赤酵母中都有各自相互补的突变基因。
毕赤酵母是甲醇营养型酵母:毕赤酵母是甲醇营养型酵母,可利用甲醇作为其唯一碳源。
甲醇代谢的第一步是:醇氧化酶利用氧分子将甲醇氧化为甲醛,还有过氧化氢。
为避免过氧化氢的毒性,甲醛代谢主要在一个特殊的细胞器-过氧化物酶体-里进行,使得有毒的副产物远离细胞其余组分。
毕赤酵母发酵手册
毕赤酵母发酵手册总览简介:毕赤酵母和酿酒酵母很相似,都非常适合发酵生长。
毕赤酵母在有可能提高总体的蛋白质产量的发酵中能够达到非常高的细胞浓度,我们建议只有那些有过发酵经验或者能得到有经验的人的指导的人参与发酵。
因为发酵的类型很多,所以我们很难为您的个人案例提高详细的过程。
下面所给出的指导是基于Mut+和Mut s两种基因型的毕赤酵母菌株在15L的台式玻璃发酵罐中发酵而成。
请在您的发酵开始前先阅读操作员手册。
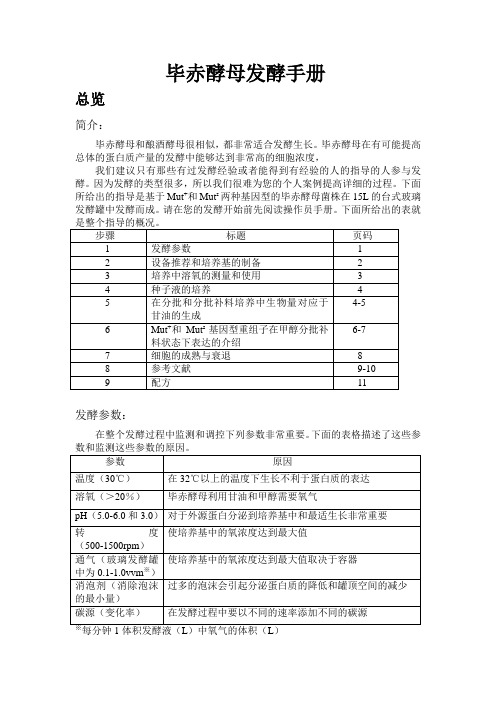
下面所给出的表就发酵参数:在整个发酵过程中监测和调控下列参数非常重要。
下面的表格描述了这些参设备推荐:下面是所推荐设备的清单:·发酵罐的夹套需要在发酵过程中给酵母菌降温,尤其是在甲醇流加过程中。
你需要一个固定的来源来提供冷却水(5-10℃)。
这可能意味着你需要一个冷冻装置来保持水的冷却。
·一个泡沫探针就像消泡剂一样不可或缺。
·一个氧气的来源——空气(不锈钢的发酵罐需要1-2vvm)或者纯氧(玻璃发酵罐需要0.1-0.3vvm)。
·添加甘油和甲醇的补料泵。
·pH的自动控制。
培养基的准备:你需要准确配置下列溶液:·发酵所需的基本盐类(第11页)·PTM1补充盐类(第11页)·75ml的50%的甘油每升初始发酵液,12ml的PTM1补充盐每升甘油。
·740ml的100%的甲醇每升初始发酵液,12ml的PTM1补充盐每升甲醇。
毕赤酵母生长的测定:在不同的时间点通过测OD600的吸光值和湿细胞的重量来检测毕赤酵母的生长。
培养的代谢速率通过通过观察溶氧浓度对应于有效碳源来测定。
溶氧的测定:简介:溶解氧的浓度时指氧气在培养基中的相关比例,溶氧100%是指培养基中氧达到饱和。
毕赤酵母的生长需要消耗氧气,减少溶解氧的满度。
毕赤酵母在生长时会消耗氧气,减少溶氧的程度。
然而,因为代谢甲醇的最初阶段需要氧气,所以将溶氧浓度维持在一个适当的水平(>20%)来确保毕赤酵母在甲醇上的生长就至关重要。
毕赤酵母手册

毕赤酵母表达实验手册作者:Jnuxz 来源:丁香园时间:2007-9-5大肠杆菌表达系统最突出的优点是工艺简单、产量高、周期短、生产成本低。
然而,许多蛋白质在翻译后,需经过翻译后的修饰加工,如磷酸化、糖基化、酰胺化及蛋白酶水解等过程才能转化成活性形式。
大肠杆菌缺少上述加工机制,不适合用于表达结构复杂的蛋白质。
另外,蛋白质的活性还依赖于形成正确的二硫键并折叠成高级结构,在大肠杆菌中表达的蛋白质往往不能进行正确的折叠,是以包含体状态存在。
包含体的形成虽然简化了产物的纯化,但不利于产物的活性,为了得到有活性的蛋白,就需要进行变性溶解及复性等操作,这一过程比较繁琐,同时增加了成本。
大肠杆菌是用得最多、研究最成熟的基因工程表达系统,当前已商业化的基因工程产品大多是通过大肠杆菌表达的,其主要优点是成本低、产量高、易于操作。
但大肠杆菌是原核生物,不具有真核生物的基因表达调控机制和蛋白质的加工修饰能力,其产物往住形成没有活性的包涵体,需要经过变性、复性等处理,才能应用。
近年来,以酵母作为工程菌表达外源蛋白日益引起重视,原因是与大肠杆菌相比,酵母是低等真核生物,除了具有细胞生长快,易于培养,遗传操作简单等原核生物的特点外,又具有真核生物时表达的蛋白质进行正确加工,修饰,合理的空间折叠等功能,非常有利于真核基因的表达,能有效克服大肠杆菌系统缺乏蛋白翻译后加工、修饰的不足。
因此酵母表达系统受到越来越多的重视和利用。
[1]。
同时与大肠杆菌相比,作为单细胞真核生物的酵母菌具有比较完备的基因表达调控机制和对表达产物的加工修饰能力。
酿酒酵母(Saccharomyces.Cerevisiae)在分子遗传学方面被人们的认识最早,也是最先作为外源基因表达的酵母宿主。
1981年酿酒酵母表达了第一个外源基因----干扰素基因[2],随后又有一系列外源基因在该系统得到表达[3、4、5、6]。
干扰素和胰岛素虽然已经利用酿酒酵母大量生产并被广泛应用,当利用酿酒酵母制备时,实验室的结果很令人鼓舞,但由实验室扩展到工业规模时,其产量迅速下降。
酵母表达系统步骤

毕赤酵母表达系统步骤(参考Invitrogen公司说明书):一、pPICZαA、B、C质粒以及DH5α菌株的保存1取0.5μl pPICZα A、B、C质粒,热击转化DH5α,在低盐LB(含有25μg/ml Zeocin)的平板上37℃培养过夜。
2挑取转化子,甘油保存。
二、载体构建1将目的基因构建到pPICZα载体上,转化DH5α,用Zeocin筛选转化子。
2提质粒酶切鉴定或PCR鉴定3载体测序测序可用α-Factor引物或5’AOX1引物,3’AOX1引物三、线性化DNA1提取足够量的质粒DNA(一次转化至少需要5-10μg质粒)2 酶切线性化10μg构建好的载体,同时酶切空载体做对照,根据载体选择线性化酶切位点(样品分管酶切),pPICZα载体在5’AOX1区域有三个酶切位点可选择:SacI、PmeI、BstXI3 取1-2μl酶切产物跑电泳,确定是否酶切完全;4 过柱纯化线性化质粒(用50μl EB洗脱);四、线性化DNA的去磷酸化处理线性化质粒43μlCIAP Buffer 5μlCIAP酶2μl四、总体积为50μl的样品37℃ 1h,过柱纯化,用30μl ddH2O洗脱;五、感受态细胞的制备实验前准备:无抗性YPD平板一个、无抗生素液体YPD培养基,100μg/ml Zeocin YPD 平板和液体、50ml离心管两个、500ml预冷的无菌水、20ml 1M 山梨醇(灭菌预冷的),0.2cm预冷的电击杯;1YPD平板划线培养菌,30℃培养2-3d;250ml三角瓶中,加入5ml YPD,挑取酵母单菌落,30℃培养过夜;3吸取0.5ml菌液,加入至含有200ml新鲜YPD的1L三角瓶中,30℃,225rpm/min培养至OD值1.3-1.5;41500g,4℃离心5min收集菌体;540ml冰预冷的无菌水重悬沉淀;61500g,4℃,5min;730ml无菌水重悬;81500g,4℃,5min;910ml 1M 山梨醇重悬;101500g,4℃,5min;11加入1ml山梨醇,重悬冰上放置,直接做转化,或加入灭菌甘油每管80ul分装,冻存于-80℃(长时间保存会影响转化效率);六、电击转化15-10μg线性化DNA(20μl<)与80ul上述感受态细胞混合,转移至预冷的0.2cm电击杯中(点击条件:电压1.5kV;电容25µF;电阻200Ω,电击时间为4~10msec);2冰上放置5min3电击(按生产厂商提供的适合酵母用的参数)4迅速加入1ml预冷的1M 山梨醇,转移至1.5ml EP管中530℃静置培养1-2h(如果要增加存活率,获得更多的转化克隆,可在30℃静置培养1h后,加入1mlYPD培养基,30℃200rpm培养1h后取部分涂布与不同浓度抗生素的平板)6取50、100、200ul分别涂布于含有Zeocin的YPD平板,30℃培养2-10 d至有菌落出现;7如果要筛选多拷贝转化子,将转化克隆混合在一起,涂布在Zeocin 浓度为500、1000、2000μg/ml的YPD平板,培养2-3d。
GS115毕赤酵母表达菌使用说明

编号
名称
北京华越洋生物 NRR01030 GS115 毕赤酵母表达菌
基 本 信 息 :
名称:GS115 毕赤酵母表达菌
规格:300ul 甘油菌
储 存 温 度 : -‐80℃
发突变为组氨酸野生型的概率一般低于 10-‐8。GS115 毕赤酵母可以在 YPD
培养基中生长,或者在补充有组氨酸的 minimal media 中生长,但是无法
在单独的 minimal media 中生长。GS115 毕赤酵母在做质粒转化的时候,
可 采 用 电 转 化 的 方 式 将 质 粒 转 入 。
基 因 组 :
His4( 基 因 5 是毕赤酵母菌株,是巴斯德毕赤酵母的一种,属于真核细胞。
一般的针对原核生物的抗生素例如卡那和氨苄对酵母是无效的,因此为了
操作说明:
1,本品包含一份甘油菌,使用本甘油菌时可以不用完全融解,在甘油菌表
面蘸取少量涂板或进行液体培养即可。也可以完全融解后使用,但随着冻融次数
的增加,细菌的活力会逐渐下降。
2,为保证菌种纯正,避免其它细菌污染,尽量先划平板,然后再挑单克隆
菌落进行后续操作。
毕赤酵母适宜的生长温度是 28 至 30 度,温度超过 32 度对蛋白的表
达是有害的,并可能导致细胞的死亡。GS115 毕赤酵母是是组氨酸缺陷型
(His4 基因型),如果表达载体上携带有组氨酸基因,可补偿宿主菌的组
氨酸缺陷,因此可以在不含组氨酸的培养基上筛选转化子。这些受体菌自
养。细菌在 30-‐35℃培养箱中培养 24-‐48h,真菌在 23-‐28℃培养箱中培养 24-‐72h
(必要时,可适当延长培养时间)。
毕赤酵母常用表达载体

毕赤酵母常用培养基与载体一、毕赤酵母表达常用载体:典型的巴斯德毕赤酵母表达载体载体包含醇氧化酶-1(AOX1)基因的启动子和转录终止子(5'AOX1和3'AOX1),它们被多克隆位点(MCS)分开,外源基因可以在此插入。
此载体还包含组氨醇脱氢酶基因(HIS4)选择标记及3'AOX1区。
当整合型载体转化受体时,它的5'AOX1和3'AOX1能与染色体上的同源基因重组,从而使整个载体连同外源基因插入到受体染色体上,外源基因在5'AOX1启动子控制下表达。
毕赤酵母本身不分泌内源蛋白,而外源蛋白的分泌需要具有引导分泌的信号序列。
而由89个氨基酸组成的酿酒酵母的分泌信号—α交配因子(α-factor)引导序列已经成功地引导了几种外源蛋白的分泌。
分泌表达载体主要有:pPIC9,pPIC9K,pHIL-S1,pPICZα A,pYAM75P等。
胞内表达载体主要有:pHIL-D2,pA0815,pPIC3K,pPICZ,pHWO10,pGAPZ,pGAPZa(Invitrogen),pPIC3.5K等。
工程菌株Y11430,MG1003,GS115 (AOX1),KM71,SMD1168。
毕赤酵母宿主菌常用的有GS115和KM71两种,都具有HIS4营养缺陷标记。
其中,GS115茵株具有AOX1基因,是Mut+,即甲醇利用正常型;而KM71菌株的AOX1位点彼ARG4基因插入,表型为Muts,即甲醇利用缓慢型,两种菌株都适用于一般的酵母转化方法。
多拷贝表达菌株的获得方式:与自主复制的质粒型表达载体不同,整合型表达载体的拷贝数可以有很大的变化。
含多拷贝外源基因的表达菌株合成蛋白的量也较多。
体内整合可通过高遗传霉素抗性,筛选可能的多拷贝插入;而体外整合可通过连接产生外源基因的串联插入。
多拷贝表达菌株的获得方式有两种:一种是利用SDS-PAGE电泳、免疫杂交或菌落点杂交方法在大量的转化子中进行自然筛选。
毕赤酵母表达(pichia pastoris expression )实验手册(3)
毕赤酵母表达(pichia pastoris expression )实验手册(3)液体YPD培养基可常温保存;琼脂YPD平板在4℃可保存几个月。
加入Ze ocin 100ug / ml,成为YPDZ培养基,可以4℃条件下保存1~2周。
2.4 YPDS + Zeocin 培养基(Yeast Extract Peptone Dextrose Medi um):yeast extract 1%peptone 2%dextrose (glucose) 2%sorbitol 1 M+agar 2%+ Zeocin 100 μg/ml不管是液体 YPDS培养基,还是YPDS + Zeocin 培养基,都必须存放4℃条件下,有效期1~2周。
2.5 MGYMinimal Glycerol Medium (最小甘油培养基)(34%YNB;1%甘油;4*10-5%生物素)。
将800ml灭菌水、100ml的 10* YNB母液、2ml的500*B母液和100ml的10*GY母液混匀即可,4℃保存,保存期为2个月。
2.6 MGYHMinimal Glycerol Medium + Histidine (最小甘油培养基 + 0.004%组氨酸)在1000ml的MGY培养基中加入 10ml的100*H母液混匀,4℃保存,保存期为2个月。
2.7 RDRegeneration Dextrose Medium (葡萄糖再生培养基)(含有:1mol/L的山梨醇;2%葡萄糖;1.34%YNB;4*10-5%生物素;0. 005%氨基酸)1. 将186g的山梨醇定容至700ml,高压灭菌;2. 冷却后于45℃水浴;3. 将100ml的10*D、100ml的10*YNB;2ml的500*B;10ml的100*AA等母液和88ml无菌水混匀,预热至45℃后,与步骤2 的山梨醇溶液混合。
4℃保存。
2.8 RDHRegeneration Dextrose Medium + Histidine (葡萄糖再生培养基 + 0.004%组氨酸)在RD培养基配制的第三步中,在加入10ml的100*H母液,同时无菌水的体积减少至78ml即可,其余配制方法与RD相同。
毕赤酵母表达操作手册(精译版)
毕赤酵母多拷贝表达载体试剂盒用于在含多拷贝基因的毕赤酵母菌中表达并分离重组蛋白综述:基本特征:作为真核生物,毕赤酵母具有高等真核表达系统的许多优点:如蛋白加工、折叠、翻译后修饰等。
不仅如此,操作时与E.coli及酿酒酵母同样简单。
它比杆状病毒或哺乳动物组织培养等其它真核表达系统更快捷、简单、廉价,且表达水平更高。
同为酵母,毕赤酵母具有与酿酒酵母相似的分子及遗传操作优点,且它的外源蛋白表达水平是后者的十倍以至百倍。
这些使得毕赤酵母成为非常有用的蛋白表达系统。
与酿酒酵母相似技术:许多技术可以通用:互补转化基因置换基因破坏另外,在酿酒酵母中应用的术语也可用于毕赤酵母。
例如:HIS4基因都编码组氨酸脱氢酶;两者中基因产物有交叉互补;酿酒酵母中的一些野生型基因与毕赤酵母中的突变基因相互补,如HIS4、LEU2、ARG4、TR11、URA3等基因在毕赤酵母中都有各自相互补的突变基因。
毕赤酵母是甲醇营养型酵母:毕赤酵母是甲醇营养型酵母,可利用甲醇作为其唯一碳源。
甲醇代谢的第一步是:醇氧化酶利用氧分子将甲醇氧化为甲醛,还有过氧化氢。
为避免过氧化氢的毒性,甲醛代谢主要在一个特殊的细胞器-过氧化物酶体-里进行,使得有毒的副产物远离细胞其余组分。
由于醇氧化酶与O2的结合率较低,因而毕赤酵母代偿性地产生大量的酶。
而调控产生醇过氧化物酶的启动子也正是驱动外源基因在毕赤酵母中表达的启动子。
两种醇氧化酶蛋白:毕赤酵母中有两个基因编码醇氧化酶-AOX1及AOX2。
细胞中大多数的醇氧化酶是AOX1基因产物。
甲醇可紧密调节、诱导AOX1基因的高水平表达,较典型的是占可溶性蛋白的30%以上。
AOX1基因已被分离,含AOX1启动子的质粒可用来促进编码外源蛋白的目的基因的表达。
AOX2基因与AOX1基因有97%的同源性,但在甲醇中带AOX2基因的菌株比带AOX1基因菌株慢得多,通过这种甲醇利用缓慢表型可分离Muts菌株。
表达:AOX1基因的表达在转录水平受调控。
毕赤酵母表达系统资料整理
毕赤酵母表黑系统之阳早格格创做Mut+战Muts毕赤酵母中有二个基果编码醇氧化酶——AOX1及AOX2,细胞中大普遍的醇氧化酶是AOX1基果产品,甲醇可稀切安排、诱导AOX1基果的下火仄表黑,较典型的是占可溶性蛋黑的30%以上.AOX1基果调控分二步:压制/去压制体制加诱导体制.简朴去道,正在含葡萄糖的培植基中,纵然加进诱导物甲醇转录仍受压制.为此,用甲醇举止劣化诱导时,推荐正在苦油培植基中培植.注意纵然正在苦油中死少(去压制)时,仍缺乏以使AOX1基果达到最矮火仄的表黑,诱导物甲醇是AOX1基果可辨表黑火仄所必须的.AOX1基果已被分散,含AOX1开用子的量粒可用去促进编码中源蛋黑的手段基果的表黑.AOX2基果与AOX1基果有97%的共源性,然而正在甲醇中戴AOX2基果的菌株比戴AOX1基果菌株缓得多,通过那种甲醇利用缓缓表型可分散Muts菌株.正在YPD(酵母膏、蛋黑胨、葡萄糖)培植基中,不管是Mut+仍旧Muts其正在对付数期删殖一倍的时间约莫为2h.Mut+战Muts菌株正在不甲醇存留的情况下死少速率是一般的,存留甲醇的情况下,Mut+正在对付数期删殖一倍的时间约莫为4至6个小时,Muts正在对付数期删殖一倍的时间约莫为18个小时.菌株GS115、X-33、KM71战SMD1168的辨别GS115、KM71战SMD1168等是用于表黑中源蛋黑的毕赤酵母受体菌,与酿酒酵母相比,毕赤酵母不会使蛋黑过糖基化,糖基化后有好处蛋黑的溶解或者产死粗确的合叠结构.GS115、KM71、SMD1168正在组氨酸脱氢酶位面(His4)有突变,是组氨酸缺陷型,如果表黑载体上携戴有组氨酸基果,可补偿宿主菌的组氨酸缺陷,果此不妨正在不含组氨酸的培植基上筛选变化子.那些受体菌自收突形成组氨酸家死型的概率普遍矮于10-8.GS115表型为Mut+,沉组表黑载体变化GS115后,少出的变化子大概是Mut+,也大概是Muts(载体与代AXO1基果),不妨正在MM战MD 培植基上审定表型.SMD1168战GS115类似,然而SMD1168基果组中的Pep4基果爆收突变,是蛋黑酶缺陷型,可落矮蛋黑酶对付中源蛋黑的落解效率.其中X-33由于是家死型,果此耐受性比较佳,如果担心变化率的话不妨思量那种酵母菌,而X33与GS115一般皆是属于MUT+表示型,也便是道不妨正在含甲醇的培植基中赶快死少,然而是传闻会对付中源基果表黑灵验率,KM71的亲原菌正在粗氨酸琥珀酸裂解酶基果(arg4)有突变,正在不含粗氨酸的培植基中不克不迭死少.用家死型ARG4基果(约2kb)拔出到克隆的家死型AOX1基果的BamHI(AOX1基果15/16暗号子)及SalI(AOX1基果227/228暗号子)位面,与代了AOX1基果16-227暗号子,此结构变化至KM71亲原菌(arg4his4)中,分散爆收KM71 MutsArg+His-菌株,Arg+变化子遗传领会隐现家死型AOX1被aox1::ARG4结构所与代,所以KM71所有变化子皆是Muts表型.AOX1位面不被真足缺得,表面上可用您的手段结构通过基果与代要领替换aox1::ARG4结构,那样沉组菌株的表型是His+MutsArg-,那表示着沉组菌株死万古需粗氨酸.然而仅增加粗氨酸本去不克不迭真足缓战arg4突变的效率,arg4菌株正在含粗氨酸的最小培植基中不克不迭很佳天死少.果此不推荐正在KM71中通过与代aox1::ARG4结构去赢得His+变化子.普遍去道,如果是胞内表黑,应尽管用Muts细胞,那样得到的蛋黑产品中醇氧化酶蛋黑量较少而手段蛋黑量相对付较多,使下游杂化更易举止.而对付于分泌蛋黑的表黑,无论是甲醇利用缓(Muts)仍旧甲醇利用快(Mut+)的细胞皆可应用.基果沉组Pichia.pastoris酵母菌体内无天然量粒,所以表黑载体需与宿主染色体爆收共源沉组,将中源基果表黑框架调整于染色体中以真止中源基果的表黑,包罗开用子、中源基果克隆位面、末止序列、筛选标记表记标帜等.细菌内共源沉组被认为是沉组量粒构修历程的易面,果为已线性化的环状量粒之间爆收共源沉组的几率非常矮,所以沉组变化载体必须用特定的节制性内切酶举止线性化处理.那种处理的手段是预防随机拔出沉组时量粒正在功能区断开,制成手段基果表黑得活,让共源沉组以指定的办法爆收.表黑载体主要分为以下几类:(1)胞内表黑载体主要有pHIL-D2、pA0815、pPIC3K、pPICZ、pHWO10,pGAPZ、pGAPZa(Invitrogen)等.该类载体不妨将手段基果表黑正在胞内,不妨预防毕赤酵母的糖基化,主要符合于那些不克不迭被糖基化相闭基果的表黑;(2)分泌型表黑载体主要有pPIC9、pHIL-S1、pPICZα、pYAM75P等.由于毕赤酵母自己的泌内源蛋黑非常少,将中源蛋黑分泌到胞中,非常有好处手段蛋黑量的杂化及聚集.时常使用的分泌的旗号序列主假如由89个氨基酸组成的α接配果子(α-factor)的带领;(3)多拷贝拔出表黑载体如pPIC9K,pPIC3.5K.正在某些情况下,毕赤酵母中沉组基果多拷贝调整可减少所需蛋黑的表黑量.该载体均可用于正在体内(pPIC3.5K, pPIC9K)或者体中(pAO815)爆收并分散多拷贝拔出,共时可检测减少沉组基果的拷贝数是可减少蛋黑表黑量.体内调整可通过下遗传霉素抗性筛选大概的多拷贝拔出,而体中调整可通过对接爆收中源基果的串联拔出.正在GS115中筛选His+Mut+变化子:用SalI或者StuI线性化量粒变化GS115后,大多正在His4位面上爆收沉组,大普遍变化子是Mut+表型;然而由于量粒含有AOX1基果序列,有大概正在AOX1位面爆收沉组,损害家死型AOX1基果,爆收His+Muts变化子,则需要正在MD及MM仄板上检测可证据His+ Mut+变化子.毕赤酵母表黑时常使用培植基10×YNB(13.4%的无氨基酸酵母氮源),134gYNB固体溶于1L蒸馏火,过滤灭菌,4℃保存.YPD真足培植基:酵母提与物10 g/L,蛋黑胨20 g/L,葡萄糖20 g/L(固体培植基含1.5%琼脂).变化培植基RDB:每100mL加进山梨醇18g(186 g/L),琼脂糖2g(20g/L)121℃灭菌20分钟,而后待温度落至60℃以去正在超洁台上加进10×YNB 10mL(13.4 g/L),10×葡萄糖10mL(20 g/L),500×死物素0.2mL(4×10-4g/L),100×AA 1mL.混匀,倒仄板(灭菌时只加进80ml火即可).采用培植基MD(最小葡萄糖):配100mL,背80mL火中加进琼脂糖2g(20 g/L)121℃灭菌20分钟,待温度落至60℃以去正在超洁台上加进10×YNB10mL(13.4 g/L),10×葡萄糖10mL(20 g/L),500×死物素0.2mL(4×10-4g/L).采用培植基MM(最小甲醇):配100mL,背90mL火中加进琼脂糖2g(20 g/L) 121℃灭菌20分钟,待温度落至60℃以去正在超洁台上加进10×YNB 10mL(13.4 g/L),500×死物素0.2mL(4×10-4g/L),0.5mL甲醇(0.5%).诱导表黑培植基BMGY:配1L,酵母提与物10 g/L,蛋黑胨20 g/L,3g/L K2HPO4,11.8g/L KH2PO4,加火至890mL,121℃灭菌20分钟,而后待温度落至60℃以去正在超洁台上加进10×YNB 100mL(13.4 g/L),500×死物素1mL(4×10-4g/L),苦油10mL.诱导表黑培植基BMMY:酵母提与物10g/L,蛋黑胨20 g/L,3g/LK2HPO4,11.8g/L KH2PO4,加火至895mL,121℃灭菌20分钟,而后待温度落至60℃以去正在超洁台上加进100×YNB 100mL(13.4 g/L),500×死物素1mL(4×10-4g/L),甲醇5mL.BMGY/BMMY含酵母浸出物及蛋黑胨,可宁静分泌蛋黑,遏止或者缩小分泌蛋黑的领会.如果手段蛋黑对付中性PH蛋黑酶敏感的话,可正在无缓冲培植基(MGY、MM)中表黑.如果不凭证道明您的分泌蛋黑对付中性PH 值蛋黑酶敏感,修议开初表黑时用BMMY.如果表黑蛋黑落解了,测验考查正在无缓冲培植基中举止表黑.如果以上条件仍不克不迭灵验预防蛋黑落解,可将基果转进SMD1168中,该菌株表型是his4pep4,缺得了蛋黑酶,变化与表黑步调与GS115相共,也可用于大规模收酵.用考马斯明蓝G-250测蛋黑含量。
毕赤酵母表达系统(学习资料)
毕赤酵母表达系统前言:所用表达质粒有pPIC3.5K,pAO815用于胞内表达,而pPIC9K用于分泌表达,所有载体均利用AOX1启动子来诱导高水平表达。
抗性选择:最有效的筛选遗传霉素抗性及高抗性克隆的程序需要先对HIS+转化子进行选择,再进行不同水平遗传霉素抗性筛选。
毕赤菌株表型:毕赤酵母菌GS115 及KM71 在组氨酸脱氢酶位点(His4)有突变,因而不能合成组氨酸,所有表达质粒都有HIS4 基因可与宿主进行互补,通过不含组氨酸的培养基来选择转化子。
GS115 及KM71都可在复合培养基如YPD(YEPD)及含组氨酸的最小培养基中生长。
转化之前,GS115 及KM71 都不能在最小培养基中生长,因为它们是His-。
培养温度:毕赤酵母生长温度为28-30度(液体、平板、斜面)。
在32 度以上诱导生长时,对蛋白表达有害,甚至会导致细胞死亡。
贮存:贮存细胞几周或几月,用YPD培养基或YPD 琼脂斜面1 挑取所需菌株单克隆在YPD 平板上划线生长;2 挑取单克隆转移至YPD进行穿刺培养,30 度2 天;3 细胞在4 度可放几周几月或几年,存于-80度1 挑取所需菌株单克隆在YPD 中过夜培养;2 收集细胞,在含15%甘油的YPD 中悬浮至终OD600 为50-100(大约2.5-5.0×109细胞/ml);3 细胞先用液氮或干冰/酒精浴中冰冻再贮存于-80 度。
注意:在4 度或-80 度长期保存后,用之前建议在MM、MD 或MGY 平板上划线培养以检测His+转化子的表型是否正确及其活力。
以质粒pPIC9K,酵母Pichia pastoris GS115为例说明做法。
载体pPIC9K酶切为点线性化质粒DNA:建议使用下列方法线性化载体以获得Mut+及Muts重组子,可能其中一个会比另一个更利于表达多拷贝重组子。
如果只想得到Muts重组子,使用KM71 菌株。
单个十字交换事件可比双重十字交换更容易、更有效地获得Muts重组菌(例如:插入A OX1或his4 而不是取代AOX1)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
版权声明:本站几乎所有资源均搜集于网络,仅供学习参考,不得进行任何商业用途,否则产生的一切后 果将由使用者本人承担! 本站仅仅提供一个观摩学习与交流的平台, 将不保证所提供资源的完 整性,也不对任何资源负法律责任。
所有资源请在下载后 24 小时内删除。
如果您觉得满意, 请购买正版,以便更好支持您所喜欢的软件或书籍!☆☆☆☆☆生物秀[]☆☆☆☆☆中国生物科学论坛[/bbs/]☆☆☆☆☆生物秀下载频道[/Soft/]生物秀——倾力打造最大最专业的生物资源下载平台!■■■ 选择生物秀,我秀我精彩!!■■■欢迎到生物秀论坛(中国生物科学论坛)的相关资源、软件版块参与讨论,共享您的资源,获 取更多资源或帮助。
毕赤酵母多拷贝表达载体试剂盒用于在含多拷贝基因的毕赤酵母菌中表达并分离重组蛋白综述:基本特征:作为真核生物,毕赤酵母具有高等真核表达系统的许多优点:如蛋白加工、折叠、翻译后修饰等。
不仅如此,操作时与E.coli及酿酒酵母同样简单。
它比杆状病毒或哺乳动物组织培养等其它真核表达系统更快捷、简单、廉价,且表达水平更高。
同为酵母,毕赤酵母具有与酿酒酵母相似的分子及遗传操作优点,且它的外源蛋白表达水平是后者的十倍以至百倍。
这些使得毕赤酵母成为非常有用的蛋白表达系统。
与酿酒酵母相似技术:许多技术可以通用:互补转化基因置换基因破坏另外,在酿酒酵母中应用的术语也可用于毕赤酵母。
例如:HIS4基因都编码组氨酸脱氢酶;两者中基因产物有交叉互补;酿酒酵母中的一些野生型基因与毕赤酵母中的突变基因相互补,如HIS4、LEU2、ARG4、TR11、URA3等基因在毕赤酵母中都有各自相互补的突变基因。
毕赤酵母是甲醇营养型酵母:毕赤酵母是甲醇营养型酵母,可利用甲醇作为其唯一碳源。
甲醇代谢的第一步是:醇氧化酶利用氧分子将甲醇氧化为甲醛,还有过氧化氢。
为避免过氧化氢的毒性,甲醛代谢主要在一个特殊的细胞器-过氧化物酶体-里进行,使得有毒的副产物远离细胞其余组分。
由于醇氧化酶与O2的结合率较低,因而毕赤酵母代偿性地产生大量的酶。
而调控产生醇过氧化物酶的启动子也正是驱动外源基因在毕赤酵母中表达的启动子。
两种醇氧化酶蛋白:毕赤酵母中有两个基因编码醇氧化酶-AOX1及AOX2。
细胞中大多数的醇氧化酶是AOX1基因产物。
甲醇可紧密调节、诱导AOX1基因的高水平表达,较典型的是占可溶性蛋白的30%以上。
AOX1基因已被分离,含AOX1启动子的质粒可用来促进编码外源蛋白的目的基因的表达。
AOX2基因与AOX1基因有97%的同源性,但在甲醇中带AOX2基因的菌株比带AOX1基因菌株慢得多,通过这种甲醇利用缓慢表型可分离Muts菌株。
表达:AOX1基因的表达在转录水平受调控。
在甲醇中生长的细胞大约有5%的polyA+ RNA 来自AOX1基因。
AOX1基因调控分两步:抑制/去抑制机制加诱导机制。
简单来说,在含葡萄糖的培养基中,即使加入诱导物甲醇转录仍受抑制。
为此,用甲醇进行优化诱导时,推荐在甘油培养基中培养。
注意即使在甘油中生长(去抑制)时,仍不足以使AOX1基因达到最低水平的表达,诱导物甲醇是AOX1基因可辨表达水平所必需的。
AOX1突变表型:缺失AOX1基因,会丧失大部分的醇氧化酶活性,产生一种表型为Muts的突变株(methanol utilization slow),过去称为Mut,而Muts可更精确地描述突变子的表型。
结果细胞代谢甲醇的能力下降,因而在甲醇培养基中生长缓慢。
Mut+(methanol utilization plus)指利用甲醇为唯一碳源的野生型菌株。
这两种表型用来检测外源基因在毕赤酵母转化子中的整合方式。
蛋白胞内及分泌表达:外源蛋白可在毕赤酵母胞内表达或分泌至胞外。
分泌表达需要蛋白上的信号肽序列,将外源蛋白靶向分泌通路。
几种不同的分泌信号序列已被成功应用,包括几种外源蛋白本身分制作者:陈苗商汉桥泌信号序列,利用酿酒酵母α因子前原肽信号序列也获得许多成功。
分泌表达外源蛋白的最大优点是:毕赤酵母只分泌很少的自身蛋白,加上毕赤酵母最小生长培养基中只有少量的蛋白,这意味着分泌的外源蛋白是培养基中蛋白的主要组成成份,也可算作蛋白纯化的第一步。
注意,如果外源蛋白一级结构中有可识别的糖基化位点(Asn-X-Ser/Thr),则这些位点可能发生糖基化。
翻译后修饰:与酿酒酵母相比,毕赤酵母在分泌蛋白的糖基化方面有优势,因为不会使其过糖基化。
酿酒酵母与毕赤酵母大多数为N-连接糖基化高甘露糖型,然而毕赤酵母中蛋白转录后所增加的寡糖链长度(平均每个支链8-14个甘露糖残基)比酿酒酵母中的(50-150个甘露糖残基)短得多。
另外,酿酒酵母核心寡糖有末端α-1,3聚糖连接头,而毕赤酵母则没有。
一般认为酿酒酵母中糖基化蛋白的α-1,3聚糖接头与蛋白的超抗原性有关,使得这些蛋白不适于治疗应用。
虽然未经证明,但这对毕赤酵母产生的糖蛋白不构成问题,因为毕赤酵母表达蛋白与高级真核生物糖蛋白结构相似。
选择载体用于基因多拷贝整合:在某些情况下,毕赤酵母中重组基因多拷贝整合可增加所需蛋白的表达量。
该试剂盒中的三个载体均可用于在体内(pPIC3.5K, pPIC9K)或体外(pAO815)产生并分离多拷贝插入,同时可检测增加重组基因的拷贝数是否增加蛋白表达量。
体内整合可通过高遗传霉素抗性,筛选可能的多拷贝插入;而体外整合可通过连接产生外源基因的串联插入。
pPIC3.5K, pAO815用于胞内表达,而pPIC9K用于分泌表达,所有载体均利用AOX1启动子来诱导高水平表达。
多拷贝插入频率:毕赤酵母His+转化子高拷贝整合事件自发发生的概率为1-10%,体内方法可筛选可能插入多拷贝外源基因的His+转化子,体外方法可通过连接构建多拷贝子。
当选择His+转化子时,它们中插入体外构建结构多聚体的概率很高。
体内多拷贝插入的产生:Ppic3.5k及Ppic9k含有细菌kan基因,赋予毕赤酵母遗传霉素抗性,注意Kan并不赋予毕赤酵母卡那霉素抗性。
遗传霉素抗性水平主要依赖整合的kan基因的数目。
单拷贝Ppic3.5k或Ppic9k整合入毕赤酵母基因组后,赋予毕赤酵母约0.25mg/ml的遗传霉素抗性水平。
任何载体多拷贝整合可增加遗传霉素抗性水平,从0.5mg/ml(1-2拷贝)到4mg/ml(7-12拷贝)。
由于kan基因与表达盒(pAOX1及目的基因)之间有遗传连锁,可从遗传霉素高抗性推断该克隆所包含多拷贝目的基因数。
由于基因的剂量效益,蛋白的表达可能会增加。
因此,kan基因可检测转化子是否含有多拷贝目的基因。
下图显示多拷贝插入及kan基因与表达盒的连锁。
制作者:陈苗商汉桥制作者:陈苗 商汉桥遗传霉素直接选择:在酵母中对遗传霉素抗性进行直接选择并不十分有效,因为新转化的细胞需要时间表达足够量的抗性因子。
由于酵母生长比细菌慢得多,大部分重组酵母在积累足够多的抗性因子以抵抗平板上抗生素之前就已经被杀死了。
最有效的筛选遗传霉素抗性及高抗性克隆的程序需要先对HIS +转化子进行选择,再进行不同水平遗传霉素抗性筛选。
虽然可以用电泳进行直接筛选,但用在遗传霉素筛选之后再进行电泳筛选,获得含高拷贝克隆的机会更大,大约可获得5-9拷贝的克隆,而直接电泳选择只能获得平均为1-3拷贝的克隆。
原生质转化时不能用遗传霉素直接选择。
体外多拷贝插入的产生:下图显示如何产生多表达盒插入载体以转化毕赤酵母。
目的基因插入独个EcoRI 位点 后,产生的表达盒(pAOX1及目的基因)上下游侧翼分别为独个的BglII 及BamHI 位点。
含目的基因的pAOX815用BglII 及BamHI 消化以分离表达盒,表达盒再插入BamHI位点以产生串联重复表达盒,重复该插入程序可产生一系列含单个HIS4基因及逐渐增加数目表达盒的载体。
用体外形成的多拷贝子转化毕赤酵母增加了多拷贝表达盒重组子出现的频率,可设计包含一特定数目多拷贝插入的毕赤酵母重组子。
转化及整合:可产生两个不同表型的His+重组菌株:质粒DNA 线性化位置不同,转化GS115后可产生两种转化子His+Mut+及His+Muts 。
KM71只产生His+Muts ,因为该菌株为Muts 表型。
两种重组子Mut +及 Muts 都是有用的,因为一个表型可能比另一个表型更有利于蛋白表达。
理想条件下,每一个表型应该检测6-10个重组子。
没有办法预测哪个结构或克隆更利于蛋白表达。
强烈推荐用PCR 分析重组子来证实整合情况。
成功将基因构建至AOX1启动子下游后,线性化质粒转化毕赤酵母时激发重组。
下图显示用不同酶消化时产生何种重组子。
限制酶插入事件 GS115表型 KM71表型 SalI 或StuI插入his4 His+Mut+ His+Muts SacI插入5’AOX1 His+Mut+ His+Muts BglII 取代AOX1 His+Muts His+Muts (不推荐)制作者:陈苗 商汉桥表达及扩大培养:用PCR 证实毕赤酵母重组后,可检测His+Mut+及 His+Muts 的表达。
小规模培养每个重组子,用甲醇诱导,检测时间点.如果是胞内表达,每个时间点细胞沉淀用SDS-PAGE 分析;如果是分泌表达,分析每个时间点的细胞及上清。
如果有蛋白的抗体,推荐既用考马斯亮蓝染色又用western blot 分析SDS-PAGE 凝胶。
如果可以,建议检测蛋白活性。
因为并不是所有蛋白都能达到g/l 的水平,所以建议进行western blot 或活性分析,不要仅做SDS-PAGE 考马斯亮蓝染色分析。
如何选择最佳的表达蛋白毕赤酵母菌株及优化诱导见P49-50。
如表达已达最优,大规模表达以产生更多蛋白。
方法毕赤菌株表型:毕赤酵母菌GS115及KM71在组氨酸脱氢酶位点(His4)有突变,因而不能合成组氨酸,所有表达质粒都有HIS4基因可与宿主进行互补,通过不含组氨酸的培养基来选择转化子。
GS115及KM71自发回复突变到His+原养生物机率小于1/108。
KM71的亲本菌在精氨酸琥珀酸裂解酶基因(arg4)有突变,在不含精氨酸的培养基中不能生长。
用野生型ARG4基因破坏AOX1基因后,产生KM71 MutsArg+His-菌株。
GS115及KM71都可在复合培养基如YPD(YEPD)及含组氨酸的最小培养基中生长。
转化之前,GS115及KM71都不能在最小培养基中生长,因为它们是His-。
KM71结构:ARG4基因(约2kb)插入到克隆的野生型AOX1基因的BamHI(AOX1基因15/16密码子)及SalI(AOX1基因227/228密码子)位点。
ARG4取代了AOX1基因16-227密码子。
此结构转化至KM71亲本菌(arg4his4)中,分离Arg+转化子并分析Muts表型。
