炔烃
4炔烃

炔烃1.炔烃:为分子中含有碳碳三键的碳氢化合物的总称,其官能团为碳-碳三键(C≡C),分子通式为CnH2n-2,是一种不饱合的碳氢化合物。
2.炔烃物理性质炔烃的熔沸点低,密度小,难溶于水,易溶于有机溶剂。
简单的炔烃的熔点、沸点,密度均比具有相同碳原子数的烷烃或烯烃高一些.不易溶于水,易溶于乙醚、苯、四氯化碳等有机溶剂中。
炔烃可以和卤素、氢、卤化氢、水发生加成反应,也可发生聚合反应。
工业中乙炔被用来做焊接时的原料。
在正炔烃的同系列中,C2~C4的炔烃是气体,C5~C15的是液体,C15以上的是固体。
炔烃的熔点和沸点也随着碳原子数目的增加而增高。
(注:乙炔不纯时,含有H2S,PH3杂质气体,有臭味)3炔烃化学性质炔烃的化学活性比烯烃弱。
炔烃的官能团是--C≡C--,其化学性质与烯烃有不少相似之处,例如能发生加成、氧化和聚和反应等。
(1)氧化反应炔烃能使高锰酸钾和浓溴水褪色(2)加成反应①加氢:R-C≡C-R'+2H2→RCH2CH2R'CH3≡CCH3+H2→CH3-CH=CH-CH3(顺式)CH3≡CCH3+Na+NH3(l)→CH3-CH=CH-CH3(反式)②加卤素:R-C≡CH可生成相应的卤代烯和卤代烷③加卤化氢:R-C≡CH+HX→R-CX=CH2R-CX=CH2+HX→R-CX2-CH3(3)聚合反应炔会发生聚合反应:炔会发合成苯:3HC≡CH→(苯环)4.乙炔:俗称风煤、电石气,最简单的炔烃,是炔烃化合物系列中体积最小的一员,主要作工业用途,特别是烧焊金属方面。
乙炔在室温下是一种无色、极易燃的气体。
纯乙炔是无臭的,但工业用乙炔由于含有硫化氢、磷化氢等杂质,而有一股大蒜的气味。
分子式CH≡CH,化学式C2H2,电子式:H:C:::C:H ,C-C键中间是六个点,分两列,每列三个—H:C:::C:H ,分子空间构型为直线型非极性分子。
5.乙炔的物理性质纯乙炔为无色无味的易燃、有毒气体。
有机化学 第四章 炔烃
R-C
C-Na + NH3↑
R-C≡C-Na + R/X R/X/
6、聚合反应
Cu2Cl2 2 CH CH NH Cl H2O CH2 CH 4
CH CH CH2 CH Cu2Cl2 NH 4Cl H 2O
C CH
C
C CH CH2
增碳
例: 以乙炔为原料合成下列化合物: (1)Z-3-己烯; (3)醋酸乙烯脂; (2)E-3-己烯;
2) 和卤化氢加成
RC
注:
CH
HX
HgCl2
R
C X
CH2 HX
HgCl2
R
X C X
CH3
① 反应可以停留在卤代烯烃阶段; ② 在催化剂汞盐或铜盐存在时,叁键与HX反应 活性比双键大; ③ 不对称炔烃与HX加成符合马氏规则,对于HBr 有过氧化物效应。
3) 和水加成
RC CH + H2O
HgSO4 H 2SO4 ) (稀
5 4 3 2 1
CH3-CH = CH-C
CH
3-戊烯-1-炔
(不叫 2-戊烯-4-炔)
如对称,优先考虑双键。
HC CCHCH=CH 2 CH 3
6 5 4 3 2 1
3-甲基-1-戊烯-4-炔
HC C-CH2-CH2-CH=CH2
1-己烯-5-炔
§4.3 物理性质(自学) §4.4 化学性质 1、氢化反应 1)催化氢化
RC CR' + H2
催化加氢反应活性:炔烃>烯烃
Ni(Pt , Pd)
RCH
CHR'
Ni(Pt, Pd)
H2
RCH2CH2R'
RC
第4章 炔烃

O
HC
CH + CH3C
OH
Zn(OAc)2/活性炭 170~230 °C
O H2C CH O CCH3
乙酸乙烯酯
二、聚合反应 乙炔也能聚合。在不同条件下乙炔可生成链状的二聚
物或三聚物,也可生成环状的三聚物或四聚物。
乙炔的二聚物与氯化氢加成,得到2-氯-1,3-丁二烯 。是合成氯丁橡胶的单体。
三、氧化反应 与C=C双键相似,C≡C三键也被高锰酸钾烟花。
最终的产物是二氧化碳(C≡C三键断裂),高锰酸钾被 乙炔还原生成棕色的二氧化锰沉淀。
如果是非末端炔烃,氧化的最终产物是羧酸(C≡C三键 断裂)。如:
“十二五”职业教育国家规划教材修订版
有机化学
(第六版)
高职高专化学教材编写组 编
Organic Chemistry
第四章 炔 烃
“十二五”职业教育国家规划教材修订版
主要内容
炔烃的通式、同分异构和命名; 炔烃的结构; 炔烃的物理性质; 炔烃的化学性质; 炔烃的制法。
学习目标
了解炔烃的制备方法及炔烃的物理性质; 了解不同杂化状态碳原子电负性的比较; 理解碳原子sp杂化及直线形的空间构型; 理解炔烃的结构; 掌握炔烃的同分异构现象; 掌握炔烃的命名、烯炔的命名; 掌握炔烃的化学性质及其应用。
CH3-CH=CH-C CH
3-戊烯-1-炔 (不叫2-戊烯-4-炔)
第二节 炔烃的结构
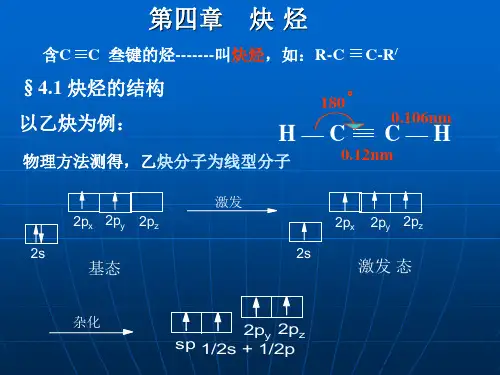
一、乙炔的结构 乙炔(CH≡CH)分子是一个直线形结构,四个原子
都排布在同一直线上。X-光衍射和电子衍射等物理方法 测定,分子中各键的键长与键角如下式所示:
炔烃

炔烃1.基本性质 1.1概述1.定义 分子里有碳碳三键的不饱和链烃叫做炔烃。
2.通式 C n H 2n-2(n ≥2) ,炔烃与二烯烃、环烯烃为同分异构体(类别异构)。
3.乙炔(1)结构:分子式C2H2,结构式为H -C ≡C -H ,直线型分子,键角180°。
(2)物理性质:纯净的乙炔是无色、无臭气体,比空气轻,微溶于水,易溶于有机溶剂。
(3)乙炔的实验室制法: 4.炔烃通性(1)随着碳原子数的增加,熔沸点逐渐升高,相对密度逐渐增大。
(2)碳原子数小于或等于4的炔烃,在常温下均为气体,其他的炔烃为液体或固体。
(3)炔烃不溶于水,易溶于有机溶剂。
2.性质应用2.1乙炔的实验室制法 (1)化学反应原理CaC 2+2H 2O −−→HC ≡CH ↑+Ca(OH)2 说明:碳化钙(CaC 2)属于离子型碳化物,它遇水可水解,即碳化钙中的钙离子跟H 2O 中的OH -生成氢氧化钙,伴随产生的H+与碳化物中的碳负离子结合成相应的烃。
即CaC 2+2H -OH −−→HC ≡CH ↑+Ca(OH)2 同理:ZnC 2+2H -OH −−→HC ≡CH ↑+Z n (O H )2 Al 4C 3+12H -OH −−→3CH 4↑+Al(OH)2 (2)仪器装置设计从物质的状态、反应条件等方面看,以电石跟水反应制备乙炔气体的反应属于“固+液−−−→常温气”的类型,与实验室中以Zn 和H2SO4稀溶液制备H2的反应类型相同。
因此,制乙炔气体可采用“制氢简易装置”。
(3)实验操作步骤设计该实验与大多数制备实验相似,操作步骤为:连接各仪器为整套装置;检验装置的气密性;将化学药品加到各仪器中去;使反应物混合;收集气体。
(4)应注意的问题①由于CaC 2与H 2O 的反应太剧烈,即便是CaC 2与H 2O 蒸气接触,它们也能顺利地反应,反应又是放热的,所以实验中要获得平稳的乙炔气流,主要措施有:a.以饱和NaCl 溶液代替水;b.通过分液漏斗向广口瓶中加水(或饱和NaCl 溶液)时,要慢、要少。
第六章炔烃

114第六章 炔烃分子中含有碳碳叁键的烃叫做炔烃。
碳碳叁键可位于碳链中的任意位置。
开链炔烃的分子通式为C n H 2n-2 。
碳碳叁键位于碳链一端的炔烃称之为单取代或末端炔烃。
6.1 炔烃的结构与烯烃的碳碳双键相比,炔烃的碳碳叁键经历了不同的杂化。
在此杂化过程中,碳的2s 轨道和三个2p 轨道中的一个进行杂化。
每个杂化轨道含有1/2 s 轨道和1/2 p 轨道的成分。
这些杂化轨道称之为sp 轨道。
由于sp 轨道的s 成分增加,乙炔中碳氢键的极性比乙烷和乙烯中的大很多。
乙烯的pK a 值大约在44,而乙炔的pK a 值大约在25,所以末端炔烃在一些特定的情况下,可以当成弱酸,尽管酸性甚至比水还弱很多。
碳碳叁键是两个sp 杂化的碳原子相互之间形成的。
碳原子中的两个sp 杂化轨道沿一轴线呈180 o 伸展 ,该轴线与非杂化的2p x 和2p y 轨道垂直。
当两个sp 杂化碳原子相互靠近时,sp-sp σ 键形成,于是每个碳原子其它两个p 轨道之间就以肩并肩方式重叠,形成两个相互垂直的π键,如图6.1所示。
因此,乙炔C 2H 2是一个线形分子,四个原子都排布在同一条直线上。
由于此线形特性,环状炔烃至少含有十个碳原子才能消除过多的张力。
此外,围绕炔烃叁键部分的电子云密度要比乙烷、乙烯大得多。
与烯烃类似,炔烃容易与亲电试剂相互作用。
(a)(b)图6.1 乙炔的模型(a )乙炔 sp 杂化示意图(b)乙炔的电子云结构模型乙炔碳碳叁键的长度为120pm,键能大约是836 kJ/mol,所以碳碳叁键是已知的键能最大,键长最短的碳碳键。
表格6.1 乙烷,乙烯,乙炔的共价键参数乙烷乙烯乙炔C-C 键键能(KJ) 368 607 836C-C 键长度(pm) 154 134 120C-H 键键能(KJ) 410 444 506C-H键长度(pm) 110 108 106 很明显可以看出(836-368) 并不是(607-368)的两倍,而且实验结果表明,要打开乙炔中的π键需要大约318 KJ/mol的能量,而对于乙烯需要268KJ/mol,所以我们可以得到结论,炔烃与亲电试剂的反应比烯烃与亲电试剂的反应要迟钝。
有机化学-炔烃

b.London 5/22/1912 d.IN,US 12/20/2004
“For their development of use of boron and phosphorus-containing compounds,respectively, into important reagents in organic synthesis"
1500oC HC CH + 3H2
3) CH4 + O2 1500oC HC CH + CO + H2O
2. 由烯烃制备:
CH3CH2 HC
Br2 CH2
CCl4
CH3CH2 HC CH2 Br Br
NaNH2
Mineral Oil 110-160oC
NH4Cl CH3CH2 C CH
R Cl + Mg ether
R Mg Cl
R C CH + CH3CH2MgBr
R C CMgBr
炔格氏试剂
R C CMgBr + R' Cl
R C C R'
炔烃制备
四、炔烃的制备
1. 乙炔的制备:
1) CaO + C
CaC2 + CO
CaC2 + H2O
HC CH + Ca(OH)2
2) 2CH4
“For their development and use of molecules with structure-specific interactions of high selectivity"
3) 控制加氢------反式加氢
05炔烃
sp的特点
① sp的形状类似于sp3和sp2,呈葫芦形 ②sp的能量介于s和p轨道之间; ③方向性:两个sp杂化轨道在同一条直线上;
④剩余的两个未参与杂化的p轨道,互相垂直,且均与两个sp 杂化轨道所在的直线垂直。
5)电负性: sp3 < sp2 < sp
(5) 总结 •碳碳叁键是由一个 键和两个 键 组成. •键能—乙炔的碳碳叁键的键能是:837 kJ/mol; 乙烯的碳碳双键键能是:611 kJ/mol; 乙烷的碳碳单键键能是:347 kJ/mol. •C-H键长—和p轨道比较, s轨道上的电子云更接近原 子核.一个杂化轨道的s成分越多,则在此杂化轨道上的 电子也越接近原子核.由sp杂化轨道参加组成共价键 , 所以乙炔的 C-H 键的键长 (0.106 nm) 比乙烯 (0.108 nm)和乙烷(0.110nm)的C-H键的键长要短. •碳碳叁键的键长—最短(0.120 nm),这是除了有两个 键,还由于 sp 杂化轨道参与碳碳键的组成.
CH3 Br C=C H H
(3) 和水的加成 CHCH + H2O
H2SO4 HgSO4
HO H2C=CH
RCCH + H2O
记住反应 条件!
H2SO4 HgSO4
H 分子重排 CH3-C=O 乙醛 OH O 分子重排 R-C=CH2 R-C-CH3 烯醇式化合物 酮
为什么发生重排? CH2=C-OH CH3-C=O H H •乙 醛 的 总 键 能 2 7 4 1 kJ/mol 比 乙 烯 醇 的 总 键 能 2678kJ/mol大,即乙醛比乙烯醇稳定. •由于两者能量差别不大 (63kJ/mol),在酸存在下 ,它们中 间相互变化的活化能很小.
(3) 乙炔的键
03-第三章:炔烃
三、氧化反应
• 炔烃和氧化剂反应,往往使碳碳叁键断裂,最后得到完全
氧化的产物——羧酸或二氧化碳。
CH CH R C C R'
KMnO4 H2O
KMnO4 100oC
CO2 + H2O
O
O
R C OH + R' C OH
• 在缓和的氧化条件下,二取代炔烃的氧化可停止在
二酮的阶段。
CH3(CH2)7 C
C-H
0.120
0.106
0.133
0.108
0.154
0.110
1)s轨道的电子较p电子接近原子核,故杂化轨道的s成分越多,则在杂化 轨道上的电子越接近原子核。乙炔分子中的Csp- Hs 键,因sp杂化轨道的 s成分大(50%),其电子云更靠近原子核。
2)乙炔分子中有两个形成键,且sp杂化轨道参与了碳碳键的组成。
和叁键时,首先在双键上发生卤素的加成。
Br
低温
Br
+ Br2
• 炔烃的亲电加成不如烯烃活泼,是由于第一步得到的烯基
碳正离子不如烷基碳正离子稳定。从电离势能来看,从乙炔 分子中移去一个电子所需要的能量比乙烯更大。
(B)与氢卤酸的加成
• 炔烃可和氢卤酸HX(X = Cl、Br、I)加成,但不如烯烃易
进行,不对称炔烃的加成按马尔可夫尼克夫规律进行。
(2)液氨还原
H3C
H
CH3C≡CCH3
Na,NH3(l)
或Li,HNHEt
H
CH3
反应机理:
.R
Na
RC≡CR’
H-N··H2 R
H
·R
Na
·· H
R
R
炔烃
炔烃
4、乙炔
1)乙炔的分子结构:
电子式: 结构式:
H C
● ×
●● ●● ●●
C H
● ×
H—C≡C—H
结构简式: CH≡CH 或 HC≡CH
直线型,键角1800 空间结构:
2
炔烃
乙炔结构 (1)C≡C的键能和键长并不是C-C的三倍,也 不是C=C和C—C之和。说明叁键中有二个键不 稳定,容易断裂,有一个键较稳定。
脂肪烃---------炔烃
三、炔烃
1、概念: 分子里含有碳碳三键的一类不饱 和脂肪烃称为炔烃。 2、炔烃的通式:CnH2n-2 (n≥2) 3、炔烃的通性: (1)物理性质:随着碳原子数的增多,沸点 逐渐升高,液态时的密度逐渐增加。 C小于等于4时为气态,难溶于水。
(2)化学性质:能发生氧化反应,加成反应。
24
脂肪烃的来源及其应用
原 油 的 分 馏 及 裂 化 的 产 品 和 用 途
25
脂肪烃的来源及其应用
26
脂肪烃的来源及其应用
27
脂肪烃的来源及其应用
28
脂肪烃的来源及其应用
学与问 P35
石油分馏是利用石油中各组分的沸点 不同而加以分离的技术。分为常压分馏和 减压分馏,常压分馏可以得到石油气、汽 油、煤油、柴油和重油;重油再进行减压 分馏可以得到润滑油、凡士林、石蜡等。 减压分馏是利用低压时液体的沸点降低的 原理,使重油中各成分的沸点降低而进行 分馏,避免高温下有机物的炭化。
33
脂肪烃的来源及其应用
烷烃 CnH2n+2 (n≥1) 结构特点 碳碳之间仅 含单键 代表物 甲烷 主 与溴 不 褪色 要 (CCl4) 化 与高锰 不褪色 学 酸钾 性 (H SO ) 通式 烯烃 炔烃 CnH2n CnH2n-2(n (n≥2) ≥2) 有碳碳 有碳碳三键 双键 乙烯 乙炔 褪色 褪色 褪色 褪色
炔烃
炔烃炔烃是分子中含有碳碳叁键的烃,炔烃比相应的烯烃少两个氢原子,通式为C n H2n-2。
1 炔烃的异构和命名乙炔是最简单的炔烃,分子式为C2H2,构造式为HC ≡ CH。
根据杂化轨道理论,乙炔分子中的碳原子以sp杂化方式参与成键,两个碳原子各以一条sp杂化轨道互相重叠形成一个碳碳σ键,每个碳原子又各以一个sp轨道分别与一个氢原子的1s轨道重叠,各形成一个碳氢σ键。
此外,两个碳原子还各有两个相互垂直的未杂化的2p轨道,其对称轴彼此平行,相互“肩并肩”重叠形成两个相互垂直的π键,从而构成了碳碳叁键。
两个π键电子云对称地分布在碳碳σ键周围,呈圆筒形。
乙炔分子中π键的形成及电子云分布其它炔烃中的叁键,也都是由一个σ键和两个π键组成的。
现代物理方法证明,乙炔分子中所有原子都在一条直线上,碳碳叁键的键长为0.12 nm,比碳碳双键的键长短,这是由于两个碳原子之间的电子云密度较大,使两个碳原子较之乙烯更为靠近。
但叁键的键能只有836.8 kJ•mol -1,比三个σ键的键能和(345.6 kJ•mol -1 × 3)要小,这主要是因为p轨道是侧面重叠,重叠程度较小所致。
乙炔分子的立体模型。
由于叁键的几何形状为直线形,叁键碳上只可能连有一个取代基,因此炔烃不存在顺反异构现象,炔烃异构体的数目比含相同碳原子数目的烯烃少。
Kekule 模型 Stuart模型乙炔的立体模型示意图2 炔烃的结构炔烃的系统命名法与烯烃相同,只是将“烯”字改为“炔”字。
例如:CH3C≡CH CH3C≡CCH3(CH3)2CHC≡CH丙炔 2-丁炔 3-甲基-1-丁炔分子中同时含有双键和叁键的化合物,称为烯炔类化合物。
命名时,选择包括双键和叁键均在内的碳链为主链,编号时应遵循最低系列原则,书写时先烯后炔。
CH3-CH=CH-C≡CH CH2=CH-CH=CH-C≡CH 3-戊烯-1-炔 1,3-己二烯-5-炔双键和叁键处在相同的位次时,应使双键的编号最小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
炔烃(CnH2n-2)
一、炔烃的分子结构 ( 以乙炔为例 )
碳的杂化:
杂化 2s 2p sp 2p
sp3
sp2
sp
H
C
C
H
sp杂化的碳原子含有较多的S成分 (50%),电负性较sp2、sp3强。
二、异构和命名 *异构 :
官能团异构、碳链异构、位置异构。
*命名:
原则与烯烃相同,但分子中同时含叁键和双键时:
1、结构(以 CH2=CH - CH=CH2 为例)
H H
———
C
C H
H
———
———
C
C
H H
H H
———
形成大π键 ↓ π 电子离域 ↓
H H
0.135 C CH
0.135 CH C 0.148
键长趋于平均化
↓ 共轭体系
2、共轭效应
在1,3-丁二烯中四个p轨道相邻且平行,
互相交盖,π电子不再局限于两个碳原子之 间运动,而离域到整个体系,使键长平均化, 内能降低,这样产生的效应叫
碳相连的氢容易给出而具有酸性。
1、金属炔化物的生成
CH CH + Ag(NH3)2NO3 AgC CAg↓
CHBiblioteka CH +Cu(NH3)2 Cl
CuC
CCu ↓
Na CH CH NH3(l) CH CNa
Na NaC
190~220℃
CNa
注意:
H R R C C C C C C H H R AgC RC CAg CAg
CO2 + H2O
RC
CH
RCOOH + CO2 + H2O
RC
CR'
KMnO4 OH
RCOOH + R'COOH
注意反应现象 酸性高锰酸钾的氧化
4、聚合反应
二聚
2 HC
CuCl CH NH4Cl H2C CH C CH
(Ph3P)2Ni(CO)2
三聚
3 HC
CH 1.5 MPa, 60~70oC
δ
H CH2
δ
<
H C CH R
CH2
δ
<H
C CH H
δ
CH2
δ
超共轭效应依次增大
三、共轭二烯烃的化学性质
1、 1,4-加成 和 1,2-加成
HBr + CH2-CH=CH-CH2 H Br
CH2=CH-CH=CH2
+
CH2-CH-CH=CH2 H Br
反应机理:
H CH2 CH CH CH2 CH2 CH
松香酸
某JH类似物的合成 以香叶醇为原料
PBr 3 OH
COOOH NaO Cl O
Br
O
O
返回
作业:
3.3 3.14
3.17
3.21
1,2-加成产物
氯仿
(37%)
∴ 极性溶剂利于1,4-加成反应
• 温度
H2C CH CH CH2 + HBr
H2C
CH CH Br
CH3 + CH2 CH Br
CH CH3
-80℃
H2C
(80%)
CH CH Br Br
(20%)
CH3 + CH2 CH CH CH3
40℃
(20%)
(80%)
∴ 低温利于1,2-加成,温度升高,利于1,4-加成
Br CH Br
Br CH Br
CH
CH
CCl4
CH Br
CH Br
Br
+
Br2
CCl4
Br
2o 加卤化氢
Cl
CH
CH +
HCl
HgCl2 120~180oC
CH H
CH Cl
HCl
CH3
CH Cl
Cl
CH3
C
CH + HCl
HgCl2
CH3
C Cl
CH H
HCl CH3 C Cl CH3
3o 加水
6 CH3 5 C CH3 4 CH 3 CH CH3 2 C 1 CH 1 CH2 2 C CH3 3 CH2 4 CH CH3 5 C 6 CH
3,5-二甲基-4-己烯-1-炔
2,4-二甲基-1-己烯-5-炔
三、炔烃的物理性质 四、炔烃的化学性质 * 有π 键存在,故性质与烯烃相似 *因sp杂化的碳原子电负性较大,故与叁键
2、双烯合成-Diels-Alder反应
200oC +
O
高压
O
100oC +
O
O 苯
O
O
CHO +
20oC
CHO
思考:
CN
+
CN
+
O
+
O
O
3.4 萜类化合物 与异戊二烯规律
C
C C
C
C
异戊二烯
异 戊 二 烯单 位
萜 烷
个别化合物
CH2OH
CH2OH 香叶 醇
橙 花醇
COOH
α-蒎烯
β-蒎烯
+ Ag (NH3)2
可用于炔烃的鉴别及叁键位置的确定
产物有爆炸性,可用硝酸分解
2、加成反应
(1)催化加氢
RC
CH
H2 Pt
RCH
CH2
H2 Pt
RCH2CH3
CH
C
C CH3
Pd-CaCO3 CHCH3 + H2 CH2 喹啉
CH
C CH3
CHCH3
(2)亲电加成
1o 加卤素
Br2 Br2 CCl4
四聚
Ni(CN)2
4 HC
CH 1.5~2.0 MPa, 505oC
3.3 二烯烃
一、二烯烃的分类和命名 三类二烯烃:
H2C C CH2
丙二烯
H2C C C CH2 H2C CH CH2 C CH2 H H CH3
1,3-丁二烯 2-甲基-1,4-戊二烯
累积双烯
共轭双烯
隔离双烯
二、共轭二烯烃的结构和共轭效应
共轭效应。
共轭效应的特点:
(1)所有原子都在同一平面上,大π键垂直于
这个平面 。
(2)键长趋于平均化,且共轭链越长,平均化
程度越大。
(3)体系能量降低,稳定性增加。 (4)当π电子云转移时,链上出现正、负交替 现象。
问:CH2=C=CH2中存在 共轭效应吗?
H H
H
C C CH2
H
H H
两个π键相互垂直
甲基酮
末端炔
R C C R H2O, Hg H
+ ++
O R C CH2 R
酮
对称二取代炔
(3)亲核加成 加氢氰酸
CH CH + HCN CuCl NH4Cl CH2 CH CN
注意:这是烯烃不能发生的反应 产物可以聚合 历程:亲核加成
3、氧化反应
CH CH KMnO4 OH
KMnO4 OH
氯乙烯呢?
CH2
δ
-
CH Cl
CH2
CH Cl
δ
-
δ
+
p-π共轭
*共轭体系的种类:
(1) π-π共轭
(3)σ -π超共轭
H H C H CH CH2
(2) P-π共轭
丙烯 •
丙烯分子中的超共轭
作用结果:增加了π键的电子云密度。
H
δ
• 参与超共轭的C-Hσ键越多,超共轭效应越强 :
H R C CH R
+
CH2
CH
+ CHCH3 (稳) + CH2CH2
Br
-
δ+
CH2
δCH
δ+
CH CH3 Br
-
CH2-CH=CH-CH3 Br CH2=CH-CH-CH3 Br
影响加成方式的因素:
• 溶剂
CH2 CH CH CH2 + Br2 -15 C
°
正己烷
(62%)
(38%) + 1,4-加成产物 (63%)
HC CH + HOH HgSO4 H2SO4 HC H CH HO
重排
CH3 C
O H
CH3 C
CH + HOH
HgSO4 H2SO4
CH3 C
CH
重排
O CH3 C CH3
OH H
炔烃水合反应在合成上的应用
H2O, HgSO4 HC CH H2SO4 H O C CH3
乙醛
乙炔
R C CH H2O, Hg++ H+ R O C CH3
