烷烯炔有机合成全解
高中化学总复习之(基础)知识讲解—有机合成题的解题策略-
有机合成题的解题策略【高考展望】考试说明中明确要求掌握烃(烷、烯、炔和芳香烃)及其衍生物(卤代烃、醇、酚、醛、羧酸、酯)的组成、结构特点和性质,认识不同类型化合物之间的转化关系,能设计合理路线合成简单有机化合物,能举例说明烃及其衍生物在有机合成和有机化工中的重要作用。
有机合成与推断是高考的必考内容,此类题目综合性强,难度大,情景新,要求高,只有在熟练掌握各类有机物及相互衍变关系的基础上,结合具体的实验现象和数据,再综合分析,才能作出正确、合理的推断。
题型以填空题为主,命题多以框图的形式给出,有时还给出一定的新信息来考查学生的思维能力和知识迁移能力。
解决这类题目的法宝就是:熟练掌握各类官能团之间的衍变关系,做到以不变应万变。
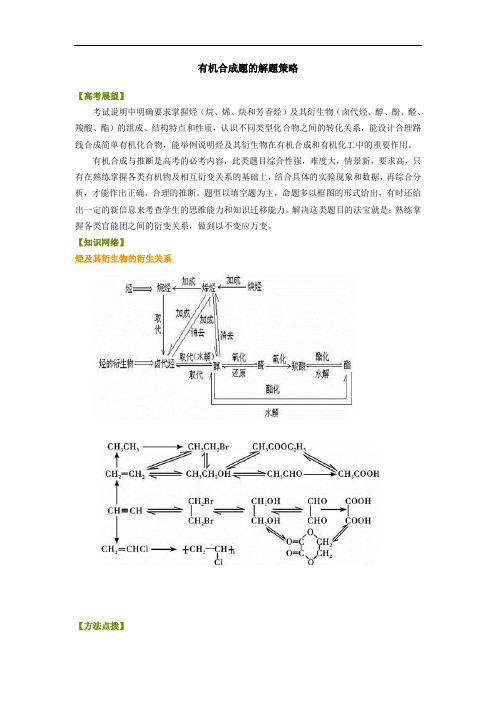
【知识网络】烃及其衍生物的衍生关系【方法点拨】一、有机合成的一般思路和方法:1.有机合成的任务:目标化合物碳骨架的构建和官能团的转化。
2. 有机合成的要求:选择合理的有机合成途径和路线3. 原则:原料价廉,原理正确,途径简便,便于操作,条件适宜,易于分离。
4.有机合成的一般思路和方法:(1)判断原料、产物各有哪些官能团,官能团如何转化、如何引入和保护。
(2)读懂信息,认真分析信息中涉及到官能团或碳链结构的变化、与原料和产品有何联系。
(3)采用顺推、逆推或中间向两边推的推理方式得出合成路线。
①正向合成分析法的过程基础原料→中间体→中间体→……目标化合物②逆向合成分析法的过程目标化合物→中间体→中间体→……基础原料二、碳链改变和官能团改变的基本方法:【高清课堂369463基本知识讲解】有机合成中可通过加成、取代、消去、氧化、还原等反应实现官能团的引入、消除及转化,分析时既要注意反应条件及各类有机物的结构是否符合相应官能团的转化,同时要考虑它对其他官能团的影响。
1.碳链的改变:增长碳链(酯化;炔、烯加HCN;聚合等)缩短碳链(酯的水解;裂化;裂解;烯催化氧化)2.成环反应(酯化;分子间脱水;缩合等)3.官能团的引入(1)引入卤素原子的方法①烃与卤素单质(X2)取代。
烷烯炔的结构与性质

烷烯炔的结构与性质烷烯炔是有机化合物中常见的一类化合物,它们在化学反应和应用中具有重要的地位。
本文将对烷烯炔的结构与性质进行探讨。
一、烷烯炔的结构烷烯炔由碳、氢原子组成,其中碳原子形成链状结构,并与氢原子通过共价键相连。
烷烯炔分为烷烃、烯烃和炔烃三类。
烷烃中的碳原子之间通过单键相连,无不饱和键;烯烃中有一个或多个双键,其中一个碳原子与另一个碳原子之间通过一个双键相连;炔烃中有一个或多个三键,其中一个碳原子与另一个碳原子之间通过一个三键相连。
二、烷烯炔的性质1. 物理性质烷烯炔的物理性质与其分子结构有关。
一般来说,烷烯炔在常温常压下为无色气体或液体,呈无色透明状。
烷烯炔的沸点较低,挥发性强。
2. 化学性质烷烯炔的化学性质较为活泼,容易发生反应。
以下是烷烯炔常见的化学反应及其性质。
(1)加成反应:烷烯炔与其他化合物中较活泼的原子或原团发生加成反应,生成新的有机化合物。
这类反应常见的有氢化、卤化等。
例如,炔烃可以与氯气反应生成取代的炔烃。
(2)氧化反应:烷烯炔在强氧化剂的作用下可以发生氧化反应,生成醛、酮、羧酸等有机化合物。
例如,丙炔经过氧化反应可以生成丙酮。
(3)聚合反应:烯烃和炔烃可以发生聚合反应,生成高分子化合物。
例如,乙烯可以聚合成聚乙烯等。
三、烷烯炔的应用烷烯炔在化学工业中具有广泛的应用。
以下是烷烯炔的几个应用领域。
1. 燃料和能源烷烯炔在燃料领域有重要的作用。
例如,烯烃被用作高效燃料,如乙烯可以用于制造乙烯燃料。
2. 合成材料烷烯炔可以用于合成各种高分子材料,如聚乙烯、聚丙烯、聚丁烯等。
这些材料在塑料、纤维和橡胶等领域中具有广泛的应用。
3. 医药领域烷烯炔在医药领域中也有重要的应用。
一些炔烃化合物被用作医药中间体,如乙炔酸可以用于合成某些药物。
4. 农药和化肥烷烯炔可以用于制造农药和化肥,如丙炔可以用于制造杀菌剂。
5. 光电材料烯烃和炔烃可以用于合成光电材料,如聚苯乙烯可以用于制造光纤。
综上所述,烷烯炔是一类重要的有机化合物,具有丰富的结构和多样的化学性质。
有机化学合成总结

有机化学合成总结1.饱和脂肪烃(1).偶联反应(2).醛、酮还原(3).烯烃、炔烃还原2. 不饱和脂肪烃 一、烯烃合成 (1).醇脱水(2).卤代烷脱卤化氢(3).邻二卤化合物脱卤化氢(4).炔的还原RORR-XR-R RCCRRCH 2-CH 2RRCH=CHR RCH 2-CH 2RCH=CH 2R RCH2-CH 2-OHR-CH 2CH2XR-CH=CH 2R-CHX-CH 2XR -CH=CH 2(5).Wittig 反应二、炔烃合成 (1)从其它炔烃(2)通过二卤消除反应3.卤代烃(1)烷烃的卤代(2)不饱和烃和卤化氢或卤素加成(3)从醇制备C CR1R2RHCOR1R2R-CH=P(Ph)3R-C C-R 1R-CR1XCH R-C CR 1R-C-C-R 1X H H XRX RHX 2R-CH-CH 2XR-CH=CH 2R-CH=CH 2R-CH CH 2X X X 2RXROHX-G(4)卤素的置换 4.醇(1) 烯烃水合C-CH 2OH H RHR-CH=CH 2OH 2(2)硼氢化-氧化(3).醛,酮,羧酸及其酯还原(4) 从格利雅试剂RCl NaIRI R-CH 2CH 2OHR-CH=CH 2(BH 3)2C-CH 2OHH RHR-CH=CH 2R-CH 2OHRCHOR-COOH RCOOR 1RROR ROHR-CH 2-OHRMgXCH 2O RH R1ORMgX R 1CHOR 1MgX RCHORR2R1ORMgX R 1R 2CO R 1MgXRR2CO(5)卤烃水解5.醚(1)从醇去水(2)威廉森合成法6.酚的合成(1)从芳卤衍生物(2)从芳磺酸(3)重氮盐水解7.醛酮(1).醇的氧化和脱氢(2).炔烃的水合R-CH2OH R-CH2XOHR-O-RR-O-R1RXRONa OHNO2NO2ClNO2NO2SO3Na OHNH2OHR-C-R'OHHR-C-R'OR-C C-R R-C-CH2RO(3).同碳二卤化合物水解CH 3OCX 2CH 3(4).傅-克酰基化反应(5).芳烃侧链的氧化(6).β-二羰基化合物8.醌(1)二元酚氧化(2).苯胺氧化9.羧酸及其衍生物和取代酸R(Ar)OR(Ar)COClCHOCH 3OHOHOOOO NH 2CH 3O CH 2R CH 3O CH 2O OC 2H 5RXCH 3O CHR 1R 2CH 3OCH 2OOC 2H 5R 1XR 2X一、酸(1).从伯醇或醛制备(2).从烃氧化(3).从格利雅试剂制备(4).腈水解(5).苯甲酸制备6.β-二羰基化合物二、羟基酸(1).从羟(基)腈水解R C O HR-CH 2OH R C OOHCOOHRR-MgX R-COOH CO2R-CN R-COOH CH 3CCl3COOH RCHO HCN R C COOHOHHHO O CH 2R C 2H 5O O CH 2O OC 2H 5RX O H O CHR 1R 2C 2H 5O O CH 2O OC2H5R 1X R 2X(2).从卤代酸水解(3).雷福尔马茨基反应ZnBrCH 2COOC 2H 5R-CHORCHCH 2COOHOH9. 含氮化合物一、硝基化合物 (1)芳烃和硝酸反应:二、胺类化合物(1).从硝基化合物还原(2).氨的烷基化(3).腈和酰胺的还原(4).醛酮的还原胺化(5).霍夫曼酰胺降级反应(6).盖布瑞尔合成法Cl-CH 2COOHCH 2-COOHOHNO 2NO2NH 2RNH 2RXR 2NHR-CNR-CH 2NH 2R-CH 2-NH-R 1R-CHONH 2-R 1R 1CONH 2RNH 2NHORNH 2RX。
高考化学一轮复习 专题10.2 脂肪烃(烷、烯、炔)讲案(含解析)

2015年高考化学一轮复习 专题10.2 脂肪烃(烷、烯、炔)讲案(含解析)复习目标:1、 以烷、烯、炔的代表物为例,比较它们在组成、结构、性质上的差异。
2、 举例说明烃类物质在有机合成和有机化工中的重要作用。
3、 了解加成反应、取代反应和聚合反应。
基础知识回顾: 一、烃的分类二、烃的结构特点①饱和烃:碳原子之间以碳碳单键结合,剩余的价键跟氢原子相结合,这样的烃叫做饱和烃,如烷烃、环烷烃。
不饱和烃:烃分子中含有碳碳双键或碳碳叁键,碳原子所结合的氢原子数少于饱和链烃的氢原子数,这样的烃叫做不饱和烃。
如:烯烃、炔烃,环烯烃、环炔烃、芳香烃等。
②碳原子的SP 3杂化与甲烷、烷烃、环烷烃的结构特点:甲烷是正四面体结构,烷烃、环烷烃中碳原子进行SP 3杂化,杂化后的轨道分别与另外的碳原子或氢原子形成σ键,因此烷烃、环烷烃为立体结构。
③碳原子的SP 2杂化与乙烯的结构:组成乙烯分子的6个原子在同一个平面内,是平面形结构。
④碳原子的SP 杂化与乙炔的结构:乙炔分子的4个原子在一条直线上,是直线形分子。
三、烷烃、烯烃和炔烃的物理性质烷烃、烯烃、炔烃具有相似的物理性质。
它们均为无色物质,不溶于水而易溶于苯、乙醚等有机溶剂。
密度比水小分子中有1~4个碳原子的开链,脂肪烃的常温下均为气体。
随着碳原子数的增加物理性质显现规律性变化,沸点逐渐升高,相对密度逐渐增大,常温下的存链烃(开链脂肪烃)烷烃烯烃 炔烃 环烃脂肪环烃环烷烃环烯烃 环炔烃芳香烃在状态,也由气态逐渐过渡到液态、固态。
【典型例题1】下列说法正确的是( )A .碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定是饱和链烃B .分子组成符合C n H 2n +2的烃一定是烷烃C .正戊烷分子中所有的碳原子均在同一条直线上D .碳、氢原子个数比为1∶3的烃有两种【迁移训练1】下列对丙烯(CH 2===CH —CH 3)的叙述不正确的是( )A .分子式为C 3H 6B .分子中所有原子都在同一平面上C .能使溴的四氯化碳溶液褪色D .能发生聚合反应 四、烷烃的化学性质烷烃分子中的碳氢键和单键的链能较高,在常温下很不活泼与强酸强、强碱、强氢化剂和还原剂等都不发生反应。
有机化学第五章炔烃(陈青)-幻灯片

Na
C3 C H2 C HCC 2 C3 H H 液 NH3
CH3CH2 C
H
H C
CH2CH3
18
机理:
Na
RCCR
R C C R Na
负离子自由基
NH3
R
CC
H
R
乙烯型自由基
R
CC
H
R
反式 稳定
R
R
CC H
顺式
R CC
Na
H
R
乙烯型自由基
R
NH3
CC
H
R
乙烯型负离子
R
H
CC
H
R
反式烯烃
② 炔烃用LiAlH4还原得反式烯烃。 ③ 炔烃硼氢化,醋酸处理得顺式烯烃。
3
异构:由于炔烃是个直线形分子,故没有几何异构, 它具有碳链异构和官能团位置异构。 碳链不同
叁键位置不同
1—戊炔
碳链位置异构
3—甲基—1—丁炔
2—戊炔 官能团位置异构
6
命名:系统命名 (IUPAC) 命名原则
炔烃的系统命名原则与烯烃相同,无顺反异构,只将烯字改 为“炔”字即可(英文词尾ene改为yne,乙炔英文名称采用 俗名acetylene)。
乙炔中的碳为SP杂化,轨道中S成分较大,核对电子的束缚
14
能力强,电子云靠近碳原子,使乙炔分子中的C-H键 δ- δ+
极性增加: HCCH 氢具有酸性。
(2)炔化物的生成
①乙炔或 RCCH可和NaNH2、RLi、RMgX反应
RCCH+ NaNH2 RCCH+ n-C4H9Li
RC CNa+ NH3
19
《烷烯炔的知识串讲》课件

总结与展望
总结
通过本次知识串讲,我们全面了解了烷烯炔的定义、 特征、结构以及其在不同领域的应用。
展望
展望未来,烷烯炔将在科学研究和工业应用中继续 发挥重要作用,为人类社会的进步和发展做出贡献。
烷烯炔的应用领域
有机合成
烷烯炔作为一种重要的有机中间体,广泛用于有机合成过程中的碳碳键构建和官能团的引入。
医药化工
烷烯炔在医药化工领域中具有多种应用,如合成药物、催化剂和试剂的生产。
电子材料
烷烯炔可以用于制备具有特殊结构和性能的电子材料,如有机发光二极管和有机太阳能电池。
烷烯炔的未来发展趋势
随着科技的不断进步,烷烯炔在各个领域的应用将不断扩展。未来,我们可 以期待烷烯炔在能源、环境保护和材料科学等方面发挥更大的作用。
《烷烯炔的知识串讲》 PPT课件
欢迎大家来到本次的烷烯炔知识串讲。通过这个PPT课件,我们将深入了解烷 烯炔的定义、特征以及其在各个领域中的应用。让我们一起开始探索吧!
烷烯炔的定义和特征
1 定义
烷烯炔是一类有机化合物,由碳和氢元素组成,其分子中含有碳碳双键和碳碳三键。
2 特征
烷烯炔具有高度的反应活性和化学稳定性,能够参与多种有机反应,具有重要的应用价 值。
烷烯炔的结构与命名
结构 命名
烷烯炔的分子结构是由碳碳双键和碳碳三键连接 而成,形成直链、支链或环状结构。
烷烯炔的命名方法基于碳链的长度和双键、三键 的位置,采用一定的命名规则来表示不同的化学 结构。
烷烯炔的物理性质
1 熔点处 理。
2 溶解性
烷烯炔在许多有机溶剂中 具有良好的溶解性,便于 在实验室中进行反应。
3 稳定性
烷烯炔在大部分常见的物 质中相对稳定,但某些情 况下可能会发生自燃或爆 炸。
烷烯炔性质小结

2000C
三、共轭二烯烃的化学性质
1、共轭二烯烃的加成
共轭二烯烃含有单双键交替现象,与1mol卤 素或卤化氢进行加成反应时,得到1,2-和1,4两种加成产物。
1,2-加成:CH2=CH-CH=CH2 + Br2→CH2-CH-CH=CH2 Br Br Br Br
1,4-加成: CH2=CH-CH=CH2 + Br2→CH2-CH=CH-CH2
反应条件:纯溴(液态)、催化剂
+
Br2
FeBr3
-Br
+ HBr
溴苯
在催化剂的作用下,苯也可以和其他卤 素发生取代反应。
苯与溴的取代反应
实验装置
实验探究
1.铁屑的作用是什么? 生成催化剂FeBr3 2.长导管的作用是什么? 用于导气和冷凝回流 3. 锥形瓶内的现象说明发生何种反应?
有溴化氢生成,发生的是取代反应
(3)、加成反应
C H3
C H3
+ 3H2
Ni △
苯与苯的同系物的区别
反应类型
加成
苯
苯的同系物
一般要六个C一起 一般要六个C一起 加成 加成
取代
容易
邻对位更容易
不反应,但能萃 取(物变) 发生氧化反应使 之退色
与溴的四氯 不反应,但能萃 化碳溶液 取(物变) 与酸性高锰 不能反应,只分 酸钾溶液 层(苯为油状比 水轻)
苯的化学性质小结
通常情况下比较稳定,在一定条件下 能发生氧化、加成、取代等反应。
一、苯的化学性质 1、氧化反应
2C6H6 + 15 O2
点燃
12CO2+6 H2O
现象:
明亮的火焰并带有浓烟
烷烯炔的定义

烷烯炔的定义【烷烯炔的定义】“嘿,朋友们!不知道你们在学习化学或者日常生活中,有没有对那些复杂的有机化合物感到头疼?今天咱们就来好好聊聊烷烯炔这一家子!”什么是烷烯炔?其实啊,烷烯炔就是有机化学里的三类重要化合物。
简单来说,烷烃就是碳碳之间全是单键连接的烃类化合物,就像一群人手拉手,每个手都只拉着一个伙伴,比如甲烷(CH₄)。
烯烃呢,有碳碳双键,就好像两个人不只是拉一只手,还多牵了一只手,像乙烯(C₂H₄)。
而炔烃则有碳碳三键,就像是两个人手挽手还不够,还要再勾着一只胳膊,比如乙炔(C₂H₂)。
关键点解析3.1 核心特征或要素烷烃的核心特征是只有单键,性质比较稳定。
比如说汽油里的主要成分就是各种烷烃,它们在常温下不容易发生反应,所以能稳定地给汽车提供动力。
烯烃的双键让它们具有一定的活性。
比如水果催熟常用的乙烯,能让水果加速成熟,这就是因为双键带来的化学活性。
炔烃的三键使其反应活性更强。
像焊接金属时用的乙炔,在氧气中燃烧能产生高温火焰。
3.2 容易混淆的概念烷烃、烯烃和炔烃容易和芳香烃混淆。
芳香烃有特殊的苯环结构,比如苯(C₆H₆)。
烷烯炔主要是直链或者支链的结构,而芳香烃的结构更复杂,性质也有所不同。
起源与发展烷烯炔的研究可以追溯到很久以前。
随着化学学科的不断发展,人们对它们的结构和性质有了更深入的了解。
在现代工业中,它们的作用越来越重要。
比如,通过对烯烃和炔烃的聚合反应,可以生产出各种塑料和合成纤维。
实际意义与应用在日常生活中,烷烃的应用广泛,像天然气、液化石油气,主要成分就是烷烃,为我们的生活提供能源。
在化工产业里,烯烃可以用来制造塑料、橡胶等产品。
而炔烃在金属焊接和切割方面发挥着重要作用。
总结与展望所以呀,烷烯炔这三类化合物虽然看起来复杂,但了解了它们的定义和特点后,就会发现它们在我们的生活和工业中无处不在。
未来,随着科技的进步,对烷烯炔的研究和应用肯定会更加深入和广泛。
那朋友们,你们觉得未来会不会出现更神奇的基于烷烯炔的新材料呢?。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Br HBr Zn
2CH3CHCH2CH2 H ZnBr2 CH3
4. 羰基直接还原成亚甲基
❖ Кижнер-Wolff -黄鸣龙还原法:
R R
C
NH2
O
NH2 R R
C
N
NaOH, Δ R NH2二缩乙二醇 R
CH2
反应是 Кижнер 和Wolff 分别发现,要求高温、高压及 回流100h以上。
Zn or Mg
CH3CH=CHCH3 + ZnBr2
Br Br
Zn, CH3OH
4.1 Hofmann消除反应:
O2N
NO2
C2H5
CH2CH2 N CH3 OH
NO2
C2H5
NO2
O2N
CH = CH2 + CH3N ( C2H5 )2 + H2O
NO2
CH3CH2CHCH3 OH- 150oC CH3CH2CH=CH2 + CH3CH=CHCH3 + (CH3)3N + H2O
CH3Cl + Cl CH2Cl + HCl Cl2 CH3CH3
链增长 链终止
Cl + CH4
Cl H CH3 过渡态
CH3 + HCl
❖用
练习
I
和少于或等于4个碳原子的原料合成:
第二节、烯烃的制备
烯 烃 的 主 要 合 成 反 应
烯烃的亲电加成1 烯烃的亲电加成2
2. 卤代烃脱卤化氢
H
H
NH2NH2,C2H5ONa
O
200 ℃ , 高压
H
H
原因是生成腙时,同时生成了水,水的存在促进了逆反应。
R R C O + NH2 NH2
R C N NH2+H2O
R
黄鸣龙改进:加入高沸点溶剂,使水和过量的肼蒸出, 能在常压下进行,缩短了反应时间,提高了产率。
O
NH2NH2,NaOH
CCH2CH3 二缩乙二醇
CHC3HC3H H
CH3 CCHC2 H2 HH H
HH22
Ni Pd CC2H2H5O5OHH
(2(9289K8K,5,01atm)
CH3 CH3 C CH2
HH
CH3
O
CH3CHC CH NaNH2 环壬炔(--6N-H酮3)
HC22HH3C2CC(HH2239CHe8PPt5KhdOdy,1HlCaatcm-eN)taate+
CH3 CH3CH2CH2CHCH3
3.卤代烷的还原
(1)格氏(Grignard)试剂的水解(遇活泼氢)
• 具体实例如:
C2H5MgBr + C6H5C CH
C2H6 + C6H5C CMgBr
(在制备Grignard reagents时需要避免活性氢)
❖ (2)金属-酸还原卤代烃 多数卤代烃可与锌及酸性水溶液反应生成烷烃。通式为
R X Zn HX 可用简式表示为
R X Zn,HX (-ZnX2)
其反应机理可能是:
RH RH
ZnX2
Zn
+ RX
R- Zn2+
.. X..
-
卤化烷基锌
HX
RH
Zn2+
2
.. X..
-
• 具体实例如
2CH3CH2CHCH3 HBr Zn
Br
2CH3CH2CHCH3 ZnBr2 H
2CH3CHCH2CH2 CH3
烷烃 烯烃 炔烃
芳香烃
卤代烃 醇酚醚 醛酮 羧酸及其 衍生物
含氮化合物
反应
TM
❖ 具体实例如:
CH3 CCHH33CHC CCHH22
CH3 CH3 C CH2
C2H5OH (298K,50atm)
HH
HH22
NNii C(C(222929HH885K5KOO,,5H5H00aattmm))
2°和3°卤代烃在强碱性条件下、 1°在位阻强碱条件下进行 E2消除反应可制备烯烃,当碱性基团较小时更易生成双键上取代 基多即热力学稳定的烯烃,此即为Zaitsev规则:
KOH/EtOH
RCH CHR'
RCH CHR' + KX + H2O
HX Br
CH3CCH3 CH3CH2ONa/EtOH
55oC
反应历程:醛或酮和磷叶立德发生亲核加成后再消除, 生成烯烃。
+-
Ph3P CR2 +
O CR'2
+
Ph3P
-
O
CR2 CR'2
Ph3P CR2 O CR'2
Ph3P + CR2 O CR'2
反应时通过环状过渡状态协同完成的。
CH3
CH2 CCH3 + H2O + NaBr CH3
X = F , Cl / Br / I , S+Me2 , N+Me3 , RCOO , ROCSO , RSCSO
❖但当碱性基团较大时易于生成取代基少的烯烃,此即为 Hofmann规则:
3. 邻二卤代烷脱卤素
Br Br CH3CHCHCH3
N+ (CH3)3
(95%)
(5%)
CH3CH2CHCH3 -OC2H5
CH3CH2CH=CH2 + CH3CH=CHCH3 + (CH3)2S + C2H5OH
S(CH3)2
+
4.2. 叔胺氧化物的Cope消除反应
H O-
160oC
N+
CH3CH3
CH2 + (CH3)2NOH
5. 裂解反应:
O CH3
CH3Br (-NaBr)
CH3CHC
excess H2
CH3 O
Pd 2H2 ethyl acetate
O
Pt, pressure CH3CHCH2CH2CH3
环壬炔-6-酮
C CH3
2. 烯烃硼氢化-质子化:
CH3 CH3CH2CH2C=CH2
(1) BH3:THF
(2) CH3COOH, heat
CH2CH2CH3
❖Clemmensen还原法:醛或酮和锌汞齐、浓盐酸一起 加热,可将羰基还原成亚甲基。
R
Zn-Hg R
CO R
HCl
R CH2
此法对芳酮较好,对酸敏感的醛或酮不能使用,这时可 使用黄鸣龙法,两种方法互为补充。
O CCH3
Zn-Hg,HCl
Δ
CH2CH3
4. 羰基间接还原成亚甲基
X
:B OH
RO
R
X = leaving group, e.g. : -OSO2C6H4CH3-p , -
OSO2CH3
例:
OTos HH
OH
H OTos
t - BuOk
H
t - BuOH
OH
( 90% )
O
7.
8. Wittig试剂和醛酮反应
+-
R'2C O + (C6H5)3P CR2
R'2C CR2+(C6H5)3P O
烷烃的反应
❖
烷烃的反应活性较低,在光照或加热条件下,能与卤素
发生卤代反应。
❖ 氯代
烷烃的氯代反应是按游离基历程(机理)进行的
日光 C日光
CH2Cl2 + HCl
CCl4
光
Cl Cl
2Cl
链引发
Cl + CH4
CH3 + HCl
CH3 + Cl Cl CH3Cl + Cl Cl + Cl CH3 + CH3
