2015年高中化学竞赛辅导 无机化学 15.1硼及其化合物知识点素材
高中化学竞赛-硼族元素
高中化学奥林匹克竞赛辅导硼族元素一、硼族元素简介硼族元素包括硼(B)、铝(Al)、镓(Ga)、铟(In)、铊(Tl),在周期表中处于第Ⅲ A族。
硼族元素的价电子构型为n s2n p1,除硼外其余元素均为金属元素,金属性随原子序数的增加而增强。
B的半径较小,失去三个电子非常困难,因此硼不能形成简单阳离子B3+,只能通过共用电子对形成共价化合物。
Al、Ga、In、Tl在水溶液中可以形成M3+。
因为惰性电子对效应,Tl3+具有强氧化性。
在硼族元素形成的共价分子中,中心原子最外层只有6个电子,未达到8电子的外层结构,属于缺电子化合物,它们具有一个空p轨道,可以接受孤对电子形成配位键,是强的路易斯酸。
硼族元素的性质二、硼及其化合物1.硼的单质硼的非金属单质以原子晶体形式存在。
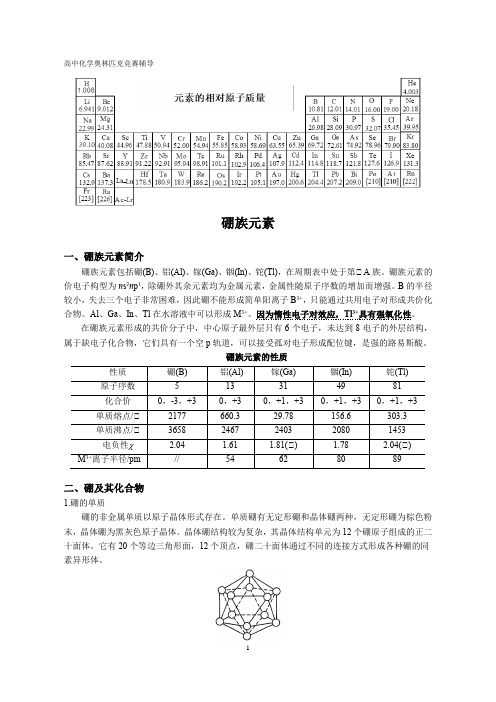
单质硼有无定形硼和晶体硼两种,无定形硼为棕色粉末,晶体硼为黑灰色原子晶体。
晶体硼结构较为复杂,其晶体结构单元为12个硼原子组成的正二十面体。
它有20个等边三角形面,12个顶点,硼二十面体通过不同的连接方式形成各种硼的同素异形体。
晶体硼的化学活性较低,无定形硼较活泼。
常温下,硼能与F 2反应,高温下能与N 2、O 2、S 等非金属单质反应。
无定形硼可被热的浓硝酸、浓硫酸氧化成硼酸,也能与强碱作用放出氢气。
2B+N 22BN(与金刚石C 2互为等电子体,是原子晶体) B+3HNO 3(浓)B(OH)3+3NO 2↑2B+2NaOH+2H 2O2NaBO 2+3H 2↑(与Al 的性质相似)2.硼的氧化物及含氧酸硼最重要的氧化物是B 2O 3,熔融B 2O 3能溶解许多金属氧化物,形成具有特征颜色的偏硼酸盐,这个反应用于定性分析,称为硼珠实验:CuO+B 2O 3Cu(BO 2)2(蓝色) NiO+B 2O 3Ni(BO 2)2(绿色) B 2O 3的水化物为硼酸H 3BO 3或B(OH)3。
H 3BO 3是白色的片状晶体,具有片层结构,层和层 之间存在范德华力,容易发生滑动,其中氢键对其结构的形成具有支配的作用。
硼元素的高考知识点归纳

硼元素的高考知识点归纳硼(B)是一种化学元素,其在化学元素周期表中的原子序数为5。
作为一种主组元素,硼具有许多重要的化学和物理特性,是高中化学学科中重要的一部分内容。
在高考中,对于硼元素的相关知识点的了解和掌握是非常必要的。
本文将对硼元素的高考知识点进行归纳和总结,希望能够帮助读者更好地掌握相关知识。
硼元素的基本性质硼元素是一种典型的准金属元素,具有特殊的物理和化学性质。
硼的原子结构为1s²2s²2p¹。
硼元素的原子半径较小,电负性较高,具有较强的电子亲和能力。
另外,硼元素具有良好的导电性和热导性能,并且对于中子有很好的吸收能力,因此在核能工业中也有一定的应用。
硼元素的同位素硼元素存在两种稳定同位素,分别为硼-10和硼-11。
硼-10的质量数为10,占自然界中硼元素的约20%;硼-11的质量数为11,占自然界中硼元素的约80%。
此外,硼元素还存在一种放射性同位素,即硼-8,其半衰期极短,仅为157 ns。
硼元素的化合物和反应硼元素与氧、氢等多种元素之间能够形成多种化合物。
其中,最重要的化合物之一是硼酸(H3BO3),硼酸是一种弱酸,可溶于水,并具有良好的缓冲和阻燃性能。
此外,硼元素还与碱金属和碱土金属等元素形成金属硼化物,如NaBH4和CaB6等。
这些金属硼化物在化工和材料领域有着广泛的应用。
硼元素的应用硼元素具有广泛的应用价值,在许多领域都有重要的应用。
首先,硼元素在玻璃和陶瓷工业中被用作增强剂和阻燃剂;其次,硼元素也被用于制备特种材料,如硼化硅陶瓷、金属硼化物等;此外,硼元素还在医学、农业和能源等领域有着广泛的应用。
例如,硼中子俘获治疗(BNCT)是一种新型的抗癌治疗方法,利用硼元素对中子的吸收作用,对癌细胞进行热杀伤。
硼元素的历史和发现硼元素的发现和研究历史可以追溯到公元前9世纪的古代文明。
在古代,人们就已经开始使用含硼矿石来制备颜料,如硼砂(硼酸钠)。
然而,直到1808年,英国化学家梅杰(Humphry Davy)才成功地从硼酸中分离出纯净的硼元素。
高中化学竞赛辅导 无机化学 15.1硼及其化合物知识点素

第十五章 硼族元素Chapter 15 The Boron Family ElementsBoron (B) Aluminum (Al) Gallium (Ga) Indium (In)Thallium (Tl)Electron configuration :n s 2n p 1§15-1 硼及其化合物 Boron and its Compounds一、General Properties1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。
(1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似;(4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。
2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O ,四水硼砂(kernite ):Na 2B 4O 7·4H 2O ,天然硼酸 ( sassolite ):H 3BO 3存在。
3.硼在自然界中丰度之所以低,是因为Li He B 734210105+→+n ,所以硼材料可作为核反应堆的减速剂和生物防护。
二、The Simple Substance1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals ofboron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃)单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。
高中化学竞赛知识点归纳

高中化学竞赛知识点归纳高中化学竞赛知识点归纳一、硅元素:无机非金属材料中的主角,在地壳中含量26.3%,次于氧。
是一种亲氧元素,以熔点很高的氧化物及硅酸盐形式存在于岩石、沙子和土壤中,占地壳质量90%以上。
位于第3周期,第ⅣA族碳的下方。
Si对比C最外层有4个电子,主要形成四价的化合物。
二、二氧化硅(SiO2)天然存在的二氧化硅称为硅石,包括结晶形和无定形。
石英是常见的结晶形二氧化硅,其中无色透明的就是水晶,具有彩色环带状或层状的是玛瑙。
二氧化硅晶体为立体网状结构,基本单元是[SiO4],因此有良好的物理和化学性质被广泛应用。
(玛瑙饰物,石英坩埚,光导纤维)物理:熔点高、硬度大、不溶于水、洁净的SiO2无色透光性好。
化学:化学稳定性好、除HF外一般不与其他酸反应,可以与强碱(NaOH)反应,是酸性氧化物,在一定的条件下能与碱性氧化物反应。
SiO2+4HF==SiF4↑+2H2OSiO2+CaO===(高温)CaSiO3SiO2+2NaOH==Na2SiO3+H2O不能用玻璃瓶装HF,装碱性溶液的试剂瓶应用木塞或胶塞。
三、硅酸(H2SiO3)酸性很弱(弱于碳酸)溶解度很小,由于SiO2不溶于水,硅酸应用可溶性硅酸盐和其他酸性比硅酸强的酸反应制得。
Na2SiO3+2HCl==H2SiO3↓+2NaCl硅胶多孔疏松,可作干燥剂,催化剂的载体。
高中化学竞赛必备化学方程式大全1. 氧化性:F2 + H2 === 2HF2F2 +2H2O===4HF+O2Cl2 +2FeCl2 ===2FeCl32Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I2Cl2+SO2 +2H2O===H2SO4 +2HCl2. 还原性S+6HNO3(浓)===H2SO4+6NO2↑+2H2O3S+4 HNO3(稀)===3SO2+4NO↑+2H2O(X2表示F2,Cl2,Br2)PX3+X2===PX5C+CO2===2CO (生成水煤气)(制得粗硅)Si+2NaOH+H2O===Na2SiO3+2H2↑3.(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O金属单质(Na,Mg,Al,Fe)的还原性4Na+O2===2Na2O2Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H2↑Mg+H2SO4===MgSO4+H2↑2Al+6HCl===2AlCl3+3H2↑2Al+3H2SO4===Al2(SO4)3+3H2↑2Al+6H2SO4(浓、热)===Al2(SO4)3+3SO2↑+6H2O(Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO3(稀)===Al(NO3)3+NO↑+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H2↑Fe+2HCl===FeCl2+H2↑Fe+CuCl2===FeCl2+Cu非金属氢化物(HF,HCl,H2O,H2S,NH3)1.还原性:16HCl+2KMnO4==2KCl+2MnCl2+5Cl2↑+8H2O(实验室常用)2H2S+SO2===3S↓+2H2O2NH3+3Cl2===N2+6HCl如何准备化学竞赛1.一定要认真对待前五年的真正问题,像正式考试一样,要完成并彻底研究每一个问题。
无机化学 第15章 硼族元素

硼氢配合物可通过以下反应进行制备:
B2H6 + 2LiH = 2LiBH4 BF3 + 4NaH = NaBH4 + 3NaF B(OCH3)3 + 4NaH = NaBH4 + 3NaOCH3
15.2.4 卤化物和氟硼酸
在卤化物中最重要的是BF3和BCl3。纯的 卤化物为无色,其熔沸点均较低,且随着F, Cl, Br, I原子序数的增加而增高。室温下,BF3和 BCl3为气体,BBr3是液体,BI3为固体,但 BBr3和BI3见光会部分分解而呈浅黄色。 将BF3通入水中,可得到氟硼酸和硼酸,氟硼 酸为强酸。
三卤化硼为平面三角形构型,中心硼原 子采用sp2杂化轨道与三个卤素离子的p轨道 形成三个键,键角120°。
中心硼中未参加杂化的空的p轨道与三 个卤素原子充满电子的p轨道重叠,形成了 46的离域键。
BX3属于缺电子结构,因此是典型的路 易斯酸,易与NH3,H2O等发生配位。
15.2.5 硼酸和硼酸盐
B2H6的分子结构
在B2H6分子结构中,6个氢所处的环境可以分 成两类:
一类是四个端H原子分别用它们的1s轨 道上的一个电子与以sp3杂化的B原子sp3杂化 轨道上的一个电子成键,因此构成四根正常 的B-H共价键(2c-2e共价键);
另一类是桥H的1s轨道与两个B原子的各 一个sp3杂化轨道成键,构成了二个B-H-B氢 桥键,这是一种三中心二电子键(3c-2e共价 键),即缺电子键。
的数字标出硼原子数,氢原子的数目则以阿拉 伯数字标出。
例如B5H9称为戊硼烷-9,B14H20称为十四 硼烷-20。硼与氢气不能直接化合形成硼烷,但 通过一些间接的方法则可以制备硼烷。
例如乙醚中,BCl3与LiAlH4反应可以到纯度 较高的乙硼烷。
高考化学工艺流程中的新考点 硼及其化合物

高考化学工艺流程中的新考点---硼及其化合物一、知识拓展单质硼的性质无定形和粉末状硼比较活泼,而晶态硼惰性较大。
(1)与非金属作用无定形硼在室温下与F 2反应得到BF 3,加热时也能与O 2 、Cl 2、Br 2、S 和N 2反应,分别得到BCl 3、BBr 3、B 2S 3和BN (在1473K 以上)。
它不与H 2作用。
2B + 3F 22BF 3 4B + 3O 2 2B 2O 3 (2)与酸的作用它不与盐酸作用,仅被氧化性酸,如浓HNO 3、浓H 2SO 4和王水所氧化:B + 3HNO 3H 3BO 3 + 3NO 2↑ 2B + 3H 2SO 42H 3BO 3 + 3SO 2↑ (3)与强碱作用无定形硼与NaOH 有类似硅那样的反应;有强氧化剂存在时与强碱共熔可得偏硼酸盐 : 2B + 6NaOH 2Na 3BO 3 + 3H 2↑2B + 2NaOH + 3KNO 32NaBO 2 + 3KNO 2+H 2O(4)赤热下,与水蒸气反应,2B +6H 2O(g) =====△B(OH)3+3H 2。
(5)高温下同金属反应生成金属硼化物。
2.硼的工业制法①用浓碱溶液分离硼镁矿:Mg 2B 2O 5·5H 2O+2NaOH=2NaBO 2+2Mg (OH )2↓+3H 2O ②通CO 2调节碱度,分离出硼砂:4NaBO 2+CO 2+10H 2O===Na 2B 4O 7·10H 2O +Na 2CO 3。
③用硫酸调节酸度,析出细溶解度更小的硼酸晶体:Na 2B 4O 7+H 2SO 4+5H 2O===4H 3BO 3↓+Na 2SO 4。
④加热、脱水:2H 3BO 3=====△B 2O 3+3H 2O 、⑤用镁或铝还原成粗硼:B 2O 3+3Mg=====△2B +3MgO另外,用硫酸和硼镁矿一步制得硼酸:Mg 2B 2O 5·5H 2O +2H 2SO 4=====△2MgSO 4+2H 3BO 33.氧化硼B2O3的熔点为72OK,沸点为2523K;易溶于水,形成硼酸:B2O3 + 3H2O2H3BO3但遇热的水蒸气可生成易挥发的偏硼酸:B2O3 + H2O(g)2HBO2(g)4.硼酸(1)硼酸H3BO3为白色片状晶体,微溶于水,在热水中溶解度明显增大。
化学竞赛无机化学绝密课件 硼族元素资料

这种新类型的化学键,是由于 B
的缺电子结构造成的。 下面以 B10H14,癸硼烷 - 14 为
例说明硼氢化合物中的常见键型。
B10H14,癸硼烷-14 的键联关系
H B
H H B B H HB BH B H H
H B
B H
H
HB
H
B H
硼氢化合物中有 5 种常见键型
H B B H HB H H B
结。见图中虚线。
虚线三角形角顶位置的 3 个 B 原子之间共用 2 个电子成键。 即所谓 “三中心二电子键”。
三中心二电子键所用的 B 原子,
为 B12 单元中层的 B 原子。
关于三中心二电子键这类新的化 学键后面将要详细介绍。
前后片层之间,通过 B-B 键结合。
这些 B 原子是 B12 结构单元中,前
晶体硼黑灰色,高硬度,
高熔点。
12. 1. 1 晶体硼的结构
晶体硼单质的基本结构单元为
正二十面体,十二个硼原子占据多
面体的顶点。
正二十面体共 20 个面,每个面
都是正三角形; 每个面角都是五面角;共 12 个顶点。
我们称这种基本结构单元为 B12
B12 单元中,前面 3 个硼原子
构成的三角形,其所在的平面与后
这个硼原子在形成硼桥键时提供
一个原子轨道及其中的一个电子。
H B
B H
H H B
H HB B H
HB
BH
H H B
B H
H B H
闭合式硼键
B B B
4个
闭合式硼键中成键的 3 个硼原 子彼此等价
没有哪一个属于桥上的原子。
这 3 个硼一共提供 2 个电子。
高中化学竞赛基础知识点归纳

高中化学竞赛基础知识点归纳高中化学竞赛基础知识点归纳在我们的高中阶段,化学竞赛是很受学生欢迎的,很多喜欢化学的学生都很积极参加比赛,可是想要赢得胜利,我们需要掌握哪些化学知识呢?下面是店铺为大家整理的高中化学知识点,希望对大家有用!高中化学竞赛知识一、物理性质1、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。
其它物质的颜色见会考手册的颜色表。
2、有刺激性气味的气体:HF、HCl、HBr、HI、NH3、SO2、NO2、F2、Cl2、Br2(g);有臭鸡蛋气味的气体:H2S。
3、熔沸点、状态:① 同族金属从上到下熔沸点减小,同族非金属从上到下熔沸点增大。
② 同族非金属元素的氢化物熔沸点从上到下增大,含氢键的NH3、H2O、HF反常。
③ 常温下呈气态的有机物:碳原子数小于等于4的烃、一氯甲烷、甲醛。
④ 熔沸点比较规律:原子晶体>离子晶体>分子晶体,金属晶体不一定。
⑤ 原子晶体熔化只破坏共价键,离子晶体熔化只破坏离子键,分子晶体熔化只破坏分子间作用力。
⑥ 常温下呈液态的单质有Br2、Hg;呈气态的单质有H2、O2、O3、N2、F2、Cl2;常温呈液态的无机化合物主要有H2O、H2O2、硫酸、硝酸。
⑦ 同类有机物一般碳原子数越大,熔沸点越高,支链越多,熔沸点越低。
同分异构体之间:正>异>新,邻>间>对。
⑧ 比较熔沸点注意常温下状态,固态>液态>气态。
如:白磷>二硫化碳>干冰。
⑨ 易升华的物质:碘的单质、干冰,还有红磷也能升华(隔绝空气情况下),但冷却后变成白磷,氯化铝也可;三氯化铁在100度左右即可升华。
⑩ 易液化的气体:NH3、Cl2 ,NH3可用作致冷剂。
4、溶解性① 常见气体溶解性由大到小:NH3、HCl、SO2、H2S、Cl2、CO2。
极易溶于水在空气中易形成白雾的气体,能做喷泉实验的气体:NH3、HF、HCl、HBr、HI;能溶于水的气体:CO2、SO2、Cl2、Br2(g)、H2S、NO2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十五章 硼族元素Chapter 15 The Boron Family ElementsBoron (B) Aluminum (Al) Gallium (Ga) Indium (In)Thallium (Tl)Electron configuration :n s 2n p 1§15-1 硼及其化合物 Boron and its Compounds一、General Properties1.硼的化学性质与Si 有某些相似之处(对角线相似原则),通常硼呈现+3氧化态,负氧化态的情况很少。
硼与金属形成非化学计量的化合物(nonstoichiometric compounds ),M 4B 、M 2B 、MB 、M 3B 4、MB 2、MB 6等。
(1) B 2O 3与SiO 2都是固态酸性氧化物,Al 2O 3是两性,CO 2是气态酸性; (2) H 3BO 3与H 4SiO 4都是很好的酸; (3) 多硼酸盐与多硅酸盐结构相似;(4) 硼烷、硅烷可形成多种可燃性气态物质,而AlH 3是固态。
2.在自然界中,硼以硼砂(borax ):Na 2B 4O 7·10H 2O ,四水硼砂(kernite ):Na 2B 4O 7·4H 2O ,天然硼酸 ( sassolite ):H 3BO 3存在。
3.硼在自然界中丰度之所以低,是因为Li He B 734210105+→+n ,所以硼材料可作为核反应堆的减速剂和生物防护。
二、The Simple Substance1.Boron has several allotropic forms. 无定形硼为棕色粉末, The crystals ofboron are black. 高熔沸点(m.p. 2300℃,b.p. 2550℃)单质硼有多种复杂的晶体结构,其中最普通的一种是α - 菱形硼,其基本结构单元为正二十面体的对称几何构型,然后由B 12的这种二十面体的布起来组成六方晶系的α - 菱形硼。
2.Properties(1) 硼和硅一样在常温下较惰性,仅与F 2反应。
对于单质硼的同素异构形体而言,结晶状单质硼较惰性,无定形硼则比较活泼,在高温下:(2)单质硼作还原剂: 3SiO 2 + 4B强热3Si + 2B 2O3 2B + 6H 2O(g)赤热2B(OH)3 + 3H 2↑ (3) 与氧化性的酸反应,生成H 3BO 3 (4) 在有氧化剂存在时,与碱反应:B 2S B BCl 2O 3Fig 15.1 Icosahedral arrangement of B 122B + 2NaOH + 3KNO 3共熔2NaBO 2 + 3KNO 2 + H 2O3.Preparation : (1) 金属还原: B 2O 3 + 3Mg 2B + 3MgO KBF 4 + 3Na3NaF + KF + B(2) 工业上:从硼镁矿 → 单质硼 → 精制硼 a .用浓碱溶液来分解硼镁矿: Mg 2B 2O 5·5H 2O + 2NaOH 2NaBO 2 + 2Mg(OH)2 + 4H 2O b .通入CO 2调节碱度,分离出硼砂 4NaBO 2 + CO 2 + 10H 2O Na 2B 4O 7·10H 2O + Na 2CO 3 c .用H 2SO 4调节酸度,可析出溶解度小的硼酸晶体:Na 2B 4O 7 + H 2SO 4 + 5H 2O 4H 3BO 3 + Na 2SO 4d .加热,脱水: 2H3BO 3B 2O 3 + 3H 2Oe .用Mg 或Al 还原成粗硼:B 2O 3 + 3Mg 2B + 3MgO f .精制:2B (粗) + 3I 22BI 32BI 31000-1300K钽丝2B(α - 菱形硼) + 3I 2三、Compounds 1.Boron hydrides:(1) 这类氢化物的物理性质相似于烷烃(paraffin ),故称硼烷(Borane )。
多数硼烷组成是B n H n + 4、B n H n + 6,少数为B n H n + 8、B n H n + 10。
但最简单的硼烷是B 2H 6。
BH 3之所以不存在是由于B 的价轨道没有被充分利用,且配位数未达到饱和,又不能形成稳定的sp 2杂化态的离域π键,所以 BH 3(g) + BH 3(g)B 2H 6(g) ∆r G m,298 =-127kJ ·mol -1而BF 3之所以存在,是因为 64Π的存在。
(2) preparation : a .质子置换法: ++3H MnB ++362Mn H B 21b .氢化法: 233H BCl +HCl 3H B 2162+ c .氢负离子置换法: 34BF 43LiAlH +ether 362AlF 33LiF H 2B ++ 344BF 3NaBH +ether4623NaBF H 2B +(3) 硼烷的结构特点:它是缺电子化合物(electron deficient compound ),例如B 2H 6中价电子总共只有12个,不足以形成七个二中心二电子单键(2c-2e),B 原子采取sp 3杂化,位于一个平面的BH 2原子团,以二中心二电子键连接,位于该平面上、下且对称的H 原子与硼原子分别形成三中心二电子键,称为氢桥键。
其分子轨道能级图为:在各种硼烷中呈现五种成键情况:a . 2c —2e 端侧b . 3c —2e 氢桥键c . 2c —2e 硼硼键d . 开放式 3c —2e 硼桥键e . 闭合式 3c —2e 硼桥键1957-1959年,Lipscomb.W.N 提出了解决硼氢化合物的“三中心键理论”,获得了巨大的成功,荣获1976年Nobel 化学奖。
“硼氢化合物拓扑理论”对于B n H n + m :s 表示硼烷分子中氢桥键数目 t 表示硼桥键数目y 表示硼硼(B -B )键数 x 表示(BH)n (端基氢)以外的切向B -H 基团的数目根据守恒原理:氢原子守恒:s + x = m B 原子的价电子守恒:s + 2t + 2y + x = 2nB 原子的轨道守恒:2s + 3t + 2y + x = 3n s + x = m①即 s + 2t + 2y + x = 2n ②2s + 3t + 2y + x = 3n ③由②、③ 得:s + t = n由①、② 得:m n y t 21-=+x = m - s B 4H 10 (4012)∴ t = n - sy = s -21m例: B 2H 6 (2002) (styx ) (4) properties :B 的两个 sp 3杂化轨道H 的 1s 原子轨道三中心二电子键σσnonσ*Fig 15.2 Structure of biborane, B 2H 63B 2H 6(g) + 6NH 3(g)2B 3N 3H 6(l) + 12H 2(g) B 3N 3H 6(l) + 3HCl(g)B 3N 3H 9Cl 3(s)NaBH 4B 3N 3H 12(5) applications :a .火箭燃料:B 2H 6(g) + 3O 2(g) B 2O 3(g) + 3H 2O(l) ∆c H m =-2152.5kJ ·mol -1B 2H 6理应是理想的火箭燃料,但由于所有硼烷有很高的毒性(B 2H 6 0.1ppm 致死),且贮存条件苛刻(易燃且水解:B 2H 6 + 6H 2O 2H 3BO 3 + 6H 2),只好暂时放弃。
b .万能还原剂(在有机化学上) 2NaH + B 2H 62NaBH 4c .可以制备聚合物,高温稳定,低温保持粘度不变d .硼烷化合物与蛋白质结合,用于肿瘤治疗 2.卤化物(Boron halides )(1) preparation :3CaF 2 + B 2O 3 + 3H 2SO 4(浓)2BF 3↑+ 3CaSO 4 + 3H 2O B 2O 3 + 3C + 3Cl 22BCl 3 + 3CO (2) properties :a .hydrolysis :OH 64BF 23+343B(OH)BF 3O 3H ++-+ 3 + 3H 2O 3HF + H 3BO 33 + HF + H 2O -4BF + H 3O +BCl 3 + 3H 2O B(OH)3 + 3HClb .与碱性物质反应:4BF 3 + 2Na 2CO 3 + 2H 2O 3NaBF 4 + NaB(OH)4 + 2CO 2↑可以看作首先形成HBF 4 + H 3BO 3,再与Na 2CO 3碱性物质反应。
3.含氧化物 (1) B 2O 3a .易溶于水:B 2O 3 + 3H 2O 2H 3BO 3 所以它是吸水剂。
b .硼珠试验:熔融的B 2O 3可熔解许多金属氧化物反应可得到特征颜色:CuO + B 2O 3Cu(BO 2)2 (蓝色) NiO + B 2O 3Ni(BO 2)2 (绿色)c .与NH 3反应,在500℃生成(BN)n ,与石墨结构相似。
B 2O 3(s) + 2NH 3(g) 1000℃2BN(s) + 3H 2O(g)(2) H 3BO 3a .硼酸为一元弱酸,呈片状晶体结构,OH 间以氢键连接OH B(OH)23++-+H B(OH)4在冷水中溶解度小,在热水中因部分氢键断裂而使溶解度增大。
b .与碱反应:2NaOH + 4H 3BO 3Na 2B 4O 7 + 7H 2O 过量NaOH 使Na 2B 4O 7变成NaBO 2Na 2B 4O 7 + 2NaOH4NaBO 2 + H 2Oc .H 3BO 3的酸性可因加入甘油或甘露醇等多元醇而大大增强HOBOOH HHOCH 2CHOHCH 2OH+H 3O + H 2O++OCH 2CHOH 2OB O [ ]d .H 3BO 3也表现出微弱的碱性3HCl )B(PO POH B(OH)4433++(3) 一些硼酸盐阴离子结构a .环状 -332)(BO ,在KBO 2,NaBO 2晶体中b .zig —zag chains -n n )(BO 2,在Ca(BO 2)2,LiBO 2中4NaBO 2 + CO 2 + 10H 2O Na 2[B 4O 5(OH)4]·8H 2O + Na 2CO 3 c .硼砂:Na 2B 4O 7·10H 2ONa 2[B 4O 5(OH)4]·8H 2ONa 2B 4O 7 + H 2SO 4(浓) + 5H 2O4H 3BO 3↓+ NaSO 4-2454](OH)O [B :-452O B 焦硼酸盐:d .硼酸盐阴离子结构式的特点: B 原子采取sp 2杂化33BO -:Mg 3(BO 3)2 ,LaBO 3 ; (B 2O 5)4-:Mg 2B 2O 5 ,Fe 2B 2O 5 ; (B 3O 6)3-:K 3B 3O 6 ,Ba 3(B 3O 6)2 (BBO 晶体) ; 2(B O )n n -:Ca(BO 2)2(s) B 原子采取sp 3杂化54BO -:TaBO 4 ; 4B (O H )-:Na2[B(OH)4]Cl ;Mg[B 2O(OH)6] [B 2(O 2)(OH)4]2-:Na 2[B 2(O 2)2(OH)4]·6H 2OB 原子既采取sp 2又采取sp 3杂化K[B 5O 6(OH)4]·2H 2O ,Ca[B 3O 3(OH)5]·H 2O ,Na 2[B 4O 5(OH)4]·8H 2O 从上面的各种硼酸盐阴离结构式来看:当B 原子的端基是OH 基团时,硼酸根离子的结构式中,sp 3杂化的硼原子数目等于硼酸根阴离子的电荷数。
