2007年高考化学试题(海南卷)
近五年海南高考化学卷分析
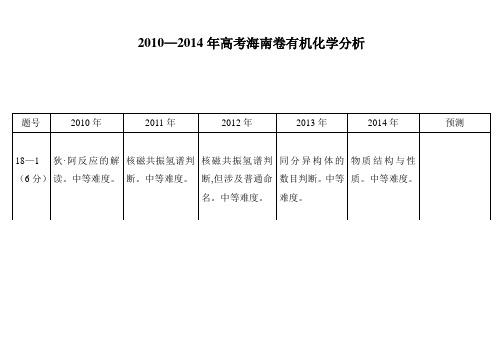
题号
2010年
2011年
2012年
2013年
2014年
预测
18—1
(6分)
狄∙阿反应的解读。中等难度。
核磁共振氢谱判断。中等难度。
核磁共振氢谱判断,但涉及普通命名。中等难度。
同分异构体的数目判断。中等难度。
物质结构与性质。中等难度。
18—2ቤተ መጻሕፍቲ ባይዱ
无信息,考查点有:计算求分子式、反应式书写、反应类型与反应条件判断、同分异构体种数判断、核磁共振氢谱应用。思维常规,中等难度,但同分异构体种数判断较难(涉及苯环上三个取代基的异构)。
无信息,考查点有:计算求分子式、反应式书写、反应类型判断、核磁共振氢谱判断,简单的合成线路(两步)思维常规,中等难度。但合成尼龙的反应式书写学生较少见。
无信息,聚酯合成。考查点有:反应式书写、反应类型判断、有条件书写同分异构体。思维常规,中等难度。
有信息,考查点有:有机物的命名、反应式书写、反应类型判断、天然橡胶的单体的同分异构体种数判断(包括顺反异构)。思维常规,中等难度,但同分异构体种数判断较难(涉及两个碳碳双键的顺反异构)。
有信息,考查点有:有机物的命名、反应式书写、反应类型判断、核磁共振氢谱判断,但同分异构体种数判断较难(有序地书写思想)
2008年普通高等学校招生全国统一考试(海南卷) 化学

2008年海南高考化学试题注意事项:1.本试卷分第I卷(选择题)和第II卷(非选择题)两部分。
答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答第I卷时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
写在本试卷上无效。
3.回答第II卷时,将答案写在答题卡上。
写在本试卷上无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 C1 35.5第I卷一、选择题:本题共12小题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.HBr分子的电子式为:2.用pH试纸测定溶液pH的正确操作是:A.将一小块试纸放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照B.将一小块试纸用蒸馏水润湿后放在表面皿上,用玻璃棒蘸取少量待测液点在试纸上,再与标准比色卡对照C.将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照D.将一小条试纸先用蒸馏水润湿后,在待测液中蘸一下,取出后与标准比色卡对照3.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是:A.甲的分子数比乙的分子数多B.甲的物质的量比乙的物质的量少C.甲的摩尔体积比乙的摩尔体积小D.甲的相对分子质量比乙的相对分子质量小4.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。
当生成1 mol硝酸锌时,被还原的硝酸的物质的量为:A.2mol B.1 mol C.0.5mol D.0.25mol5.设N A为阿伏加德罗常数,下列说法正确的是:A.标准状况下,5.6L四氯化碳含有的分子数为0.25N AB.标准状况下,14g氮气含有的核外电子数为5N AC.标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为N AD.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为N A6.下列离子方程式正确的是:7.关于铅蓄电池的说法正确的是:A.在放电时,正极发生的反应是 Pb(s) +SO42—(aq)= PbSO4(s) +2e—B.在放电时,该电池的负极材料是铅板C.在充电时,电池中硫酸的浓度不断变小D.在充电时,阳极发生的反应是 PbSO4(s)+2e—= Pb(s)+ SO42—(aq)8.白磷与氧可发生如下反应:P4+5O2=P4O10。
高考高考化学试题分项解析 水溶液中的离子平衡试题

定额市鞍钢阳光实验学校专题16 水溶液中的离子平衡1.【高考海南卷】向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是()A.c(CO32−)B.c(Mg2+) C.c(H+) D.K sp(MgCO3)【答案】A考点:考查难溶电解质的溶解平衡及K sp【名师点睛】难溶电解质的溶解平衡是这几年高考的热点,掌握难溶电解质的溶解平衡及溶解平衡的应用,并运用平衡移动原理分析、解决沉淀的溶解和沉淀的转化问题,既考查了学生的知识迁移能力、动手实验的能力,又考查了学生实验探究的能力和逻辑推理能力。
本题较基础,只需把握平衡移动原理即可得到结论。
2.【高考江苏卷】下列图示与对应的叙述不相符合....的是()A.图甲表示燃料燃烧反应的能量变化B.图乙表示酶催化反应的反应速率随反应温度的变化C.图丙表示弱电解质在水中建立电离平衡的过程D.图丁表示强碱滴定强酸的滴定曲线【答案】A【考点定位】本题主要是考查化学图像分析,热化学,化学反应速率,溶液中的离子平衡等有关判断【名师点晴】掌握有关的化学反应原理,明确图像中曲线的变化趋势是解答的关键。
注意酶的催化效率与温度的关系,温度太高或太低都不利于酶的催化。
注意电离平衡也是一种动态平衡,当溶液的温度、浓度以及离子浓度改变时,电离平衡都会发生移动,符合勒·夏特列原理。
3.【高考上海卷】能证明乙酸是弱酸的实验事实是()A.CH3COOH溶液与Zn反应放出H2B.0.1mol/L CH3COONa溶液的pH大于7C.CH3COOH溶液与NaCO3反应生成CO2D.0.1 mol/L CH3COOH溶液可使紫色石蕊变红【答案】B【解析】试题分析:A.只能证明乙酸具有酸性,不能证明其酸性强弱,错误;B.该盐水溶液显碱性,由于NaOH是强碱,故可以证明乙酸是弱酸,正确;C.可以证明乙酸的酸性比碳酸强,但是不能证明其酸性强弱,错误;D.可以证明乙酸具有酸性,但是不能证明其酸性强弱,错误。
海南省化学高考试卷及解答参考(2024年)

2024年海南省化学高考自测试卷及解答参考一、单项选择题(本大题有16小题,每小题3分,共48分)1、下列关于化学基本概念的说法正确的是:A、元素是具有相同核电荷数的一类原子的总称,化合物是由不同元素组成的纯净物。
B、同位素是指质子数相同、中子数不同的原子。
C、同素异形体是指由同一种元素组成的,具有不同物理性质和化学性质的单质。
D、氧化还原反应是指电子的转移过程,其中氧化剂接受电子,还原剂失去电子。
答案:C解析:选项A中,化合物是由不同元素组成的纯净物,元素是由具有相同核电荷数的原子组成的物质。
选项B中,同位素是指质子数相同、中子数不同的原子。
选项D 中,氧化还原反应中氧化剂失去电子,还原剂接受电子。
而选项C正确地描述了同素异形体的概念。
2、在一定条件下,反应(A(g)+B(g)→C(g))达到平衡状态。
若增大体系的压强,下列叙述正确的是:A. 若A和B的计量数之和大于C的计量数,则平衡向正反应方向移动。
B. 若A和B的计量数之和小于C的计量数,则平衡向逆反应方向移动。
C. 增大压强对平衡没有影响。
D. 平衡一定向正反应方向移动。
答案:A解析:根据勒夏特列原理(Le Chatelier’s Principle),当一个平衡系统受到外界改变时,系统会自动调整以抵消这种改变。
对于气体反应来说,增加系统的总压强会导致体积减小,从而增加单位体积内的粒子浓度。
如果反应物A和B的总摩尔数大于产物C的摩尔数,那么增加压强会使平衡向着体积减少的方向移动,即向正反应方向移动,以减少粒子数量并降低压强的影响。
因此选项A正确。
选项B描述的情况会导致平衡向体积增大的方向移动,即逆反应方向;选项C忽略了压强对气体反应平衡的影响;选项D则未考虑反应前后气体摩尔数的变化情况。
3、下列物质中,不属于纯净物的是:A、蒸馏水B、氯化钠晶体C、空气D、二氧化碳答案:C解析:纯净物是由单一物质组成的,具有固定的化学组成和性质。
蒸馏水(A)是纯净的水,氯化钠晶体(B)是纯净的食盐,二氧化碳(D)是纯净的气体。
2013年高考真题——化学(海南卷)解析版

2013年海南省高考化学科试题答案及解析(word版)可能用到的相对原子质量:H1 C12 O16K39 Fe56 Cu64 Ag108 Ba137 Pb207第I卷一、选择题:本题共6小题。
每小题2分,共12分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列有机化合物中沸点最高的是A.乙烷B.乙烯C.乙醇D.乙酸[答案]D[解析]:四项中,C、D两项为液态,沸点明显要高,但学生只注意了乙醇的氢键,易失误。
2.下列化合物的俗称与化学式不对应的是A.绿矾-FeSO4·7H2O B.芒硝-Na2SO4·10H2OC.明矾- Al2(SO4)3·12H2O D.胆矾- CuSO4·5H2O[答案]C[解析]:对常见物质俗称识记。
3.重水(D2O)是重要的核工业原料,下列说法错误的是A.氘(D)原子核外有1个电子B.1H与D互称同位素C.H2O与D2O互称同素异形体D.1H18O与D216O的相对分子质量相同[答案]C[解析]:同位素是同种元素不同种原子间互称。
4.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+ Mg = Mg2++ 2Ag +2Cl-。
有关该电池的说法正确的是A.Mg为电池的正极B.负极反应为AgCl+e-=Ag+Cl-C.不能被KCl 溶液激活D.可用于海上应急照明供电[答案]D[解析]:根据氧化还原判断,Mg为还原剂是负极、失电子,所以A、B都错,C是指电解质溶液可用KCl 溶液代替。
5.已知下列反应的热化学方程式:6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H12 H2(g)+ O2(g)= 2H2O(g) △H2C(s)+ O2(g)=CO2(g) △H3则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为A.12△H3+5△H2-2△H1B.2△H1-5△H2-12△H3C.12△H3-5△H2-2△H1D.△H1-5△H2-12△H3[答案]A[解析]:盖斯定律常规考查。
高考化学试题答案及解析

目夺市安危阳光实验学校普通高等学校招生全国统一考试(海南卷)化学试题、答案与解析可能用到的相对原子质量:H 1 C 12 N14 O 16 F 19 Mg 24 C1 35.5 Ca 40 Fe 56 Ag l08 Pb 207第I卷一、选择题:本题共12小题,每小题3分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.将等体积的苯、汽油和水在试管中充分混合后静置。
下列图示现象正确的是4.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:物质X Y Z初始浓度/mol·L-10.1 0.2 0平衡浓度/mol·L-10.05 0.05 0.1下列说法错误的是A.反应达到平衡时,X的转化率为50%B.反应可表示为X+3Y2Z,其平衡常数为1600C.增大压强使平衡向生成Z的方向移动,平衡常数增大D.改变温度可以改变此反应的平衡常数6.已知室温时,0.1mo1/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是A.该溶液的pH=4 B.升高温度,溶液的pH增大C.此酸的电离平衡常数约为1×10-7D.由HA电离出的c(H+)约为水电离出的c(H+)的10-6倍8.下列叙述正确的是(用N A代表阿伏加德罗常数的值)A.2.4g金属镁变为镁离子时失去的电子数为0.1N AB.1molHCI气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等C.在状况下,22.4LCH4与18gH2O所含有的电子数均为10 N AD.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等10.门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。
根据元素周期律,下列有关X性质的描述中错误的是A.X单质不易与水反应 B.XO2可被碳或氢还原为XC.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高第Ⅱ卷本卷包括必考题和选考题两部分。
2007年高考化学真题12套(附答案)

目录07年高考 (2)山东卷 (2)全国新课标卷 (6)全国卷Ⅰ (9)全国卷Ⅱ (12)北京卷 (16)天津卷 (21)江苏卷 (26)上海卷 (34)四川卷 (44)重庆卷 (50)广东卷 (56)海南卷 (67)07—13年全国各地高考真题收集07年高考山东卷9、下列叙述正确的是A.目前加碘食盐中主要添加的KIO3 B.日常生活中无水乙醇常用于杀菌消毒C.绿色食品是不含任何化学物质的食品D.在空气质量日报中CO2含量高于空气污染指数10.物质的量浓度相同时,下列既能与NaOH溶液反应、又能跟盐酸反应的溶液中,pH 最大的是A.Na2CO3溶液B.NH4HCO3溶液C.NaHCO3溶液D.NaHSO4溶液11、下列说法正确的是A.乙烯的结构简式可以表示为CH2CH2 B.苯、乙醇和乙酸都能发生取代反应C.油脂都不能使溴的四氯化碳溶液褪色D.液化石油气和天然气的主要成分都是甲烷12、下列叙述正确的是A.168O2和188O2互为同位素,性质相似B.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe3+可以大量共存C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同D.石墨△H>0,所以石墨比金刚石稳定13、下列关于元素的叙述正确的是A.金属元素与非金属元素能形成共键化合物B.只有在原子中,质子数才与核外电子数相等C.目前使用的元素周期表中,最长的周期含有36种元素D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或814、氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是A.再通入少量氯气,c(H+)/c(ClO-)减小B.通入少量SO2,溶液漂白性增强C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-)D.加入少量水,水的电离平衡向正反应方向移动15、一定体积的KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。
2007年高考化学(海南)试题及详细解析

2007年普通高等学校招生全国统一考试(海南卷)化学注意事项:1.本试卷第I卷(选择题)和第II卷(非选择题)两部分,答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答第I卷时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其它答案标号。
写在本试卷上无效。
3.回答第II卷时,将答案写在答题卡上。
写在本试卷无效。
4.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5第I卷一、选择题:本题共12小题,每小题3分,在每小题给出的四个选项中,只有一个选项符合题目要求的。
1.(2007海南新课标,01)下列物质中,不含有硅酸盐的是[ ]A.水玻璃B.硅芯片C.黏土D.普通水泥2.(2007海南新课标,02)下列原子序数所对应的元素组中,两者可形成离子键的是[ ]A.1和17 B.12和9 C.14和6 D.15和83.(2007海南新课标,03)下列叙述正确的是[ ]A.95℃纯水的pH<7,说明加热可导致水呈酸性B.pH=3的醋酸溶液,稀释至10倍后pH=4C.0.2mol/L的盐酸,与等体积水混合后pH=1D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液等体积混合后pH=74.(2007海南新课标,04)下列叙述正确的是[ ]A.一定温度、压强下,气体体积由其分子的大小决定B.一定温度、压强下,气体体积由其物质的量的多少决定C.气体摩尔体积是指1mol任何气体所占的体积为22.4LD.不同的气体,若体积不等,则它们所含的分子数一定不等5.(2007海南新课标,05)下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是[ ]6.(2007海南新课标,06)已知:(1)Zn(s)+1/2O2(g)==ZnO(s);ΔH=-348.3kJ/mol(2) 2Ag(s)+1/2 O2(g)== Ag2O(s);ΔH=-31.0kJ/mol则Zn(s)+ Ag2O(s)== ZnO(s)+ 2Ag(s)的ΔH等于[ ]A.-317.3kJ/mol B.-379.3kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol 7.(2007海南新课标,07)下列实验现象的描述错误的是[ ]A.氢气在氯气中燃烧生成绿色烟雾B.红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒C.点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰D.钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体8.(2007海南新课标,08)下列溶液能与镁反应生成氢气的是[ ]A.氯化铵溶液B.氢氧化钠溶液C.碳酸钾溶液D.饱和石灰水9.(2007海南新课标,09)由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2007年高考化学试题(海南卷)本试卷满分100分,考试时间90分钟可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Cl 35.5第I卷一、选择题:本题共12小题,每小题3分,共36分。
在每小题给出的四个选项中,只有一个选项符合题目要求。
1.下列物质中,不含有硅酸盐的是( )(A)水玻璃(B)硅芯片(C)黏土(D)普通水泥[答案]B。
2.下列原子序数所对应的元素组中,两者可形成离子键的是( )(A)1和17 (B)12和9 (C)14和6 (D)15和8[答案]B。
3.下列叙述正确的是( )(A)95 ℃纯水的pH<7,说明加热可导致水呈酸性(B)pH = 3的醋酸溶液,稀释至10倍后pH = 4(C)0.2 mol·L-1的盐酸,与等体积水混合后pH = 1(D)pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7[答案]C。
4.下列叙述正确的是( )(A)一定温度、压强下,气体体积由其分子的大小决定(B)一定温度、压强下,气体体积由其物质的量的多少决定(C)气体摩尔体积是指1 mol任何气体所占的体积为22.4 L(D)不同的气体,若体积不等,则它们所含的分子数一定不等[答案]B。
5.下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( ) (A)CH3CH2CH2CH3(B)CH3CH(CH3)2(C)CH3C(CH3)3(D)(CH3)2CHCH2CH3[答案]C。
6.已知:(1)Zn(s)+1/2O2(g) = ZnO(s);△H=-348.3 kJ/mol(2)2Ag(s)+1/2O2(g) = Ag2O(s);△H =-31.0 kJ/mol则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H 等于( )(A)-317.3 kJ/mol (B)-379.3 kJ/mol(C)-332.8 kJ/mol (D)317.3 kJ/mol[答案]A。
7.下列实验现象的描述错误的是( )(A)氢气在氯气中燃烧生成绿色烟雾(B)红热的铁丝在氧气中燃烧,火星四射,生成黑色固体颗粒(C)点燃的硫在氧气中剧烈燃烧,发出蓝紫色火焰(D)钠在空气中燃烧,发出黄色的火焰,生成淡黄色固体[答案]A。
8.下列溶液能与镁反应生成氢气的是( )(A)氯化铵溶液(B)氢氧化钠溶液 (C)碳酸钾溶液 (D)饱和石灰水[答案]A。
9.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。
其先后顺序正确的是( )(A)②④⑤③① (B)③②④①⑤ (C)③④②⑤① (D)②④③⑤①[答案]D。
10.能正确表示下列反应的离子方程式是( )(A)碳酸氢钙溶液和氢氧化钠溶液混合:HCO3-+OH-= CO32-+H2O(B)醋酸钠溶液和盐酸混合:CH3COONa+H+= CH3COOH+Na+(C)少量金属钠放入冷水中:Na+2H2O = Na++2OH-+H2↑(D)硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO42-+Ba2++2OH-= Cu(OH)2↓+BaSO4↓[答案]D。
11.在pH = 1时,可大量共存且形成无色溶液的一组离子或分子是( )(A)Ca2+、CH3COOH、Br-、Na+(B)NO3-、Fe3+、Mg2+、SO42-(C)HClO、Ba2+、Na+、Cl-(D)K+、Cl-、Al3+、SO32-[答案]A。
12.有BaCl2和NaCl的混合溶液a L,将它均分成两份。
一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。
反应中消耗x mol H2SO4、y mol AgNO3。
据此得知原混合溶液中的c(Na+)/mol·L-1为( )(A)(y-2x)/a(B)(y-x)/a(C)(2y-2x)/a(D)(2y-4x)/a[答案]D。
第II卷本卷包括必考题和选考题两部分。
第13题~第17题为必考题,每个试题考生都必须做答。
第18题~第29题为选考题,考生根据要求做答。
13.(10分)下表为元素周期表的一部分,请回答有关问题:IAIIAIIIAIVAVAVIAVIIA2①②3③④⑤⑥⑦⑧4 ⑨(1)⑤和⑧的元素符号是______和_______;(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号)(3)表中能形成两性氢氧化物的元素是_______,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的化学方程式:_________________________________,____________________(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:________________________________________ __[答案](1)Si;Ar。
(2)K;F。
(3)Al;2Al(OH)3+3H2SO4= Al2(SO4)3+6H2O;Al(OH)3+KOH = KAlO2+2H2O。
(4)在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强。
14.(9分)依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:(1)电极X的材料是________;电解质溶液Y是___________;(2)银电极为电池的________极,发生的电极反应为______________________________;X电极上发生的电极反应为____________________________;(3)外电路中的电子是从_______电极流向________电极。
[答案](1)铜(或Cu);AgNO3溶液。
(2)正, Ag++e- = Ag; Cu-2e- = Cu2+。
(3)负(Cu);正(A g)。
15.(10分)通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;(2)X与金属钠反应放出氢气,反应的化学方程式是_____________________________________(有机物用结构简式表达);(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是_________________;(4)X与高锰酸钾酸性溶液反应可生成Z。
在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184 g X和120 g Z反应能生成106 g W,计算该反应的产率。
(要求写出计算过程)[答案](1)C2H6O。
(2)2CH3CH2OH+2Na2CH3CH2ONa+H2↑。
(3)CH3CHO。
(4)生成的有香味的W就为酯,即:Z为CH3COOH,W为CH3COOC2H5,所以有下列反应。
用十字交叉法可确定CH3CH2OH过量。
设该反应的产率为α,所以有:CH3CH2OH+CH3COOH CH3COOC2H5+H2O= 解得α = 60.2%答:略。
16.(6分)PCl5的热分解反应为:PCl5(g)PCl3(g)+Cl2(g)(1)写出反应的平衡常数表达式:(2)已知某温度下,在容积为10.0 L的密闭容器中充入2.00 mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150 mol/L。
计算该温度下的平衡常数。
[答案](1)K =。
(2)K = 0.45。
17.(9分)下表是稀硫酸与某金属反应的实验数据:实验序号金属质量/g金属状态c(H2SO4)/mol·L-1V(H2SO4)/mL溶液温度/℃金属消失的时间/s反应前反应后1 0.10 丝0.5 50 20 34 5002 0.10 粉末0.5 50 20 35 503 0.10 丝0.7 50 20 36 2504 0.10 丝0.8 50 20 35 200 5 0.10 粉末50 20 36 25 6 0.10 丝1.0 50 20 35 125 7 0.10 丝1.0 50 3550 8 0.10 丝1.1 50 20 34 100 9 0.10 丝1.1 50 30 44 40分析上述数据,回答下列问题:(1)实验4和5表明,________________________ 对反应速率有影响,________________反应速率越快,能表明同一规律的实验还有_________(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有__________________________(填实验序号);(3)本实验中影响反应速率的其他因素还有_____________________,其实验序号是___________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:_________________ _______________[答案](1)固体反应物的表面积;表面积越大; 1和2(或4和5)。
(2)1、3、4、6、8;或2和5。
(3)反应温度; 6和7,8和9。
(4)可能是硫酸过量,金属全反应,放出的热量相等,所以使等体积溶液的温度升高值相近。
以下是选考题,其中第18、19、20、21题为《有机化学基础》模块题,第22、23、24、25题为《物质结构与性质》模块题,第26、27、28、29题为《化学与技术》模块题。
考生只能从三个模块中任选一个模块作答,不得跨模块答题,否则只能以所答的第一个模块计分。
《有机化学基础》模块18~20为选择题,每小题只有一个正确选项,每小题3分。
18.下列分子中,所有原子都处在同一平面的是( )(A)环已烯 (B)丙炔 (C)乙烷 (D)苯[答案]D。
19.分子式为C5H10的烯烃共有(要考虑顺反异构体)( )(A)5种 (B)6种 (C)7种 (D)8种[答案]B。
20.从甜橙的芳香油中可分离得到如下结构的化合物:现在试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2,能与该化合物中所有官能团都发生反应的试剂有( )(A)①②(B)②③(C)③④(D)①④[答案]A。
21.(11分)根据图示回答下列问题:(1)写出A、E、G的结构简式:A__________________E____________________G_________________;(2)反应②的化学方程式(包括反应条件)是_______________________________________________,反应④化学方程式(包括反应条件)是___________________________________________________;(3)写出①、⑤的反应类型:①________________、⑤__________________。
