分子的立体结构第二章第二节配位化合物
高中化学 选修三 第二章 第二节 配合物理论

(2) 配合物的组成
(配离子或内界)
Cu(H2O)4
SO4
配 位 数 外界
中 配配 位 心 体原 子 读作:硫酸四水合铜离 子
(3)配合物的命名 1 内界命名: 配体数--配体名称—“合”字— —中心离子名称—中心离子化合价(利用化合 价代数和原理计算,用带圆括号的罗马数字 表示)。
[Co(NH3)5(H2O)]3+ 一水五氨合钴(Ⅲ) 离子
[Cu(H2O)4]2+
Cu2+与H2O是如何结合的呢?
H2O
H+
提供孤电子对
提供空轨道接 受孤对电子
H2O Cu2+
H O H
H
配位键
H2O H2O Cu OH2 H2O
2+
2、配合物 (1) 定义 通常把接受孤电子对的金属离子
(或原子)与某些提供孤电子对的 分子或离子以配位键结合形成的化 合物称为配位化合物,简称配合物
1、配位键
(1)定义 提供孤电子对的原子与接受孤电 子对的原子之间形成的共价键, 注意: 配位键与共价键性质完全相同 (2)配位键的形成条件 一方提供孤电子对(配位体)
一方提供空轨道
常见的配位体 H2O NH3 X- CO CN SCN-
(3)配位键的表示方法
A B
电子对给予体 —电子对接受体” H O H H
天蓝色 溶液
H 2O H 2O Cu OH2 H 2O
蓝色 沉淀
2+
深蓝色 溶液
H 3N
+乙醇 静置 2+
深蓝色 晶体
[Cu(NH3) 4 ] SO4•H2O
Cu(OH)2
NH3 Cu NH3 NH3
化学选修3第二章第二节分子的立体构型
3个sp2杂化轨 4个sp3杂化轨 道 道
1200 1090 28’
1800
空 间 构 型
实 例
直 线形
平面三角形
四面体形 CH4 , H2O
BeCl2 CO2 C2H2 BF3 , C2H4
杂化轨道只用于形成σ键或者用来容纳孤对电子,剩 余的p轨道可以形成π键
1、氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是 因为( C ) A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化, 而CH4是sp3杂化 B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形 成4个杂化轨道 C.NH3分子中有未成键的孤电子对,它对成键电子的排斥 作用较强 D.氨气分子中氮原子电负性强于甲烷分子中的碳原子 2、用价层电子对互斥理论预测H2S和BF3的立体结构,两个 结论都正确的是( D )
sp2杂化轨道的形成过程
120° z z z z
y x x
y x
y x
y
sp2杂化轨道由1个s轨道和2个p轨道杂化而得到三个sp2杂化轨道。 三个杂化轨道在空间分布是在同一平面上,互成120º 例如:C2H4
C2H4(sp2杂化)
sp杂化轨道的形成过程
z
z
180°
z
z
y x x
y x
y x
y
sp杂化轨道由1个s轨道和1个p轨道杂化而得到两个sp杂化轨道。 两个杂化轨道在空间分布呈直线型,互成180º 例如:C2H2
4、下列分子或离子中,不含有孤对电子的是( D ) A、H2O B、H3O+ C、NH3 D、NH4+
5、以下分子或离子的结构为正四面体,且键角为 109°28′ 的是( B ) ①CH4 ②NH4+ ③CH3Cl ④P4 ⑤SO42A、①②③ B、①②④ C、①②⑤ D、①④⑤
第二章-配位化合物

D M A C B
D M A B C
DD MM AA D M A C B BC CB
镜面
D C B M A
固定一个配体(D)后 在空间不能 另三个配体具有相反的 完全重合 螺旋(顺反时针)的排列
互为镜像的关系
4个配体不同的四面体配合物具有手性
六配位络合物[M(A2B2C2)]的异构现象复杂
C B A M C A B B A M B C A C A B M A C B C A C M A B C B A A M B C C B
配离子的定义
配离子:由金属原子与中性分子或者阴离 子结合形成的复杂离子叫做配离 子(络离子)。 中心原子:其中的金属原子是配离子形成 体或中心原子, 配体:其中的H2O、NH3、Cl-等叫做配体。
我们把像[Cu(H2O)4]2+、[Cu(NH3)4]2+、 [CuCl4]2-这样的复杂离子叫做配离子。
。
4-3 配合物的价键理论
价键理论认为,配位键的形成是配位原子的孤对电子进 入中心原子的空轨道,并杂化成一种规则的多面体。
3d 4s
Ni [Ar] Ni [Ar] ..
N 2+
氮原子的孤对电子 进入镍离子的 一个4s轨道 3个4p轨道 .. .. .. 形成sp 3 杂化轨道 N N N
H3N NH3 Ni H3N NH3
五氯化-羟•二[五氨合铬(Ⅲ)]
( -表示“桥联基团” )
例:
OH / \ [(H2O)4Fe Fe (H2O)4]SO4 \ / OH
硫酸二( -羟基)•二[四水合铁(Ⅱ)]
习题:下列配合物具有正方形或八面体的几 何构型,问其中哪个CO32-离子作为螯合剂? (1) [Co(NH3)5CO3]+ (2) [Co(NH3)4CO3]+ (3) [Pt(en)CO3] (4) [Pt (en) (NH3) CO3]
分子结构与配位化合物

配位键的形成往往会导致分子结构的改变,如电子云的重新分布、 键长的变化等。
配位化合物的稳定性
配位键的稳定性与分子结构密切相关,通常来说,共价键越稳定, 配位键也越稳定。
配位化合物的稳定性与分子结构的关系
配位化合物的稳定性
配位化合物的稳定性取决于配位键的强弱和配位体的数目。
分子结构的因素
离子键
正离子和负离子之间的吸引力, 如食盐(NaCl)。
金属键
金属原子之间通过自由电子形 成的化学键,如金属单质。
分子间作用力
分子之间的弱相互作用力,包 括范德华力和氢键。
02 配位化合物介绍
配位化合物的定义
配位化合物是由金属或类金属元素与 配位体通过配位键结合形成的化合物 。
配位键是一种特殊的共价键,由一方 提供空轨道,另一方提供孤对电子形 成。
化学反应控制
通过配位化合物的稳定性和反应性, 可以控制化学反应的速率和选择性。
在生物医学中的应用
药物研发
许多药物分子中含有配位基团,如抗 生素、抗癌药物和重金属解毒剂等。
生物成像
生物传感器
配位化合物可以作为生物传感器,用 于检测生物体内的金属离子和有害物 质。
配合物可用于生物成像技术,如荧光 探针和磁共振成像剂。
分子结构的分类
01
02
03
单质分子
由同种元素组成的分子, 如氧气(O2)和金属单质。
化合物分子
由不同元素组成的分子, 如水(H2O)和盐类。
配位化合物
是一种特殊的化合物,其 中一种或多种中心原子或 离子被其他原子或离子通 过配位键所包围。
分子结构的键合方式
共价键
原子之间通过共享电子形成的 化学键,如碳氢化合物。
学案第二章第二节分子立体结构

第二节分子的立体结构(学案)【学习目标】1、熟悉共价分子的多样性和复杂性;2、初步熟悉价层电子对互斥模型;3、能用VSEPR模型预测简单分子或离子的立体结构;理解价层电子对互斥模型和分子空间构型间的关系。
4、熟悉杂化轨道理论的要点5、进一步了解有机化合物中碳的成键特征6、能按照杂化轨道理论判断简单分子或离子的构型7、进一步增强分析、归纳、综合的能力和空间想象能力【重点知识】:分子的立体结构;利用价层电子对互斥模型、杂化轨道理论模型预测分子的立体结构。
【回顾思考】1 举例说明什么叫化学式?2 举例说明什么叫结构式?3 举例说明什么是结构简式?4 举例说明什么是电子式?5 举例说明什么价电子?(第一课时)一、形形色色的分子【阅读讲义】认真阅读讲义35到37页“二、价层电子对互斥理论”处。
在阅读进程中勾出你以为重要的句子、词语、规律等,如发现新问题请写在讲义中相应地方。
认真读图2-8、2-9、2-10、2-11、2-12和36页的知识卡片等去熟悉分子的多样性,自己动手制作几种分子的模型体验分子的空间构型。
然后思考下列问题。
【阅读思考1】完成下表1、原子数相同的分子,它们的空间结构相同吗?2、请你利用身旁的易患材料参照讲义35、36页内容制作CO2、H2O、NH3、CH2O、CH4分子的球辊模型(或比例模型);并用书面用语描述它们的分子构型。
3、你如何理解分子的空间结构?4、写出CO2、H2O、NH3、CH2O、CH4的电子式;5、观察上述分子的电子式,分析H、C、N、O原子别离可以形成几个共价键,你知道原因吗?6、如何计算分子中中心原子的价层电子对?(成σ键电子对、未成键电子对)二、价层电子对互斥理论【阅读讲义】认真阅读讲义37到39页“三、杂化轨道理论简介”处。
在阅读进程中勾出你以为重要的句子、词语、规律等,如发现新问题请写在讲义中相应地方。
认真读图2-15、表2-4、2-5,对比价层电子对互斥模型和分子构型。
第二章第二节第2课时 杂化轨道理论简介 配合物理论简介

第2课时杂化轨道理论简介配合物理论简介1.知道杂化轨道理论的基本内容,能根据杂化轨道理论确定简单分子的立体构型。
2.能正确叙述配位键的概念及其形成条件,会分析配位化合物的形成及应用。
3.熟知几种常见的配离子:[Cu(H2O)4]2+、[Cu(NH3)4]2+、[Fe(SCN)n](3-n)+、[Ag(NH3)2]+等的颜色及性质。
杂化轨道理论简介[学生用书P24]1.用杂化轨道理论解释甲烷分子的形成在形成CH4分子时,碳原子的一个2s轨道和三个2p轨道发生混杂,形成四个能量相等的sp3杂化轨道。
四个sp3杂化轨道分别与四个H原子的1s轨道重叠成键形成CH4分子,所以四个C—H键是等同的。
可表示为2.杂化轨道的类型与分子构型的关系(1)sp杂化sp杂化轨道是由一个s轨道和一个p轨道杂化而得,杂化轨道间的夹角为180°,呈直线形,如BeCl2分子。
(2)sp2杂化sp2杂化轨道是由一个s轨道和两个p轨道杂化而得,杂化轨道间的夹角为120°,呈平面三角形,如BF3分子。
(3)sp3杂化sp3杂化轨道是由一个s轨道和三个p轨道杂化而得,杂化轨道间的夹角为109°28′,立体构型为正四面体形,如CH4分子。
(1)在形成多原子分子时,中心原子价电子层上的某些能量相近的原子轨道发生混杂,重新组合成一组新的轨道的过程,叫做轨道的杂化。
双原子分子中,不存在杂化过程。
(2)只有能量相近的轨道才能杂化(n s,n p)。
(3)杂化过程中,原子轨道总数不变,即杂化轨道的数目与参与杂化的原子轨道数目相等。
(4)杂化过程中,轨道的形状发生变化。
(5)杂化轨道的形状相同,能量相等。
(6)杂化轨道之间要满足最小排斥原理。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)杂化轨道与参与杂化的原子轨道的数目相同,但能量不同。
()(2)杂化轨道间的夹角与分子内的键角不一定相同。
()(3)凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体形。
2 配位化合物的立体结构

起的配合物空间构型的变化情况。
2-1 配位数与配合物的结构
一、低配位配合物
1、配位数为1的配合物
配位数为1的配合物数量很少。直至最近才得到2个含一个单齿配体的配 合物,2,4,6-triphenylphenylcopper和2,4,6-triphenylphenylsilver。这事实上是一 个有机金属化合物,中心原子与一个大体积单齿配体键合。
常见的配体主要是F-、O2-、CN-、NO3-、NCS-、H2O等。
八配位的几何构型有五种基本方式:
四方反棱柱体 十二面体
立方体
双帽三角棱柱体 六角双锥
其中最常的是四方反棱柱体和十二面体。
四方反棱柱 D4d
12面体 D2d
例: Na3Mo(CN)8 · 2O中 Mo(CN)83– 为四方反棱柱 D4d 8H
Cu(Me3PS)3]Cl 中的Cu也是3配 位的。
在所有3配位的情况下, 金属原子 与三个直接配位的配位原子都是共平 面的, 平面三角形的结构。
◆并非化学式为MX3都是三配位的。如, CrCl3为层状 结构, 是六配位的;而CuCl3是链状的, 为四配位, 其中 含有氯桥键,u2Cl6等。
P P Ni Cl P Cl 红色、反磁性 P 蓝色、顺磁性 Ni Cl
Cl
(2)顺反异构(cis-trans isomerism)
在配合物中, 配体可以占据中心原子周围的不同位置。所研
究的配体如果处于相邻的位置, 即称为顺式结构, 如果配体处于
相对的位置, 则称为反式结构。由于配体所处顺、反位置不同而 造成的异构现象称为顺-反异构。顺反异构体的合成曾是Werner 确立配位理论的重要实验根据之一。 配位数为2的配合物, 配体只有相对的位置, 没有顺式结构; 配位数为3和配位数为4的四面体, 所有的配位位置都是相邻的 , 因而不存在反式异构体。 平面四边形和八面体配合物中, 顺-反异构是很常见的。
分子的立体构型
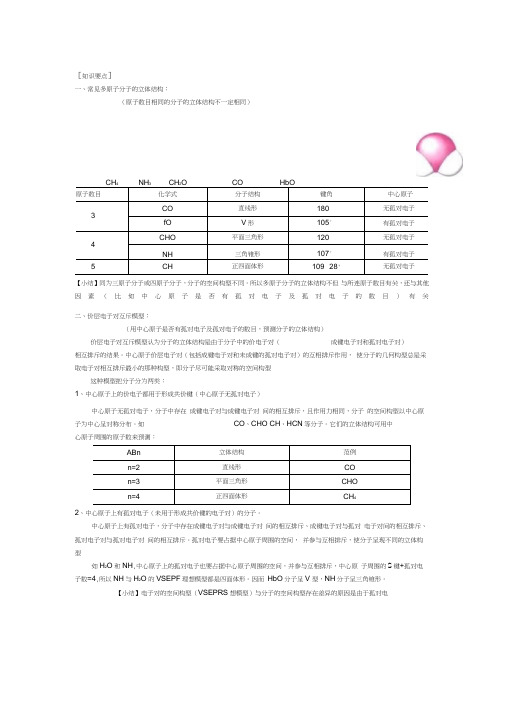
[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)CH4 NH3 CH2O CO HbO原子数目化学式分子结构键角中心原子3CO直线形180°无孤对电子fO V形105°有孤对电子4CHO平面三角形120°无孤对电子NH三角锥形107°有孤对电子5CH正四面体形109° 28' 无孤对电子【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用,使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在成键电子对与成键电子对间的相互排斥,且作用力相同,分子的空间构型以中心原子为中心呈对称分布。
如CO、CHO CH、HCN等分子。
它们的立体结构可用中心原子周围的原子数来预测:ABn立体结构范例n=2直线形COn=3平面三角形CHOn=4正四面体形CH42、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对间的相互排斥、成键电子对与孤对电子对间的相互排斥、孤对电子对与孤对电子对间的相互排斥。
孤对电子要占据中心原子周围的空间,并参与互相排斥,使分子呈现不同的立体构型如H2O和NH,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原子周围的S键+孤对电子数=4,所以NH与H2O的VSEPF理想模型都是四面体形。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
江苏省郑梁梅高级中学高三化学一轮复习学案
主备人:徐礼祥做题人:朱延龙审核人:马春红
课标要求
基础知识整理
一、配位键与配合物
1.孤电子对:分子或离子中,是孤电子对。
2.配位键:
在共价键中,若电子对是由一个原子提供,而跟另一个原子共用,这样的共价键叫做配位键,具有方向性和饱和性。
成键条件:一方有,另一方有
3.配合物
(1)定义
由与的中心原子(或离子)以形成的化合物称配合物,又称络合物。
(2)形成条件
①中心原子(或离子)必须存在。
②配位体具有提供的原子。
4.配合物的组成
(1)内界:一般加[ ]表示。
①中心原子(或离子)——提供空轨道,接受孤电子对的原子(或离子)。
②配位体——指配合物中与中心原子结合的离子或分子。
配位原子:指配位体中含孤电子对,与中心原子直接相连的原子,主要是非金属元素C、N、O、S、卤素等原子。
③配位数——直接与中心原子相连的配位原子个数。
(2)外界:除内界以外的部分。
特例:Fe(C0)5无外界
例2:在[Cu(NH3)4]2+配离子中NH3与中心离子Cu2+结合的化学键是
A.离子键B.非极性键C.极性键D.配位键
课堂练习:
1.铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有()
A.离子键和共价键
B.离子键和配位键
C.配位键和共价键
D.离子键
2.下列属于配合物的是()
A.NH4Cl
B.Na2CO3.10H2O
C.CuSO4
D.Co(NH3)6Cl3
3.对于配合物中位于中心位置的中心形成体的正确说法是()
A.一般是金属阳离子
B.一般是金属阳离子,中性原子,也可以是非金属阳离子或阴离子
C.只能是金属阳离子
D.以上几种说法都对
4.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是()
①H2O ②NH3③F—④CN—⑤CO
A.①②
B.①②③
C.①②④
D.①②③④⑤
5.配合物在许多方面有着广泛的应用。
下列叙述不正确的是()
A.以Mg2+为中心的大环配合物叶绿素能催化光合作用
B.Fe2+的卟啉配合物是输送O2的血红素
C.[Ag(NH3)2]+是化学镀银的有效成分
D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+
6.下列微粒:①H3O+②NH4+③CH3COO-④ NH3⑤CH4中含有配位键的是()
A.①②
B.①③
C.④⑤
D.②④
7.关于配位键的形成,下列说法正确的是()
A.提供电子对的原子一般要有孤对电子
B.接受电子对的原子一般要有空轨道
C.任意两个原子间都可以形成配位键
D.配位键一般是单键,和普通单键性质不同
三、课堂小结:
四、教学后记:
江苏省郑梁梅高级中学高三化学作业
班级姓名学号日期等第
1.由配位键形成的离子[Pt(NH3)6]2+和[PtCl4]2—中,两个中心离子铂的化合价是()A.都是+8 B.都是+6 C.都是+4 D.都是+2
2.在[Co(NH3)6]3+中,与中心离子形成形成配位键的原子是()A.N原子 B.H原子 C.Co原子 D.N、H两种原子同时
3.与人体血液中血红蛋白以配位键结合的一种有毒气体是()A.氯气 B.氮气 C.一氧化碳 D.甲烷
4.在NH4+离子中存在4个N-H共价键,则下列说法正确的是()A.四个共价键的键长完全相同
B.四个共价键的键长完全不同
C.原来的三个N-H的键长完全相同,但与由配位键形成的N-H键不同。
D.四个N-H键键长相同,但键能不同
5.已知NH3分子可与Cu2+形成配位化合物离子[Cu(NH3)4]2+,则除去硫酸铜溶液中少量硫酸可选用的试剂是()
A.NaOH B.NH3 C.BaCl2 D.Cu(OH)2
6.下列化合物中既有离子键又有共价键和配位键的是()
A.KF;B.H2SO4;C.CuCl2;D.NH4NO3
7.在CuCl2溶液中存在如下平衡:下列说法中不正确的是()
[CuCl4]2-+4H2O===[Cu(H2O)4]2++4Cl-
绿色蓝色
A.将CuCl2固体溶于少量水中得到绿色溶液
B.将CuCl2固体溶于大量水中得到蓝色溶液
C.[CuCl4]2-和[Cu(H2O)4]2+都是配离子
D.从上述平衡可以看出[Cu(H2O)4]2+比[CuCl4]2-稳定
8.已知信息:[Cu(NH3)4]SO4的电离方程式:[Cu(NH3)4]SO4=[Cu(NH3)4]2++SO42-。
具有6个配体的Co3+的配合物CoCl m·nNH3,若1 mol此配合物与足量的AgNO3溶液反应只生成1 mol AgCl沉淀,则m, n的值分别是()
A.m=1, n=5
B.m=3, n=4
C.m=5, n=1
D.m=3, n=3
9.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液。
下列对此现象说法正确的是()
A.反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变。
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4] 2+。
C.向反应后的溶液加入乙醇,溶液将会没有发生变化,因为[Cu(NH3)4] 2+。
不会与乙醇发生反应。
D.在[[Cu(NH3)4] 2+。
离子中,Cu2+给出孤对电子,NH3提供空轨道。
10. Co2+与SCN–离子生成蓝色Co(SCN)2–离子,可利用该反应检出Co2+;若溶液也含Fe3+,为避免[Fe(NCS)n]3–n离子的红色干扰,可在溶液中加入NaF,将Fe3+掩蔽起来。
这是由于生成了()
A.难溶的FeF3;
B.难电离的FeF3;
C.难电离的[FeF6]3–;
D.难溶的Fe(SCN)F2。
11.将化学组成为CoCl3·4NH3的紫色固体配制成溶液,向其中加入足量的AgNO3溶液后,只有1/3的氯从沉淀析出。
该配合物的内界含有()
A.2个Cl–和1个NH3;
B.2个Cl–和2个NH3
C.2个Cl–和3个NH3;
D.2个Cl–和4个NH3。
12.气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示.请将
图中,你认为是配位键的斜线上加上箭头.
13.在白磷分子中,每个磷原子以________________键与另外的________个磷原子相结合成__________________空间构型,键角为________ ___。
如果把一个白磷分子的每一个P-P 都打开插入一个氧原子,则一共可结合________个氧原子,这样得到的化合物的分子式为__________,若每个磷原子再以配位键结合一个氧原子,则得到化合物的分子式为_____ __ ___。
形成的配位键中,________原子提供孤对电子,_________原子提供空轨道。
14.把CoCl2溶解于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成
[Co(NH3)6]2+.此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示.把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀.经测定,每
1molCoCl3·5NH3只生成2molAgCl.请写出表示此配合物结构的化学式:
此配合物中的Co化合价为 .
15.亚硝酸根NO2-作为配体,有两种方式。
其一是氮原子提供孤对电子与中心原子配位;另一是氧原子提供孤对电子与中心原子配位。
前者称为硝基,后者称为亚硝酸根。
[Co(NH3)5NO2]Cl2就有两种存在形式,试画出这两种形式的配离子的结构式。
