【红对勾】2014-2015学年高中化学 期中测试评估 新人教版必修1
《红对勾》2015版高一化学人教版必修1课件:2-3-1氧化还原反应

第三节
氧化还原反应
学习目标
1.了解有些化学反应中存在着化合价的变化,建立 起氧化还原反应的概念,能用化合价升降的观点理解氧化 还原反应。(重点) 2.理解氧化还原反应的实质是电子的转移。(难点) 3.了解氧化还原反应中,物质的氧化性和还原性。 (重点) 4.学会判断物质的氧化性或还原性的强弱,了解电 子转移的表示方法。(重点)
课堂探究·提能力
氧化还原反应的判据
1.利用氧化还原反应与元素化合价的关系,可以 进行有关氧化还原反应的判断,判断是否准确的关键是 正确把握化合价及其升降情况。 (1)氧化反应判断:物质所含元素化合价升高的反 应。 (2)还原反应判断:物质所含元素化合价降低的反 应。
(3)氧化还原反应的判断:反应前后元素的化合价是否发生变 化,有变化的反应为氧化还原反应,否则为非氧化还原反应。
2.氧化还原反应与四种基本反应类型的关系 (1)置换反应一定是氧化还原反应; (2)复分解反应一定不是氧化还原反应; (3)有单质参加的化合反应和有单质生成的分解反应是氧化还 原反应;没有单质参加的化合反应和没有单质生成的分解反应大 多数不是氧化还原反应。关系如图所示:
1.下列说法是否正确? (1)有单质参加的化合反应和有单质生成的分解反应一定是氧 化还原反应; (2)没有单质参加的化合反应和没有单质生成的分解反应一定 不是氧化还原反应。试举例说明。
【思路分析】
判断一个反应是否是氧化还原反应的关键是
看反应前后各元素有无价态的改变,故化合价是分析氧化还原反 应的基础。
【标准答案】
+4
CD A项,Cl2―→KCl、KClO3;
+3 +5
0
-1
+5
B项, N O2―→NaN O2、NaN O3。 以上两项的反应都有元素化合价的变化,所以是氧化还原反 应。 C项,SnCl4―→SnO2; D项,NaO H+HCl ===H2O+NaCl。 这两项都没有化合价的变化,故不是氧化还原反应。
《红对勾》高一化学人教版必修1课时作业1 化学实验基本方法 Word版含答案[ 高考]
![《红对勾》高一化学人教版必修1课时作业1 化学实验基本方法 Word版含答案[ 高考]](https://img.taocdn.com/s3/m/d82a10a4cc22bcd126ff0cee.png)
课时作业1化学实验基本方法时间:45分钟满分:100分一、选择题(每小题4分,共44分)1.进行化学实验必须注意安全,下列说法中正确的组合是()①点燃氢气前要检验氢气的纯度,以免发生爆炸②CO气体有毒,处理CO气体时可将其点燃,转化为无毒的CO2③在盛O2的集气瓶中进行铁丝燃烧实验时,事先在集气瓶底部铺上一层沙子④用氢气还原氧化铜时,先加热再通入氢气,以免浪费氢气⑤稀释浓硫酸的操作如右上图所示A.①②③④B.①②③C.①②④D.①②③④⑤解析:2.下列实验操作先后顺序正确的是()A.先装好药品,再检查装置的气密性B.先用双手握紧试管,再将导管插入水中检查装置气密性C.结束氢气还原氧化铜的实验时,先熄灭酒精灯后撤出导管D.稀释硫酸时,先在烧杯里倒入浓硫酸,再小心倒入水并不断搅拌答案:C3.做化学实验时,必须十分重视安全和环保问题。
下列操作方法不符合上述要求的是()A.制取氧气时,用排水法收集氧气出现倒吸现象,立即打开试管上的橡皮塞B.在气体发生装置上点燃氢气等气体时,必须先检验气体的纯度C.实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室D.给试管中的液体加热时,不停沿试管倾斜方向移动试管或加入碎瓷片,以免液体暴沸伤人解析:A项,产生倒吸的原因是装置内压强减小,使收集装置中水槽中的水进入制气装置,打开试管上的橡皮塞可防止倒吸的水进入制气装置中,正确。
B项,点燃可燃性气体之前,要对气体进行验纯,防止出现爆炸事故,正确。
C项,实验结束后的废液中有的含有有毒物质,不能直接倒入下水道,应倒入指定的容器中,经处理后再排放,错误。
D项,给试管中的液体加热时,不停沿试管倾斜方向移动试管可使试管内的液体受热均匀,加入碎瓷片也能防止暴沸,正确。
答案:C4.(双选题)下列实验准备工作正确的是()A.洗净后的试管,整齐地倒插在试管架上B.固体食盐盛装在细口试剂瓶内C.将酒精灯芯剪平整,并添加酒精至不超过酒精灯容积的2/3 D.将氢氧化钠溶液盛放在试剂瓶内,并用玻璃塞塞紧解析:固体试剂应放在广口瓶内,容易取出,故B不对;氢氧化钠溶液易使玻璃塞与瓶口间因生成黏性物质而不易打开,故D不对。
人教版高中化学必修一第一学期高一化学期中练习卷3含答案.docx

高中化学学习材料唐玲出品北京市西城区(南区)重点高中校2014-2015学年度第一学期高一化学期中练习卷 3 相对原子质量:H:1 N:14 C:12 O:16 Cl:35.5 Al:27 S:32 Zn:65 Cu:64 Na:23第Ⅰ卷(共40分)一、选择题:将答案填涂在机读卡上。
(每题只有1个选项符合题意,1—20每题1分,21---30每题2分,共40分)1.下列物质中,不属于电解质的是()A.NaOH B.H2SO4 C.蔗糖 D.NaCl2.下列电离方程式中,正确的是()A.Na2S04=2Na++S04-2 B.Ba(0H)2=Ba2++0H2-C.Al2(S04)3=2A13++3SO42- D.Ca(NO3)2=Ca2++2(N03)2-3.下列不存在丁达尔效应的分散系是()A.有尘埃的空气 B.氢氧化铝胶体C.CuSO4溶液 D.向沸水中滴入FeCl3饱和溶液所得液体4.已知丙酮(C3H6O)通常是无色液体,不溶于水,密度小于1g·mL-1,要从水与丙酮的混合物里将丙酮分离出来,下列方法中最合理的是()A.蒸馏 B.分液 C.过滤 D.蒸发5.下列实验操作中有错误的是()A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出。
B.蒸馏时,温度计水银球应浸没在液体中。
C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出。
D.把几滴FeCl3饱和溶液滴入250mL的沸水中制取Fe(OH)3胶体。
6.下列行为符合安全要求的是()A.进入煤矿井时,用火把照明B.节日期间,在开阔的广场燃放烟花爆竹C.用点燃的火柴在液化气钢瓶口检验是否漏气D.实验时,将水倒入浓硫酸配制稀硫酸7.在一定条件下,NO跟NH3可以发生反应:6NO+4NH3=5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是()A.3:2 B.2:1 C.1:1 D.2:38.下列溶液中的Cl-浓度与50 mL 1 mol/L MgCl2溶液中的Cl-浓度相等的是()A. 100 mL 1 mol/L NaCl溶液 B. 75 mL 1 mol/LCaCl2溶液C. 150 mL 2 mol/L CuCl2溶液 D. 75 mL 1 mol/L AlCl3溶液9.下列离子方程式,书写正确的是()A、盐酸与碳酸钡反应 CO32-+2H+==CO2↑+H2OB、硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-==BaSO4↓+Cu(OH)2↓C、硝酸银溶液中加入铜粉 Ag++Cu==Cu2++Ag↓D、铁与稀盐酸反应 2Fe+6H+==2Fe3++3H2↑10.比较1.0mol N2和1.0mol CO的下列物理量:①质量②分子总数③原子总数,其中相同的是()A.① B.①② C.①②③ D.②③11.下列化学方程式中,不能用H++OH-=H2O表示的是()A.2NaOH + H2SO4 = Na2SO4 + 2H2OB.Ba(OH)2 + 2HCl = BaCl2 + 2H2OC.Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2OD.KOH + HCl = KCl + H2O12.氧化还原反应的本质是()A. 有电子的转移B.有化合价的升降C. 得氧失氧D.有单质参与反应或生成13.现有三组实验:①除去混在植物油中的水②将海水制成淡水③用食用酒精浸泡中草药提取其中的有效成份。
人教版高中化学必修一第一学期高一化学期中测试卷1含答案.docx

高中化学学习材料北京市西城区基础薄弱高中校2014-2015学年度第一学期高一化学期中测试卷 1可能用到的原子量:H-1 C-12 O-16 N-14 S-32 P-31 Na-23 Mg-24 Cl-35.5 Ca-40 Fe-56 Cu-64试卷一选择题本部分共25道选择题(每题只有一个正确答案,1-10每题2分,11-25每题3分,共65分,请将正确答案涂在机读卡上,否则不得分)1.下列选项中属于纯净物的是()A 分散系B 稀硫酸C 天然气D 铝2. 下列物质中,不属于...电解质的是()A.NaOH B.NaCl C.H2SO4D.CO23.根据某种性质,可将CaO、CuO归为一类氧化物。
下列物质中,也属于这一类氧化物的是()A CO2B SO2C Na2OD KMnO44.下列电离方程式错误的是()A Na2CO3=2Na++CO32-B NaHSO4=Na++H++SO42-C MgCl2=Mg2++Cl2-D Ba(OH)2=Ba2++2OH-5. 离子方程式CO32- + 2H+ = H2O + CO2↑中的CO32-代表的物质可以是()A、CaCO3B、NaHCO3C、Na2CO3D、BaCO36.下列化学方程式中,不能用离子方程式 Ba2+ +SO42―====BaSO4↓表示的是( )A.Ba(NO3)2+H2SO4==BaSO4↓+2HNO3B.BaCl2+Na2SO4==BaSO4↓+2NaClC.BaCO3+H2SO4==BaSO4↓+H2O+CO2↑ D.BaCl2+H2SO4==BaSO4↓+2HCl7.下列各组离子反应可用H++OH-H2O表示的是()A.氢氧化钡和硫酸B.氢氧化铁和盐酸C.硝酸和氢氧化钠D.醋酸和氢氧化钠8.下列离子方程式,书写正确的是()A、盐酸与碳酸钡反应 CO32-+2H+==CO2↑+H2OB、硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-==BaSO4↓+Cu(OH)2↓C、硝酸银溶液中加入铜粉 Ag++Cu==Cu2++Ag↓D、铁与稀盐酸反应 2Fe+6H+==2Fe3++3H2↑9. 下列各组中的离子,能在溶液中大量共存的是()10. 下列反应中,属于氧化还原反应的是()A.CaCO3 + 2HCl = CaCl2 + CO2↑+ H2OB.CaO + H2O = Ca(OH)2C.Fe + CuSO4 = FeSO4 + CuD.CaCO3= CaO + CO2↑11.下列粒子中,只有还原性的是()A.Cl- B. Fe2+ C. Mg2+ D. H2O12. 下列反应中,氯元素被氧化的是()A.↑B.2P+5Cl2= 2PCl5C.MnO2+4HCl(浓)= MnCl2十2H2O+Cl2↑D.H2+Cl2 = 2HCl13. 下列变化需要加入还原剂才能实现的是()A.MnO4-→Mn2+B.HCl→Cl2C.Fe→Fe3+D.KClO3→O214. 下列说法正确的是()A.氧化还原反应的本质是元素化合价发生变化B.还原剂是一种能够得到电子的物质C.物质所含元素化合价升高的反应是还原反应D.氧化反应和还原反应是同时发生的Δ15.在Fe2O3+3CO=2Fe+3CO2的反应中,氧化剂是()A Fe2O3B COC FeD CO216.下列说法错误的是()A 一种分散系中可能只有一种分散质,也可能是多种分散质B 分散系中分散质粒子直径由大到小的顺序是:浊液、胶体、溶液C 丁达尔效应可以区分胶体和溶液D 可以用过滤的方法分离胶体和溶液17.用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是()A 将溶液滴入蒸馏水中就可以得到氢氧化铁胶体B 将溶液滴入热水中,生成棕黄色液体就可以得到氢氧化铁胶体C 将溶液滴入沸水中,并继续煮沸至生成红褐色沉淀就可以得到氢氧化铁胶体D 将溶液滴入沸水中,并继续煮沸至生成红褐色液体就可以得到氢氧化铁胶体18.下列五种物质中均含有氮元素,它们是按氮元素化合价由低到高的顺序排列的。
红对勾45分钟·人教版化学必修1高中化学期中测试评估
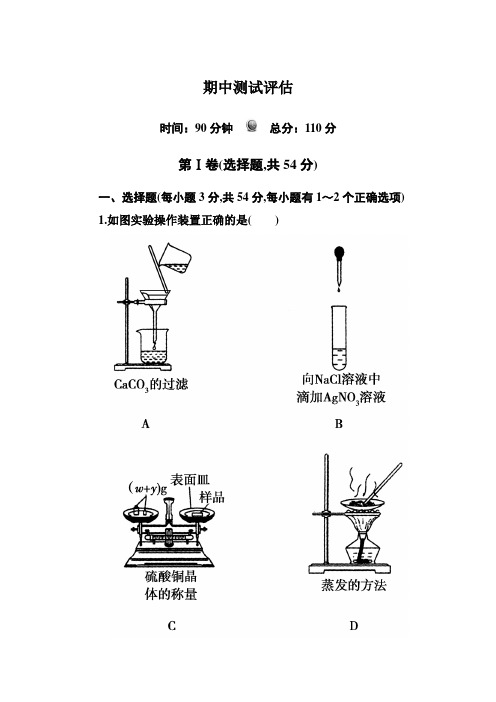
期中测试评估时间:90分钟总分:110分第Ⅰ卷(选择题,共54分)一、选择题(每小题3分,共54分,每小题有1~2个正确选项)1.如图实验操作装置正确的是()解析:A 的错误在于漏斗颈没紧靠烧杯内壁,且玻璃棒没有靠在滤纸上;C 的错误在于物品和砝码放反了位置;D 的错误在于加热蒸发皿用了石棉网。
答案:B2.为了配制100 mL1 mol·L -1的NaOH 溶液,其中有下列几个操作:①NaOH 用纸盛装进行称量;②选刚用蒸馏水洗净的100 mL 容量瓶进行配制;③NaOH 在烧杯里刚完全溶解时,即把溶液转移到容量瓶;④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度线相切,其操作错误的是( )A.①②③B.③④⑤C.②③⑤D.①③⑤解析:解析:溶液的配制分为五个步骤:溶质为固体⎩⎪⎨⎪⎧ (1)计算(2)称量(3)溶解(4)转移(洗涤)(5)定容(摇匀)溶质为液体⎩⎪⎨⎪⎧ (1)计算(2)量取(3)稀释(4)转移(洗涤)(5)定容(摇匀)步骤①中用托盘天平称量像苛性钠等易潮解或有腐蚀性的药品时,必须用干燥而洁净的烧杯或表面皿,先称出烧杯或表面皿的质量,然后再放入NaOH,称出它们的总质量,用差量法得出苛性钠的质量;步骤③中,应把冷却的稀溶液沿玻璃棒注入容量瓶(“引流”),并用少量蒸馏水洗涤烧杯2~3次。
洗涤液也一并注入容量瓶(“洗涤”);步骤⑤中,定容时,先往容量瓶中小心地加水,直到液面接近刻度线1~2 cm处,改用胶头滴管加水,使溶液凹液面恰好与刻度线相切。
答案:D3.学习和研究化学,经常要进行实验,下列关于实验安全的说法正确的是()A.用燃着的酒精灯去点燃另一只酒精灯B.做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸C.不慎把浓硫酸洒在皮肤上要立即用NaOH溶液冲洗D.盛放盐酸的试剂瓶上要贴上如右图的标志答案:B4.下列关于实验操作的叙述中正确的是()①从试剂瓶中取出的任何药品,若有剩余都不能再放回原试剂瓶②可燃性气体点燃之前必须验纯③用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中④用托盘天平称量固体药品时,应左物右码⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却⑥选用100 mL 量筒量取4.53 mL的稀硫酸A.①③④⑤B.①③④⑥C.②④⑤D.以上答案均不正确答案:C5.具有相同数目氧原子的SO2和SO3,下列关系中一定正确的是()A.n(SO2)∶n(SO3)=3∶2B.V(SO2)∶V(SO3)=3∶2C.m(SO2)∶m(SO3)=6∶5D.M r(SO2)∶M r(SO3)=5∶4解析:所含的O原子数相等,也就是所含的O的物质的量相等,则n(SO2)×2=n(SO3)×3,n(SO2)∶n(SO3)=3∶2,则m(SO2)∶m(SO3)=(3×64)∶(2×80)=6∶5;由于不知是否处于标准状况下,所以V(SO2)∶V(SO3)不确定是否为3∶2;M r(SO2)∶M r(SO3)=4∶5。
人教版高中化学必修一第一学期高一化学期中测试卷4含答案.docx

高中化学学习材料北京市西城区基础薄弱高中校2014-2015学年度第一学期高一化学期中测试卷 4A 卷〔必修模块1〕满分100分可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 S 32 Cl 35.5第一部分(选择题共56分)一、选择题(1 ~ 28小题,每小题只有一个选项......符合题意;每小题2分,共56分)1.下列仪器中,能用于直接加热的是A.烧杯B.试管 C.烧瓶 D.锥形瓶2.摩尔是A.物质的数量单位 B.物质的质量单位C.物质的量的单位 D.既是物质的数量单位又是物质的质量3.下列物质中,属于电解质的是A.CO2 B.H2 C.Na2SO4 D.Cu4.当光束通过下列分散系时,能观察到丁达尔效应的是A.蔗糖溶液 B.盐酸 C.氯化钠溶液 D.Fe (OH)3 胶体5.萃取碘水中的碘,可用的萃取剂是①四氯化碳②汽油③酒精A.只有① B.①和② C.①和③ D.①②③6.在无色透明的溶液中,能够大量共存的离子组是A.K+、MnO4—、Na+、SO32—B.Cu2+、Cl—、NO3—、OH—C.Fe2+、S2—、NO3—、CO32—D.K+、Na+、Cl—、H+7.在汽车加油站见到的油罐车上,所贴的危险品标志是剧毒品遇湿易燃物品易燃液体氧化剂 A B C D 8.如图所示,下列实验操作与方法正确的是检查容量瓶是否漏水 给液体加热 滴加液体 过滤 A B C D9.下列电离方程式错误的是A .NaOH = Na ++ OH -B .CuSO 4 = Cu 2++ SO 42-C .H 2SO 4 = 2H ++ SO 42-D .HNO 3 = H ++ N 5++ 3O 2-10.下列仪器中,常用于物质分离的是A .①③B .②③C .②④D .①② 11.下列各组混合物中,能用分液漏斗进行分离的是A .酒精和水B .碘和四氯化碳C .水和四氯化碳D .汽油和植物油 12.0.5mol 的氢气在标准状况下所占的体积约是A .22.4LB .11.2LC .5.6LD .2.24L 13.等质量的下列物质中,所含分子数最少..的是 A .Cl 2 B .HCl C .NH 3 D .H 2SO 414.下列各组物质分类正确的是15. A .使用前要检验容量瓶是否漏液 B .用蒸馏水洗后必须要将容量瓶烘干C .为了操作方便,浓溶液稀释或固体溶解可直接在容量瓶中进行D .为了所配溶液浓度均匀,定容结束后,手握瓶颈,左右振荡 16.下列溶液中,氯离子浓度最大的是A .100mL 1mol/L 的NaCl 溶液B .150mL 1mol/L 的MgCl 2溶液C .200mL 1mol/L 的HCl 溶液D .10mL 1mol/L 的AlCl 3溶液 17.下列关于化学实验基本操作的叙述正确的是A .用托盘天平称量药品时,将药品置于天平右盘B .蒸馏实验中,要在烧瓶中加入沸石或碎瓷片,以防止液体暴沸C .将浓硫酸注入盛水的量筒中稀释D .用蒸发皿进行加热蒸发操作时,必须垫石棉网18.下列离子方程式,正确的是① ② ③ ④A.碳酸钙与盐酸反应:2 H+ + CO32- = H2O + CO2↑B.氢氧化钡溶液跟稀硫酸反应: Ba2+ + SO42-= BaSO4↓C.用氢氧化铝治疗胃酸过多: Al(OH)3 + 3 H+ = Al3+ + 3H2OD.稀硫酸滴到铁片上:2 Fe+ 6 H+ = 2Fe3+ +3 H2↑19.下列试剂中,可区别KNO3、BaCl2、Na2CO3三种无色溶液的是A.NaOH B.H2SO4C.Ba(OH)2D.AgNO320.下列各组离子,能在溶液中大量共存的是A.OH─、Al3+、SO42-、Na+ B.Na+、NO3-、SO42-、K+C.Cl─、Ag+、H+、NO3─ D.H+、CO32-、K+、Cl─21.将30mL 0.5mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为 A.0.3 mol/L B.0.03 mol/L C.0.05 mol/L D.0.5 mol/L22.关于SO2的叙述中,正确的是A.SO2的摩尔质量是64 g B.1mol SO2中所含分子数约为6.02×1023C.1 mol SO2的质量是64 g / mol D.常温常压下,1 mol SO2的体积为22.4 L 23.下列化学反应中,不能..用H++OH-=H2O表示的是A.2NaOH + H2SO4 = Na2SO4 + 2H2OB.Ba(OH)2 + 2HCl = BaCl2 + 2H2OC.Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2OD.KOH + HCl = KCl + H2O24.下列有关物质分离方法的叙述中,不正确...的是A.用过滤的方法分离溶液和胶体 B.用蒸馏的方法将自来水制成蒸馏水C.用四氯化碳萃取碘水中的碘 D.用结晶的方法分离氯化钠和硝酸钾固体25.下列实验操作中有错误的是A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出。
2014-2015学年高中化学必修1(人教版)期中测试评估 Word版含解析

期中测试评估时间:90分钟总分:100分第Ⅰ卷(选择题,共44分)一、选择题(1—10每小题2分,11—18每小题3分,共44分)1. 如图实验操作装置正确的是()2. 为了配制100 mL1 mol·L-1的NaOH溶液,其中有下列几个操作:①NaOH用纸盛装进行称量;②选刚用蒸馏水洗净的100 mL容量瓶进行配制;③NaOH在烧杯里刚完全溶解时,即把溶液转移到容量瓶;④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度线相切,其操作错误的是()A. ①②③B. ③④⑤C. ②③⑤D. ①③⑤3. 学习和研究化学,经常要进行实验,下列关于实验安全的说法正确的是()A. 用燃着的酒精灯去点燃另一只酒精灯B. 做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸C. 不慎把浓硫酸洒在皮肤上要立即用NaOH溶液冲洗D. 盛放盐酸的试剂瓶上要贴上如右图的标志4. 下列关于实验操作的叙述中正确的是()①从试剂瓶中取出的任何药品,若有剩余都不能再放回原试剂瓶②可燃性气体点燃之前必须验纯③用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中④用托盘天平称量固体药品时,应左物右码⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却⑥选用100 mL 量筒量取4.53 mL的稀硫酸A. ①③④⑤B. ①③④⑥C. ②④⑤D. 以上答案均不正确5.(双选)具有相同数目氧原子的SO2和SO3,下列关系中一定正确的是()A.n(SO2)∶n(SO3)=3∶2 B.V(SO2)∶V(SO3)=3∶2C.m(SO2)∶m(SO3)=6∶5 D.M r(SO2)∶M r(SO3)=5∶46. 下列混合物的分离方法不可行的是()A. 互溶的液态混合物可用分液方法分离B. 互不相溶的液态混合物可用分液方法分离C. 沸点不同的液态混合物可用蒸馏方法分离D. 可溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离答案1. B 。
人教版高中化学必修一第一学期高一化学期中阶段复习测试卷4含答案.docx

高中化学学习材料(灿若寒星**整理制作)北京市西城区普通高中校2014—2015学年度第一学期高一化学期中阶段复习测试卷 4班级姓名可能用到的原子量有:H:1 O:16 C:12 S:32 Na:23 Cu:64 Cl:35.5第一部分(选择题共50分)每小题只有一个选项......符合题意(1 ~ 20小题,每小题2.5分)1.如果你家里的食用花生油混有水份,你将采用下列何种方法分离()A.过滤B.蒸馏C.分液D.萃取2.下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是()①过滤②蒸发③溶解④向容量瓶转移液体A.①和②B.①和③C.③和④D.①和④3.以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是()A B C D4.实验中的下列操作正确的是()A.用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中B.Ba(NO3)2 溶于水,可将含有Ba(NO3)2 的废液倒入水槽中,再用水冲入下水道C.用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部加热蒸干D.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中5.下列叙述正确的是()A.1 mol H2O的质量为18g/mol B.CH4的摩尔质量为16gC.3.01×1023个SO2分子的质量为32g D.标准状况下,1 mol任何物质体积均为22.4L6.同温同压下,等质量的下列气体所占有的体积最大的是()A.O2B.CH4C.CO2D.SO27.用N A表示阿伏德罗常数,下列叙述正确的是()A.标准状况下,22.4LH2O含有的分子数为1 N AB.常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 N AC.通常状况下,1 N A个CO2分子占有的体积为22.4LD.物质的量浓度为0.5mol·/L的MgCl2溶液中,含有Cl-个数为1 N A8.0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比()A.5:2 B.3:1 C.15:2 D.1:39.下列电离方程式,书写正确的是()A. Al2(SO4)3 =2Al3+ +3SO42-B.AlCl3 = Al3+ + Cl3-C. M g(N O3)2 = Mg+2 +2NO3-D.KMnO4 =K+ +Mn7+ +4O2-10.下列说法正确的是()A. 易溶于水的物质一定是电解质B. 液态氯化氢能导电C. 液态氯化钠能导电D. 熔融的液态钠是电解质11.下列反应中,铁元素被氧化的是()A. FeS +2HCl = FeCl2 + H2S↑B. Fe +H2SO4 = FeSO4 +H2↑C. FeO + 2HCl =FeCl2 +H2OD. Fe2O3 +3CO = 2Fe +3CO212.下列离子反应方程式,书写正确的是()A. 向碳酸钠溶液中加盐酸CO32- + 2H+ = H2O +CO2↑B.向稀硫酸溶液中投入铁粉2Fe +6H+ = 2Fe3+ +3H2↑C. 向盐酸中投入碳酸钙CO32- + 2H+ = H2O +CO2↑D. 氢氧化钡溶液中加入硫酸H+ + OH- =H2O13.下列关于分散系的说法,正确是()A. 稀硫酸不是分散系B. 一种分散系里只有分散质和分散剂两种物质C. 分散剂一定是液体D. 按分散质和分散剂的状态(气、液、固态),有9种组合方式的14. 下列基本反应类型中,一定是氧化还原反应的是()A.化合反应B.分解反应C.置换反应D.复分解反应15. 下列各组分散系,需用丁达尔效应区分的是()A. 溶液和浊液B. 胶体与胶体C. 溶液与胶体D. 溶液与溶液16.农药波尔多液不能用铁制容器盛放,是因为铁能与该农药中的硫酸铜反应,在该反应中,铁做了()A.氧化剂B.还原剂C.被还原D.既不是氧化剂也不是还原剂17. 下列变化中,必须加入氧化剂才能发生的是()A. SO2→SB. SO32—→SO2C. I- →I2D. HCO3—→CO32—18.下列物质中,导电性能最差的是()A.熔融的氢氧化钠B.石墨棒C.盐酸溶液D.固态氯化钾19.下列各组中的离子,能在溶液中大量共存的是()A.Mg2+、H+、C1-、OH-B.Na+、Ba2+、CO-23、NO-3C.Na+、H+、Cl-、CO-23D.K+、Cu2+、NO-3、SO-24、20. 以水为分散剂的分散系,按稳定性由强到弱的顺序排列的是()A. 溶液、胶体、浊液B. 浊液、胶体、溶液C. 胶体、浊液、溶液D. 浊液、溶液、胶体第二部分(非选择题共50分)21.(8分)写出下列物质在水溶液里的电离方程式:(1)硫酸铁;(2)氢氧化钡;(3)碳酸钠;(4)氢氧化钠。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
"【红对勾】2014-2015学年高中化学期中测试评估新人教版必修1"时间:90分钟总分:100分第Ⅰ卷(选择题,共44分)一、选择题(1—10每小题2分,11—18每小题3分,共44分)1. 如图实验操作装置正确的是( )2. 为了配制100 mL1 mol·L-1的NaOH溶液,其中有下列几个操作:①NaOH用纸盛装进行称量;②选刚用蒸馏水洗净的100 mL容量瓶进行配制;③NaOH在烧杯里刚完全溶解时,即把溶液转移到容量瓶;④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度线相切,其操作错误的是( )A. ①②③B. ③④⑤C. ②③⑤D. ①③⑤3. 学习和研究化学,经常要进行实验,下列关于实验安全的说法正确的是( )A. 用燃着的酒精灯去点燃另一只酒精灯B. 做水的蒸馏实验时,要在烧瓶内加几粒沸石以防止暴沸C. 不慎把浓硫酸洒在皮肤上要立即用NaOH溶液冲洗D. 盛放盐酸的试剂瓶上要贴上如右图的标志4. 下列关于实验操作的叙述中正确的是( )①从试剂瓶中取出的任何药品,若有剩余都不能再放回原试剂瓶②可燃性气体点燃之前必须验纯③用胶头滴管向试管中滴加液体,一定要将滴管伸入试管中④用托盘天平称量固体药品时,应左物右码⑤配制浓硫酸与蒸馏水的混合液时,应将浓硫酸慢慢加到蒸馏水中并及时搅拌和冷却⑥选用100 mL 量筒量取4.53 mL的稀硫酸A. ①③④⑤B. ①③④⑥C. ②④⑤D. 以上答案均不正确5.(双选)具有相同数目氧原子的SO2和SO3,下列关系中一定正确的是( )A.n(SO2)∶n(SO3)=3∶2 B.V(SO2)∶V(SO3)=3∶2C.m(SO2)∶m(SO3)=6∶5 D.M r(SO2)∶M r(SO3)=5∶46. 下列混合物的分离方法不可行的是( )A. 互溶的液态混合物可用分液方法分离B. 互不相溶的液态混合物可用分液方法分离C. 沸点不同的液态混合物可用蒸馏方法分离D. 可溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离答案1. B 。
A 的错误在于漏斗颈没紧靠烧杯内壁,且玻璃棒没有靠在滤纸上;C 的错误在于物品和砝码放反了位置;D 的错误在于加热蒸发皿用了石棉网。
2. D 。
解析:溶液的配制分为五个步骤:溶质为固体⎩⎪⎨⎪⎧ 1 计算 2 称量3 溶解4 转移 洗涤5 定容 摇匀溶质为液体⎩⎪⎨⎪⎧ 1 计算 2 量取3 稀释4 转移 洗涤5 定容 摇匀步骤①中用托盘天平称量像苛性钠等易潮解或有腐蚀性的药品时,必须用干燥而洁净的烧杯或表面皿,先称出烧杯或表面皿的质量,然后再放入NaOH ,称出它们的总质量,用差量法得出苛性钠的质量;步骤③中,应把冷却的稀溶液沿玻璃棒注入容量瓶(“引流”),并用少量蒸馏水洗涤烧杯2~3次。
洗涤液也一并注入容量瓶(“洗涤”);步骤⑤中,定容时,先往容量瓶中小心地加水,直到液面接近刻度线1~2 cm 处,改用胶头滴管加水,使溶液凹液面恰好与刻度线相切。
3. B4. C 。
5.AC 。
所含的O 原子数相等,也就是所含的O 的物质的量相等,则n (SO 2)×2=n (SO 3)×3,n (SO 2)∶n (SO 3)=3∶2,则m (SO 2)∶m (SO 3)=(3×64)∶(2×80)=6∶5;由于不知是否处于标准状况下,所以V (SO 2)∶V (SO 3)不确定是否为3∶2;M r(SO 2)∶M r(SO 3)=4∶5。
6. A 。
7. 下列溶液中NO -3的物质的量浓度最大的是( )A. 500 mL 1 mol·L -1的KNO 3溶液B. 500 mL 1 mol·L -1的Ba(NO 3)2溶液C. 1 000 mL 0.5 mol·L -1的Mg(NO 3)2溶液D. 1 L 0.5 mol·L -1的Fe(NO 3)3溶液8.下列叙述正确的是( )A .元素的单质一定由氧化或还原该元素的化合物制得B .在化学反应中,得电子越多的氧化剂,其氧化性就越强C .阳离子只能得到电子被还原,阴离子只能失去电子被氧化D .含有最高价元素的化合物不一定具有很强的氧化性9.下列说法正确的是( )A .把100 mL 3 mol·L -1的H 2SO 4跟100 mL H 2O 混合,硫酸的物质的量浓度变为1.5 mol·L -1B .把100 g 20%的NaCl 溶液跟100 g H 2O 混合后,NaCl 溶液的质量分数是10%C .把200 mL 3 mol·L -1的BaCl 2溶液跟100 mL 3 mol·L -1的KCl 溶液混合后,溶液中的c (Cl -)仍然是3 mol·L -1D .把100 mL 20%的NaOH 溶液跟100 mL H 2O 混合后NaOH 溶液的质量分数是10%10.化合物A 、B 、C 都只含有两种元素,且A 、B 均含X 元素。
已知一定条件下可发生反应:A +B ―→X+C ,X 是一种单质,由此可知X 元素( )A .一定是金属元素B .一定是非金属元素C .可能是金属元素,也可能是非金属元素D .无法确定11. 除去下列溶液中的杂质(括号内是杂质)所用试剂不正确的是( )A. NaOH 溶液[Ba(OH)2]:用Na 2SO 4溶液B. KOH 溶液(K 2CO 3);用Ca(OH)2溶液C. NaCl 溶液(Na 2SO 4);用Ba(NO 3)2溶液D. HNO 3溶液(HCl);用AgNO 3溶液12. 下列反应中氯元素仅被还原的是( )A. 5Cl 2+I 2+6H 2O===10HCl +2HIO 3B. 2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2OC. MnO 2+4HCl(浓)=====△MnCl 2+2H 2O +Cl 2↑D. HCl +NaOH===NaCl +H 2O13. 对于反应8NH 3+3Cl 2===N 2+6NH 4Cl ,下列说法正确的是( )A. N 2是氧化产物,且还原剂与氧化剂物质的量之比是8∶3B. N 2是氧化产物,且还原剂与氧化剂物质的量之比是2∶3C. NH 4Cl 是氧化产物,且还原剂与氧化剂物质的量之比是8∶3D. NH 4Cl 是氧化产物,且还原剂与氧化剂物质的量之比是2∶314. 配制250 mL 、0.10 mol·L -1的NaOH 溶液时,下列实验操作会使配得的溶液中NaOH 物质的量浓度偏大的是( )A. 转移溶液后未洗涤烧杯和玻璃棒就直接定容B. 在容量瓶中进行定容时仰视刻度线C. 在容量瓶中定容时俯视刻度线D. 定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水15.设N A为阿伏加德罗常数,下列叙述正确的是( )A.1 mol FeCl3完全转化为Fe(OH)3胶体后生成N A个胶粒B.在MnO2的作用下,1 mol H2O2充分反应转移2N A个电子C.在标准状况下,22.4 L H2和4 g He均含有N A个分子D.50 ℃、1×105Pa下,46 g NO2与0 ℃、2×105 Pa下46 g N2O4均含有3N A个电子16.下列离子方程式,正确的是( )A.氢氧化铁与盐酸反应:H++OH-===H2OB.过量NaHSO4溶液与少量Ba(OH)2溶液反应:2H++SO2-4+Ba2++2OH-===BaSO4↓+2H2O C.铁与H2SO4反应:Fe+2H+===Fe3++H2↑D.CaCO3溶于稀盐酸中:CO2-3+2H+===CO2↑+H2O17.已知常温下在溶液中可发生如下两个离子反应:Ge4++Fe2+===Fe3++Ge3+①Sn2++2Fe3+===2Fe2++Sn4+②由此可以确定Fe2+、Ge3+、Sn2+三种离子的还原性由强到弱的顺序是( )A.Sn2+、Fe2+、Ge3+B.Sn2+、Ge3+、Fe2+C.Ge3+、Fe2+、Sn2+D.Fe2+、Sn2+、Ge3+答案7. B 。
注意此题比较的是NO -3 的物质的量浓度,而不是物质的量,故与体积大小无关。
8.D 。
A 中如2O 3===3O 2反应不合题意;B 中氧化性强弱与得电子多少无关,而是体现在得电子的能力强弱;C 中Fe 2+可被氧化,也可被还原;D 中如HClO 4中氯元素处于最高价态,具有很强的酸性,但氧化性很弱。
9.B 。
A 错,因为100 mL 3 mol·L -1的H 2SO 4跟100 mL H 2O 混合后的体积小于200 mL ;B 对,w =100 g×20%/(100 g+100 g)=10%;C 错,因为3 mol·L -1的BaCl 2溶液中的氯离子浓度为6 mol·L -1,混合后溶液中氯离子浓度大于3 mol·L -1;D 错,因为NaOH 溶液的密度大于1 g·mL -1,加入水的质量等于100 g ,所以混合后溶液中溶质的质量分数大于10%。
10.B 。
根据题意:(1)A 、B 、C 都是化合物;(2)A 、B 均含X 元素;(3)反应生成单质X ,可以推知该反应为“归中型”氧化还原反应。
即化合物A 、B 中X 元素的化合价“一高一低”(一个高于0价、一个低于0价),两者共同作用生成X 单质(化合价为0)。
由于金属元素在化合物中只呈现正价态,不可能有负价态,因此可以肯定X 不是金属元素;只有非金属元素在化合物中才既可呈正价态,又可呈负价态,并在一定条件下可以发生归中反应。
例如:2H 2S +SO 2===3S↓+2H 2O,4NH 3+6NO===5N 2+6H 2O ,所以X 应该是非金属。
11. C 。
12. A 。
关键在于正确标出氯元素化合价的变化,A 中C 0l 2―→Cl -1;B 项中C 0l ―→Cl -1+Cl +1 (自身氧化还原);C 项中Cl -1 ―→C 0l ;D 项不属于氧化还原反应。
13. B 。
反应中化合价变化为:其中氧化剂:Cl 2,还原剂:NH 3,氧化产物:N 2,还原产物:NH 4Cl 。
注意到参加反应的8 mol NH 3 中有6mol 生成了NH 4Cl ,无化合价变化,有2mol 生成了N 2,是被氧化的。
14. C 。
本题的难点在于对B 、C 两项的判断。
B 项如图中乙,定容后液面高于刻度线,溶液体积偏大,NaOH 物质的量浓度偏小。
