_铜族元素
第二十章 铜族和锌族综述

西 昌 学 院
西昌学院
(2)、硫化物 Cu2S和Ag2S两种黑色化合物溶解度很 小,不溶于水和非氧化性酸。如可溶于氧 化性的硝酸: Cu2S+HNO3===? Ag2S+HNO3===? Cu2S可溶于KCN生成[Cu(CN)4]3-
(3)、AgNO3 Cu(I)不形成硝酸盐,AgNO3是一种重 要试剂。
西 昌 学 院
西昌学院
1、活泼性 IB族的最外层电子的Z*(有效核电荷 Z-)高,故第一电离势比碱金属的高。
由于d电子也包含在金属键中,故它 们的升华热和熔点也比碱金属的高得多。 其较惰性的特点与这些因素有关。结果是 其化合物有较多的共价性和较高的晶格能。
2、氧化数 铜、银、金三个元素,每一个元素都 有+1、+2和+3三种氧化数。最常见的氧化 数:铜为+2、银为+1、金为+3。
(5)、配合物 二价铜离子有较强的配合性。 [Cu(H2O)4]2+、[Cu(NH3)4]2+等,但实际上它们的 应该是[Cu(H2O)6]2+、[Cu(NH3)4(H2O)2]2+离子,原因 是因它们的结构是一种特殊的变形八面体结构。
西 昌 学 院
西昌学院
二价铜离子与CN-形成配合物时比较特殊: 2Cu2++4CN-===(CN)2↑+2CuCN↓(白色) 继续加入CN-则有: CuCN+3CN-===[Cu(CN)4]3用此方法可分离Cu2+和Cd2+离子,也说明Cu2+与 CN-不能共存。另外Cu2+还能形成螯合物。
西 昌 学 院
西昌学院
3、标准电极电势 Zn2++2e-==Zn =-0.786V Cd2++2e-==Cd =-0.4026V Hg22++2e-==2Hg =0.7986V 2Hg2++2e-==2Hg22+ =0.905V Ca2++2e-==Ca =-2.76V 化学活泼性远于碱土金属; 从上到下,金属活泼性递减;与碱土 金属的变化规律相反。 4、氢氧化物的碱性和稳定性 IIB族氢氧化物属弱碱,且易脱水形成 氧化物。 Be(OH)2和Zn(OH)2为两性氢氧化物。
知识总结——铜族元素和锌族元素
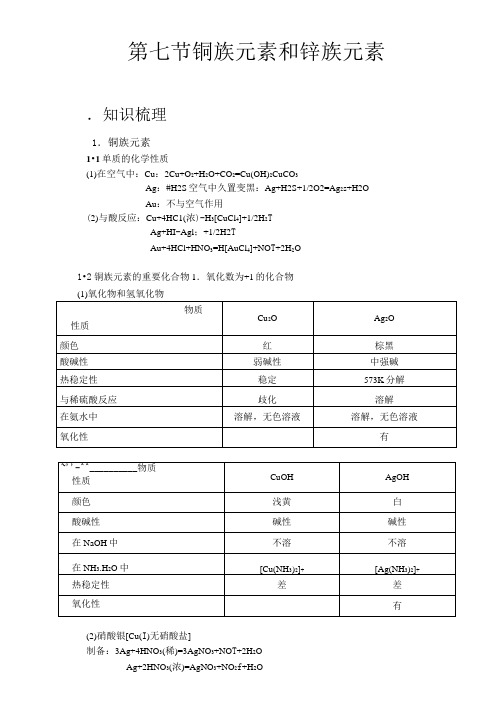
第七节铜族元素和锌族元素.知识梳理1.铜族元素1•1单质的化学性质(1)在空气中:Cu:2Cu+O2+H2O+CO2=Cu(OH)2CuCO3Ag:#H2S空气中久置变黑:Ag+H2S+1/2O2=Ag2s+H2OAu:不与空气作用(2)与酸反应:Cu+4HC1(浓)-H3[CuCl4]+1/2H2TAg+HI-Agl;+1/2H2TAu+4HCl+HNO3=H[AuCl4]+NO T+2H2O1•2铜族元素的重要化合物1.氧化数为+1的化合物(2)硝酸银[Cu(I)无硝酸盐]制备:3Ag+4HNO3(稀)=3AgNO3+NO T+2H2OAg+2HNO3(浓)=AgNO3+NO2f+H2O遇蛋白质生成黑色蛋白银,对有机组织有破坏作用,使用时勿使皮肤接触,在医药上用作消毒剂和腐蚀剂。
大量AgNO3用于制造照相底片上的卤化银,是重要的化学试剂。
(3)卤化物:①CuX2Cu2++2X-+SO2+2H2O-CuX;+4H++SO42-Cu2++2Cl-+Cu-2CuCl-2H[CuCl2]2Cu2++4I-=2CuI;+I2;CuX主要性质:在潮湿含氧环境下稳定性差:4CuCl+O2+4H2O=3CuOCuCl2^3H2O+2HCl8CuCl+O2=2Cu2O+4Cu2++8Cl-在相应卤化物中形成较稳定的卤配离子:CuX+X-=^CuX2-(无色)有一定氧化性:4CuI+Hg=Cu2[HgI4]+2Cu白暗红此反应用于检验实验室空气中的汞含量。
②AgX性质:见光分解:AgBr-Ag+Br因此AgBr用作感光材料。
(4)硫化物:Cu2S,Ag2S:黑色;难溶于水;溶于热浓硝酸3Cu2s+16HNO3(浓)一6Cu(NO3)2+3s;+4NO f+8H2O3Ag2s+8HNO3(浓)一6Ag(NO3)2+3S;+2NO f+4H2O2.氧化数为+2的化合物(1)氢氧化铜和氧化铜CuSO4+2NaOH=Cu(OH)2J+Na2SO4Cu(OH)2O①氧化铜热稳定性:在高温时明显分解2CuO1237K>Cu2O+1/2O2加热可被H2、CO、NH3还原3CuO+2NH3=3Cu+3H2O+N2②氢氧化铜(浅蓝色)微显两性(以碱性为主),可溶于浓强碱:Cu(OH)2+2OH-[Cu(OH)4]2-溶于氨水Cu(OH)2+4NH3^^[Cu(NH3)4](OH)2(2)氯化铜CuCl2无水CuCl2为共价化合物,结构为链状,其中Cu采取dsp2杂化方式。
ds 区 元 素

ds 区 元 素
2. 锌族元素的重要化合物
(1)锌的化合物。 锌的化合物主要有锌的氧化物、 氢氧化物和卤化物等。
①氧化锌(ZnO)。ZnO是白色粉末状不溶于水的两性 化合物,它既能溶于酸,又能溶于碱:
ZnO+2HCl →ZnCl2+H2O ZnO+2NaOH →Na2ZnO2+H2O
ds 区 元 素
由表可知,卤化银中只有AgF易溶于水,其余 均微溶于水,且溶解度按AgCl→AgBr→AgI的顺序 降低,它们的颜色也依此顺序加深。这种变化趋势 与从AgF到AgI键型的变化有关,即以离子键为主变 成以共价键为主结合。
ds 区 元 素
(2)二价化合物。 铜族元素中氧化态为+2的 只有铜,铜的化合物最重要的有CuO、Cu(OH)2、 CuSO4·5H2O等。
ds 区 元 素
氧化亚铜(Cu2O)是红色固体,很稳定,在自然界中以赤铜 矿形式存在,当灼烧氧化铜达1273~1473 K时,分解出氧,生 成氧化亚铜:
ds 区 元 素
因此,AgNO3晶体或溶液都应在棕色玻璃瓶内保存。AgNO3可溶 于水,其水溶液与卤化物作用,生成卤化银。固体AgNO3或其溶液都是 氧化剂,即使在室温下,许多的有机物都能将它还原成黑色的银粉。
2Cu+H2O+CO2+O2 → Cu2(OH)2CO3
ds 区 元 素
2. 铜族元素的重要化合物
铜、银、金都可以形成氧化数为+1、+2、+3的化合 物,其中,Cu(+2)、Ag(+1) Au(+1) 态。不同氧化数的铜族元素离子能与CN-等简单配体形成稳 定配合物。
第八章 Cu Zn族元素
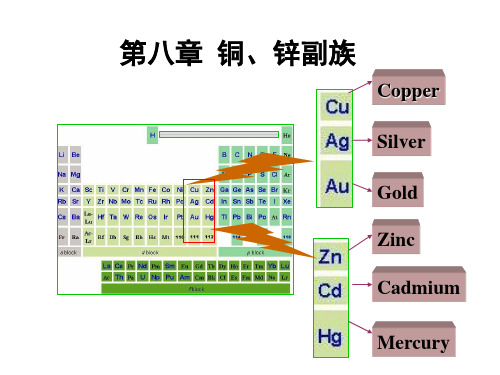
(3) 除渣 形成熔渣FeSiO3,因其密度小而浮在上层,而Cu2S和 剩余的FeS熔在一起生成所谓“冰铜”,并沉于熔体下层:
FeO + SiO2 ─→ FeSiO3(渣) mCu2S + nFeS ─→ 冰铜
+1、+2、+3 IA<< IB
密度大、熔沸点较高
导电、导热性很好
延展性好
二、铜族元素的单质
1.物理性质
(1) 特征颜色:Cu(紫红),Ag(白),Au(黄)
(2) 它们的密度都大于5,都是重金属,其中金的 密度最大,为19.3g·cm-3。
(3) 溶、沸点较其它过渡金属低
(4) 导电性、导热性好,且Ag>Cu>Au
(5) 延展性好:1g金可以拉成长达3.4km的金线, 也能碾压成0.0001mm厚的金箔。
(6) 能与许多金属形成合金,其中铜的合金品种最 多,金易生成汞齐。
2.化学性质 (1) 与O2作用
2Cu O2 2CuO(黑) 2Cu O2 H2O CO2
Cu 2 (OH) 2 CO3 (绿)
Ag 2HNO3(浓) AgNO3 NO2 H2O Cu 2H2SO4 (浓) CuSO 4 SO2 2H2O 2Ag 2H2SO4 (浓) Ag2SO4 (s) SO2 2H2O Au 4HCl(浓) HNO3(浓)
H[AuCl 4 ] NO H2O
铜的冶炼、金的提取、银的回收
3. 银的回收 仍用氰化法浸取,然后用Zn或Al将Ag置换出来,反应如下:
4Ag + 8CN- + O2 + 2H2O → 4[Ag(CN)2]- + 4OHAg2S + 4CN- → 2[Ag(CN)2]- + S2-
副族元素性质归纳及解题分析(1)

1 铜族元素
11 铜族元素的通性
IB族:铜(Cu)、银(Ag)、金(Au)。 价电子构型: (n1)d10 ns1, 靠近d区。
氧化态+I、+II、+III
铜族元素 金属键较强,具有较高的熔沸点, 升华热,导电、导热性能好,密度 大
碱金属元素 金属键较弱,熔沸点 低,硬度、密度小 极活泼,随原子序数 增加而活泼性增加 +I 大多是离子型的无色 物质,正离子难还原 极少,仅能同极强的 配位剂生成配合物 强碱,热稳定性高
Cl Cl Cl
2、锌族元素 2-1 锌族元素的通性
锌族元素 物理性质 碱土金属元素
熔沸点、熔化热、气化热比碱土金属和 熔沸点较锌族元素高 铜族元素低(s电子成对后稳定性增加)
化学性质及 较不活泼,随原子序数增加活泼性降低, 较活泼,随原子序数 变化规律 锌溶于稀酸、镉较慢、汞不溶 增加活泼性增加
三、三氯化金 金在473K下同氯气作用,可得到褐红色的晶体三氯化金。在金 的化合物中,氧化态为+III的化合物最稳定,氧化态为+I的化合 物很容易转化成氧化态为+III的化合物。 Cl Cl 3Au+=Au3++2Au K=[Au3+]/[Au+]=1013。 Cl 三氯化金在固态和气态时为二聚体结构。 Au Au
13 铜族元素的主要化合物 一、铜的化合物 1、氧化态为+I的化合物 (1)氧化物 硫酸铜碱性溶液用葡萄糖还原,可以制得Cu2O: 其化学反应方程式为: 2[Cu(OH)4]2+CH2OH(CHOH)4CHO== 3OH+CH2OH(CHOH)4COO+3H2O+Cu2O↓ (2)卤化物 2Cu2++4I=2CuI↓+I2;定量测定铜。 I2+SO2+2H2O=H2SO4+2HI 2CuCl2+SO2+2H2O=2CuCl↓+H2SO4+2HCl Cu+CuCl2=2CuCl CuCl在不同浓度的KCl溶液中,可以形成配离子[CuCl2]、 [CuCl3]2、 [CuCl4]3。 (3)硫化亚铜:Ksp=2×1047,2Cu+S=Cu2S 2Cu2++2S2O32+2H2O=Cu2S↓+S↓+2SO42+4H+
无机化学反应式-铜族元素
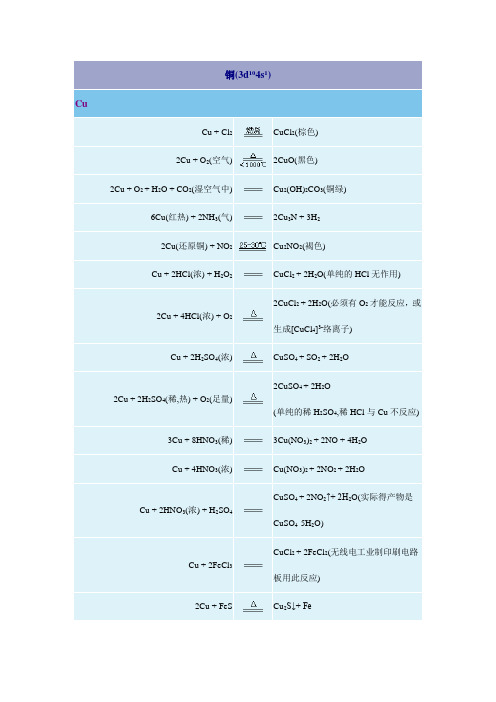
Cu(OH)2 + 2HNO3 Cu(OH)2 + 2H+ 3Cu(OH)2 + 2KBr 2K2O2·H2O 2Cu(OH)2 + (NH4)2SO4 Cu(OH)2 + (NH4)2SO4 + 2NH3 2Cu(OH)2 + (NH2OH)·H2SO4
Cu(NO3)2 + 2H2O Cu2+ + 2H2O Cu2Br2·Cu(OH)2·H2O + K2O2·H2O 4KOH + O2 Cu2(OH)2SO4 + 2NH3 + 2H2O CuSO4·4NH3 + 2H2O Cu2OSO4·2NH4OH + 3H2O Cu2O(红色) + C6H12O7(葡萄糖酸) +
CuO
4CuO CuO + H2 2CuO + C CuO + Fe 2CuO + Fe CuO + Cu 2CuO + Zn(粉,小量) + 4HCl(浓) 2CuO + 2SO2 + O2 CuO + CO 2CuO + 3FeO CuO + 2H+ CuO + 2HCl CuO + H2SO4 CuO + 2HNO3 CuO + 2CH3COOH 3CuO + FeCl3 CuO + 2FeCl3 + H2O 3CuO + Fe2(SO4)3 CuO + Na2B4O7 2Cu2O + O2↑(Cu2O 在干态时稳定) Cu + H2O 2Cu + CO2 FeO + Cu FeO + Cu Cu2O Cu2Cl2 + ZnCl2 + 2H2O 2CuSO4(用 SO2 制取 CuSO4 的反应) Cu + CO2↑ Cu2O + Fe3O4 Cu2+ + H2O CuCl2 + H2O CuSO4 + H2O Cu(NO3)2 + H2O Cu(CH3COO)2 + H2O Fe2O3 + 3CuCl2 CuSO4 + Fe2O3 + SO3 + H2 3CuSO4 + Fe2O3 2NaBO2 + Cu(BO2)2
元素的反应周期表中的催化剂元素

元素的反应周期表中的催化剂元素元素是构成物质的基本单位,而催化剂元素则是在化学反应中起到促进反应速率的作用。
在元素的反应周期表中,存在着一些具有催化剂性质的元素,它们可以加速化学反应的进行,降低能量激活要求,提高反应的效率。
本文将会介绍一些常见的催化剂元素,并探讨它们在化学反应中的作用机制。
第一组:铂族元素铂族元素包括铂(Pt)、钯(Pd)、铑(Rh)、钌(Ru)、铱(Ir)和锇(Os),它们在化学反应中常被用作催化剂。
铂族元素具有良好的催化活性和稳定性,能够参与氧化还原反应、氢化反应、加氢反应等多种反应。
以铂为例,它常被用作汽车尾气中的催化转化剂,将有害的尾气中的氮氧化物、碳氢化合物和一氧化碳转化为无害的氮、水和二氧化碳。
铂能够吸附氮氧化物和碳氢化合物分子,使其发生反应,并在反应过程中不发生氧化还原。
第二组:镍族元素镍族元素包括镍(Ni)、钯(Pd)、铂(Pt)、钴(Co)、铁(Fe)和钌(Ru)。
这些元素在催化剂中常常起到氢化和脱氢反应的催化作用。
以镍为例,它在加氢反应中有着广泛的应用,能够加速烯烃和脂肪酸的加氢,将其转化为饱和烃。
镍的催化作用是通过吸附氢气和底物分子,使底物分子与氢气发生反应,并在反应后释放出反应产物。
第三组:铜族元素铜族元素包括铜(Cu)、银(Ag)和金(Au),它们在化学反应中常被用作催化剂。
铜族元素具有良好的电子传导性能,在电化学反应中能够提供电子传递的通道。
以铜为例,它在有机合成反应中广泛应用,能够参与氧化和加氢反应,促进有机物的转化。
铜的催化作用是通过吸附底物分子和提供电子,使底物分子与其他反应物或氧气发生反应,并加速反应进程。
第四组:铁族元素铁族元素包括铁(Fe)、钌(Ru)、钴(Co)、铑(Rh)、铑(Ir)和镍(Ni)。
这些元素在化学反应中常被用作氧化还原反应和氢化反应的催化剂。
以铁为例,它在催化剂中有着广泛的应用,能够参与合成氨、甲醇和合成气等反应。
铁的催化作用是通过吸附底物分子并与其他反应物发生反应,转化为反应产物。
元素化学—s区、d区、ds区元素及其重要化合物

锌盐
与S2-的作用 Zn2+ + H2S → ZnS(s,白) ,氨碱性条件下沉淀完全,溶于0.3 mol-1的HCl ZnSO4(aq) BaS(aq) ZnSBaSO4(s,白) 锌钡白(立德粉)
汞盐
为什么氯化亚汞分子式要写成 Hg2Cl2而不能写成 HgCl ?
汞除了形成氧化数为+2的化合物外,还有氧化数为+1的化合物。在氧 化数为+1的汞的化合物中,汞以(—Hg—Hg—)形式存在。Hg(Ⅰ) 的化合物叫亚汞化合物。试验证明其中的汞离子是{Hg-Hg}2+,而不是 Hg+。
2Cd O2 2CdO(s,红棕色)
2Hg O2
360 2HgO(s,红、黄)
470
ห้องสมุดไป่ตู้
潮湿
4Zn 2O2 CO2 3H2O ZnCO3 3Zn(OH)2 碱式碳酸锌
单质的化学性质
(2) 与S的 作用
溶
ZnS(白)
解
度
M+S
MS
CdS(黄)
依 次
HgS (红、黑)
减 小
氧化物与氢氧化物
铜盐
CuSO4·5H2O称为胆矾,呈蓝色
CuSO 4 5H 2O 102C CuSO 4 3H 2O 113C CuSO 4 H 2O 258C CuSO 4
无水CuSO4为白色粉末,易溶于水,吸水性强,吸水后呈蓝色, 可检验有机液体中的微量水分
铜盐
CuSO4溶液中加入氨水,先生成浅蓝色的碱式硫酸铜沉淀: 2Cu2+ + SO42-+ 2NH3∙H2O = Cu2(OH)2SO4(s) + 2NH4+
基 础 化 学
ds区元素
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氯化铜(CuCl2)
盐类
无水CuCl2为棕黄色固体, 是共价化合物
易溶于水和有机溶剂(如乙醇、丙酮) CuCl2溶液随c(Cl-)不同而呈不同颜色★ [CuCl4]2-+ 4H2O [Cu(H2O)4]2+ + 4Cl(黄色) (浅蓝色)
硫酸铜(CuSO4)
盐类
无水CuSO4为白色粉末,易溶于水,吸 水性强,吸水后呈蓝色,可检验有机液 体中的微量水分
单质 Cu+4HNO3(浓) → Cu(NO3)2+2NO2 +2H2O Cu :干燥空气中稳定,在含有CO2的 3Cu+8HNO3(稀) → 3Cu(NO3)2+2NO +4H2O 潮湿空气中表面生成铜绿 Cu + 2H2SO4(浓) → CuSO4+ SO2 + 2H2O Ag :室温时不与氧气和水作用,若与 2Ag+ 2H22SO 浓) → Ag SO42(OH) + SO22CO +2H O 2Cu+O +H 4( 2O+CO2 → 2 Cu 32 含 H S 空气接触,表面蒙上一层 Ag S 2 2 Ag + 2HNO3(65%) → AgNO3 + NO2 + H2O 4Ag + 2H Cu、 Ag :不溶于非氧化性酸,能与硝 2S + O2 → 2Ag2S + H2O 酸、热浓硫酸作用
氢氧化物 CuOH不稳定,至今尚未制得 2-+C H O (葡萄糖) 2[Cu(OH) ] (CuOH) 为浅蓝色,难溶于水 6 12 6 2 4 -+2H O → Cu O +C H O +4OH 1. 受热易脱水 2 6 12 7 2 C 80~90 ( 葡萄糖酸 Cu(OH)2 CuO) + H2O 用此反应可检查尿糖 2. 两性:以碱性为主 (演示实验) Cu(OH)2 + 2H+ → Cu2+ + H2O (浅兰色) Cu(OH)2 + 2OH- → [Cu(OH)4]2-(亮兰色) 3. 溶于氨水 (演示实验) Cu(OH)2+4NH3 → [Cu(NH3)4]2+ + 2OH-
Ag+的鉴定
KCl、NH3、HNO3 Ag+ + Cl- → AgCl (白色) AgCl+2NH3· H2O → [Ag(NH3)2]++Cl-+2H2O [Ag(NH3)2]++Cl-+2H+ → AgCl +2NH4+ (白色) K2CrO4
2Ag+ + CrO42- → Ag2CrO4 (砖红色)
Au 金
主要 矿物
放 岩石 闪银矿 射 ( 岩脉金 ) 性 (Ag2S) 砂砾 元 角银矿 素 ( 冲积金 ) (AgCl)
通性 ds 区
ⅠB族
Cu 铜
Ag 银
4d105s1
、 、
Au 金
5d106s1
、 、
价层电子构型 3d104s1
、 、
主要氧化数 +3 +2 +1 +3 +2 +1 +3 +2 +1 离子有较强的极化力,变形性大,其化合 物有一定的共价性。
CuSO4· 5H2O称为胆矾,呈蓝色
Cu2+易水解,水溶液呈酸性 Cu2++ H2O Cu(OH)+ + H+
配合物
Cu(I) Cu(II)
常见配位数 主要配合物
2
4
[CuCl2]- [Cu(H2O)4]2+ [Cu(SCN)2][CuCl4]2[Cu(NH3)2]+ [Cu(NH3)4]2+ [Cu(S2O3)2]3[Cu(CN)2]-
共价
r(X-)增大,变形性增大,共价性增强,溶 解度减小 卤化银具有感光性,可作感光物质 2AgX
日光
2Ag + X2
卤化银
敷有AgBr 曝光 (亮)感光多 (暗)感光少 照相底片
曝 发生反应:AgBr 光子 Ag(银核) + Br 光
亮,感光多,产生Ag 核多 暗,感光少,产生Ag 核少
卤化银
配合物 过量NH 具有弱氧化性 3 过量Na2S2O3 过量KCN ++RCHO+3OH-→ 2[Ag(NH ) ] 3 2 AgCl 溶 溶 溶 2Ag +RCOO-+4NH3 +2H2O AgBr 微溶 溶 溶 用于在玻璃、暖水瓶胆上的镀银 AgI 不溶 微溶 溶 溶解 [Ag(NH3)2]+ [Ag(S2O3)2]3- [Ag(CN)2]产物 Kf 1.12×107 2.88×1013 1.26×1021 配离子稳定性增大
盐类 氯化亚铜(CuCl) 制取: 1. 在热、浓HCl溶液中, 用Cu粉还原CuCl2 Cu2+ + Cu + 4Cl- → 2[CuCl2]2. 用水稀释 2[CuCl2]- → 2CuCl (白色) + 2Cl总反应:Cu2+ + Cu + 2Cl- → 2CuCl CuCl盐酸溶液可用作测定气体中CO含量 CuCl +CO+H2O → [CuCl(CO)]· H2O (氯化羰基亚铜)
13-6-2铜的重要化合物
Cu2O CuO 颜色 暗红色 黑色 溶解性 难溶于水,易溶于酸 热稳定性 稳定,1235 C 熔化也不分解 高 +(无色) [Cu(NH ) ] 加入氨水 微溶 + 2+ 3 2 Cu O + 2H → Cu + Cu + H O Cu2O + 2HCl → 2CuCl + H2O 1000 C (白色) 4CuO Cu2O + O2 + 2+ CuO + 2H → Cu + H2O
Cu2+的鉴定
—— 在酸性或中性溶液中,
用K4[Fe(CN)6]试剂 2Cu2+ +[Fe(CN)6]4- → Cu2[Fe(CN)6]
红褐色
13-6-3银的重要化合物
颜色 溶解性 溶于水
键型 离子
13-6-3 银的重要化合物 AgX AgF AgCl AgBr AgI
白 浅黄 黄 难溶于水
卤化银
配合物 过量 NH3 过量Na2S2O3 过量KCN 为电镀液的主要成分 - + e- → Ag + 2CN[Ag(CN) ] AgCl 溶2 溶 溶 电镀效果好,但有剧毒,现逐渐用 AgBr 微溶 不溶 不溶 - 代替 [Ag(SCN) ] 2 AgI 不溶 微溶 溶 溶解 [Ag(NH3)2]+ [Ag(S2O3)2]3- [Ag(CN)2]产物 Kf 1.12×107 2.88×1013 1.99×1038 配离子稳定性增大
再进行曝光、显影、定影,即得照片。
硝酸银
1. 制取: Ag+2HNO3(65%)→ AgNO3+NO2 +H2O 2. 性质: 为易溶于水的无色菱形片状晶体 不稳定,受热或见光易分解 Δ 2AgNO3 2Ag + 2NO2 + O2 AgNO3 应保存在棕色瓶中 具有氧化性,遇微量有机物被还原为Ag 3. 用途:主要用于照相制造溴化银乳剂、 分析试剂
定 影
用定影剂(主要Na2S2O3)处理
AgBr + 2S2O32- → [Ag(S2O3)2]3- + Br亮,Ag 多,底片黑 暗,Ag 少,底片亮
卤化银
敷有AgBr 曝光 (物亮)感光多 显影 Ag多 定影 黑 AgBr多 亮 (物暗)感光少 照相底片
说 明
以上得到的是“底片” 洗相时,将“底片”放在照相纸上
无机化学多媒体电子教案
第十三章 过渡元素
第六节铜族元素
第六节
铜族元素
13-6-1铜族元素概述 13-6-1铜族元素概述
ds ⅠB 区 族 Cu 铜
辉铜矿(Cu2S) 黄铜矿(CuFeS2) 赤铜矿(Cu2O) 孔雀石 (Cu2(OH)2CO3) 蓝铜矿 (Cu3(OH)2(CO3)2
通性 Unn
Ag 银
物理性质
单质
Cu 红色 Ag 银白色 Au 黄色 密度大, 为重金属, 其中金的密度最大。 延展性好。 1g Au 能抽成长 3.4km 的丝, 如黄铜 ——60%Cu 、40%Zn 压成 0.0001mm 厚的薄片 青铜 ——80%Cu 、15%Sn、5%Zn 白铜——50~70%Cu、13~15%Ni、 导电性居金属前列, 13~25%Zn Ag 第一, Cu 第二,Au 第三。 能与许多金属形成合金。
Cu(Ⅱ)与Cu(Ⅰ)的相互转化
Cu(Ⅱ)与Cu(Ⅰ)的稳定性比较 Cu(Ⅰ) Cu(Ⅱ) 价层电子构型 3d10 3d9 固态稳定性 > + 2+ 离子 Cu Cu 由于Cu(Ⅰ)固态稳定 电荷 +1 < +2 所以存在有CuCl、Cu2S、Cu2O 等化合物 半径/pm 96 > 72 水合焓/(kJ· mol-1) -593 > -2100 溶液中稳定性 <
化学性质——化学活泼性差
化学性质——化学活泼性差
单质
Cu :干燥空气中稳定,在含有CO2的 潮湿空气中表面生成铜绿 Ag :室温时不与氧气和水作用,若与 含H2S空气接触,表面蒙上一层Ag2S Cu、Ag :不溶于非氧化性酸,能与硝 酸、热浓硫酸作用 Au:溶于王水 Au+HNO3+4HCl →H[AuCl4]+NO +2H2O
Cu(Ⅱ)与Cu(Ⅰ)的相互转化 在酸性溶液中,Cu+易发生歧化 2Cu+ Cu2+ + Cu K =1.2×106 使Cu(Ⅱ) Cu(Ⅰ) 1. 有还原剂存在 2. 生成Cu(Ⅰ)的难溶物或配离子 2Cu2++SO2+2Cl-+2H2O → 2CuCl +SO42-+4H+ 2Cu2+ + 4I- → 2CuI (白色) + I2 ★ 2Cu2++4CN- → 2CuCN (白色) + (CN)2 KCN过量 CuCN+(x-1)CN-→Cu(CN)x]1-X (x=2~4)
