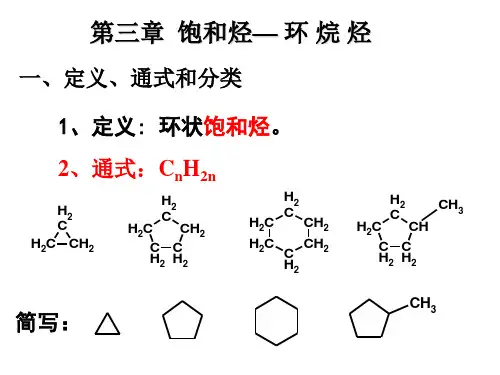
第三章 环烷烃
合集下载
第三章 环烷烃

第三章 环烷烃 (Cycloalkane)
1
主要内容
单环与双环的命名 小环化合物的化学性质 脂肪环的构象与稳定性因素 环己烷及其取代物的优势构象
2
§3.1 环烷烃的分类及命名
1. 环烷烃的分类
按环的大小
小环 (三元环、四元环) 常见环 (五元环、六元环) 中环 (七元环~十二元环) 大环 (十二元环以上)环烷烃
向外扩张了-5º16' 16
24º14'
9º44'
0º44'
环烷烃分子中键角与正四面体键角差值
-5º36'
角张力(angle strain):环的角度与sp3轨道夹角差别引起的张力
环的稳定性: 三元环 < 四元环 < 五元环 化学反应活性:三元环 > 四元环 > 五元环
——角张力学说的合理性 对于中等环和大环化合物,角张力学说的结论与实验 事实不符。
10
§3.2 单环脂环烃的性质
1. 自由基取代反应 : 环烷烃与烷烃相似
Br
300℃ + Br2
+ HBr
2. 加成反应
小环化合物的特殊性质-----易开环加成
11
(1) 加氢
H2 / Ni, 40oC
CH3CH2CH3
H2 / Ni, 100oC
CH3CH2CH2CH3
H2 / Pt, 300oC CH3CH2CH2CH2CH3
§3.4 脂环烃的构象
1. 环丙烷的构象
桥头碳
10 2
1
9
3
8
6
4
7
5
十氢萘
桥头间的碳原子数
(用"."隔开)
1
主要内容
单环与双环的命名 小环化合物的化学性质 脂肪环的构象与稳定性因素 环己烷及其取代物的优势构象
2
§3.1 环烷烃的分类及命名
1. 环烷烃的分类
按环的大小
小环 (三元环、四元环) 常见环 (五元环、六元环) 中环 (七元环~十二元环) 大环 (十二元环以上)环烷烃
向外扩张了-5º16' 16
24º14'
9º44'
0º44'
环烷烃分子中键角与正四面体键角差值
-5º36'
角张力(angle strain):环的角度与sp3轨道夹角差别引起的张力
环的稳定性: 三元环 < 四元环 < 五元环 化学反应活性:三元环 > 四元环 > 五元环
——角张力学说的合理性 对于中等环和大环化合物,角张力学说的结论与实验 事实不符。
10
§3.2 单环脂环烃的性质
1. 自由基取代反应 : 环烷烃与烷烃相似
Br
300℃ + Br2
+ HBr
2. 加成反应
小环化合物的特殊性质-----易开环加成
11
(1) 加氢
H2 / Ni, 40oC
CH3CH2CH3
H2 / Ni, 100oC
CH3CH2CH2CH3
H2 / Pt, 300oC CH3CH2CH2CH2CH3
§3.4 脂环烃的构象
1. 环丙烷的构象
桥头碳
10 2
1
9
3
8
6
4
7
5
十氢萘
桥头间的碳原子数
(用"."隔开)
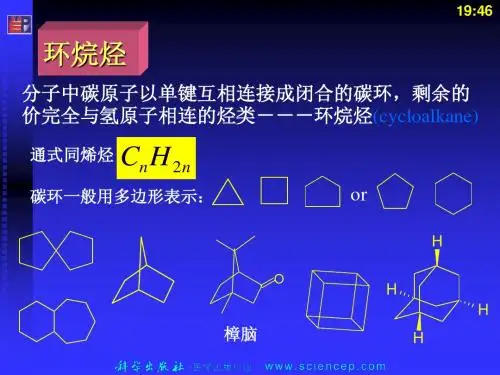
第3 环烷烃

第三章 环烷烃
第三章 环烷烃
• 环烷烃是环状的烷烃。环烷烃分子中碳原子相互以单键联结成闭合碳 环,其余的价全部与氢原子连接。 • 要将链状烷烃变为环状,需将链端两个碳原子上的氢原子去掉,因此 单环烷烃的通式为CnH2n。 • 多环烷烃中每成一个环,氢原子将减少两个,所以双环烷烃的通式为 CnH2n-2。 • 可想而知,环烷烃和烷烃的大多数性质相似。 • 许多有机化合物具有环状结构。
§3.4 环烷烃的稳定性和张力
环的稳定性 与环的大小 有关
环丙烷最不 稳定,环丁 烷次之,环 戊烷比较稳 定,环己烷 以上的大环 都稳定
环稳 定性
环大小
(Aldolf von Baeyer)
1885年拜尔
张力 学说
张力学说假定成环碳原子处于同一平面,并形成等边多 边形:
109.5° 49.5° 60° 109.5° 19.5° 90° 108° 1.5° 109.5°
环戊烷
甲基环丁烷
乙基环丙烷
1, 1-二甲基环丙烷 1, 2-二甲基环丙烷
1, 2-二甲基环丙烷还有顺( cis-,两个取代基在环平面同侧)、反 (trans-,取代基在环平面两侧)异构;反式-1, 2-二甲基环丙烷又有对 映异构。
顺式 bp37℃
反式 bp29℃
顺、反异 构
镜面
对映异构
顺反异构和对映异构都属于立体异构。 顺、反异构属于立体异构中的构型异构,两个顺反异构体之间要相互变 化,必须打开共价键才行,而这在常况下是不可能的。因此,二者是具有 不同物理性质的异构体。
CH3
CH3
CH3
1, 3-二甲基环戊烷
CH3
CH2CH3
反-1-甲基-4-异丙基环己烷
1,4-二甲基-1-乙基环己烷
第三章 环烷烃
• 环烷烃是环状的烷烃。环烷烃分子中碳原子相互以单键联结成闭合碳 环,其余的价全部与氢原子连接。 • 要将链状烷烃变为环状,需将链端两个碳原子上的氢原子去掉,因此 单环烷烃的通式为CnH2n。 • 多环烷烃中每成一个环,氢原子将减少两个,所以双环烷烃的通式为 CnH2n-2。 • 可想而知,环烷烃和烷烃的大多数性质相似。 • 许多有机化合物具有环状结构。
§3.4 环烷烃的稳定性和张力
环的稳定性 与环的大小 有关
环丙烷最不 稳定,环丁 烷次之,环 戊烷比较稳 定,环己烷 以上的大环 都稳定
环稳 定性
环大小
(Aldolf von Baeyer)
1885年拜尔
张力 学说
张力学说假定成环碳原子处于同一平面,并形成等边多 边形:
109.5° 49.5° 60° 109.5° 19.5° 90° 108° 1.5° 109.5°
环戊烷
甲基环丁烷
乙基环丙烷
1, 1-二甲基环丙烷 1, 2-二甲基环丙烷
1, 2-二甲基环丙烷还有顺( cis-,两个取代基在环平面同侧)、反 (trans-,取代基在环平面两侧)异构;反式-1, 2-二甲基环丙烷又有对 映异构。
顺式 bp37℃
反式 bp29℃
顺、反异 构
镜面
对映异构
顺反异构和对映异构都属于立体异构。 顺、反异构属于立体异构中的构型异构,两个顺反异构体之间要相互变 化,必须打开共价键才行,而这在常况下是不可能的。因此,二者是具有 不同物理性质的异构体。
CH3
CH3
CH3
1, 3-二甲基环戊烷
CH3
CH2CH3
反-1-甲基-4-异丙基环己烷
1,4-二甲基-1-乙基环己烷
第3章 环烷烃(武汉大学化学与分子科学学院)

饱和脂环烃— 饱和脂环烃—环烷烃 脂环烃 不饱和脂环烃—环烯烃、 不饱和脂环烃—环烯烃、环炔烃
环丙烷
环丁烷
环戊烷
环己烷
环戊二烯
环己烯
环辛炔
2
目录
3-1 3-2 3-3 3-4 3-5 小结 环烷烃的结构、分类、 环烷烃的结构、分类、异构和命名 环烷烃的稳定性与环大小的关系 环己环及其衍生物的构象 环烷烃的物理性质 环烷烃的化学性质 环烷烃的
5
环烷烃的分类 环烷烃的分类
单环 1. 按环数 二环 多环
小环( 小环(C3-C4) ) 普通环( 普通环(C5-C7) ) 中环( 中环(C8-C11) ) 大环( 大环(> C12) )
螺环:两环共用1 螺环:两环共用1个碳 2. 按环的 连接方式 螺[4.5]癸烷 癸烷 桥环: 桥环:共有两个或三个 以上的碳原子
22
环戊烷的构象:环戊烷具有信封式的构象,键角 戊烷的构象 环戊烷具有信封式的构象,
6
环烷烃的异构: 环烷烃的异构:构造异构和立体异构
构造异构: 1. 构造异构:由于环的大小及取代基位置的不同而有各 种构造异构体。 种构造异构体。 三元环最简单,无构造异构体。 ① 三元环最简单,无构造异构体。 含四个碳原子的单环烃( ),仅有 构造异构体: 仅有2个 ② 含四个碳原子的单环烃(C4H8),仅有 个构造异构体:
命名时,从桥头碳原子开始编号,从最长桥编到另一桥头碳; 命名时,从桥头碳原子开始编号,从最长桥编到另一桥头碳; 然后沿次长桥回到第一个桥头碳; 然后沿次长桥回到第一个桥头碳;再按桥渐短的次序将其余的桥 编号;按所含碳原子的总数,称为某烷。还要标明取代基的位置, 编号;按所含碳原子的总数,称为某烷。还要标明取代基的位置, 数目,名称,所含环的数目,桥的长短。 数目,名称,所含环的数目,桥的长短。
第三章 环烷烃
如何鉴别: 如何鉴别:
CH3-CH=CH2 CH3-CH2-CH3
褪褪 Br2/H2O
褪褪 KMnO4
×
褪褪
×
在强烈条件下,环烷烃也能被氧化。 在强烈条件下,环烷烃也能被氧化。 如:
OH
O
+ O2 (air)
环烷酸钴 140~180℃ ℃ 1-2.5MPa
+
氧化
HOOC
COOH
工业生产己二酸 锦纶-66单体 单体) (锦纶-66单体)
总之: 总之: 三元环的稳定性最小,最易开环; 三元环的稳定性最小,最易开环; 四元环的稳定性次之;也易开环; 四元环的稳定性次之;也易开环; 五元、六元环等,较稳定,不易开环。 五元、六元环等,较稳定,不易开环。 作业 : P73 二(4、5、6) 、 、 )
Ni + H2 200
+ 开环 加
Pt H2 300
CH3-CH2-CH2-CH2-CH3
(2)加成卤素 ) +
常温 Br2 CCl4
Br-CH2-CH2-CH2-Br
+ Br2
CCl4
Br-CH2-CH2-CH2-CH2-Br
棕红色褪去,用以鉴定环丙烷及环丁烷 鉴定环丙烷及环丁烷。 使Br2/CCl4棕红色褪去,用以鉴定环丙烷及环丁烷。
(3)加成卤化氢 )
+ HBr
CH3
CH3CH2CH2Br
+
HBr
CH3CHCH2CH3 Br
带有取代基的小环烷烃加成HX或 带有取代基的小环烷烃加成HX或Br2时,环 HX 的断裂是在取代基最多与最少的两个环碳原子 的断裂是在取代基最多与最少的两个环碳原子 加到含H多的碳上。( P67有错误 。(书 有错误!) 之间, 之间,且H加到含H多的碳上。(书P67有错误!)
《有机化学(第二版)》第3章:环烷烃
三、(小环)环烷烃的化学性质 、(小环) 小环
环烷烃的反应和烷烃相似( 个方面 个方面) 环烷烃的反应和烷烃相似(2个方面) 三元环、四元环不稳定,易开环, 三元环、四元环不稳定,易开环,生成开链化合物 1、氢解 、 Ni 40℃ 常压 ℃ 环丁烷在较高温度下反应: 环丁烷在较高温度下反应:
19:46
4 5 6 1 3
1-甲基 异丙烯基环己烯 甲基-4-异丙烯基环己烯 甲基 苧烯 4-甲基 环己烯 甲基-1-环己烯 甲基
2
如取代基为较长的碳链,将环作为取代基: 如取代基为较长的碳链,将环作为取代基: 3-环己基己烷 环己基己烷
19:46
环烷烃的异构
环的大小、 环的大小、侧链的长短及位置不同而产生构造异构体 4C
1,3-二溴丙烷 二溴丙烷
环丁烷、环戊烷常温下不 环丁烷、环戊烷常温下不和溴起加成反应 高温或者光照下发生取代反应 高温或者光照下发生取代反应
+
3、加HBr 、
+ HBr
Br2
hv
Br
CH 3 CH 2 CH 2 Br
室 温
常温下环丁烷、 常温下环丁烷、环戊烷不与 HBr反应 反应
CH 3 CH CH 2 CH 2 + HBr CH 3 CHCH 2 CH 3 Br 2-溴丁烷 溴丁烷
5
4°4’ °
6
-5°16’ °
7
-9°33’ °
从偏转角度来看,五员环应最稳定, 从偏转角度来看,五员环应最稳定,大于五员环或小于 五员环都将越来越不稳定。但实际上,五员, 五员环都将越来越不稳定。但实际上,五员,六员和更大的 环型化合物都是稳定的。这就说明张力学说存在缺陷。 环型化合物都是稳定的。这就说明张力学说存在缺陷。
第3章 环烷烃

第20页
24。44′
60。
109。28′
90。 (109。28′-90。)/ 2 = 9。44′ 108。 (109。28′-108。)/ 2 = 0。44′
24。44′
120。 ( 120。-109。28′)/ 2 = 5。16′
(109。28′-60。)/ 2 = 24。44′
成功之处:能解释大多数实验事实. 不成功之处:对五员环及六员环的推测不对. 不成功原因:把分子都看成平面,实际上除三员环外,其 它环的碳原子都不在一个平面内.
H
H
在船型构象中,有的C-H键处于重叠式。
H
H H
45
HH 3 H
HH H
6
1
HH
2
H
1
H H
6 5
CCHH22 4
2
3
H H
HH H H
第31页
3.环己烷的α键与e键
α键—竖键(或直立键) e 键—横键(或平伏键)
ee
a 5a
ae6
a e
e
ae
4
3a 2
a
1
a a
a a
a
e e
e
ee e
● 10 4__10 6 秒/次 转环
③母体:按成环碳原子总数称为 “某烷”.
第8页
7
CH1 2CH3 2 CH3
8 CHCH3 3 CH2
6
5
4
2,8-二甲基-1-乙基- 二环[3.2.1] 辛烷
定编号: 编号从一个桥头碳开始,沿最长桥到另一
桥头碳,再沿次长桥回到起始桥头碳,最后是最 短桥的碳原子.
写取代基:
将取代基位次和名称放在“二环”之前即可.
24。44′
60。
109。28′
90。 (109。28′-90。)/ 2 = 9。44′ 108。 (109。28′-108。)/ 2 = 0。44′
24。44′
120。 ( 120。-109。28′)/ 2 = 5。16′
(109。28′-60。)/ 2 = 24。44′
成功之处:能解释大多数实验事实. 不成功之处:对五员环及六员环的推测不对. 不成功原因:把分子都看成平面,实际上除三员环外,其 它环的碳原子都不在一个平面内.
H
H
在船型构象中,有的C-H键处于重叠式。
H
H H
45
HH 3 H
HH H
6
1
HH
2
H
1
H H
6 5
CCHH22 4
2
3
H H
HH H H
第31页
3.环己烷的α键与e键
α键—竖键(或直立键) e 键—横键(或平伏键)
ee
a 5a
ae6
a e
e
ae
4
3a 2
a
1
a a
a a
a
e e
e
ee e
● 10 4__10 6 秒/次 转环
③母体:按成环碳原子总数称为 “某烷”.
第8页
7
CH1 2CH3 2 CH3
8 CHCH3 3 CH2
6
5
4
2,8-二甲基-1-乙基- 二环[3.2.1] 辛烷
定编号: 编号从一个桥头碳开始,沿最长桥到另一
桥头碳,再沿次长桥回到起始桥头碳,最后是最 短桥的碳原子.
写取代基:
将取代基位次和名称放在“二环”之前即可.
有机化学第三章环烷烃
2-甲基-4-环己基己烷 4-cyclohexyl-2-methylhexane
侧链比较简单, 以环为母体, 链为取代基,
侧链比较复杂, 以链为母体, 环为取代基。
CH3
实 例 二
CH2CH3 H3C
1,4-二甲基-2-乙基环己烷 2-ethyl -1,4-dimethylcyclohexane
CH3
螺原子
螺[2.4]庚烷
桥头碳
二环[2.2.1]庚烷
(A) 螺化合物的命名: (a) 组成环的碳原子总数命名为“某烷”,加上词头“螺”. (b) 再把连接于螺原子的两个环的碳原子数(不含螺原子),按由 小到大的次序写在“螺”和“某烷”之间的方括号里,数字 用圆点分开. 例1:
螺原子
螺[2.4]庚烷
例2:
顺反异构体
镜 面
H
CH3
H
CH3
CH3
H
H3C
CH3
H3C
CH3
顺反异构用 “顺”或“反” 注明基团相对位 置。 英文用 “cis”和“trans” 表示。
反-1,3-二甲基环戊烷(两者为对映异构体) (trans-1, 3-dimethylcyclopentane)
4
3
环丙基环己烷 cylcopropylcyclohexane
实 例 四
H3C H
CH3 H
带有二个或二 个以上取代基 时,分子有对 称性,构型用 顺、反表示(
顺-1,2-二甲基环丙烷 cis-1,2-dimethylcyclopropane
英文用 “cis”
和“trans”表 示)。
二、双环化合物的命名
其中两个碳环共用一个碳原子的叫螺环化合物. 共用两个或以上碳原子的叫桥环化合物.
第 三 章环 烷 烃(Cycloalkanes)
④. 写法:
第 三 章环 烷 烃(Cycloalkanes)
9
位次 ( 取代基位置 半
取代基名称
相
几环[a
.
b
.
c]某烷
用
字
同 的
阿
线取
除
由
桥
大
拉 )代
头
桥
伯
基
碳
到
数
合
外
小
字
并
每
桥
,
数 字
起
个
。
来 ,
桥
间
用
中
用
一
的
逗
、
碳
二 第 三 章环 烷 烃(Cycloalkanes)
10
8 H3C1 2
3
CH2
(Physical Properties,Chemical Reactions of Cycloalkanes)
1. 物理性质(自学)
2. 化学反应 1). 取代反应
+Br2 hν
Br +HBr
机理:自由基机理
取代反应一般在五、六元环上易发生。
2). 加成反应
小环易发生第加三成章环反烷 烃应(Cy。cloalkanes)
扭船式
椅式
第 三 章环 烷 烃(Cycloalkanes)
31
2. 取代环己烷的构象 1). 一取代环己烷的构象
结论:一取代环己烷最稳定构象是取代基在e键上。
例:
H HH
H H
H
H
H
H HH H
HH
95%
HH H
HH
HH
H
H H
HH H
第三章 环烷烃
a.命名与开链烃相似:以不饱和碳环为母体,侧链为取代基。 b.碳环上的编号顺序:应是不饱和键所在的位置号码最小。 c.对于只有一个不饱和键的环烯(或炔)烃,双键或叁键位置可不标。
环戊烯
环辛炔
1,3-环己二烯
带有侧链的环烯烃命名:
a. 若只有一个不饱和碳上有侧链,该不饱和碳编号为1; b. 若两个不饱和碳都有侧链或都没有侧链,则碳原子编号顺序除双 键所在位置号码最小外,还要同时以侧链位置号码的加和数为最 小。
第三章 环烃
第一节 脂环烃
脂环族化合物:结构上具有环状碳骨架,性质与开链化合物相似的
一类化合物。脂环烃:只有C、H两种元素组成的脂环化合物。
一、脂环烃的分类
1、按碳环数分:单环脂环烃;二环脂环烃和多环脂环烃等
CH3
十氢化萘
降冰片烷
螺[2,4]庚烷
立方烷
棱烷
蓝烷
金刚烷
2、按成环碳原子数分:三元环、四元环、五元环脂环烃等
环己烷不是平面结构,较为稳定的构象 为折叠的船型构象和椅型构象。
1
(Ⅰ)
6 1
2
3 5 3 2 5
4
(Ⅱ)
6
4
Ⅰ
Ⅱ
在(Ⅰ)和(Ⅱ)中,C2、C3 、C5 、C6都在一个平面内,但在(Ⅱ)
中,C1和C4在平面的同一侧,这种构象叫船式构象;而在(Ⅰ)
中,C1和C4在平面的上下两侧,这种构象叫椅式构象
HH3C 3C
11
1 C1-C2 1 C1-C2
C5-C4 6 C5-C4 6 C1-C2 C1-C2 C5-C4 C5-C4
4
HH HH3C 2 3C HH HH
2
H H
6 6 44 55
环戊烯
环辛炔
1,3-环己二烯
带有侧链的环烯烃命名:
a. 若只有一个不饱和碳上有侧链,该不饱和碳编号为1; b. 若两个不饱和碳都有侧链或都没有侧链,则碳原子编号顺序除双 键所在位置号码最小外,还要同时以侧链位置号码的加和数为最 小。
第三章 环烃
第一节 脂环烃
脂环族化合物:结构上具有环状碳骨架,性质与开链化合物相似的
一类化合物。脂环烃:只有C、H两种元素组成的脂环化合物。
一、脂环烃的分类
1、按碳环数分:单环脂环烃;二环脂环烃和多环脂环烃等
CH3
十氢化萘
降冰片烷
螺[2,4]庚烷
立方烷
棱烷
蓝烷
金刚烷
2、按成环碳原子数分:三元环、四元环、五元环脂环烃等
环己烷不是平面结构,较为稳定的构象 为折叠的船型构象和椅型构象。
1
(Ⅰ)
6 1
2
3 5 3 2 5
4
(Ⅱ)
6
4
Ⅰ
Ⅱ
在(Ⅰ)和(Ⅱ)中,C2、C3 、C5 、C6都在一个平面内,但在(Ⅱ)
中,C1和C4在平面的同一侧,这种构象叫船式构象;而在(Ⅰ)
中,C1和C4在平面的上下两侧,这种构象叫椅式构象
HH3C 3C
11
1 C1-C2 1 C1-C2
C5-C4 6 C5-C4 6 C1-C2 C1-C2 C5-C4 C5-C4
4
HH HH3C 2 3C HH HH
2
H H
6 6 44 55
有机化学第三章环烷烃
※ 在不同的环烃中键角大于或小于 109o28’,而正常的 SP3 杂化轨道之间的夹角为 109°28′ 即 C - C 之间的电子云 没有达到最大程度的重叠。
1 (109° 28′-60° )= 24° 64′ 2 1 (109° 28′-90° )= 9° 44′ 2 1 (109° 28′-108° )= 0° 44′ 2 1 (109° 28′-120° )= -5° 16′ 2
两个环共用两个或两个以上碳原子的化合物称桥环化合物。
3、环戊烷的结构
C:sp3杂化,轨道夹角109.5o,五边形内角为108o角张力: 109.5-108=1.5o 可见,环戊烷分子中几乎没有什么角张力,故五元 比较稳定,不易开环,环戊烷的性质与开链烷烃相似。
事实上,环戊烷分子中的五个碳原子亦不共 平面,而主要是以“信封式”构象存在,使 五元环的环张力可进一步得到缓解。
二、化学性质
结构分析:C-C, C-H σ键牢固,化性稳定,似烷烃;
但C3—C4环易破,环可以加成,似烯烃。
1、取代反应
+ Cl2 光照 + HCl Cl Cl + HCl
+ Cl2
加热 300oC
反应条件加强, 反应程度减弱。
2、加成反应
小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 A: 加氢(随碳原子数增加,环的稳定性增加;加氢反应条 件也愈苛刻)
7 6 5 4 3
9 1 2 8
10
1 2 5
7
6
5 4
3 2 1 CH3
7 CH3
6
4
3
8
9
螺[2, 4]庚烷
7-甲基螺[4, 5]癸烷
1-甲基螺[3,5]-5-壬烯
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CH3 CH3CHCH3
构造——分子中各原子的连接顺序。 分子中各原子的连接顺序。 构造 分子中各原子的连接顺序 CH3 CH3 构型 3 构造相同,原子 CH 构造相同, 构型 顺反异构 构型——构造相同 空间连接次序不同 不同。 异构 对映异构 的空间连接次序不同。 CH3 立体 异构 构象——构造、构型相同,原子 构造、 构造 构型相同, 构象 构象 空间相对次序不同 不同。 异构 的空间相对次序不同。
(1)在烷烃分子中,C(sp3杂化)与其它四个原子相连时,任 ) 烷烃分子中 ( 杂化)与其它四个原子相连时, 何两个键之间的夹角均为四面体角, 称为“正常键角” 何两个键之间的夹角均为四面体角,即109.50,称为“正常键角”。 杂化) (2)在环烷烃分子中,每个 (sp3杂化)上的两个键角不能是 ) 环烷烃分子中 每个C 正常键角(称为“实际键角” 正常键角 (称为“ 实际键角 ” ), 必须压缩到一定角度才能适应 环的几何形状。 环的几何形状。 例如,在环丙烷分子中,三个C在同一平面上 环是正三角形, 在同一平面上, 例如, 在环丙烷分子中,三个 在同一平面上, 环是正三角形, 而不是109.50,因此,相邻两 以sp3杂化轨道 因此,相邻两C以 ∠ C—C—C = 600,而不是 交盖形成C-Cσ键时,只能以弯曲的方式交盖。 键时, 交盖形成 键时 只能以弯曲的方式交盖。
环丙烷 丙烷
溴水
室温褪色 不褪色
(3)加HX )
CH2 + HBr H Br CH2 CH2
重要结论:环丙烷的烷基衍生物与 加成时, 重要结论:环丙烷的烷基衍生物与HX加成时,环的断裂发 加成时 生在连接H最多和最少的两个 之间; 中的 加到含H较多 最多和最少的两个C之间 中的H加到含 生在连接 最多和最少的两个 之间;HX中的 加到含 较多 加到含H较少的 的C上,X加到含 较少的 上。 上 加到含 较少的C上
环烷烃的沸点、 环烷烃的沸点、熔点和 环烷烃的分子结构比链烷烃对称性高、 环烷烃的分子结构比链烷烃对称性高、排列紧密 相对密度都较含同数碳 原子的开链脂肪烃为高
3-7 环烷烃的化学性质
对于环戊烷和环已烷, 分子中的键与开链烃中的键相同, 对于 环戊烷和环已烷,分子中的键与开链烃中的键相同 , 环戊烷和环已烷 同烷烃的性质,易发生取代反应。 同烷烃的性质,易发生取代反应。 取代反应 对于环丙烷及环丁烷 , 分子中的键是“ 弯曲键” 对于 环丙烷及环丁烷,分子中的键是 “ 弯曲键 ” , 具有 环丙烷及环丁烷 一定的烯烃的性质,可以开环发生加成反应。 一定的烯烃的性质,可以开环发生加成反应。 加成反应
第三章 环烷烃
3.1 环烷烃的分类 3.2 环烷烃的命名 3.3 环烷烃的异构现象 3.4 环烷烃的结构 3.5 环烷烃的工业来源 和制法 3.6 环烷烃的物理性质 3.7 环烷烃的化学性质 掌握:环己烷的构象, 掌握:环己烷的构象,环烷烃的化 学性质:取代反应、开环反应。 学性质:取代反应、开环反应。 了解:脂环烃的分类、顺反异构, 了解:脂环烃的分类、顺反异构, 烷烃稳定性的理论解释。 烷烃稳定性的理论解释。 讲课要点: 讲课要点: 1.环烷烃的分类 结构、 环烷烃的分类、 1.环烷烃的分类、结构、顺反异构 及命名 2.环己烷及衍生物的构象 2.环己烷及衍生物的构象 3.环烷烃的张力学说和稳定性 3.环烷烃的张力学说和稳定性 4.环烷烃的化学反应 4.环烷烃的化学反应
Ni 80 C Ni 200 C
o o
(1)加氢
+ H2
CH3CH2CH3
+ H2
CH3CH2CH2CH3
(2)加X2
CCl4 80 C
o
+ Br2
CH2 Br CH2 Br
CH2
CH2 Br
+ Br2
CH2
CH2
CH2 Br
不能用溴褪 色的方法来 区别环烷烃 与烯烃! 与烯烃!
问:如何鉴别丙烷和环丙烷? 如何鉴别丙烷和环丙烷?
小环(3-4);普通环(5-7);中环(8-11);大环(≥12) 小环( );普通环( 普通环 );中环( 11);大环( 12) 中环 );大环
单环环烷烃的通式C 单环环烷烃的通式CnH2n。
3-2 环烷烃的命名
命名规则 (1)根据分子中成环碳原子数目,称为环某烷。 根据分子中成环碳原子数目,称为环某烷。
3-5 环烷烃的工业来源和制法
自学
3-6 环烷烃的物理性质
与烷烃相似
随含C数增加 沸点升高; 数增加, (1)沸点、沸点 随含 数增加,沸点升高; )沸点、 增加, (2)相对密度 )相对密度——随C增加,小于水。 随 增加 小于水。 3)溶解度——不溶于水 (相似相溶 不溶于水。 相似相溶) (3)溶解度——不溶于水。(相似相溶)
OH 钴催化剂 + O2 + 140oC-180oC,1-2.5MPa + O3 O CH3 CH3 OH
Co催化剂、HAc、100oC + O2 或浓硝酸、
CH2 CH2CH2 C源自2COOH COOH空 气 , H 3 BO 3 150~160 。 C
OH
+
O
环十二烷
环十二醇
环十二酮
三、小环的加成反应(C3,C4) 小环的加成反应(C3,C4) 三元环比四元环更易开环,环戊烷和环己烷稳定, 三元环比四元环更易开环,环戊烷和环己烷稳定,难于 加成,温度升高,则发生自由基取代。 加成,温度升高,则发生自由基取代。
加成反应——在反应中,化学键断裂,该化学键所连的两个 在反应中,化学键断裂, 加成反应 在反应中 碳原子和其它原子或原子团结合,形成新的化学键。 碳原子和其它原子或原子团结合,形成新的化学键。
一、取代反应(C5,C6) 取代反应(C5,C6)
Cl 紫外光 + Cl2 + HCl
二、氧化反应 在常温下,环烷烃不能与KMnO 反应,因此, 在常温下,环烷烃不能与KMnO4反应,因此,可用于鉴别 烯烃与环烷烃。但在加热或在催化剂存在下也能被氧化。 加热或在催化剂存在下也能被氧化 烯烃与环烷烃。但在加热或在催化剂存在下也能被氧化。
键角偏差减小, 键角偏差减小, 角张力减小, 角张力减小, 稳定性增大。 稳定性增大。
– 1080 = 1.50
环己烷: 环己烷:109.50 - 109.5 ≈ 00 对于环烷烃,随环的增大,弯曲程度小,键角接近正常, 对于环烷烃,随环的增大,弯曲程度小,键角接近正常, 角 张力逐渐减小,分子趋于稳定。 张力逐渐减小,分子趋于稳定。
CH2 CH2
C CH3
维生素A 维生素
3-1 环烷烃的分类
环烷烃:分子中含有碳环结构且性质与烷烃相似的碳氢 环烷烃:
化合物(即分子中含有C 化合物(即分子中含有C-C和C-H的一类环状化合物)。 的一类环状化合物) 按碳环的数目分三类: 按碳环的数目分三类:
多环 单 双
环己烷
十氢化萘
金刚烷
通常所说环烷烃指单环烷烃。按成环碳原子数分类: 通常所说环烷烃指单环烷烃。按成环碳原子数分类:
沿键轴 CH3 CH3旋转1800 CH3 H ①分子中存在限制旋 旋转180 H–C—–C–H H–C—–C–H 转的因素, 转的因素,如:环 H H H CH3 CH3 至少有两个C, ②至少有两个 ,分别 连两个不同的基团
=
碳链异构 CH3CH2CH2CH3 构造 官能团位置异构 异构 官能团异构 同分 异构
顺 1,2
反1,2
上述顺和反上述顺和反-1,2-二甲基环丙烷的特点:构造相同(分子的排 二甲基环丙烷的特点:构造相同( 列顺序) 分子中原子在空间的排列(构型)不同, 列顺序),但分子中原子在空间的排列(构型)不同,叫构 型异构体,也叫顺-反异构。 型异构体,也叫顺-反异构。
产生顺反异构的必要条件
3-4 环烷烃的结构
一、环的大小与稳定性 (1)环烷烃的稳定性顺序 环越小,越不稳定,能量越高。 实验结论 :环越小,越不稳定,能量越高。
<
<
<
(2)现代结构理论解释 ) ——杂化轨道理论和 杂化轨道理论和Baeyer张力学说 :成环碳原子的 3 杂化轨道理论和 张力学说 成环碳原子的sp 杂化轨道未能形成最大程度交盖。具体地说: 杂化轨道未能形成最大程度交盖。具体地说:
1-甲基 乙基环己烷 甲基-3-乙基环己烷 甲基
(3)当环上只有一个取代基时,不需要注明位次。 )当环上只有一个取代基时,不需要注明位次。
练习
CH3
C2H5 CH3
CH2CH3
C2H5
CH(CH3)2
Cl
1-甲基 甲基-3-乙基 氯 乙基-4氯 甲基 乙基 环己烷
1-甲基 甲基-2-乙基 乙基-5甲基 乙基 异丙基环己烷
二、顺反异构 由于环的存在,限制了键的自由旋转, 由于环的存在,限制了键的自由旋转,当两个或两个以上 成环碳原子分别连有不同的原子或基团时,产生顺反异构现象。 成环碳原子分别连有不同的原子或基团时,产生顺反异构现象。 顺反异构现象
在环烷烃分子中(看成是平面),连有 在环烷烃分子中(看成是平面) 两个相同基团时 两个相同基团位于环平面同侧——顺式 两个相同基团位于环平面同侧 顺式 两个相同基团位于环平面两侧——反式 两个相同基团位于环平面两侧 反式
即相邻两个sp 即相邻两个 3杂化轨道对称 轴不在一条直线上, 轴不在一条直线上 , 这样形 成 的 C-Cσ 键 是 弯 曲 的 —— “弯曲键” (香蕉键)。 弯曲键” 香蕉键) 弯曲键 环丙烷分子中的键
实际键角” 正常键角”的偏差, (3) “实际键角”与“正常键角”的偏差,引起了分子 内存在着一定的力——角张力( ——角张力 内存在着一定的力——角张力(力图使实际键角恢复到正常键 角。 环丙烷: 环丙烷:109.50 – 环丁烷: 环丁烷:109.50 环戊烷:109.50 环戊烷: – 600 = 49.50 900 = 19.50
