第三章饱和烃环烷烃讲解
饱和烃

CH3 1 6 5 4
2 CH2CH3
3
甲基环戊烷
1,2-二甲基环己烷
1-甲基-3-乙基环己烷
• 二环脂环烃
指分子碳架中含有两个碳环的烃。它又分为: 联环烃 螺环烃(螺烃) 桥环烃(桥烃)
联二环己烷
螺[4.4]壬烷
二环[4.4.0]癸烷 (十氢化萘)
二环[2.2.1]庚烷 (降冰片烷)
(1) 桥环烷烃
ethylene-
C(CH3)2 亚异丙基
CH2(CH2)4CH2 1,6-亚己基(或六亚甲基)
主要应用于烯烃的命名
3) 常见环烷基 p.27
(3)烷烃的命名
(A)普通命名法(习惯命名法) • 碳原子数用“天干”字——甲、乙、丙、丁、戊、己、
庚、辛、壬、癸和十一、十二……等数目字表示。 体。 CH3
CH2CH3
CH3
CH3
CH3
CH3
CH3
环戊烷 甲基环丁烷
乙基环丙烷 1,1-二甲基环丙烷 1,2-二甲基环丙烷
(二)烷烃和环烷烃的命名
(1)烷基(alkyl)的概念
(甲)伯、仲、叔、季碳原子和伯、仲、叔氢原子
H H CH3CH3 H C C C C CH3 H H H CH3 1
。
2
。
3
。
4
。
饱和烃(烷烃和环烷烃)
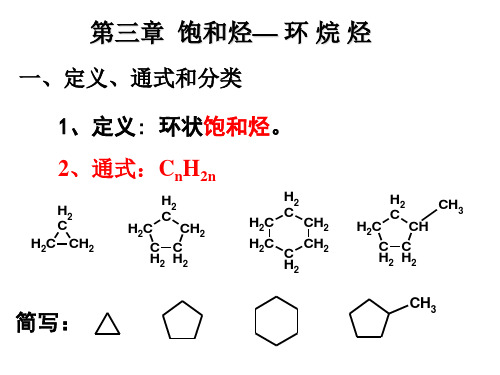
烷烃:指由碳和氢两种元素组成的饱和、开链有机化合物。 环烷烃: 是由碳和氢两种元素组成的一类饱和碳环化合物。
• • • • • •
(一)通式和构造异构 (二)命名 (三)结构 (四)构象 (五)物理性质 (六)化学性质
(一)烷烃和环烷烃的通式和 构造异构
烷烃通式为:CnH2n+2,n为碳原子个数
环烷烃1ppt课件

环辛烷 环壬烷 环癸烷
663.8 664.6 663.6
环十四烷 658.6 环十五烷 659.0
对比:开链烷烃每个CH2的燃烧热:658.6 KJ/mol
稳定性: 普通环 > 中环:> 小环
环的张力越小,相应的环烷烃越稳定。
环丙烷的结构: CH3
H
H
C
C H 2 1 0 9 .5 ° CH3
HC H
➢ 相同环连结时,可 用词头“联”开头。
顺反异构体:
由于环状结构,环烷烃有两个侧面:“上”方和“下” 方。因此,取代环烷烃可能存在同分异构现象。例如,有两 个1,3-二甲基环戊烷同分异构体:一个异构体的两个甲基在 环的同侧,另一个异构体的两个甲基在环的两侧。两个异构 体都是稳定的化合物。
CH3 CH3
➢ 了解三元和四元环化合物的活性,掌握相应的特殊化学性质。 ➢ 掌握环丙烷和环丁烷的结构特点(有角张力)和构象。 ➢ 了解并掌握环戊烷的构象。
➢ 掌握几种类型环烷烃(普通环烷烃、桥环烃和螺环烃)的命名
方法。
课后练习:p61 (一)、(十)
3 CH3CHCH2CH3
1
主要产物
H2 / Pt, 120oC or Ni, 200oC
CH3CH2CH2CH3
支链多 较稳定
➢ 小环化合物与卤素的反应
Br2 / r.t. Cl2 / FeCl3
Br2 / r.t.
Br Br CH2CH2CH2CH2
(离子型) 加成反应
不反应(难开环)
C H 4 + 2 O 2 C O 2 + 2 H 2 O + 燃 烧 热
环烷烃的燃烧热数据
小 C3 环 C4
普 C5 通 环 C7
有机化学第三章环烷烃
2、加成反应 、
小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 A: 加氢(随碳原子数增加,环的稳定性增加;加氢反应条 加氢(随碳原子数增加,环的稳定性增加; 件也愈苛刻) 件也愈苛刻)
Ni + H2 40 C Ni 110 C Pt 330 C以 上 以
互为构象异构体。 互为构象异构体。
重叠式构象
交叉式构象
一、环己烷的构象
1918年 Mohr提出非平面无张力环学说,提出环已烷 年 提出非平面无张力环学说, 提出非平面无张力环学说 的六个碳原子都保持正常键角109o28’的椅式和船式构象。 构象。 的六个碳原子都保持正常键角 的椅式和船式构象
1、椅式构象(稳定的极限构象) 椅式构象(稳定的极限构象)
环 丁烷 环 丙烷 cyclopropane cyclobutane
环戊烷 cyclopentane
CH3 CH3 A: Isopropylcyclopentane
CH2CH2CH2CH2CH3 B: 1-Cyclobutylpentane
C3
2
4
D
1
5 4 3 2
E
CH3 CH3 CH CH3
F
CH3 CH3 CH3CCH CH3 Br
+ HBr
3、氧化反应 、
a)小环不被高锰酸钾,臭氧所氧化 )小环不被高锰酸钾,
+ KMnO4 + O3 H+ × H+ ×
应用:鉴别小环与不饱和烃类化合物 应用:
CH3 CH=C H 3C H3C CH3 KMnO4 H3C H
+
COOH +
环烷烃

+ HBr
(主)
2013-11-18 30
四、氧化反应
环丙烷与烯烃既类似又有区别,环丙烷
有抗氧化能力,不使KMnO4水溶液褪色。
应用:环丙烷和不饱和烃
2013-11-18
31
空气 钴盐 OH
+
O
O
O2
O
+
O
2013-11-18
32
3.5 环烷烃的稳定性
椅式
2013-11-18
50
1 3 4 5 2 6
半椅式
2013-11-18 51
4
5
6
1
3
2
船式
2013-11-18 52
扭船式
2013-11-18 53
1. 椅式
5 4 3
6 2
1
2013-11-18
54
4
5
6
3
2
C3
1
碳1、2、4、5在同一平面上,是椅座。 碳1、5、6在同一平面上,是椅背。 碳2、3、4在同一平面上,是椅腿。
转角,并且环越大,偏转角越大,张力越大。
这一推论不正确。这是由于张力学说前提
不合理,即环中碳原子在同一平面内不合理。 拜尔张力学说存在于小环中。
2013-11-18 38
二、分子中的张力
现代理论认为:分子能量的升高,都是分
子中存在张力的结果。有机分子中可能存在 的张力主要有4种。 (1)Van der Waals张力——非键作用力。Enb (2)键张力——键长偏离正常值引起的张力。El
CH3 CH3
1,1-Dimethylcyclohexane
烷烃、环烷烃

烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的一类有机化合物。
烷烃分子里的碳原子之间以单键结合成链状(直链或含支链)外,其余化合价全部为氢原子所饱和。
烷烃分子中,氢原子的数目达到最大值,它的通式为CnH2 n+2。
分子中每个碳原子都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
连接了1、2、3、4个碳的碳原子分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原子分别叫做伯、仲、叔氢。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体(tetrahedro n)。
甲烷是标准的正四面体形态,其键角为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。
直链烷烃是最基本的结构,理论上这个链可以无限延长。
在直链上有可能生出支链,这无疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数目会迅速增长烷烃还可能发生光学异构现象。
当一个碳原子连接的四个原子团各不相同时,这个碳就叫做手性碳,这种物质就具有光学活性。
烷烃失去一个氢原子剩下的部分叫烷基[1],一般用R-表示。
因此烷烃也可以用通式RH来表示。
烷烃最早是使用习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使用。
于是有人提出衍生命名法,将所有的烷烃看作是甲烷的衍生物,例如异丁烷叫做2-一甲基丙烷。
现在的命名法使用IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。
第三章 环烷烃
如何鉴别: 如何鉴别:
CH3-CH=CH2 CH3-CH2-CH3
褪褪 Br2/H2O
褪褪 KMnO4
×
褪褪
×
在强烈条件下,环烷烃也能被氧化。 在强烈条件下,环烷烃也能被氧化。 如:
OH
O
+ O2 (air)
环烷酸钴 140~180℃ ℃ 1-2.5MPa
+
氧化
HOOC
COOH
工业生产己二酸 锦纶-66单体 单体) (锦纶-66单体)
总之: 总之: 三元环的稳定性最小,最易开环; 三元环的稳定性最小,最易开环; 四元环的稳定性次之;也易开环; 四元环的稳定性次之;也易开环; 五元、六元环等,较稳定,不易开环。 五元、六元环等,较稳定,不易开环。 作业 : P73 二(4、5、6) 、 、 )
Ni + H2 200
+ 开环 加
Pt H2 300
CH3-CH2-CH2-CH2-CH3
(2)加成卤素 ) +
常温 Br2 CCl4
Br-CH2-CH2-CH2-Br
+ Br2
CCl4
Br-CH2-CH2-CH2-CH2-Br
棕红色褪去,用以鉴定环丙烷及环丁烷 鉴定环丙烷及环丁烷。 使Br2/CCl4棕红色褪去,用以鉴定环丙烷及环丁烷。
(3)加成卤化氢 )
+ HBr
CH3
CH3CH2CH2Br
+
HBr
CH3CHCH2CH3 Br
带有取代基的小环烷烃加成HX或 带有取代基的小环烷烃加成HX或Br2时,环 HX 的断裂是在取代基最多与最少的两个环碳原子 的断裂是在取代基最多与最少的两个环碳原子 加到含H多的碳上。( P67有错误 。(书 有错误!) 之间, 之间,且H加到含H多的碳上。(书P67有错误!)
有机化学课件-3-环烷烃
105.5o,H-C-H键角114º:
HH
C
H
H
CC
H
H
C-C弯曲键电子云重叠面积较链状烷烃的小,故键的稳定性
较低。
(二)环丁烷和环戊烷:
环丁烷与环丙烷相似,C-C键也是弯曲的,C-C-C键角约111.5º, 其中四个C不在同一平面。呈信封式结构。
十氢萘有两种顺反异构体:
H
顺式:
或
H
H
反式:
或
H
Bp(0C) 187.3
195.7
顺式的构象: 反式的构象:
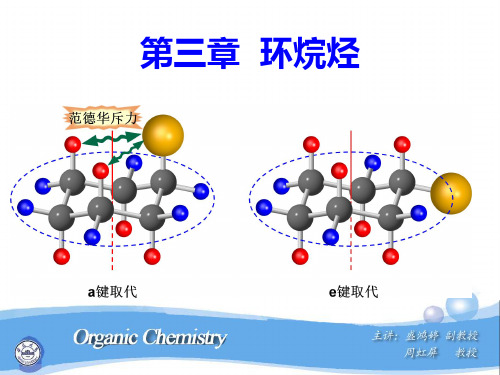
a
H
e
H H
e
e
H
反式的十氢萘内能更低一些;
H
H
Pd
500oC
H
H
9%
91%
4
5
6
7
8
△ H[(CH2)n]
n
-697.1 -686.2 -664 -658.6 -662.4 -663.6
(kJ/mol)
从环烷烃的开环反应条件(见本章§2)及燃烧热数据可以看出: 环丙烷最不稳定,环丁烷次之,环戊烷比较稳定,环己烷以上的 大环都稳定,这反映了环的稳定性与环的结构有着密切的联系。
H
H
HH
H
HH
H
环戊烷分子中,C-C-C夹角为108°,接近sp3杂化轨道间夹角
109.5°,环张力甚微,是比较稳定的环。因此,环戊烷的化学性
质稳定。
H
H H
H
H
H H
H HH
(三)环己烷
所有键的键角都接近于理想sp3杂化的109.50,故最稳定;
胡宏纹第四版有机化学-第三章 环烷烃(上下)(完整版)
1,5-二甲基螺 [3,5]壬烷
7
6
12
2
54
3
2,7,7-三甲基二环[2,2,1]庚烷
CH3
1
56
4
3
9
7 8
2,8-二甲基-1-乙基二环[3,2,1]辛烷
1,8-二甲基-2-乙基-6-氯-双环[3,2,1]辛烷
8
1
7
2
8
71
6
2
1 8
2 10
97
3
Cl 6 5 4
3
5
43
65 4
三环[3,3,11,5 ,13,7 ]癸烷
Br
Br + HBr
CH2CH2Br
+ Br2
rt
Br
FeBr3
C: 与卤化氢加成
+ HBr
CH3CH2CH2Br
+ HBr
CH3CHCH2CH3
Br
规律:环丙烷衍生物与HX加成时,环的破裂处发生在
连接烷基最多的和最少的碳原子间,加成时产
物符合马氏规则,卤素加在含H较少的C上,H
加
在含H较多的C上。
7
6
1
5
32
4
9 10 1
2 8
5
3
7
64
CH3
螺[2, 4]庚烷
7-甲基螺[4, 5]癸烷
9 10 1
5 8
母体为:螺[3,4]辛烷
65 3
5-甲基螺[3,4]辛烷
7 8
4 2
1 9
CH3
2
1-甲基螺[3,5]-5-壬烯
螺[4,5]-1,6-癸二烯
3
76 4
有机化学第三章饱和烃
根据烃分子中碳原子间连接方式可分为:
饱和烃:链烷烃 链烃 不饱和烃: 烯烃 炔烃 饱和烃:环烷烃 不饱和烃:环烯烃 环炔烃
芳香烃: 苯,萘,蒽,菲等
烃
环状烃
烃:只由C、H两种元素组成的有机化合物。 烷烃:包括链烷烃和环烷烃
cubane adamantane
甾族化合物:
甾族化合物的结构特征是包含一个四环稠合的碳环骨架, 同时还有三个侧链。 CH
3
甾环结构:
1 2 3
H3C
11 9 B 6
12
H3C
R
17 D 16 15
HO H3C H
H3C H H
CH CH2 CH2 CH2 CH CH3 H CH3
C
13 14
A 10 4 5
0
60
120
180
240
300
360
degrees of rotation
CH 3 H H CH 3 H H
CH3 H3C H H H H
3. 其它烷烃的构象
例:画出化合物
H 3C H Br
2
CH3 Br 的 全 交叉式 和 全重 叠 式 构 象
3
H
H H3C Br
H3C H3C
Br Br
Br H
2、
(CH3CH2)2CHCHCH2CH3
3-甲基-4-乙基己烷
CH3
3、
(CH3)2CHCH2CH2CHCHCH2CH3 CH3
CH3
2,5,6-三甲基辛烷
4、
CH3CH2CHCH2CHCHCH2CH2CH2CH(CH3)2 CH3 CH2CH(CH3)2
第三章--环烷烃PPT课件
Cyclohexane
船 式 构 象 球 棒 模 型
32
Cyclohexane
船 式 斯 陶 特 模 型
33
转环作用中的能量变化
半椅式
船式
扭船式
椅式
34
环己烷的椅式构象最稳定
✓ 角张力为0
✓ 采取邻位交叉式构象,扭转张力最小
✓
1,3-二a键相互作用小。因为H原子 范德华半径小,所以范德华张力为0
环数:使环状化合物 变成开链化合物所需 打破的碳碳键的数目
单环: 如
C
H
C
2
H
2
C
H
2
(
环
丙
烷
)
、
(环 己 烷 )
二环:如
(十 氢萘) 又叫二 环[4.4.0]癸烷
多环:二环以上。 如 金刚烷
螺环:共有1个碳 如 按环的连接方式 稠环:共有2个碳 如十氢萘
桥环:共有2个以上碳原子 如
3
二. 单环烷烃的命名
1,1-二甲基-4-乙基环己烷
4-Ethyl-1,1-dimethylcyclohexane 7
例3
CH3
CH3 CH CH3
CH 3 CH 2 C CH 2 CH 3 CH 3
1-甲基-2-异丙基环己烷 1-甲基-2-(1-甲基乙基)环己烷
3-甲基-3-环丁基环戊烷 (长链作母体) 8
环烷烃顺反异构
h
C H 2 H 2 CC H C l+ H C l
甲基环己烷+氯r
+Br2
Br
3. 环烯烃的氧化
O 3 Z n /H 2 O C H 3 C O C H 2 C H 2 C H (C H 3 )C H O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Cl + HCl
+ Cl2 光或热
Cl + HCl
(2) 氧化反应 ?据此室可温区下别,环C烷=烃C和不C能≡使C。KM例n:O4褪色,
CH2=CH2 KMnO4
紫色退去 不退色
? 在加热或催化剂存在下,环烷烃可 被氧化,产物因反应条件而异:
环烷酸钴
+ O2
OH
O
+
环己醇 环己酮
浓硝酸 + O2
? 实验事实: 环的稳定性:三元环<四元环<五元、六元环
? why? 结构所致!环张力所致!
? 环烷烃的环张力越大,表明分子的能量越高, 稳定性越差,越容易开环加成。
? 可用环烷烃每个 CH 2单位的燃烧热来表明环 张力的大小。
一些环烷烃的燃烧热如下所示 :
以上的数据说明: 环越小,每个 CH 2的燃烧热越大,环张力越大。
? 根据环上碳原子的饱和程度不同,可将脂环烃分为 环烷烃、环烯烃、环炔烃等。
饱和脂环烃
环烷烃 如
... ...
脂环烃
环烯烃 如
... ...
不饱和脂环烃
环二烯烃 如
... ...
环炔烃 如
... ...
? 根据脂环烃分子中所含的碳环数目不同,分为单环、 二环和多环脂环烃。
(二) 脂环烃的命名
(1) 单环脂环烃 (2) 二环脂环烃
环丙烷的结构 物理方法测得,环丙烷分子中三个碳原子共平面。
显然,环丙烷中没有正常的 C-C键,而是形成“弯曲 键”:
? 由于环丙烷分子中的 C-C键不是沿 轨道对称轴实现头对头的最大重叠,而 重叠较少,张力较大,具有较高的能量。
? 根据结构与性能的关系,环丙烷的 化学性质应该活泼,容易开环加成。
BrCH2CH2CH2Br ò×?a ?·
Br(CH2)4Br (1 1 1 1 · 1 1 !)
+ Br2 + Br2
1 1ú 1ú 1 1 1ú 1ú 1
2? ò×?a ?·
(丙) 加卤化氢
ò×?a ?· 2? ò×?a ?·
+ HBr H2O CH3CH2CH2Br
+ HBr + HBr
1 ·1 1 1 ·1 1
COOH COOH
(己二酸)
(3) 加成反应
(甲) 加氢
+ H2
Ni
80 ?£C
CH3CH2CH3
+ H2
Ni
200 ?£C
CH3CH2CH2CH3
2? ò×
+ H2
Pt
300 ?£C
CH3(CH2)3CH3
?a ?·
(乙) 加卤素 (区分环丙烷与开链烷烃)
+ Br2 CCl4
11
+ Br2 D
CH3
5-甲基-1,3-环戊二烯
(2) 二环脂环烃 ?分子中含有两个碳环的是双环化合物。
联二环己烷 (联环烃)
螺[4,4]壬烷二环[4,4,0]癸烷二环[2,2,1]庚烷
(螺环烃)
(稠环烃)
(桥环烃)
? 两环共用一个碳原子双环化合物的叫做螺环化合物;
? 两环共用两个或更多个碳原子的叫做桥环化合物。
43
CH3
1,3-二甲基螺 [3.5]-5-
壬烯
(三) 脂环烃的性质
(1) 取代反应 (2) 氧化反应 (3) 加成反应
(甲) 加氢 (乙) 加卤素 (丙) 加卤化氢
(4) 环烯烃的反应
(三) 脂环烃的性质
(1) 取代反应 ? 五元、六元环易发生取代反应。
1 1ò 1
+ Cl2
Cl + HCl
+ Cl2 光或热
(甲) 桥环烃 (乙) 螺环烃
(二) 脂环烃的命名
(1) 单环脂环烃
CH2 CH2 CH2
CH3
即
CH2 CH2
环戊烷
甲基环丁烷
CH3 CH3
1,2-二甲基环戊烷
CH3
即
CH
H3C
CH3
1-甲基-4-异丙基环己烷
H CH3
H CH3
CH3 H
即
CH3 H
反-1,4-二甲基环己烷
CH3
3-甲基-1-环己烯
1
6
2
7
5
3
4
双环[2.2.1]-2庚-烯
7ቤተ መጻሕፍቲ ባይዱ
2
1
6
3
45
CH3
5-甲基双环[2.2.1]-2庚-烯
(乙) 螺环烷烃的命名
? 固定格式: 螺[a.b] 某烃 (a≤b)
? 先找螺原子,编号从与螺原子相连的碳开始, 沿小环编到大环。例:
H3C 5
4
1
3 2
6
7
5-甲基螺 [2.4]
庚烷
6
5
CH3
1
7
2
(五) 环己烷及其衍生物的构象
? 椅式构象和船式构象 ? 椅式构象的特点
? 椅式构象和船式构象
? 环己烷分子中的六个碳不共平面,且六元环是无张力 环,键角为109.5°。
环丁烷的结构:
C:sp3杂化, 轨道夹角 109.5° 若四个碳形成正四边形,内角应为 90°
角 张 力 : 109.5 - 90 = 19.5° < 109.5 - 60 = 49.5° 环丁烷中的 C-C键也是“弯曲键”,但弯曲 程度较小。
∴环丁烷较环丙烷稳定,但仍有相当大的张力, 属不稳定环,比较容易开环加成。
第三章 脂环烃 -cycloalkane
(一) 脂环烃的分类 (二) 脂环烃的命名 (三) 脂环烃的性质 (四) 环烷烃的结构与稳定性 (五) 环己烷及其衍生物的构象 (六) 脂环化合物的立体异构 (七) 脂环烃的主要来源和制法 (八) 环戊二烯 (九) 萜类和甾族化合物
(一) 脂环烃的分类
? 脂环烃 ——由碳原子相互连接成环,性质与开链烃相 似的环状碳氢化合物。
事实上,环丁烷中四个 碳原子不共平面,这样可 使部分张力得以缓解。 (动 画)
环戊烷的结构:
C:sp3杂化, 轨道夹角 109.5° 正五边形内角为 108° 角张力: 109.5-108=1.5°
可见,环戊烷分子中几乎没有什么角张力,故五元环 比较稳定,不易开环,环戊烷的性质与开链烷烃相似。
事实上,环戊烷分子中的五 个碳原子亦不共平面,而是 以“信封式”构象存在,使 五元环的环张力可进一步得 到缓解。 (动画)
(4) 环烯烃的反应
? 环烯烃的性质与开链烯烃类似,易加成、氧化等。
CH 3
H 2/Ni
Br CH 3
HBr
CH 3
Br 2
Br CH 3 Br
KMnO 4
CH 3
O COOH
(四) 环烷烃的结构与稳定性
? 环的大小与环张力、环的稳定性 ? 环丙烷的结构 ? 环丁烷的结构 ? 环戊烷的结构
(四) 环烷烃的结构与稳定性
(甲) 桥环烃的命名
? 固定格式:双环 [a.b.c] 某烃 (a≥b≥c)
?先找桥头碳(两环共用的碳原子),从桥头碳 开始编号。沿大环编到另一个桥头碳,再从该 桥头碳沿着次大环继续编号。分子中含有双键 或取代基时,用阿拉伯数字表示其位次:
21
36
7
4
双环[3.1.1]
5
庚烷
21
3 45
双环[2.1.0戊] 烷
