第三章饱和烃(环烷烃)
饱和烃

CH3 1 6 5 4
2 CH2CH3
3
甲基环戊烷
1,2-二甲基环己烷
1-甲基-3-乙基环己烷
• 二环脂环烃
指分子碳架中含有两个碳环的烃。它又分为: 联环烃 螺环烃(螺烃) 桥环烃(桥烃)
联二环己烷
螺[4.4]壬烷
二环[4.4.0]癸烷 (十氢化萘)
二环[2.2.1]庚烷 (降冰片烷)
(1) 桥环烷烃
ethylene-
C(CH3)2 亚异丙基
CH2(CH2)4CH2 1,6-亚己基(或六亚甲基)
主要应用于烯烃的命名
3) 常见环烷基 p.27
(3)烷烃的命名
(A)普通命名法(习惯命名法) • 碳原子数用“天干”字——甲、乙、丙、丁、戊、己、
庚、辛、壬、癸和十一、十二……等数目字表示。 体。 CH3
CH2CH3
CH3
CH3
CH3
CH3
CH3
环戊烷 甲基环丁烷
乙基环丙烷 1,1-二甲基环丙烷 1,2-二甲基环丙烷
(二)烷烃和环烷烃的命名
(1)烷基(alkyl)的概念
(甲)伯、仲、叔、季碳原子和伯、仲、叔氢原子
H H CH3CH3 H C C C C CH3 H H H CH3 1
。
2
。
3
。
4
。
饱和烃(烷烃和环烷烃)
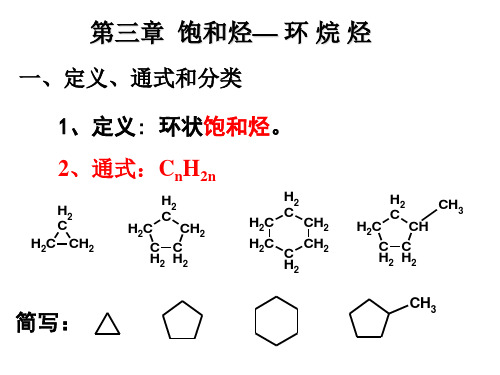
烷烃:指由碳和氢两种元素组成的饱和、开链有机化合物。 环烷烃: 是由碳和氢两种元素组成的一类饱和碳环化合物。
• • • • • •
(一)通式和构造异构 (二)命名 (三)结构 (四)构象 (五)物理性质 (六)化学性质
(一)烷烃和环烷烃的通式和 构造异构
烷烃通式为:CnH2n+2,n为碳原子个数
饱和烃的结构和性质

饱和烃的结构和性质饱和烃是指分子中只含有碳和氢,碳原子之间的化学键都是单键的化合物。
饱和烃可分为烷烃和环烷烃两大类,其中烷烃分子中只包含直链或支链的碳链,而环烷烃则包含了一个或多个碳环。
这些化合物在自然界中普遍存在,如石油和天然气中含有大量的饱和烃,其化学性质主要是烷烃和环烷烃之间的分子量差异,长链的分子量会比短链的分子量更大,同时在同一种分子量下,支链烷烃的沸点也比直链烷烃的沸点低。
烷烃的结构和性质烷烃的分子结构是由碳原子链构成的,每个碳原子上都与四个其它原子(其中一个是氢原子)连接。
这种化学键称为单键,通过这种单键链可以形成不同长度的直链链烷烃。
此外,由于碳原子能够在空间上自由旋转,这种链烷烃的分子也可以通过碳原子之间的旋转来改变的,产生的结构就是所谓的支链烷烃。
烷烃分子中每个碳原子上都有2个可能的氢原子位,因此线性烷烃分子的数目很大。
其中,最简单的是甲烷(CH4)和乙烷(C2H6),它们的分子式分别为CH4和C2H6。
甲烷是一种无色、无味的气体,燃烧时能够发生强烈的火焰,而乙烷则具有明显的气味。
此外,随着碳原子数量的增加,烷烃分子的物理和化学性质也在逐渐发生着变化。
长链烷烃分子的熔点和沸点一般比较高,这是因为长链烷烃分子之间的范德华力较强,分子之间吸引力度随分子量的增加而增强,因此大分子量的烷烃会出现固态、液态、气态三态平衡,其沸点逐渐升高。
此外,直链烷烃分子之间的相互作用力会比支链烷烃大,因此支链烷烃往往比直链支链烷烃的沸点低。
环烷烃的结构和性质环烷烃是包含一个或多个碳环的烷烃,是一类由相邻的碳原子单键组成的环状分子。
环烷烃中的环越大,则其相对稳定性越高。
六元环状的烷环烃最为稳定,如正己烷(C6H14)就是一种典型的烷环烃。
同时,环烷烃有一个特点,它们分子内的碳——碳键、碳——氢键倾向于来回转动,从而使环内碳原子的键价能量特别稳定。
环烷烃由于分子内强烈的形成屏障而难于引发反应,因此环烷烃的反应活性比同分子量的非环烷烃要低。
有机化学第三章环烷烃
2、加成反应 、
小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 小环烷烃,特别是环丙烷,和一些试剂作用时易发生开环。 A: 加氢(随碳原子数增加,环的稳定性增加;加氢反应条 加氢(随碳原子数增加,环的稳定性增加; 件也愈苛刻) 件也愈苛刻)
Ni + H2 40 C Ni 110 C Pt 330 C以 上 以
互为构象异构体。 互为构象异构体。
重叠式构象
交叉式构象
一、环己烷的构象
1918年 Mohr提出非平面无张力环学说,提出环已烷 年 提出非平面无张力环学说, 提出非平面无张力环学说 的六个碳原子都保持正常键角109o28’的椅式和船式构象。 构象。 的六个碳原子都保持正常键角 的椅式和船式构象
1、椅式构象(稳定的极限构象) 椅式构象(稳定的极限构象)
环 丁烷 环 丙烷 cyclopropane cyclobutane
环戊烷 cyclopentane
CH3 CH3 A: Isopropylcyclopentane
CH2CH2CH2CH2CH3 B: 1-Cyclobutylpentane
C3
2
4
D
1
5 4 3 2
E
CH3 CH3 CH CH3
F
CH3 CH3 CH3CCH CH3 Br
+ HBr
3、氧化反应 、
a)小环不被高锰酸钾,臭氧所氧化 )小环不被高锰酸钾,
+ KMnO4 + O3 H+ × H+ ×
应用:鉴别小环与不饱和烃类化合物 应用:
CH3 CH=C H 3C H3C CH3 KMnO4 H3C H
+
COOH +
环烷烃

+ HBr
(主)
2013-11-18 30
四、氧化反应
环丙烷与烯烃既类似又有区别,环丙烷
有抗氧化能力,不使KMnO4水溶液褪色。
应用:环丙烷和不饱和烃
2013-11-18
31
空气 钴盐 OH
+
O
O
O2
O
+
O
2013-11-18
32
3.5 环烷烃的稳定性
椅式
2013-11-18
50
1 3 4 5 2 6
半椅式
2013-11-18 51
4
5
6
1
3
2
船式
2013-11-18 52
扭船式
2013-11-18 53
1. 椅式
5 4 3
6 2
1
2013-11-18
54
4
5
6
3
2
C3
1
碳1、2、4、5在同一平面上,是椅座。 碳1、5、6在同一平面上,是椅背。 碳2、3、4在同一平面上,是椅腿。
转角,并且环越大,偏转角越大,张力越大。
这一推论不正确。这是由于张力学说前提
不合理,即环中碳原子在同一平面内不合理。 拜尔张力学说存在于小环中。
2013-11-18 38
二、分子中的张力
现代理论认为:分子能量的升高,都是分
子中存在张力的结果。有机分子中可能存在 的张力主要有4种。 (1)Van der Waals张力——非键作用力。Enb (2)键张力——键长偏离正常值引起的张力。El
CH3 CH3
1,1-Dimethylcyclohexane
第三章饱和烃环烷烃讲解

Cl + HCl
+ Cl2 光或热
Cl + HCl
(2) 氧化反应 ?据此室可温区下别,环C烷=烃C和不C能≡使C。KM例n:O4褪色,
CH2=CH2 KMnO4
紫色退去 不退色
? 在加热或催化剂存在下,环烷烃可 被氧化,产物因反应条件而异:
环烷酸钴
+ O2
OH
O
+
环己醇 环己酮
浓硝酸 + O2
? 实验事实: 环的稳定性:三元环<四元环<五元、六元环
? why? 结构所致!环张力所致!
? 环烷烃的环张力越大,表明分子的能量越高, 稳定性越差,越容易开环加成。
? 可用环烷烃每个 CH 2单位的燃烧热来表明环 张力的大小。
一些环烷烃的燃烧热如下所示 :
以上的数据说明: 环越小,每个 CH 2的燃烧热越大,环张力越大。
? 根据环上碳原子的饱和程度不同,可将脂环烃分为 环烷烃、环烯烃、环炔烃等。
饱和脂环烃
环烷烃 如
... ...
脂环烃
环烯烃 如
... ...
不饱和脂环烃
环二烯烃 如
... ...
环炔烃 如
... ...
? 根据脂环烃分子中所含的碳环数目不同,分为单环、 二环和多环脂环烃。
(二) 脂环烃的命名
(1) 单环脂环烃 (2) 二环脂环烃
环丙烷的结构 物理方法测得,环丙烷分子中三个碳原子共平面。
显然,环丙烷中没有正常的 C-C键,而是形成“弯曲 键”:
? 由于环丙烷分子中的 C-C键不是沿 轨道对称轴实现头对头的最大重叠,而 重叠较少,张力较大,具有较高的能量。
? 根据结构与性能的关系,环丙烷的 化学性质应该活泼,容易开环加成。
烷烃、环烷烃

烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的一类有机化合物。
烷烃分子里的碳原子之间以单键结合成链状(直链或含支链)外,其余化合价全部为氢原子所饱和。
烷烃分子中,氢原子的数目达到最大值,它的通式为CnH2 n+2。
分子中每个碳原子都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
连接了1、2、3、4个碳的碳原子分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原子分别叫做伯、仲、叔氢。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体(tetrahedro n)。
甲烷是标准的正四面体形态,其键角为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。
直链烷烃是最基本的结构,理论上这个链可以无限延长。
在直链上有可能生出支链,这无疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数目会迅速增长烷烃还可能发生光学异构现象。
当一个碳原子连接的四个原子团各不相同时,这个碳就叫做手性碳,这种物质就具有光学活性。
烷烃失去一个氢原子剩下的部分叫烷基[1],一般用R-表示。
因此烷烃也可以用通式RH来表示。
烷烃最早是使用习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使用。
于是有人提出衍生命名法,将所有的烷烃看作是甲烷的衍生物,例如异丁烷叫做2-一甲基丙烷。
现在的命名法使用IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。
第三章 环烷烃
如何鉴别: 如何鉴别:
CH3-CH=CH2 CH3-CH2-CH3
褪褪 Br2/H2O
褪褪 KMnO4
×
褪褪
×
在强烈条件下,环烷烃也能被氧化。 在强烈条件下,环烷烃也能被氧化。 如:
OH
O
+ O2 (air)
环烷酸钴 140~180℃ ℃ 1-2.5MPa
+
氧化
HOOC
COOH
工业生产己二酸 锦纶-66单体 单体) (锦纶-66单体)
总之: 总之: 三元环的稳定性最小,最易开环; 三元环的稳定性最小,最易开环; 四元环的稳定性次之;也易开环; 四元环的稳定性次之;也易开环; 五元、六元环等,较稳定,不易开环。 五元、六元环等,较稳定,不易开环。 作业 : P73 二(4、5、6) 、 、 )
Ni + H2 200
+ 开环 加
Pt H2 300
CH3-CH2-CH2-CH2-CH3
(2)加成卤素 ) +
常温 Br2 CCl4
Br-CH2-CH2-CH2-Br
+ Br2
CCl4
Br-CH2-CH2-CH2-CH2-Br
棕红色褪去,用以鉴定环丙烷及环丁烷 鉴定环丙烷及环丁烷。 使Br2/CCl4棕红色褪去,用以鉴定环丙烷及环丁烷。
(3)加成卤化氢 )
+ HBr
CH3
CH3CH2CH2Br
+
HBr
CH3CHCH2CH3 Br
带有取代基的小环烷烃加成HX或 带有取代基的小环烷烃加成HX或Br2时,环 HX 的断裂是在取代基最多与最少的两个环碳原子 的断裂是在取代基最多与最少的两个环碳原子 加到含H多的碳上。( P67有错误 。(书 有错误!) 之间, 之间,且H加到含H多的碳上。(书P67有错误!)
《饱和烃:烷烃和环烷烃》习题及答案

《饱和烃:烷烃和环烷烃》习题及答案习题2. 1 写出分子式为C 6H 14的烷烃和C 6H 12的环烷烃的所有构造异构体,用短线或缩简式表示。
【解答】C 6H 14共有5 个构造异构体,如下所示:环烷烃C 6H 12共有12个构造异构体, 如下所示:习题2.2 下列化合物哪些是同一化合物? 哪些是构造异构体?(1) CH 3C(CH 3)2CH 2CH 3(2) CH 3CH 2CH(CH 3)CH 2CH 3(3) CH 3CH(CH 3) (CH 2)2CH 3(4) (CH 3)2CHCH 2CH 2CH 3(5)CH 3(CH 2)2CHCHCH 3CH 3(6)(CH 3CH 2)2CHCH 3【解答】 ( 2 ) 和 ( 6 ) 是同一化合物; ( 3 ) 、( 4 ) 和( 5 ) 是同一化合物; ( 1 ) 、( 2 ) 和( 3 ) 是构造异构体。
习题2. 3 将上述系统命名法基本原则( a) 和( b) 中所列举的三例( I )、( II )和(III)用系统命名法命名。
【解答】( I ) 2,3,5 -三甲基-4-丙基庚烷; ( II ) 2,3-二甲基-4-异丙基庚烷; (III) 2,3,5 -三甲基己烷。
习题2.4 下列化合物的系统命名是否正确?若有错误予以改正(P30)(1)CH 3CHCH 2CH 3C 2H 52-乙基丁烷(2)CH 3CH 2CHCHCH 3CH 3CH 32,3-甲基戊烷(3)CH 3CH 2CH 2CHCH 2CH 2CH 3CH(CH 3)24-异丙基庚烷(4)CH 3CHCH 2CH CH 3CH 3CHCH 2CH 3CH 2CH 34,6-二甲基-乙基庚烷(5)CH 3CH 2CH 2CHCH 2CH 3CH(CH 3)23-异丙基己烷(6)CH 3CH 2CH 2CHCH 2CHCH 2CH 2CH 3C 2H 5CH 2CH 2CH 36-乙基-4-丙基壬烷【解答】(1)3-甲基戊烷 (2) 2, 3-二甲基戊烷 (3)正确(4)2, 4-二甲基-5-乙基庚烷 (5)2-甲基-3-乙基己烷 (6)4-乙基-6-丙基壬烷习题2.5 命名下列各化合物:(P30)(1)(2)(3)(4)CH 3CHCH 2CHCH 2CH 3C 2H 5CH 2CH 2CH 3CH 3CH CH 3CCH 2CH 2CH 2CCH 3CH 3CH 3CH 3CH 3CH 3CHCHCH 2CHCH 2CH 3CH 3CH 3CH 2CH(CH 3)2CH 3CHCH 2CH CH 3CH 3CCH 2CH 2CH 2CHCHCH 3CH 3CH 3CH 3CH 3【解答】 (1)3-甲基-5-乙基辛烷 (2)2, 2,6, 6, 7-五甲基辛烷(3)2, 3, 7-三甲基-5-乙基辛烷 (4)2, 3, 7, 7, 8, 10-六甲基十一烷习题2.6 命名下列各化合物(1)(2)(3)(4)(5)(6)CH 3C 2H 5CH(CH 3)23CH 3CH3CH3C 2H 5CH 2(CH 2)4CH 3【解答】 (1)1-甲基-2-乙基-3-异丙基环己烷 (2)1, 1, 2, 3-四甲基环丁烷 (3)正戊基环戊烷 (4)2-甲基-3-环丙基庚烷 (5)1-甲基-3-环丁基戊烷 (6)1-乙基-4-己基环辛烷习题2.7 命名下列各化合物(P33)(1)(2)(3)(4)3CH 3CH 3CH 3(5)CH 3CH 3CH 3(6)C 2H 5CH 3【解答】 (1)6-甲基二环[3.2.0]庚烷 (2)8-甲基二环[3.2.1]辛烷 (3)8-甲基二环[4.3.0]壬烷 (4)6-甲基螺[3.5]壬烷(5)1, 3, 7-三甲基螺[4.4]壬烷 (6)1-甲基-7-乙基螺[4.5]癸烷习题2 . 8 下列化合物中,哪个张力较大,能量较高,较不稳定?(1)(2)(3)【解答】(1)的张力最大,因为分子内含有三元环。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(五) 环己烷及其衍生物的构象
• 椅式构象和船式构象 • 椅式构象的特点
• 椅式构象和船式构象
➢ 环己烷分子中的六个碳不共平面,且六元环是无张力 环,键角为109.5°。
➢ 环己烷有两种构象(动画,船式与椅式的翻转):
1
6
2
7
5
3
4
双环[2.2.1]-2-庚烯
7
2
1
6 3 45
CH3
5-甲基双环[2.2.1]-2-庚烯
(乙) 螺环烷烃的命名
➢ 固定格式: 螺[a.b]某烃 (a≤b)
➢ 先找螺原子,编号从与螺原子相连的碳开始, 沿小环编到大环。例:
H3C 5
4
1
3 2
6
7
5-甲基螺[2.4]庚烷
6
5
CH3 1
7
2
43
CH3
1,3-二甲基螺[3.5]-5-壬烯
(三) 脂环烃的性质
(1) 取代反应 (2) 氧化反应 (3) 加成反应
(甲) 加氢 (乙) 加卤素 (丙) 加卤化氢
(4) 环烯烃的反应
(三) 脂环烃的性质
(1) 取代反应 ➢ 五元、六元环易发生取代反应。
光或热
+ Cl2
Cl + HCl
+ Cl2 光或热
主要来源:石油。
制法: (1) 芳香族化合物催化氢化 (2) 分子内关环 (3) 其它方法
(1) 芳香族化合物催化氢化
OH + 3H2
Ni DP
(2) 分子内关环
Br
Br + Zn
NaI,乙醇 D 80%
(3) 其它方法
+
CHO
。
30 C
100%
OH
+ ZnBr2 CHO
本章重点:
① 环的大小与其稳定性(三元、四元环不稳定, 易开环加成;五元、六元环稳定,不易开环加 成);
(甲) 桥环烃 (乙) 螺环烃
(二) 脂环烃的命名
(1) 单环脂环烃
CH2 CH2 CH2
CH3
即
CH2 CH2
环戊烷
甲基环丁烷
CH3 CH3
1,2-二甲基环戊烷
CH3
即
CH
H3C
CH3
H CH3
H CH3
CH3 H
即
CH3 H
1-甲基-4-异丙基环己烷
反-1,4-二甲基环己烷
CH3
3-甲基-1-环己烯
第三章 脂环烃 -cycloalkane
(一) 脂环烃的分类 (二) 脂环烃的命名 (三) 脂环烃的性质 (四) 环烷烃的结构与稳定性 (五) 环己烷及其衍生物的构象 (六) 脂环化合物的立体异构 (七) 脂环烃的主要来源和制法 (八) 环戊二烯 (九) 萜类和甾族化合物
(一) 脂环烃的分类
➢ 脂环烃——由碳原子相互连接成环,性质与开链烃相 似的环状碳氢化合物。
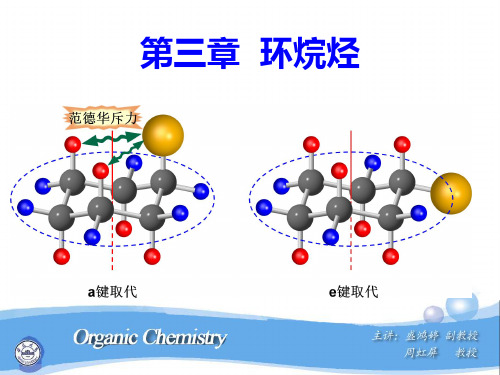
e键
a键
③由一种椅型构象可翻转为另一种椅象(动 画)。同时,a、e 键互换:
为a键
为e键
④环上有取代基时,e键取代比a键取代更稳定。
H
H
R R
e键取代,R与 CH2处于对位交叉 能量较低,含量较高 优势构象
H H
R
R
a键取代,R与 CH2处于顺位交叉 能量较高,含量较低 非优势构象
(动画)
例:
➢ 根据环上碳原子的饱和程度不同,可将脂环烃分为 环烷烃、环烯烃、环炔烃等。
饱和脂环烃
环烷烃 如
... ...
脂环烃
环烯烃 如 ... ...
不饱和脂环烃
环二烯烃 如
... ...
环炔烃 如
... ...
➢ 根据脂环烃分子中所含的碳环数目不同,分为单环、 二环和多环脂环烃。
(二) 脂环烃的命名
(1) 单环脂环烃 (2) 二环脂环烃
Cl + HCl
+ Cl2 光或热
Cl + HCl
(2) 氧化反应 ➢据此室可温区下别,环C烷=烃C和不C能≡使C。KM例n:O4褪色,
CH2=CH2 KMnO4
紫色退去 不退色
➢ 在加热或催化剂存在下,环烷烃可 被氧化,产物因反应条件而异:
环烷酸钴
+ O2
OH
O
+
环己醇 环己酮
浓硝酸 + O2
CH3
5-甲基-1,3-环戊二烯
(2) 二环脂环烃 ➢ 分子中含有两个碳环的是双环化合物。
联二环己烷 (联环烃)
螺[4,4]壬烷 二环[4,4,0]癸烷 二环[2,2,1]庚烷
(螺环烃)
(稠环烃)
(桥环烃)
➢ 两环共用一个碳原子双环化合物的叫做螺环化合物; ➢ 两环共用两个或更多个碳原子的叫做桥环化合物。
➢ 根据结构与性能的关系,环丙烷的 化学性质应该活泼,容易开环加成。
环丁烷的结构:
C:sp3杂化, 轨道夹角109.5° 若四个碳形成正四边形,内角应为90°
角 张 力 : 109.5 - 90 = 19.5° < 109.5 - 60 = 49.5° 环丁烷中的C-C键也是“弯曲键”,但弯曲 程度较小。
椅型 稳定
船型 不稳定
➢ 两种构象通过C-C单键的旋转,可相互转变;
➢ 室温下,环己烷主要在椅型构象存在(99.9%以上)。 ➢为什么椅型构象稳定?
椅型构象:(动画)
3 45
2
6
1
6
4
5
1
3
2
①所有两个相邻的碳原子的碳氢键都处于 交叉式位置;
②所有环上氢原子间距离都相距较远,无 非键张力。
船型构象:(动画)
➢ 可用环烷烃每个CH2单位的燃烧热来表明环 张力的大小。
一些环烷烃的燃烧热如下所示:
以上的数据说明: 环越小,每个CH2的燃烧热越大,环张力越大。
环丙烷的结构 物理方法测得,环丙烷分子中三个碳原子共平面。
显然,环丙烷中没有正常的C-C键,而是形成“弯曲 键”:
➢ 由于环丙烷分子中的C-C键不是沿 轨道对称轴实现头对头的最大重叠,而 重叠较少,张力较大,具有较高的能量。
Cl Cl
Cl Cl
Cl Cl
稳定
Cl Cl
Cl Cl
Cl
能量相同
Cl
CH3
H3C H
CH(CH3)2
H CH(CH3)2
稳定
CH3
H
H
不稳定 CH(CH3)2
CH3 Cl
C(CH3)3
Cl
H
C(CH3)3 CH3 H
优势构象
CH3 C2H5
CH3
H
C2H5
H
优势构象
(六) 脂环烃的主要来源和制法
∴环丁烷较环丙烷稳定,但仍有相当大的张力, 属不稳定环,比较容易开环加成。
事实上,环丁烷中四个 碳原子不共平面,这样可 使部分张力得以缓解。(动 画)
环戊烷的结构:
C:sp3杂化, 轨道夹角109.5° 正五边形内角为108° 角张力:109.5-108=1.5°
可见,环戊烷分子中几乎没有什么角张力,故五元环 比较稳定,不易开环,环戊烷的性质与开链烷烃相似。
COOH COOH
(己二酸)
(3) 加成反应
(甲) 加氢
+ H2
Ni。
80 C
CH3CH2CH3
+ H2
Ni
200 。C
CH3CH2CH2CH3
不 易
+ H2
Pt
300 。C
CH3(CH2)3CH3
开 环
(乙) 加卤素 (区分环丙烷与开链烷烃)
+ Br2 CCl4
室温
+ Br2 D
BrCH2CH2CH2Br 易开环
1
246
3
5
4H
5
H1
6
3
2
①C2-C3及C5-C6间的碳氢键处于重叠式位置; ② 船头和船尾上的两个碳氢键向内伸展, 相距较近,比较拥挤,存在非键张力。
∴我们重点掌握椅型构象。
• 椅式构象的特点
①六个碳原子分布在相互平行的两个平面 上(上三,下三):
②十二个碳氢键分为两种类型:a-键(直 立键)和e-键(平伏键),每个碳原子上都 有一个a键和和一个e键:
CH3
Br2
Br CH3 Br
KMnO4
CH3
O COOH
(四) 环烷烃的结构与稳定性
• 环的大小与环张力、环的稳定性 • 环丙烷的结构 • 环丁烷的结构 • 环戊烷的结构
(四) 环烷烃的结构与稳定性
➢ 实验事实: 环的稳定性:三元环<四元环<五元、六元环
➢ why? 结构所致!环张力所致!
➢ 环烷烃的环张力越大,表明分子的能量越高, 稳定性越差,越容易开环加成。
(甲) 桥环烃的命名
➢ 固定格式:双环[a.b.c]某烃 (a≥b≥c)
➢ 先找桥头碳(两环共用的碳原子),从桥头碳 开始编号。沿大环编到另一个桥头碳,再从该 桥头碳沿着次大环继续编号。分子中含有双键 或取代基时,用阿拉伯数字表示其位次:
21
36
7
4
5
双环[3.1.1]庚烷
21
3 45
双环[2.1.0]戊烷
Br(CH2)4Br (常温下不反应!)
+ Br2 + Br2
取代产物 取代产物
不易开环
(丙) 加卤化氢
易开环 不易开环
+ HBr H2O CH3CH2CH2Br
