2019精选教育山东科技版化学高考第一轮复习——化学键与化学反应(习题解析).doc
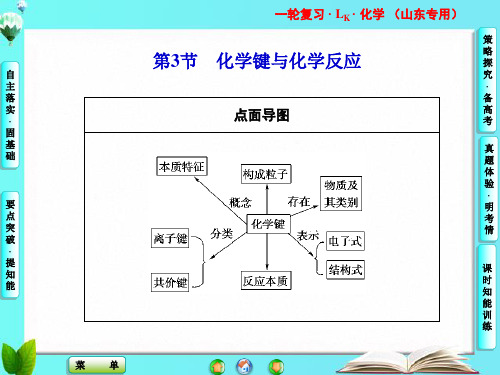
山东省高考化学一轮复习 第5章第3节 化学键与化学反应课件
菜单
一轮复习 ·LK ·化学 (山东专用)
策 略 探 究 · 备 高 考
真
题
离子化合物
体 验
·
明
考
情
课 时 知 能 训 练
一轮复习 ·LK ·化学 (山东专用)
策
略
探
自
究
主
·
落
备
实
1.(写一写)写出下列物质的电子式
高
·
考
固 基
(1)NH4Cl:____________ (2)Na2O2:____________
课 时 知 能 训
练
菜单
一轮复习 ·LK ·化学 (山东专用)
策
略
2.离子化合物和共价化合物的判断方法
探
自
究
主
(1)根据化学键的类型判断
·
落
备
实 ·
凡含有离子键的化合物,一定是离子化合物;只含有共价键
高 考
固
的化合物,是共价化合物。
基
真
础
(2)根据化合物的类型来判断
题
体
大多数碱性氧化物强碱和盐都属于离子化合物;非金属氢化
策
略
探
自
究
主
·
落
备
实 ·
4.(选一选)(1)根据化学反应的实质是旧键断裂新键形成这一事
高 考
固 基
实,下列变化不属于化学反应的是( )
真
础
A.白磷在260 ℃时转化为红磷
题
体
B.石墨在高温下转化为**石
验
·
要 点
C.NaCl熔化
明 考
突 破
山东科技版化学高考第一轮复习——醛和酮、糖类(学案含答案)

一、教学内容:高考复习《化学选修5》第2章官能团与有机化学反应烃的衍生物第3节醛和酮糖类1、醛、酮在自然界中的存在,结构特点,主要化学性质。
2、醛、酮的组成通式及化学性质的异同。
3、醛、酮与羧酸、酯和醇等烃的衍生物之间的相互转化。
4、糖类的组成及性质特点。
5、糖类的应用。
二、教学目的1、掌握醛、酮的结构特点和主要化学性质。
2、了解醛、酮的组成通式及化学性质的异同。
3、了解醛、酮与羧酸、酯和醇等烃的衍生物之间的相互转化。
4、了解糖类的组成、性质特点及其应用。
三、重点和难点1、醛、酮的结构特点和主要化学性质。
2、醛、酮与羧酸、酯和醇等烃的衍生物之间的相互转化。
3、糖类的组成及性质特点。
四、考点分析本节内容在高考中的主要考查点是:1、醛、酮的结构特点和主要化学性质。
2、醛、酮与羧酸、酯和醇等烃的衍生物之间的相互转化。
3、糖类的组成、性质特点及其应用。
五、知识要点1、醛是指________,官能团是________。
酮是指________,官能团是________。
醛、酮的区别是________________________________。
2、常见醛、酮的物理性质和用途:甲醛是一种有________气味的________色气体,________溶于水,主要在工业上用于制造________、________;乙醛是有________气味的________色液体,________溶于水;苯甲醛是一种有________气体的液体,是制造________的重要中间体;丙酮是有________气味的________液体,能与水以任意比例________,不仅是常见的有机溶剂,也是重要的有机合成原料。
3、在醛、酮中,碳氧双键具有较强的极性,不饱和碳原子带部分正电荷,发生加成反应时,碳原子与试剂中带部分负电荷的集团结合,如乙醛与氢氰酸、氨、甲醇反应的化学方程式是________,________,________。
精修版高三化学一轮复习:化学键【含答案】

成键实质
的静电吸引作用,电子与电子之 间以及原子核与原子核之间的静
核之间的静电吸引作用,电子与 电子之间以及原子核与原子核
电排斥作用
之间的静电排斥作用
形成条件
活泼金属与活泼非金属化合
一般是非金属与非金属化合
2.共价键的种类
(1) 非极性共价键: 同种元素的原子间形成的共价键, 共用电子对不偏向任何一个原
( ×)
(7) 离子化合物在任何状态下都能导电
( ×)
题组一 电子式的正误判断 1.下列电子式书写正确的是
()
答案 B 2.氯水中存在多种微粒,下列有关粒子的表示方法正确的是
A.氯气的电子式:
B.氢氧根离子的电子式: C.次氯酸分子的结构式: H—O— Cl
()
D.HClO 的电子式: 答案 C 解析 A 项应把氯原子的最外层电子都标出; B 项缺少中括号,也没标明粒子所带
子,各原子都不显电性,简称非极性键。
(2) 极性共价键:不同元素的原子间形成共价键时,电子对偏向非金属性强的一方,
两种原子,一方略显正电性,一方略显负电性,简称极性键。
3.离子键的表示方法
(1) 用电子式表示离子化合物的形成过程
① Na2S:
;
②CaCl 2:
。
(2) 写出下列物质的电子式
① MgCl2:
()
A.PCl 5
B. P4
C. CCl4
D. NH3
答案 C
解析 判断原子满足最外层 8 电子结构的方法为最外层电子数+所成价键数=
8,故
A 项、 D 项错; P4 为单质,而非化合物,故 B 项错; C 项中 5 原子最外层均为 8 电子
稳定结构, C项正确。
2019届高考化学(山东科技版通用)一轮复习作业手册(全套,含答案)

高考复习方案 | 新课标(LK) 化学课时作业(一) [第1讲钠及其重要化合物]1.下列物质露置于干燥的空气中,不发生变化的是( )A.Na2O B.Na2O2C.NaHCO3 D.Na2CO3·10H2O2.卫生部发出公告,自2019年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。
下列关于过氧化钙(CaO2)的叙述错误的是( )图11A.CaO2具有氧化性,对面粉可能具有漂白作用B.CaO2中阴、阳离子的个数比为1∶1C.CaO2和水反应时,每产生1 mol O2转移4 mol电子D.CaO2和CO2反应的化学方程式为2CaO2+2CO2===2CaCO3+O23.[2018·济南模拟] 下列各组物质相互混合反应后,既有气体生成,最终又有沉淀生成的是( )①金属钠投入到FeCl3溶液中②过量NaOH溶液和明矾溶液混合③少量Ca(OH)2投入过量NaHCO3溶液中④Na2O2投入FeCl2溶液中A.只有①④ B.只有③C.只有②③ D.只有①③④4.[2018·湘潭高三质量检测] 把NaHCO3和Na2O2的混合物放在密闭的容器中加热,关于混合物加热前后与足量盐酸反应消耗盐酸的量,下列判断正确的是( ) A.加热前后一样多B.加热前消耗的多C.加热后消耗的多D.当Na2O2适量时才会一样多5.某溶液中含有HCO-3、SO2-3、CO2-3、CH3COO-四种阴离子,向其中加入足量的Na2O2固体后,假设溶液的体积无变化,溶液中离子的浓度基本保持不变的是( ) A.CO2-3 B.HCO-3C.CH3COO- D.SO2-36.[2018·杭州质检] 下列化学实验事实及其解释不正确的是( )A.滴有酚酞的NaHCO3溶液呈浅红色,微热后红色加深,是因为NaHCO3分解生成了Na2CO3 B.钠保存在煤油中,是因为煤油不与钠发生反应,钠比煤油密度大,煤油可以使钠与空气和水蒸气隔绝C.用洁净的玻璃管向包有Na2O2的脱脂棉吹气,脱脂棉燃烧,说明CO2、H2O与Na2O2的反应是放热反应D.钠长期暴露在空气中的产物是Na2CO3,其主要原因是钠与氧气生成的Na2O与水和二氧化碳反应7.[2018·洛阳模拟] 某固体物质只含有钠和氧两种元素,将它放在足量的水中产生两种气体,这两种气体又可以在一定条件下反应生成水。
高考化学总复习化学键与化学反应鲁科版必修

高考化学总复习化学键与化学反应鲁科版必修基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业§化学键与化学反应*基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业*.了解化学键的定义了解离子键与共价键的形成。
.了解化学反应中能量转化的原因能说明常见能量的转化形式。
基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业强烈的相互作用*一、化学键.定义:相邻原子间的。
.主要类型eqblc{rc(avsalco(离子键,共价键blc{rc(avsalco(极性共价键,非极性共价键)),金属键))基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业阴、阳离子间通过静电作用相邻原子间通过共用电子对*.离子键和共价键离子键共价键极性键非极性键定义形成的化学键而形成的化学键基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业*成键微粒阴、阳离子原子原子成键条件活泼金属与活泼非金属元素原子结合不同非金属元素的原子结合相同非金属元素的原子结合实例NaCl、NaCO、NaOHHSO、CO、NaOH、NaCOO、H、HO、NaO基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业*.下列说法中正确的是()A.KOH中含有离子键也含有共价键属于离子化合物B.N属于单质不存在化学键C.MgCl中既含有离子键又含有共价键D.NHCl 中含有共价键又全部由非金属元素组成属于共价化合物基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业*解析:N 中存在共价键B项错误MgCl中只存在离子键C项错误NHCl中含有离子键也含有共价键是由非金属元素组成的离子化合物D项错误。
答案:A基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业二、化学键与化学反应*eqavsal(blc{rc(avsalco(若EE为吸热反应,若EE为放热反应)))基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业*.下列说法中正确的是( )A.物质发生化学反应都伴随着能量变化B.伴有能量变化的物质变化都是化学变化C.在一个确定的化学反应关系中反应物的总能量与生成物的总能量一定不同D.在一个确定的化学反应关系中反应物的总能量总是高于生成物的总能量基础知识回顾要点解析突破考点图解导析实验积累探究课时达标作业*解析:物质发生化学反应都伴随着能量的变化伴有能量变化的物质变化不一定是化学变化物质发生物理变化、核变化(如原子弹的爆炸)也都伴有能量变化。
山东科技版化学高考第一轮复习——认识有机化学(学案含答案)

一. 教学内容:高考第一轮复习《化学选修5》第1章 有机化合物的结构与性质 烃 第1节 认识有机化学1、有机化合物中碳的成键特征。
2、有机化合物的命名。
3、常见有机化合物的结构特点。
4、有机化合物中的官能团。
二. 教学目的:1、了解有机化合物中碳的成键特征。
2、能根据有机化合物的命名原则命名简单有机物。
3、了解常见有机化合物的结构。
4、了解有机物分子中的官能团,能正确表示它们的结构。
三. 重点和难点:1、有机化合物的命名原则。
2、常见有机化合物的结构特点。
3、有机化合物分子中官能团的结构特点。
四. 考点分析:本节内容在高考中考查的重点是: 1、有机化合物的命名。
2、有机化合物的结构特点。
3、有机化合物分子中官能团的特点。
五. 知识要点:1、有机化合物从结构上有____________分类方法:一是按照构成有机化合物分子的____________来分类;二是按反映有机化合物特性的特定的____________来分类。
2、按碳的骨架分类3、决定化合物____________性质的____________或____________叫官能团,烯烃的官能团是____________,炔烃的官能团是____________。
4、写出下列官能团的名称:5、烷烃的命名分为____________和____________。
6、烃分子失去一个氢原子所剩余的原子团叫做____________。
烷烃失去一个氢原子剩余的原子团就叫___________,“3CH -”叫做____________,“32CH CH -”叫做____________。
7、烷烃可以根据分子里所含____________来命名。
碳原子数在十以内的用____________ ____________来表示。
例如:4CH 叫____________,125H C 叫____________。
碳原子数在十以上的用____________来表示。
高考化学一轮复习辅导与测试 第5章 第3节化学键与化学反应课件 鲁科版

C 感悟 考点 透析
考向二 常用(chánɡ yònɡ)化学用语
3.(2014·湖北模拟组合题)化学用语是学习化学的重要工具。下列化学 用语或表述正确的是________
A.Ca2+的结构示意图为 B.H2O2的电子式为 C.CO2电子式
D.Cl-的结构示意图:
第二十二页,共30页。
之间为离子键,OH-中H—O键为共价
键;B项中,Cl2、HCl、SO2分子中只有
共价键,Na2S中只有离子键;C项中,
所有分子中只有共价键;D项中,Na2O2
中Na+与O
2- 2
之间为离子键,O
2- 2
中存在
共价键,其余三种分子中悟 考点 透析 考向一 化学键与物质类别(lèibié)的关系
第二十页,共30页。
C 感悟 考点 透析
考向二 常用化学(huàxué)用语
下列有关化学用语的说法中不
正确的是( A )
A.次氯酸的结构式为:H-Cl-O
B.-OH与
都表示羟基
C.氯化铵的电子式:
解析( jiě xī):
次氯酸的结构式为H-O-Cl,A 项错误(cuòwù)。
D.乙酸的分子比例模型为:
(5)结构式:
(6)结构简式:CH3COOH (7)原子结构示意图:
第十九页,共30页。
C 感悟 考点 透析
考向二 常用(chánɡ yònɡ)化学用语
3.四种方式: (1)化学方程式 (2)离子方程式 (3)电极反应式 (4)热化学方程式
【特别提醒】 由于化学方程式、离子方程式、电极反应式、热化学 方程式这四种方程式在教材有中突出的地位,专节专讲,所以高考试 卷中提到的化学用语一般不包括“方程式”
高三化学一轮复习 第五章 第3讲 化学键与化学反应 鲁科版

精选课件
2.(1)所有物质中都存在化学键吗? (2)离子化合物中一定不含共价键,共价化合物中一定不含离子 键。这种说法正确吗? 【提示】(1)不一定。稀有气体中不存在化学键,稀有气体为单 原子分子。 (2)这种说法是错误的。离子化合物是阴、阳离子通过离子键形 成的,只要存在离子键,则形成的一定是离子化合物,所以共价化合 物中一定不含离子键是正确的。但是离子化合物中可以含有共价键, 如NaOH中的OH-,O和H原子之间就是以共用电子对结合形成的共价键 。各种酸根离子中的原子间多以共价键相结合,还有NH+4中的N和H原 子之间也是以共价键相结合的。
精选课件
精选课件
1.(1)活泼金属元素和活泼非金属元素一定形成离子键吗? (2)仅由非金属元素组成的物质中一定不含离子键吗? 【提示】 (1)不一定,如AlCl3中铝元素和氯元素形成的是共 价键。 (2)不一定,如NH4Cl全是由非金属元素组成,但它是离子化合 物。
精选课件
三、共价键 1.概念:原子间通过共用电子对 形成的相互作用。 2.成键微粒: 原子 。 3.成键实质:静电作用。 4.形成条件:通常非金属元素 的原子相结合。
【答案】 D
精选课件
一、化合物的分类与物质中化学键类型的判断 1.离子化合物与共价化合物比较
项目 定义
离子化合物 含有离子键的化合物
共价化合物
只含有共价键 的化合物
结构微粒
阴、阳离子
原子
化学键类型
一定含有离子键,可能含有共价 键
只含共价键
精选课件
①强碱 与物质类别的关系 ②绝大多数盐
③活泼金属氧化物
【答案】 D
精选课件
【答案】 A
精选课件
4.(2009年北京高考)甲、乙、丙、丁4种物质分别含2种或3种元 素,它们的分子中各含18个电子。甲是气态氢化物,在水中分步电离 出两种阴离子。下列推断合理的是( )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 下列叙述中正确的是( )
A. 共价化合物中只含有共价键
B. 完全由非金属元素组成的化合物一定是共价化合物
C. 离子化合物中只含有离子键
D. 离子键就是阴、阳离子之间的静电吸引
2. 下列物质中属于离子化合物的是()
A. 苛性钠
B. 碘化氢
C. 硫酸
D. 醋酸
3. 以下叙述中错误的是()
A. 钠与氯气反应生成食盐后,其结构稳定性增强
B. 在氯化钠中,除氯离子与钠离子的静电吸引作用外,还存在电子与电子,原子核与原子核之间的排斥作用
C. 任何化学键在形成过程中必定有电子的得与失
D. 钠与氧气反应生成氧化钠后,体系能量降低
4. 氢气是一种很有前景的能源,以水为原料大量制取氢气的最理想的途径是()
A. 利用太阳能直接使水分解产生氢气
B. 以焦炭和水制取水煤气后分离出氢气
C. 用Fe跟HCl反应放出氢气
D. 由热电站提供电力电解水产生氢气
5. 下列各组化合物中化学键类型不同的是()
A. NaCl和HNO3
B. H2O和NH3
C. CaF2和CsCl
D. CCl4和Na2O
6. 下列各分子中,所有原子都满足最外层为8电子结构的是()
A. H2O
B. BF3
C. CCl4
D. PCl5
7. 当A、B两种元素的原子分别获得2个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两种元素的原子分别失去1个电子形成稳定结构时,D吸收的能量大于C 吸收的能量。
A、B、C、D之间分别形成化合物时,属于离子化合物可能性最大的是()
A. D2A
B. C2B
C. C2A
D. D2B
8. 下列说法正确的是()
A. 化学反应都伴随着能量的变化,通常表现为热量的变化
B. 需要加热的反应一定是吸热反应
C. 水解产生氢气和氧气的反应是吸热反应,又是分解反应,所以分解反应一定是吸热反应
D. 放热反应常温下易发生
9. 下列过程中,共价键被破坏的是()
A. 碘升华
B. 溴蒸气被木炭吸附
C. 酒精溶于水
D. HCl气体溶于水
10. 人在地球上生活而不能自动脱离地球,是因为地球对人有吸引力。
同样的原子之间能自动结合是因为它们之间存在着强烈的相互作用——化学键,由于有化学键使得一百多种化学元素构成了世界万物。
关于化学键的下列叙述中,正确的是()
A. 离子化合物可能含共价键,共价化合物中不含离子键
B. 共价化合物可能含离子键,离子化合物中只含离子键
C. 构成单质分子的微粒一定含有共价键
D. 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子,原子核与原子核之间的排斥作用。
11. 下列性质中,可证明其化合物内一定存在着离子键的是()
A. 可溶于水
B. 由金属和非金属元素的原子组成
C. 熔融状态能导电
D. 水溶液能导电
12. 下列物质中,既含有离子键,又含有共价键的是()
A. H2O
B. CaCl2
C. NaOH
D. Cl2
13. X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素原子的电子层结构时,X放出的能量大于Y放出的能量;Z、W两元素的原子,当它们分别失去一个电子也形成稀有气体元素的原子的电子层结构时,W吸收的能量大于Z吸收的能量,则X、Y和Z、W分别形成的化合物中,是离子化合物的可能性最大的是()
A. Z2X
B. Z2Y
C. W2X
D. W2Y
14. 在下列变化中,①I2升华,②烧碱熔化,③NaCl溶于水,④HCl溶于水,⑤O2溶于水,
⑥Na2O2溶于水,未发生化学键破坏的是_______;仅发生离子键破坏的是_______;仅发生共价键破坏的是_______;既发生离子键破坏,又发生共价键破坏的是_______。
15. W、X、Y、Z为短周期内除稀有气体元素外的四种元素。
它们的原子序数依次增大。
其中只有Y是金属元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素质子数之和的3倍。
由此可知元素W为_______;X为_______;Y 为_______;Z为_______。
上述元素中任意三种组成的,既含有离子键又含有共价键的化合物的化学式(至少写三种)_______、_______、______________,四种元素两两相结合,能生成共价化合物的化学式有(至少写四种)_______、_______、_______、_______。
【试题答案】
1. A
2. A
3. C
4. A
5. AD
6. C
7. C
8. A
9. D 10. AD
11. C 12. C 13. A
14. ①⑤②③④⑥
15. H O Na S NaOH NaHS Na2SO4H2O H2S SO2H2O2。
