安徽省高考化学二轮复习专题微题型18(含解析)
高中化学二轮复习试题微生物燃料电池

2020届届届届届届届届届届届届届——届届届届届届届1.一种微生物[化学成分表示为C m(H2O)n]燃料电池的结构如图所示。
关于该电池的叙述正确的是A. 电池工作时,电子由a流向bB. 微生物所在电极区放电时发生还原反应C. 放电过程中,H+从正极区移向负极区D. 正极反应式为MnO2+4H++2e−=Mn2++2H2O2.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是( )A. 该电池能够在高温下工作B. 电池的负极反应为C6H12O6+6H2O−24e−=6CO2↑+24H+C. 放电过程中,H+从正极区向负极区迁移D. 在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体22.4/6L3.微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。
某微生物燃料电池的工作原理如图所示,下列说法正确的是A. 若该电池电路中有0.4mol电子发生转移,则有0.45molH+通过质子交换膜B. 电子从b流出,经外电路流向aC. 如果将反应物直接燃烧,能量的利用率不会变化D. HS−在硫氧化菌作用下转化为SO42−的反应为:HS−+4H2O−8e−=SO42−+9H+4.微生物燃料电池具有广阔的应用前景。
以葡萄糖为燃料的微生物燃料电池反应原理如图所示。
下列有关该电池的说法正确的是( )A. 该电池工作时电能转化为化学能B. 该电池中电极b是正极C. 外电路中电子由电极a通过导线流向电极bD. 该电池的总反应:C6H12O6+6O2=6CO2+6H2O5.一种微生物燃料电池如图所示,下列关于该电池的说法正确的是()A. a电极发生还原反应B. 每反应1 mol乙酸,电路中转移4 mol电子C. H+由右室通过质子交换膜进入左室D. b电极反应式为2NO 3−+10e−+12H+=N2↑+6H2O6.一种三室微生物燃料电池污水净化系统原理如下图所示,图中有机废水中的有机物可用C6H10O5表示。
高考化学二轮复习考点知识专题强化训练:有机推断与合成大题 (原卷+解析卷)
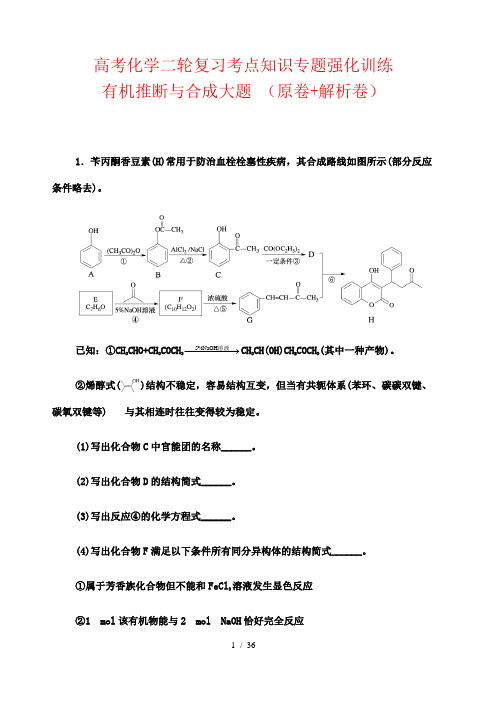
高考化学二轮复习考点知识专题强化训练有机推断与合成大题(原卷+解析卷)1.苄丙酮香豆素(H)常用于防治血栓栓塞性疾病,其合成路线如图所示(部分反应条件略去)。
已知:①CH3CHO+CH3COCH35%NaOH−−−−−→溶液CH3CH(OH)CH2COCH3(其中一种产物)。
②烯醇式()结构不稳定,容易结构互变,但当有共轭体系(苯环、碳碳双键、碳氧双键等)与其相连时往往变得较为稳定。
(1)写出化合物C中官能团的名称______。
(2)写出化合物D的结构简式______。
(3)写出反应④的化学方程式______。
(4)写出化合物F满足以下条件所有同分异构体的结构简式______。
①属于芳香族化合物但不能和FeCl3溶液发生显色反应②1 mol该有机物能与2 mol NaOH恰好完全反应③1H-NMR图谱检测表明分子中共有4种氢原子(5)参照苄丙酮香豆素的合成路线,设计一种以E和乙醛为原料制备的合成路线_______。
2.黄鸣龙是我国著名化学家,利用“黄鸣龙反应”合成一种环己烷衍生物 K 的路线如下:已知:①R-ClNaCN−−−−→一定条件R-COOH②−−−−→黄鸣龙反应R1CH2R2③RCOOR1+R2CH2COOR3−−→碱+R1OH④A 可与 NaHCO3溶液反应;I 的分子式为C5H8O2,能使Br2的CCl4溶液褪色回答下列问题:(1)下列说法正确的是____________。
A.A 与C 有相同的官能团,互为同系物B.E→F 可通过两步连续氧化反应得到C.H→J 的反应类型与工业制乙苯的反应类型相同D.K 的分子式是 C16H26 O6(2)写出化合物 D 的结构简式____________。
(3)写出 H→J 的化学方程式____________。
(4)写出化合物 D 同时符合下列条件的同分异构体的结构简式____________。
①1H-NMR 谱检测表明:分子中共有 3 种不同化学环境的氢原子;②既能发生银镜反应,又能发生水解反应。
高考化学二轮复习专题分层训练—氧化还原反应(含解析)

高考化学二轮复习专题分层训练—氧化还原反应(含解析)一、单选题1.(2022·山东济宁·高三期中)下列文献记载内容涉及氧化还原反应的是A.《旧唐书•严震传》:“梁汉之间,刀耕火耨”B.唐代诗人刘禹锡《浪淘沙》:“美人首饰侯王印,尽是沙中浪底来”C.葛洪《肘后备急方》:“青蒿一握,以水二升渍,绞取汁”D.《吕氏春秋》:“金柔锡柔,合两柔则刚"【答案】A【解析】A.“刀耕火耨”古人播种前先伐去树木烧掉野草,涉及到燃烧过程,为氧化还原反应,A正确;B.“美人首饰侯王印,尽是沙中浪底来”说的是沙里淘金,利用沙子与金的密度不同,用水流使两者分离,不涉及氧化还原反应,B错误;C.由“青蒿一握,以水二升渍,绞取汁”可知,水作溶剂,可萃取青蒿素,涉及的是萃取操作,不涉及氧化还原反应,C错误;D.“金柔锡柔,合两柔则刚”这里指的是合金,不涉及化学反应,D错误;故本题选A。
2.(2022·陕西·汉中市龙岗学校高三阶段练习)下列过程所用的物质中,利用了其氧化性的是A.用SO2的水溶液吸收Br2B.用锌块防止钢铁船体腐蚀C.用FeCl3溶液腐蚀铜板D.用铁粉防止FeSO4溶液氧化【答案】C【解析】A.用SO2的水溶液吸收Br2,S元素的化合价升高,被氧化,利用其还原性,选项A错误;D.是化合反应,同时碳的化合价发生变化,是氧化还原反应,选项D不符合;答案选A。
6.(2022·宁夏·青铜峡市宁朔中学高三开学考试)下列化学反应中电子转移的表示方法正确的是A.B.C.D.【答案】C【解析】A.在该反应中Si元素化合价降低4价,得到电子4e-个;C元素化合价升高2×2价,失去电子2×2e-个,得失电子标反了,应该为,A错误;B.在该反应中参加反应的Na是2个,电子转移数目是2e-,应该为,B错误;C.电子转移数目和方向与反应事实吻合,C正确;D.在该反应中Cu失去电子,浓硫酸中的S得到电子,电子转移方向标反了,应该为:,D 错误。
安徽2021届高考化学二轮复习专题之微题型3Word版含答案

[题型专练]1.(2022·汕头质检,7)能在水溶液中大量共存的一组离子是()A.H+、I-、NO-3、SiO2-3B.NH+4、OH-、Cl-、HCO-3C.K+、SO2-4、Cu2+、NO-3D.Al3+、Mg2+、SO2-4、CO2-3解析A项,H+、NO-3与I-发生氧化还原反应不能大量共存,H+与SiO2-3因生成H2SiO3不能大量共存;B项,OH-与HCO-3、NH+4均不能大量共存;D项,Al3+与CO2-3因发生水解相互促进反应而不能大量共存,Mg2+与CO2-3因生成沉淀而不能大量共存。
答案 C2.肯定能在下列溶液中大量共存的离子组是()A.含有大量Al3+的溶液:Na+、NH+4、SO2-4、Cl-B.c(H+)=1×10-13 mol·L-1的溶液:Na+、Ca2+、SO2-4、CO2-3C.含有大量Fe3+的溶液:Na+、Mg2+、NO-3、SCN-D.含有大量NO-3的溶液:H+、Fe2+、SO2-4、Cl-解析B项,CO2-3和Ca2+生成沉淀不能大量共存;C项,SCN-和Fe3+因发生络合反应不能大量共存;D项,H+、Fe2+、NO-3因发生氧化还原反应不能大量共存。
答案 A3.(2022·肇庆一模,8)在下述条件下,肯定能大量共存的离子组是()A.无色透亮的水溶液中:K+、Ba2+、Cl-、MnO-4B.含有大量NO-3的水溶液中:NH+4、Fe2+、SO2-4、H+C.滴入酚酞试剂显红色的溶液中:Na+、K+、CO2-3、Br-D.强碱性溶液中:ClO-、S2-、HSO-3、Na+解析A项,MnO-4有颜色,MnO-4不能大量存在;B项,NO-3在酸性环境中具有强氧化性,所以和Fe2+不能大量共存;D项,强碱性溶液中HSO-3不能大量存在,且ClO-和S2-、HSO-3因发生氧化还原反应也不行以大量共存;C项正确。
答案 C4.(2022·湛江调研,9)能在无色水溶液中大量共存的一组离子是()A.H+、Fe3+、I-、Cl-B.Al3+、Mg2+、NO-3、Cl-C.K+、Ag+、Ca2+、CO2-3D.NH+4、Na+、AlO-2、MnO-4解析A项,Fe3+是黄色的,且能与I-发生氧化还原反应不能大量共存;C项,Ag+、Ca2+与CO2-3反应生成难溶物不能大量共存;D项,MnO-4是紫色的,且NH+4与AlO-2发生相互促进水解反应而不能大量共存。
微专题18常考的新型化学电源

示为 LixSi+Li1-xCoO2 Si+LiCoO2,D 正确。
高考总复习第1轮 化学
返回导航
第六章 化学反应与能量 高考总复习第1轮 化学
返回导航
第六章 化学反应与能量
练1 (2021·山东日照一模)某可充电水溶液聚合物-空气电池工作原理装置
图如下。该电池充电时,总反应为 4nKOH+2
===2
电子时,生成 0.5 mol K2SO4,其质量分数为 0.5 mol×174 g/mol=87 g,D 正确。
高考总复习第1轮 化学
返回导航
第六章 化学反应与能量
练4 (2021·山东济宁一模)微生物燃料电池是一种利用微生物将有机物中的 化学能直接转化成电能的装置。某污水处理厂利用微生物电池将镀铬废水中的 Cr2O27- 催化还原,其工作原理如图所示。下列说法不正确的是( C )
指引
推 知 其 燃 料 电 池 的 总 反 应 为 (CH3)2NNH2 + 4O2 + 4KOH===2K2CO3+N2+6H2O; ②原电池题要结合题干中信息要素判断出原电池的电极名称,物
质转化信息,离子转移、电子转移信息,结合问题获取相应答案
解题 燃料电池产物判断,离子移动方向,电解质浓度的判断,守恒计
===NaO2,A 正确;未说明氧气所处的状态,无法计算消耗 O2 的体积,B 错误;
偏氟乙烯与六氟丙烯的结构简式分别为 CH2===CF2、CF3CF===CF2,二者在分子
高考化学二轮复习考点知识专题强化训练: 非金属及其化合物(原卷+解析卷)

高考化学二轮复习考点知识专题强化训练: 非金属及其化合物(原卷+解析卷)1.(2020·安徽省濉溪县高三联考)利用自然资源制备相关化学物质,下列化学工艺不可行...的是( ) A .提取食盐后母液2Cl −−→含Br 2的液体−−−→热空气−−−→冷凝粗溴()NaBr s −−−−→蒸馏纯溴 B .石英砂−−−→焦炭高温粗硅2Cl −−−→高温粗四氯化硅2H−−−→−−−→分馏高温高纯硅 C .FeS 22O−−−→高温SO 2→水H 2SO 32O−−→H 2SO 4 D .铝土矿NaOH −−−−→溶液过滤Na[Al(OH)4]溶液2CO −−−→过滤Al(OH)3−−−→煅烧Al 2O 3−−−→冰晶石电解铝 2.(2020·安徽省2020年江南十校综合素质测试)ClO 2是一种极易溶于水且几乎不与冷水反应的黄绿色气体(沸点11℃),实验室制备纯净ClO 2溶液的装置如图所示:已知下列反应:NaClO 3+HCl →NaCl+ClO 2+Cl 2+H 2O ;NaClO 2+HCl →NaCl+ClO 2+H 2O ;NaClO 2+Cl 2→NaCl+ClO 2(均未配平)。
下列说法正确的是( )A .a 中通入的N 2可用CO 2或SO 2代替B .b 中NaClO 2可用饱和食盐水代替C .c 中广口瓶最好放在冰水浴中冷却D .d 中吸收尾气后只生成一种溶质3.(2020·长沙七校联考)实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。
下列说法不正确的是( )A.滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2B.Y中产生的白色沉淀是BaSO4或BaSO3C.产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-D.若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化4.下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )5.(2020·湖南省金太阳高三联考)下列实验操作、现象和结论均正确的是( )6.根据下列实验和现象,所得实验结论正确的是( )7.(2021·福建厦门市期末)将KIO3、H2SO4、H2O2、MnSO4、CH2(COOH)2及可溶性淀粉(指示剂)混合进行碘钟实验,通过光线传感器绘制出碘钟振荡反应曲线如下图。
高考化学二轮复习专题演练: 专题十八 盖斯定律 反应热的计算与比较

考点专练18盖斯定律反应热的计算与比较两年高考真题演练1.(2015·海南化学,4)已知丙烷的燃烧热ΔH=-2 215 kJ·mol-1。
若一定量的丙烷完全燃烧后生成1.8 g水,则放出的热量约为() A.55 kJ B.220 kJ C.550 kJ D.1 108 kJ2.(2015·重庆理综,6)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)===K2S(s)+N2(g)+3CO2(g)ΔH=x kJ·mol-1已知:碳的燃烧热ΔH1=a kJ·mol-1S(s)+2K(s)===K2S(s)ΔH2=b kJ·mol-12K(s)+N2(g)+3O2(g)===2KNO3(s)ΔH3=c kJ·mol-1,则x为()A.3a+b-c B.c-3a-bC.a+b-c D.c-a-b3.(2014·江苏化学,10)已知:C(s)+O2(g)===CO2(g)ΔH1CO2(g)+C(s)===2CO(g)ΔH22CO(g)+O2(g)===2CO2(g)ΔH34Fe(s)+3O2(g)===2Fe2O3(s)ΔH43CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s)ΔH5下列关于上述反应焓变的判断正确的是()A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0C .ΔH 1=ΔH 2+ΔH 3D .ΔH 3=ΔH 4+ΔH 54.(2014·重庆理综,6)已知:C(s)+H 2O(g)===CO(g)+H 2(g) ΔH =a kJ ·mol -12C(s)+O 2(g)===2CO(g) ΔH =-220 kJ·mol -1H —H 、O===O 和O —H 键的键能分别为436、496和462 kJ ·mol -1,则a 为( )A .-332B .-118C .+350D .+1305.(2014·课标全国Ⅱ,13)室温下,将1 mol 的CuSO 4·5H 2O(s)溶于水会使溶液温度降低,热效应为ΔH 1,将1 mol 的CuSO 4(s)溶于水会使溶液温度升高,热效应为ΔH 2;CuSO 4·5H 2O 受热分解的化学方程式为CuSO 4·5H 2O(s)=====△CuSO 4(s)+5H 2O(l),热效应为ΔH 3。
高中化学复习 微题型5 化学键与物质化学性质的关系

3.有关配合物的重要名词
配位键
(1)配位键是一种特殊的共价键,也具有共价键的特征—— 方向性和饱和性。 (2)形成条件:成键原子一方有孤电子对,另一方有空轨道。 (3)表示方法:常用“A→B”表示配位键
配合物
由提供孤电子对的分子或离子与接 受孤电子对的原子或离子以配位键 结合形成的化合物称为配合物。
多齿配位体
一个配位体中有两个或两个以上的配位原子
4.共价键对物质化学性质的影响 共价键的强弱对物质稳定性的影响 键能越_大___,键长越_短___,分子越稳定。
5.分子稳定性差异原因解释答题模板 (1)能否形成双键、三键等原因分析 ①规律:两成键原子的半径越大,则形成σ键的键长越长,越不利于形成 π键。 ②答题模板:×××原子的半径较大,原子间形成的σ键较长,p-p轨道肩 并肩重叠程度较小或几乎不能重叠,难以形成π键。 ③应用举例:氮原子间能形成氮氮三键,而砷原子间不易形成三键的原 因:_砷__原__子__半__径__较__大__,__原__子__间__形__成__的__σ_键__较__长__,__p_-p_轨__道__肩__并__肩__重__叠__程__度___ _较__小__或__几__乎__不__能__重__叠__,__难__以__形__成__π_键__。
12345678
4.(2023·浙江1月选考,12)共价化合物Al2Cl6中所有原子均满足8电子稳定 结构,一定条件下可发生反应:Al2Cl6+2NH3===2Al(NH3)Cl3,下列说 法不正确的是
A.Al2Cl6的结构式为
B.Al2Cl6为非极性分子 C.该反应中NH3的配位能力大于氯
√D.Al2Br6比Al2Cl6更难与NH3发生反应
12345678
8.[2023·全国甲卷,35(2)]酞菁和钴酞菁的分子结构如图所示。 酞菁分子中所有原子共平面,其中p轨道能提供一对电子的N原子是 __③___(填图酞菁中N原子的标 号)。钴酞菁分子中,钴离子 的化合价为__+__2___,氮原子 提供孤对电子与钴离子形成 _配__位___键。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
安徽2015届高考化学二轮复习专题微题型18
[题型专练]
一、物质的分离与提纯
1.(2014·深圳模拟)下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是(
解析A项中Na2CO3与NaHCO3均与澄清石灰水反应,均产生沉淀,故A项错误;B项二者都与NaOH反应生成沉淀,故B错误;C项中Fe不与NaOH反应,杂质Al与NaOH反应,符合除杂原则,故C项正确;D项二者均不与饱和NaHSO3溶液反应,故D项错。
答案 C
2
解析BaSO4和BaCO3都不溶于水,通过溶解、过滤不能除去杂质,A选项错误;CO2会和饱和Na2CO3溶液反应生成NaHCO3,B选项错误;乙酸乙酯在NaOH溶液中会发生水解,C选项错误;蛋白质在浓(NH4)2SO4溶液中发生盐析,经过过滤除去葡萄糖,再将析出的蛋白质洗涤,重新溶于水,D选项正确。
答案 D
3.(2014·江门调研,10)为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和
解析
故A项错误;B项中NH4Cl与NaOH反应生成NH3·H2O,不符合除杂原则,故B项错误;D 项中苯与苯酚均为有机物,根据相似相溶原理,不应用浓溴水除杂,故D项错误。
答案 C
4.拟用如图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的物质)。
其中不能达到目的的是( )
解析A、B、D项中试剂选择正确,而C项中,NH3为碱性气体,不能用浓硫酸干燥,故C 项不能达到实验目的。
答案 C
5.实验室制取气体的装置如图所示,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。
下列选项正确的是( )
解析A项,过氧化钠和水反应生成O2,可用向上排空气法收集,正确;B项,产生的CO2不能用碱石灰干燥,也不能用向下排空气法收集;C项,生成的NO不能用排空气法收集;D 项,氯化铵和消石灰在不加热的条件下不能反应生成NH3。
答案 A
6.(2014·肇庆统考,12)下列实验室除杂(括号内为少量杂质)的方案正确的是(双选)( )
解析A Al可以与NaOH溶液反应而溶解,故把含有少量铝粉的铁粉加入足量NaOH溶液中然后过滤可以除去其中的铝粉,B正确,C项中,CO2和NO2都能与水反应,且NO2与水反应生成NO气体又引入新杂质,C错。
答案BD
二、实验操作现象与结论的评价
7.(2014·广州模拟)下列有关实验操作、现象和解释或结论都正确的是( )
解析过量的铁粉中加入稀硝酸,充分反应后生成Fe2+,滴入KSCN溶液不会出现血红色,A项现象描述错误;AgI的溶解度远小于AgCl的溶解度,AgI沉淀中滴入稀的KCl溶液,沉淀不会变成白色,B项现象描述及结论均错误;Al在稀硝酸中不发生钝化,C项错误。
答案 D
8.(2014·安徽理综,9)为实现下列实验目的,依据下表提供的主要仪器,所用试剂合理的
解析A项,分离Br2和CCl4混合物应采用蒸馏法,由于Br2易溶于CCl4,难溶于水,故不能用水萃取CCl4中的Br2,不合理;B项,葡萄糖溶液与银氨溶液混合后水浴加热产生银镜,而蔗糖溶液与银氨溶液混合后水浴加热不产生银镜,合理;C项,锌与稀硝酸反应不能生成H2,不合理;D项,试剂中缺少指示剂酚酞,不合理。
答案 B
9.下列实验对应的结论正确的是( )
说明反应
2NO2N2O4(无
色) ΔH>0
3在酸性解析选项B能证明酸性:HCl>H2CO3>H2SiO3;C项中产生的沉淀为BaSO4,NO-
条件下能氧化SO2;D项中N2O4为无色,在冷水中颜色变浅,说明N2O4的浓度增大,2NO2N2O4的反应是放热反应,即ΔH<0。
答案 A
10.下列实验操作正确且能达到预期目的的是( )
C.①⑤⑥D.①②③④⑤⑥
解析②中—CHO干扰碳碳双键的检验,错误;③除去苯中的苯酚应用NaOH溶液,错误;
④SO2能使酸性KMnO4溶液褪色,是因为其还原性,错误。
答案 C
11.(2014·韶关摸底考试,23)下列根据实验操作和现象所得出的结论正确的是
( )
3离子干扰;B项,酸越弱,浓度越大,放出H2的速率越快;C项,Mg的解析A项,SO2-
活动性大于铝,不能根据该原电池判断;D项,配制Cu(OH)2悬浊液,应使碱过量。
答案 B
12.(2014·肇庆一摸,23)下列实验操作、现象和解释都正确的是(双选)( )
答案BC
[对点回扣]
1.物质分离和提纯时,一般遵循“四原则”和“三必须”:
“四原则”:一不增,不得引入新杂质;二不减,尽量不减少被提纯和分离的物质;三易分,使被提纯或分离的物质与其他物质易分离;四复原,被提纯物质要易被复原。
“三必须”:①除杂试剂必须过量;②过量试剂必须除尽(去除过量试剂带入的新杂质,同时应注意加入试剂的顺序);③选择最佳的除杂途径。
2.“固+固”混合物的分离(提纯)
固+固⎩⎪⎪⎪⎪⎪⎨
⎪⎪⎪⎪⎪⎧
加热⎩⎪⎨⎪⎧
升华法 例如:
NaCl 和I2的分离分解法 例如:
除去
Na2CO3中混有
的NaHCO3固体
氧化法 例如:
除去氧化铜中混有的铜加水⎩⎪
⎨⎪⎧
结晶法互溶 例如:
KNO3和NaCl 的分离过滤法不互溶
例如:粗盐提纯其他——特殊法 例如:FeS 和Fe 的分离可用磁铁吸附分离
3.“固+液”混合物的分离(提纯) 固+液⎩⎪⎪⎨⎪⎪⎧
互溶⎩⎪⎨⎪⎧
萃取法
例如:海带中碘元素的分离
蒸发 例如:
从食盐水中制得食盐蒸馏法 例如:
用自来水制蒸馏水
不互溶——过滤法 例如:将NaCl 晶体从其饱和溶液中分离出来
4.“液+液”混合物的分离(提纯)
液+液⎩⎪⎨⎪⎧
互溶——蒸馏法 例如:
酒精和水、苯和硝基苯、汽油和煤油等的分离
不互溶——分液法 例如:CCl4和水的分离
5.“气+气”混合物的分离(提纯)
气+气⎩⎪⎨⎪⎧
洗气法 例如:
除去Cl2中的HCl ,可通过盛有饱和食盐水的洗气瓶其他法 例如:
除去CO2中的CO ,可通过灼热的CuO
6.必记的20个特征实验现象
(1)镁条在空气中燃烧:发出耀眼的白光,有白色粉末生成。
(2)硫在空气中燃烧:淡蓝色火焰;在氧气中燃烧:蓝紫色火焰。
(3)铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体。
(4)氢气在氯气中燃烧:安静的燃烧,发出苍白色火焰,瓶口有大量白雾生成。
(5)一氧化碳在空气中燃烧:发出淡蓝色的火焰,放出热量。
(6)细铜丝在氯气中燃烧后加入水:有棕黄色的烟生成,加水后生成绿色的溶液。
(7)新制氯水中加石蕊试液:先变红色后褪色。
(8)磷在氯气中燃烧:有白色烟雾生成。
(9)湿润的淀粉KI 试纸遇氯气:试纸变蓝。
(10)氯气遇到润湿的有色布条:有色布条的颜色褪去。
(11)溴(碘)水中加入四氯化碳:溶液分层,上层接近无色,下层接近橙(紫)色。
(12)二氧化硫气体通入品红溶液:红色褪去,加热后又恢复原来的颜色。
(13)钠在空气中燃烧:火焰呈黄色,生成淡黄色物质。
(14)把水滴入盛有过氧化钠的试管,放入带火星的木条:木条复燃。
(15)加热碳酸氢钠固体,并将产生的气体通入澄清石灰水:澄清石灰水变浑浊。
(16)氨气与氯化氢相遇:有大量白烟产生。
(17)铜片与浓硝酸反应:反应剧烈,有红棕色气体产生。
(18)铜片与稀硝酸反应:产生无色气体,气体上升逐渐变成红棕色。
(19)向含Fe2+的溶液中加入氢氧化钠:有白色沉淀出现,立即转变为灰绿色,最终转变成红褐色沉淀。
(20)向含Fe3+的溶液中加入KSCN 溶液:溶液变血红色。
[总结]。
