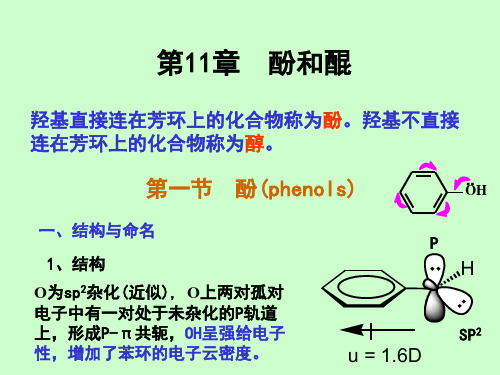
第十一章酚和醌
合集下载
第11章酚和醌

NH2
NaNO2/H2SO4
NaNO2/HCl
ArN2Cl
N2HSO4
H3+O
ArOH
OH
H3+O
Br
Br
△
Br
9. 由苯或甲苯和必要的无机或有机试剂合成下列化合物:
(1) 间苯二酚
(9)2,6-二氯苯酚
OH H2SO4 OH 2 Cl2 OH CL H2O,HCl Cl OH Cl
Cl
SO3H
SO3H
11.5.1 苯酚
俗名石炭酸,有机合成的重要原料,用于制造酚醛树脂 及其他高分子材料、药物、染料、炸药等。
例1:苯酚催化加氢生成环己醇,可用于生产尼龙-66:
[O]
己二酸
例2:鸡眼膏:苯酚与乙酰水杨酸的混合膏体。
11.5.2 甲苯酚 甲苯酚(简称甲酚)有邻、间、对位三种异构体,存 在于煤焦油中,沸点相近,不易分离。邻、对甲酚为 无色晶体,间甲苯酚为无色或淡黄色液体,用于制备 农药、染料、炸药、电木等。 工业上甲酚可由甲苯磺酸钠盐制备:
苯酚与FeCl3络合显紫色
11.4.2 芳环上的亲电取代反应
羟基是强邻对位定位基,使苯环活化。本质原因是酚氧结 构的P- π共轭增加了苯环的电子云密度,芳环亲电活性增强。
①卤化反应—酚很容易发生卤化。 •苯酚与溴水作 用,生成2,4,6三溴苯酚白色 沉淀 •溴水过量,生成黄色 的四溴苯酚析出 •邻、对位上有磺酸基 团时,可同时被取代
例如: OH
OH
OH
SO 3 H
CH3 H SO 2OH 对羟基苯甲醇
OCH3 SO 3 H 对甲氧基苯酚
对羟基苯磺酸
1. 用系统命名法命名下列化合物:
OH (1) CH3 OH (2) C 2H 5 OH (3) OH CH3 CH3
NaNO2/H2SO4
NaNO2/HCl
ArN2Cl
N2HSO4
H3+O
ArOH
OH
H3+O
Br
Br
△
Br
9. 由苯或甲苯和必要的无机或有机试剂合成下列化合物:
(1) 间苯二酚
(9)2,6-二氯苯酚
OH H2SO4 OH 2 Cl2 OH CL H2O,HCl Cl OH Cl
Cl
SO3H
SO3H
11.5.1 苯酚
俗名石炭酸,有机合成的重要原料,用于制造酚醛树脂 及其他高分子材料、药物、染料、炸药等。
例1:苯酚催化加氢生成环己醇,可用于生产尼龙-66:
[O]
己二酸
例2:鸡眼膏:苯酚与乙酰水杨酸的混合膏体。
11.5.2 甲苯酚 甲苯酚(简称甲酚)有邻、间、对位三种异构体,存 在于煤焦油中,沸点相近,不易分离。邻、对甲酚为 无色晶体,间甲苯酚为无色或淡黄色液体,用于制备 农药、染料、炸药、电木等。 工业上甲酚可由甲苯磺酸钠盐制备:
苯酚与FeCl3络合显紫色
11.4.2 芳环上的亲电取代反应
羟基是强邻对位定位基,使苯环活化。本质原因是酚氧结 构的P- π共轭增加了苯环的电子云密度,芳环亲电活性增强。
①卤化反应—酚很容易发生卤化。 •苯酚与溴水作 用,生成2,4,6三溴苯酚白色 沉淀 •溴水过量,生成黄色 的四溴苯酚析出 •邻、对位上有磺酸基 团时,可同时被取代
例如: OH
OH
OH
SO 3 H
CH3 H SO 2OH 对羟基苯甲醇
OCH3 SO 3 H 对甲氧基苯酚
对羟基苯磺酸
1. 用系统命名法命名下列化合物:
OH (1) CH3 OH (2) C 2H 5 OH (3) OH CH3 CH3
《有机化学》第11章酚和醌

基团视为取代基。 但当苯环上连有比酚羟基优先的基团时(按照
优先次序判断),要以最优先的基团作为主官能团, 由主官能团决定母体的名称,此时将羟基作取代基 处理。
羟基连在稠环上的化合物,其命名与苯酚类似, 但须遵循稠环芳烃的编号原则。
3
CH3
OH
HOOC
OH
2-甲基苯酚 邻甲苯酚
4-羟基苯甲酸 对羟基苯甲酸
苯酚的卤代非常容易,不需要L酸的催化。
OH
Br2 / H2O Br
Br
OH (白色) 过量 Br2 / H2O Br Br
Br
Br O (黄色)
Br
——用于酚的定性、定量分析
Br
OH Br2 / HBr
30℃
Br
酸性溶剂
OH
Br2 / CCl4 10℃
Br
OH
非极性溶剂
17
(2)硝化反应 室温下用稀硝酸就可将苯酚硝化,生成邻位、
O CH3
OH
+ HI
+ CH3I ——保护酚羟基
14
(3)酚酯的生成 酚与羧酸直接酯化比较困难,需要用反应活性
更强的酸酐或酰氯反应。
O
OH + Cl C
苯甲酰氯
10% NaOH 40~45℃
O OC
苯甲酸苯酯
O
CH3 C
OH +
O
H3C C O
乙酸酐
15% NaOH 30~40℃
O O C CH3
HO
OH
均苯三酚
OH
偏苯三酚
1,3,5-苯三酚 1,2,4-苯三酚 39
无溶剂条件下
40~150℃
Cl
OH
优先次序判断),要以最优先的基团作为主官能团, 由主官能团决定母体的名称,此时将羟基作取代基 处理。
羟基连在稠环上的化合物,其命名与苯酚类似, 但须遵循稠环芳烃的编号原则。
3
CH3
OH
HOOC
OH
2-甲基苯酚 邻甲苯酚
4-羟基苯甲酸 对羟基苯甲酸
苯酚的卤代非常容易,不需要L酸的催化。
OH
Br2 / H2O Br
Br
OH (白色) 过量 Br2 / H2O Br Br
Br
Br O (黄色)
Br
——用于酚的定性、定量分析
Br
OH Br2 / HBr
30℃
Br
酸性溶剂
OH
Br2 / CCl4 10℃
Br
OH
非极性溶剂
17
(2)硝化反应 室温下用稀硝酸就可将苯酚硝化,生成邻位、
O CH3
OH
+ HI
+ CH3I ——保护酚羟基
14
(3)酚酯的生成 酚与羧酸直接酯化比较困难,需要用反应活性
更强的酸酐或酰氯反应。
O
OH + Cl C
苯甲酰氯
10% NaOH 40~45℃
O OC
苯甲酸苯酯
O
CH3 C
OH +
O
H3C C O
乙酸酐
15% NaOH 30~40℃
O O C CH3
HO
OH
均苯三酚
OH
偏苯三酚
1,3,5-苯三酚 1,2,4-苯三酚 39
无溶剂条件下
40~150℃
Cl
OH
第十一章酚和醌详解

如下所示。
OH
O-
取代酚酸性的强弱与取代基的性质有关。
当苯环上连有吸电基时,由于吸电子的共轭和/或诱 导效应的影响,羟基氧原子上的电子密度降低,因此酸性 增加。
2020/9/22
18
例如,硝基苯酚的酸性比苯酚强,见下表所示。
相反,当苯环上连有供电基时,因不利于羟基氧原 子上电荷的分散,故酸性降低。
OH + NaCl
OH +
Na2CO3
X
利用醇、酚与NaOH和NaHCO3反应性的不同,可鉴别
和分离酚和醇。习题5 Nhomakorabea2020/9/22
17
苯酚具有酸性,是由于羟基氧原子上的未共用电子 对所在的p轨道与苯环的π轨道构成共轭体系,由于共轭 效应的影响,氧原子上的电子发生离域,使得羟基中的 氢原子容易以质子形式离去,同时生成苯氧负离子;也 由于共轭效应的影响,氧原子上的负电荷分散到苯环上, 使得苯氧负离子得到稳定。
OH OCH3
愈创木酚
CH(CH3)2
香芹酚
习题1
2020/9/22
11
二.酚的物理性质
在常温下,除极少数烷基酚是液体外,大多数酚是无 色晶体。
与醇相似,由于羟基的存在,酚分子间或酚与水分 子间也能形成氢键,因此,酚的沸点和熔点也都比相对分 子质量相近的烃高,在水中也有一定的溶解度。
2020/9/22
2020/9/22
5
在酚分子中,酚羟基的氧原子是sp2杂化,它以一个 sp2杂化轨道与苯环上碳原子的一个sp2杂化轨道形成 C-O σ键;以一个sp2杂化轨道与氢原子的 1s轨道形成O-H σ 键;另一个sp2杂化轨道为一对未共用电子所占据。
另一对未共用电子所占据的p轨道,与芳环的π轨道在 侧面相互交盖构成p,π-共轭体系。
第11章 酚和醌(食品2)

5
2、氯苯水解 、
Cl
+
NaOH
Cu ,20MPa 350~370℃
ONa
HCl
OH
优点: 操作简便,副产物易分离; 优点: 操作简便,副产物易分离; 缺点: 需要高温、 高压反应, 缺点 : 需要高温 、 高压反应 , 且碱对设备的腐蚀严 重,反应困难。 反应困难。 若苯环上连有强吸电子基,水解较易。 若苯环上连有强吸电子基,水解较易。 强吸电子基
OH
H3C CH3 C CH2
OH
+
CH3
浓 H2SO4
(CH3)3C
C(CH3)3
4-甲基 甲基-2,6-二 甲基 二 叔丁基苯酚
20
CH3
酚也较容易发生酰基化反应, 酚也较容易发生酰基化反应,但酚羟基上易发生酯 容易发生酰基化反应 化反应,而使酚的酰基化反应产率较低。 化反应,而使酚的酰基化反应产率较低。
二、酚的制法 1、异丙苯氧化法
O OH
OH
O2 / 过过酸过 110~120℃
稀 H2SO4 75~80℃
O
+
氢过氧化异丙苯 聚合橡胶的引发剂
此法是目前工业生产苯酚最主要 最好的方法 最主要和 的方法, 此法是目前工业生产苯酚最主要和最好的方法, 原料廉价易得,可连续化生产, 原料廉价易得,可连续化生产,副产品丙酮也是常用 的有机试剂、有机溶剂之一。 的有机试剂、有机溶剂之一。
酚过量: 酚过量:
OH
HCHO
2
H or OH
+
-
HO
CH2
OH CH2 或
OH
OH
23
以上中间产物与甲醛、苯酚继续作用, 以上中间产物与甲醛、苯酚继续作用,就可得到 线型酚醛树脂: 线型酚醛树脂:
2、氯苯水解 、
Cl
+
NaOH
Cu ,20MPa 350~370℃
ONa
HCl
OH
优点: 操作简便,副产物易分离; 优点: 操作简便,副产物易分离; 缺点: 需要高温、 高压反应, 缺点 : 需要高温 、 高压反应 , 且碱对设备的腐蚀严 重,反应困难。 反应困难。 若苯环上连有强吸电子基,水解较易。 若苯环上连有强吸电子基,水解较易。 强吸电子基
OH
H3C CH3 C CH2
OH
+
CH3
浓 H2SO4
(CH3)3C
C(CH3)3
4-甲基 甲基-2,6-二 甲基 二 叔丁基苯酚
20
CH3
酚也较容易发生酰基化反应, 酚也较容易发生酰基化反应,但酚羟基上易发生酯 容易发生酰基化反应 化反应,而使酚的酰基化反应产率较低。 化反应,而使酚的酰基化反应产率较低。
二、酚的制法 1、异丙苯氧化法
O OH
OH
O2 / 过过酸过 110~120℃
稀 H2SO4 75~80℃
O
+
氢过氧化异丙苯 聚合橡胶的引发剂
此法是目前工业生产苯酚最主要 最好的方法 最主要和 的方法, 此法是目前工业生产苯酚最主要和最好的方法, 原料廉价易得,可连续化生产, 原料廉价易得,可连续化生产,副产品丙酮也是常用 的有机试剂、有机溶剂之一。 的有机试剂、有机溶剂之一。
酚过量: 酚过量:
OH
HCHO
2
H or OH
+
-
HO
CH2
OH CH2 或
OH
OH
23
以上中间产物与甲醛、苯酚继续作用, 以上中间产物与甲醛、苯酚继续作用,就可得到 线型酚醛树脂: 线型酚醛树脂:
第11章酚和醌2解读

第十一章 酚和醌
本章主要内容: 1、酚、醌的分 类与命名——掌 握
2、酚、醌的结 构——理解
3、酚、醌的物 理性质——了解
4、酚、醌的化 学性质——掌握
第一节 酚
一、命名
§11-1 酚
酚的命名,一般是在“酚”字前面加上芳环的名 称作母体,再加上其他取代基的名称和位次。
OH
一
元 酚
CH3
间-甲苯酚
§11-1 酚
B 酚醚的生成 (—威廉森合成p237) 酚金属与烷基化剂在弱碱性溶液中作用可得
二苯基醚可用酚金属与芳卤衍生物作用而得
酚醚与氢碘酸作用,分解而得到原来的酚
有机合成中用来保 护酚羟基 P493
§11-1 酚
C 酯的生成 酚与酸酐或酰氯作用可得
酚与羧酸直接 酯化困难
§11-1 酚
2 .芳环上亲电取代 反应灵敏,可用于苯酚测定。
反应历程:自由基反应
稀硫酸分解
§11-1 酚
2. 从芳卤衍生物制备
注意反应条件!
Cl
ONa
350~370℃,20MPa
+ 2 NaOH
Cu催化剂
+ NaCl + H2O
ONa
OH
反应时的中间体更加稳定--
+ HCl
+ N中aC间l 体的负电荷得到分散
当卤原子的邻位或对位有强的吸电子基时,水解反 应容易进行。
3-甲苯酚
OH
1-萘酚 (a-萘酚)
OH CO2H
邻-羟基苯甲酸
OH
O2N
NO2
NO2
2,4,6-三硝基苯酚 (苦味酸)
HO
SO3H
4-羟基苯磺酸
二、结构
本章主要内容: 1、酚、醌的分 类与命名——掌 握
2、酚、醌的结 构——理解
3、酚、醌的物 理性质——了解
4、酚、醌的化 学性质——掌握
第一节 酚
一、命名
§11-1 酚
酚的命名,一般是在“酚”字前面加上芳环的名 称作母体,再加上其他取代基的名称和位次。
OH
一
元 酚
CH3
间-甲苯酚
§11-1 酚
B 酚醚的生成 (—威廉森合成p237) 酚金属与烷基化剂在弱碱性溶液中作用可得
二苯基醚可用酚金属与芳卤衍生物作用而得
酚醚与氢碘酸作用,分解而得到原来的酚
有机合成中用来保 护酚羟基 P493
§11-1 酚
C 酯的生成 酚与酸酐或酰氯作用可得
酚与羧酸直接 酯化困难
§11-1 酚
2 .芳环上亲电取代 反应灵敏,可用于苯酚测定。
反应历程:自由基反应
稀硫酸分解
§11-1 酚
2. 从芳卤衍生物制备
注意反应条件!
Cl
ONa
350~370℃,20MPa
+ 2 NaOH
Cu催化剂
+ NaCl + H2O
ONa
OH
反应时的中间体更加稳定--
+ HCl
+ N中aC间l 体的负电荷得到分散
当卤原子的邻位或对位有强的吸电子基时,水解反 应容易进行。
3-甲苯酚
OH
1-萘酚 (a-萘酚)
OH CO2H
邻-羟基苯甲酸
OH
O2N
NO2
NO2
2,4,6-三硝基苯酚 (苦味酸)
HO
SO3H
4-羟基苯磺酸
二、结构
第11章 酚和醌
OH H 3C O CH2CH CH3 CHCH3 200 。 C CH2CH CHCH3 H 3C CH3
克莱森重排本质上是乙烯基烯丙基的重排
CH2 CH O CH2CH CH2 CH2 CH CH2 CH CH OH 互变
CH2 CH CH2 CH2 CHO
4、与三氯化铁显色 凡具有烯醇式结构的化合物遇FeCl 烯醇式结构的化合物遇 凡具有烯醇式结构的化合物遇FeCl3溶液都有显色反应
NO2
NO2
NO2
苦味酸
Pka = 7.22
4.00
0.71
吸电子基团越多,酸性越强。 吸电子基团越多,酸性越强。
OH
OH < <
OH OCH3 <
OH
吸电子诱导 给电子共轭
OCH3
OCH3
Pka =
10.21
10.0
9.98
9.65
另外,酚的邻位上如有体积很大的取代基,由于苯氧负离 另外,酚的邻位上如有体积很大的取代基, 子的溶剂化受到阻碍,其酸性特别弱。 子的溶剂化受到阻碍,其酸性特别弱。如2,4,6-三新戊 基苯酚中液氨中与金属钠不起反应。 基苯酚中液氨中与金属钠不起反应。
OH (CH3)3C H2C CH2 C(CH3)3 CH2 C(CH3)3
2、酚酯的生成及傅瑞斯(Fries)重排 酚酯的生成及傅瑞斯(Fries)重排 (Fries) 由于酚中存在P 由于酚中存在P-π共轭,降低了氧周围的电子云密度,使其 共轭,降低了氧周围的电子云密度, 亲核性比醇弱。所以酚类不能直接与酸成酯, 亲核性比醇弱。所以酚类不能直接与酸成酯,而要与酸酐或 酰氯作用才能成酯。 酰氯作用才能成酯。
醇钠在水中几 乎全部水解
绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液, 绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液,又 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。
克莱森重排本质上是乙烯基烯丙基的重排
CH2 CH O CH2CH CH2 CH2 CH CH2 CH CH OH 互变
CH2 CH CH2 CH2 CHO
4、与三氯化铁显色 凡具有烯醇式结构的化合物遇FeCl 烯醇式结构的化合物遇 凡具有烯醇式结构的化合物遇FeCl3溶液都有显色反应
NO2
NO2
NO2
苦味酸
Pka = 7.22
4.00
0.71
吸电子基团越多,酸性越强。 吸电子基团越多,酸性越强。
OH
OH < <
OH OCH3 <
OH
吸电子诱导 给电子共轭
OCH3
OCH3
Pka =
10.21
10.0
9.98
9.65
另外,酚的邻位上如有体积很大的取代基,由于苯氧负离 另外,酚的邻位上如有体积很大的取代基, 子的溶剂化受到阻碍,其酸性特别弱。 子的溶剂化受到阻碍,其酸性特别弱。如2,4,6-三新戊 基苯酚中液氨中与金属钠不起反应。 基苯酚中液氨中与金属钠不起反应。
OH (CH3)3C H2C CH2 C(CH3)3 CH2 C(CH3)3
2、酚酯的生成及傅瑞斯(Fries)重排 酚酯的生成及傅瑞斯(Fries)重排 (Fries) 由于酚中存在P 由于酚中存在P-π共轭,降低了氧周围的电子云密度,使其 共轭,降低了氧周围的电子云密度, 亲核性比醇弱。所以酚类不能直接与酸成酯, 亲核性比醇弱。所以酚类不能直接与酸成酯,而要与酸酐或 酰氯作用才能成酯。 酰氯作用才能成酯。
醇钠在水中几 乎全部水解
绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液, 绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液,又 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。
第十一章酚和醌

• 酚具有酸性的原因——氧原子以SP2(与醇醚不同)杂化轨 道参与成键,它的一对未共用电子的P轨道与苯环的6个P轨 道平行,并且共轭,氧原子的负电荷分散到整个公轭体系中, 氧的电子云密度降低,减弱了O-H键,氢原子容易离解成为 质子。 酚具有极高的亲电反应活性的原因——氧原子的P电 子分散到苯环上,增加了苯环的电子云密度,加强了亲电反 应活性。
OH
OH
OCH3
OH COOH
CHO
OH
萘 酚 邻 甲 氧 基 苯 酚 邻 羟 基 苯 甲 酸 对 羟 基 苯 甲 醛 萘 酚 o-甲 氧 基 苯 酚
11.2 酚的制法
11.2.1 从异丙苯制备
CH3-CH-C3H
CH3
+ C3H-CH=C2HH2SO4
O2,过。 氧化物
110 C
C-O-O-H CH3
酚的氢键
IR谱图特征: O-H伸缩振动:3520-3100cm-1(强峰、宽峰)
酚C-O伸缩振动:1230cm-1 ;醇C-O伸缩振动:10501200cm-1
苯环呼吸振动:1600、1580、1500、1460 cm-1
苯酚的红外光谱
对甲苯酚的红外光谱
11.4 酚的化学性质
11.4.1 酚羟基的反应 (1)酚的酸性——O-H键容易离解。 • 极高的亲电反应活性——O-H基对苯环的供电性。
OH
ONa
+ NaOH(5%)
问题1:酚的酸性到底有多大?
+ H2O
CO2
OH
£¨»ë × Ç £©
O H+N a 2 C O 3 ( 5 % ) 不 溶 说 明 酚 的 酸 性 比 碳 酸 弱 !
O H+N a O H ( 5 % ) 溶 说 明 酚 的 酸 性 比 醇 强 。 ¡
OH
OH
OCH3
OH COOH
CHO
OH
萘 酚 邻 甲 氧 基 苯 酚 邻 羟 基 苯 甲 酸 对 羟 基 苯 甲 醛 萘 酚 o-甲 氧 基 苯 酚
11.2 酚的制法
11.2.1 从异丙苯制备
CH3-CH-C3H
CH3
+ C3H-CH=C2HH2SO4
O2,过。 氧化物
110 C
C-O-O-H CH3
酚的氢键
IR谱图特征: O-H伸缩振动:3520-3100cm-1(强峰、宽峰)
酚C-O伸缩振动:1230cm-1 ;醇C-O伸缩振动:10501200cm-1
苯环呼吸振动:1600、1580、1500、1460 cm-1
苯酚的红外光谱
对甲苯酚的红外光谱
11.4 酚的化学性质
11.4.1 酚羟基的反应 (1)酚的酸性——O-H键容易离解。 • 极高的亲电反应活性——O-H基对苯环的供电性。
OH
ONa
+ NaOH(5%)
问题1:酚的酸性到底有多大?
+ H2O
CO2
OH
£¨»ë × Ç £©
O H+N a 2 C O 3 ( 5 % ) 不 溶 说 明 酚 的 酸 性 比 碳 酸 弱 !
O H+N a O H ( 5 % ) 溶 说 明 酚 的 酸 性 比 醇 强 。 ¡
有机化学 第讲义十一章 酚和醌

OH OH Ag2O
O O + 2Ag + H2O
邻苯醌
第五节 醌
常见的醌
醌是一类特殊的环状不饱和二酮。常见的有:
O
O
O
O
O O
O
对苯醌 黄色结晶 Mp. 113℃
邻苯醌 红色结晶 Mp. 60℃~70 ℃(分解)
O
蒽醌
淡黄色结晶
O
Mp. 286℃
O 1,4-萘醌 黄色结晶 Mp. 128.5 ℃
紫 暗绿色结晶
淡棕红色 紫色沉淀 紫色沉淀
与FeCl3的显色反应并不限于酚,具有烯醇式 结构的脂肪族化合物也有此反应。
氧化反应
酚类化合物很容易氧化,产物随氧化剂和反应条
件而不同。苯酚长期与空气接触,颜色逐渐变深;苯酚 用重铬酸钾氧化,生成黄色的对苯醌。
OH
O
K2Cr2O7 / H+
O
对苯醌
二元酚与多元酚中的两个羟基处于相邻或相对的位 置时,比苯酚更易氧化。
ONa + Na2SO3
ONa
③
酸化
+ SO2 + H2O
OH + Na2SO3
氯苯的水解
Cl
+
350~400℃
NaOH 20MPa
ONa + Cl-
OH
H+
异丙苯氧化法
CH(CH3)2 + O2
CH3 CH3 C O OH
110~120℃ 过氧化物
H+,H2O ~90℃
OH
O
=
+ CH3 C CH3
OH OH
OH OH
OH OH
CH3
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(1)NaOH (2) HCl
O CH2COOH Cl Cl
2,4-二氯苯氧乙酸(2,4-D) 酚醚化学性质比酚稳定,不易氧化,而且与HI作 用,分解为酚,此反应可用来保护酚羟基。
OCH3 OH
+
2015/11/28
HI
+
习题13
CH3I
23
克莱森重排
定义:烯丙基芳基醚在高温下可以重排为邻烯 丙基酚或对烯丙基酚,这称为克莱森重排。
X
X
亲核性比醇弱
O O CH3
成酯:
OH + CH3COOH + CH3COCl + (CH3CO)2O
OH + CH3COOH
O
98%H2SO4 4h/55%
O C CH3
乙酸苯酯
2015/11/28
25
在酸催化下,酚与羧酸作用也能生成酯,但比醇 难。通常采用酰氯或酸酐与酚反应。例如:
O C Cl + HO
14
OCH2CH=CH2
OH
200oC
14
OH
CH2CH=CH2
200oC
14
O
CH2CH CH2
190-220C 6h
OH CH2CH CH2
CH2CH=CH2
O H3C
CH2CH CH2 CH3 H3C
OH CH3
CH2CH CH2
2015/11/28
24
(3)酯的生成
难
OH + HX
对 10.00 10.26 10.21 9.81 9.38 9.26 9.20 7.15
20
(2) 醚的生成
在酚分子中,由于p,π-共扼效应的影响,碳氧键 较难断裂,因此与醇不同,一般不发生两分子间脱水 生成醚的反应。
OH
+
OH
O
X X
O R
+ (CH3CO)2O
2015/11/28
21
通常是在碱存在下,酚先转变成酚盐,然后与卤烷 或硫酸酯作用得到相应的醚,其成醚也比醇困难。 例如:
硫酚>碳酸>苯酚>硫醇>水>醇
2015/11/28
19
取代酚的pKa(25℃)
取代基 H CH3 CH3O F Cl Br I NO2 邻 10.00 10.29 9.98 8.81 8.48 8.42 8.46 7.22 习题6
2015/11/28
间 10.00 10.09 9.65 9.28 9.02 8.87 8.88 8.39
16
故酚可溶于NaOH但不溶于NaHCO3,不能与Na2CO3、 NaHCO3作用放出CO2,反之羟基通CO2于酚钠水溶液中, 酚即游离出来。
CO2+ H2O
OH
OH + NaOH
ONa
HCl
+ NaHCO3
OH + NaCl
OH
+ Na2CO3
X
利用醇、酚与NaOH和NaHCO3反应性的不同,可鉴别 和分离酚和醇。 习题5
2015/11/28
32
如用浓硝酸进行硝化,则生成2,4-二硝基苯酚和 2,4,6-三硝基苯酚(苦味酸)。 但因酚羟基和环易被浓硝酸氧化,产量很低,一 般均用间接方法制备。
OH + 20%HNO3 OH
25oC
OH NO 2 + NO 2
浓 HNO3
OH NO 2 + NO 2
2015/11/28
NaOH
O C O
苯甲酸苯酯
OH COOH + (CH3CO)2O
H3PO4
COOH O C CH3 O
乙酰水杨酸(阿斯匹林)
2015/11/28
26
弗里斯重排 定义:酚酯与路易斯酸一起加热,可发生酰基重排生 成邻羟基和对羟基芳酮的衍生物。该重排反应 称为弗里斯重排 (酚的芳环上带有间位定位基的酯不能发生此重排)
2015/11/28
17
苯酚具有酸性,是由于羟基氧原子上的未共用电子 对所在的p轨道与苯环的π轨道构成共轭体系,由于共轭 效应的影响,氧原子上的电子发生离域,使得羟基中的 氢原子容易以质子形式离去,同时生成苯氧负离子;也 由于共轭效应的影响,氧原子上的负电荷分散到苯环上, 使得苯氧负离子得到稳定。 如下所示。 O H O
取代酚酸性的强弱与取代基的性质有关。
当苯环上连有吸电基时,由于吸电子的共轭和/或诱 导效应的影响,羟基氧原子上的电子密度降低,因此酸性 增加。
2015/11/28
18
例如,硝基苯酚的酸性比苯酚强,见下表所示。 相反,当苯环上连有供电基时,因不利于羟基氧原 子上电荷的分散,故酸性降低。 例如,烷基酚的酸性比苯酚弱,如下表所示。 多硝基酚的酸性更强,2,4-二硝基苯酚和2,4,6-三 硝基苯酚的pKa分别是4.09和0.25,后者是一个相当强的 酸,俗称苦味酸。 酚的邻位上如有体积很大的取代基,由于苯氧负离 子的溶剂化受阻碍,其酸性特别弱。如2,4,6-三新戊基 苯酚在液氨中也不和金属钠起反应。 几类有机物酸性强弱次序:
2015/11/28
5
在酚分子中,酚羟基的氧原子是sp2杂化,它以一个 sp2杂化轨道与苯环上碳原子的一个sp2杂化轨道形成 C-O σ键;以一个sp2杂化轨道与氢原子的 1s轨道形成O-H σ 键;另一个sp2杂化轨道为一对未共用电子所占据。 另一对未共用电子所占据的p轨道,与芳环的π轨道在 侧面相互交盖构成p,π-共轭体系。 由于p,π-共扼效应的影响,氧原子上的电子云密度 向苯转移,不仅使C-O键增强而较难断裂(与醇分子中的CO键相比);同时芳环上的电子云密度增高,而有利于环上 的亲电取代反应; 另外,也使得羟基中的O-H键减弱,而有利于羟基中 氢原子的解离。现以苯酚为例,其结构如图所示。
常见酚的物理常数见p252表11-1。
2015/11/28
13
三、酚的化学性质
酚发生化学反应的主要部位如下所示:
1. 酚羟基中氢原子的反应 2、芳环上的反应 3. 与三氯化铁的显色反应 4. 缩合反应
2015/11/28
5. 还原 6. 氧 化
14
1. 酚羟基中氢原子的反应
(1)酸性
与醇相比,酚也含有羟基,故也显示弱酸性。但又 与醇不同,由于酚分子中p,π-共轭效应的影响,氧氢键 减弱,有利于氢原子以质子形式离去,同时形成稳定的 芳氧负离子。 而醇则不存在这种共轭效应,因此,醇羟基中的氢 原子较难离去,故酚的酸性比醇强。 例如,苯酚可与氢氧化钠水溶液作用,生成苯酚钠。 习题7
OH OH
一元酚 苯酚 多元酚
HO OH
1-萘酚(α-萘酚)
OH HO OH
1,4-苯二酚
1,3,5-苯三酚(间苯三酚)
2015/11/28
8
3. 命名
酚的命名是在芳环名称之后加上“酚”字,如上述苯 酚、1-萘酚。
当芳环上有多个官能团时,首先根据官能团的优先次 序确定母体,此时有两种情况:
(1)当在芳环上所有的官能团中,羟基是优先官能团 则这些化合物不属于取 代酚,它们将根据优先官能团,分属不同类型化合物。
OH O O CH3
AlCl3
-
O CH3
Cl3Al
Me O O OAlCl3
+
O C CH3
OH
O
CH3
2015/11/28
27
2、芳环上的反应
由于羟基是较强的第一类定位基,故苯环上的亲电 取代反应不仅比苯容易进行,而且主要生成邻位和对位 取代产物。 (1)卤化反应 酚很容易进行卤化反应。例如,苯酚与溴水作用, 立即生成2,4,6-三溴苯酚白色沉淀;
2015/11/28
15
酸性比水强但比碳酸弱
OH + NaOH
CO2
ONa + H2O
OH + NaHCO3
酸性: H2CO3 > PhOH > H2O > ROH pKa : 6.38 ~10 15 16~19
当酚的邻对位上有强吸电子基时,酸性增强
OH O2N NO2
苦味酸 pKa ≤1
NO2
2015/11/28
非取代酚的命名,羟基作为取代基,按“多官能团 化合物的命名”原则命名。例如:
OH CHO OH
邻羟基苯甲醛
SO3H
(水杨醛)
2015/11/28
对羟基苯磺酸
10
有些酚有俗名。例如:
OH OH OH OH OCH 3
石炭酸
CH3 OH
儿茶酚
愈创木酚
CH(CH 3)2
香芹酚 习题1
2015/11/28
OH + Br2(H2O) Br Br OH Br + 3HBr
此反应迅速、灵敏,且可定量完成,故可用作苯酚的定 性和定量分析。
2015/11/28
28
若加过量的溴水,则沉淀由白色转为黄色:
HO
Br2 H2O
Br
OH
Br
Br2 H2O
H3C
O
Br
Br 白色沉淀
Br Br 黄色沉淀
为了获得一溴代酚,通常需在非极性或低极性溶剂 (如二硫化碳、氯仿或四氯化碳等)中进行。 例如,于0℃,溴与苯酚在四氯化碳中反应,则得 到一溴代苯酚,且以对位产物为主。
2015/11/28
6
结构与反应性
难
-
易
O
-
H
-
O上的未公用 电子与苯环 共轭(p-π)
a C-O键加强 不发生OH的亲核取代 b O-H削弱,极性强 H的酸性比醇强 c 电子云向苯环转移 邻对位亲电取代活性增大
O CH2COOH Cl Cl
2,4-二氯苯氧乙酸(2,4-D) 酚醚化学性质比酚稳定,不易氧化,而且与HI作 用,分解为酚,此反应可用来保护酚羟基。
OCH3 OH
+
2015/11/28
HI
+
习题13
CH3I
23
克莱森重排
定义:烯丙基芳基醚在高温下可以重排为邻烯 丙基酚或对烯丙基酚,这称为克莱森重排。
X
X
亲核性比醇弱
O O CH3
成酯:
OH + CH3COOH + CH3COCl + (CH3CO)2O
OH + CH3COOH
O
98%H2SO4 4h/55%
O C CH3
乙酸苯酯
2015/11/28
25
在酸催化下,酚与羧酸作用也能生成酯,但比醇 难。通常采用酰氯或酸酐与酚反应。例如:
O C Cl + HO
14
OCH2CH=CH2
OH
200oC
14
OH
CH2CH=CH2
200oC
14
O
CH2CH CH2
190-220C 6h
OH CH2CH CH2
CH2CH=CH2
O H3C
CH2CH CH2 CH3 H3C
OH CH3
CH2CH CH2
2015/11/28
24
(3)酯的生成
难
OH + HX
对 10.00 10.26 10.21 9.81 9.38 9.26 9.20 7.15
20
(2) 醚的生成
在酚分子中,由于p,π-共扼效应的影响,碳氧键 较难断裂,因此与醇不同,一般不发生两分子间脱水 生成醚的反应。
OH
+
OH
O
X X
O R
+ (CH3CO)2O
2015/11/28
21
通常是在碱存在下,酚先转变成酚盐,然后与卤烷 或硫酸酯作用得到相应的醚,其成醚也比醇困难。 例如:
硫酚>碳酸>苯酚>硫醇>水>醇
2015/11/28
19
取代酚的pKa(25℃)
取代基 H CH3 CH3O F Cl Br I NO2 邻 10.00 10.29 9.98 8.81 8.48 8.42 8.46 7.22 习题6
2015/11/28
间 10.00 10.09 9.65 9.28 9.02 8.87 8.88 8.39
16
故酚可溶于NaOH但不溶于NaHCO3,不能与Na2CO3、 NaHCO3作用放出CO2,反之羟基通CO2于酚钠水溶液中, 酚即游离出来。
CO2+ H2O
OH
OH + NaOH
ONa
HCl
+ NaHCO3
OH + NaCl
OH
+ Na2CO3
X
利用醇、酚与NaOH和NaHCO3反应性的不同,可鉴别 和分离酚和醇。 习题5
2015/11/28
32
如用浓硝酸进行硝化,则生成2,4-二硝基苯酚和 2,4,6-三硝基苯酚(苦味酸)。 但因酚羟基和环易被浓硝酸氧化,产量很低,一 般均用间接方法制备。
OH + 20%HNO3 OH
25oC
OH NO 2 + NO 2
浓 HNO3
OH NO 2 + NO 2
2015/11/28
NaOH
O C O
苯甲酸苯酯
OH COOH + (CH3CO)2O
H3PO4
COOH O C CH3 O
乙酰水杨酸(阿斯匹林)
2015/11/28
26
弗里斯重排 定义:酚酯与路易斯酸一起加热,可发生酰基重排生 成邻羟基和对羟基芳酮的衍生物。该重排反应 称为弗里斯重排 (酚的芳环上带有间位定位基的酯不能发生此重排)
2015/11/28
17
苯酚具有酸性,是由于羟基氧原子上的未共用电子 对所在的p轨道与苯环的π轨道构成共轭体系,由于共轭 效应的影响,氧原子上的电子发生离域,使得羟基中的 氢原子容易以质子形式离去,同时生成苯氧负离子;也 由于共轭效应的影响,氧原子上的负电荷分散到苯环上, 使得苯氧负离子得到稳定。 如下所示。 O H O
取代酚酸性的强弱与取代基的性质有关。
当苯环上连有吸电基时,由于吸电子的共轭和/或诱 导效应的影响,羟基氧原子上的电子密度降低,因此酸性 增加。
2015/11/28
18
例如,硝基苯酚的酸性比苯酚强,见下表所示。 相反,当苯环上连有供电基时,因不利于羟基氧原 子上电荷的分散,故酸性降低。 例如,烷基酚的酸性比苯酚弱,如下表所示。 多硝基酚的酸性更强,2,4-二硝基苯酚和2,4,6-三 硝基苯酚的pKa分别是4.09和0.25,后者是一个相当强的 酸,俗称苦味酸。 酚的邻位上如有体积很大的取代基,由于苯氧负离 子的溶剂化受阻碍,其酸性特别弱。如2,4,6-三新戊基 苯酚在液氨中也不和金属钠起反应。 几类有机物酸性强弱次序:
2015/11/28
5
在酚分子中,酚羟基的氧原子是sp2杂化,它以一个 sp2杂化轨道与苯环上碳原子的一个sp2杂化轨道形成 C-O σ键;以一个sp2杂化轨道与氢原子的 1s轨道形成O-H σ 键;另一个sp2杂化轨道为一对未共用电子所占据。 另一对未共用电子所占据的p轨道,与芳环的π轨道在 侧面相互交盖构成p,π-共轭体系。 由于p,π-共扼效应的影响,氧原子上的电子云密度 向苯转移,不仅使C-O键增强而较难断裂(与醇分子中的CO键相比);同时芳环上的电子云密度增高,而有利于环上 的亲电取代反应; 另外,也使得羟基中的O-H键减弱,而有利于羟基中 氢原子的解离。现以苯酚为例,其结构如图所示。
常见酚的物理常数见p252表11-1。
2015/11/28
13
三、酚的化学性质
酚发生化学反应的主要部位如下所示:
1. 酚羟基中氢原子的反应 2、芳环上的反应 3. 与三氯化铁的显色反应 4. 缩合反应
2015/11/28
5. 还原 6. 氧 化
14
1. 酚羟基中氢原子的反应
(1)酸性
与醇相比,酚也含有羟基,故也显示弱酸性。但又 与醇不同,由于酚分子中p,π-共轭效应的影响,氧氢键 减弱,有利于氢原子以质子形式离去,同时形成稳定的 芳氧负离子。 而醇则不存在这种共轭效应,因此,醇羟基中的氢 原子较难离去,故酚的酸性比醇强。 例如,苯酚可与氢氧化钠水溶液作用,生成苯酚钠。 习题7
OH OH
一元酚 苯酚 多元酚
HO OH
1-萘酚(α-萘酚)
OH HO OH
1,4-苯二酚
1,3,5-苯三酚(间苯三酚)
2015/11/28
8
3. 命名
酚的命名是在芳环名称之后加上“酚”字,如上述苯 酚、1-萘酚。
当芳环上有多个官能团时,首先根据官能团的优先次 序确定母体,此时有两种情况:
(1)当在芳环上所有的官能团中,羟基是优先官能团 则这些化合物不属于取 代酚,它们将根据优先官能团,分属不同类型化合物。
OH O O CH3
AlCl3
-
O CH3
Cl3Al
Me O O OAlCl3
+
O C CH3
OH
O
CH3
2015/11/28
27
2、芳环上的反应
由于羟基是较强的第一类定位基,故苯环上的亲电 取代反应不仅比苯容易进行,而且主要生成邻位和对位 取代产物。 (1)卤化反应 酚很容易进行卤化反应。例如,苯酚与溴水作用, 立即生成2,4,6-三溴苯酚白色沉淀;
2015/11/28
15
酸性比水强但比碳酸弱
OH + NaOH
CO2
ONa + H2O
OH + NaHCO3
酸性: H2CO3 > PhOH > H2O > ROH pKa : 6.38 ~10 15 16~19
当酚的邻对位上有强吸电子基时,酸性增强
OH O2N NO2
苦味酸 pKa ≤1
NO2
2015/11/28
非取代酚的命名,羟基作为取代基,按“多官能团 化合物的命名”原则命名。例如:
OH CHO OH
邻羟基苯甲醛
SO3H
(水杨醛)
2015/11/28
对羟基苯磺酸
10
有些酚有俗名。例如:
OH OH OH OH OCH 3
石炭酸
CH3 OH
儿茶酚
愈创木酚
CH(CH 3)2
香芹酚 习题1
2015/11/28
OH + Br2(H2O) Br Br OH Br + 3HBr
此反应迅速、灵敏,且可定量完成,故可用作苯酚的定 性和定量分析。
2015/11/28
28
若加过量的溴水,则沉淀由白色转为黄色:
HO
Br2 H2O
Br
OH
Br
Br2 H2O
H3C
O
Br
Br 白色沉淀
Br Br 黄色沉淀
为了获得一溴代酚,通常需在非极性或低极性溶剂 (如二硫化碳、氯仿或四氯化碳等)中进行。 例如,于0℃,溴与苯酚在四氯化碳中反应,则得 到一溴代苯酚,且以对位产物为主。
2015/11/28
6
结构与反应性
难
-
易
O
-
H
-
O上的未公用 电子与苯环 共轭(p-π)
a C-O键加强 不发生OH的亲核取代 b O-H削弱,极性强 H的酸性比醇强 c 电子云向苯环转移 邻对位亲电取代活性增大
