11-第十一章-酚和醌-中文-2013
第十一章酚和醌

O CH2COOH Cl Cl
2,4-二氯苯氧乙酸(2,4-D) 酚醚化学性质比酚稳定,不易氧化,而且与HI作 用,分解为酚,此反应可用来保护酚羟基。
OCH3 OH
+
2015/11/28
HI
+
习题13
CH3I
23
克莱森重排
定义:烯丙基芳基醚在高温下可以重排为邻烯 丙基酚或对烯丙基酚,这称为克莱森重排。
X
X
亲核性比醇弱
O O CH3
成酯:
OH + CH3COOH + CH3COCl + (CH3CO)2O
OH + CH3COOH
O
98%H2SO4 4h/55%
O C CH3
乙酸苯酯
2015/11/28
25
在酸催化下,酚与羧酸作用也能生成酯,但比醇 难。通常采用酰氯或酸酐与酚反应。例如:
O C Cl + HO
14
OCH2CH=CH2
OH
200oC
14
OH
CH2CH=CH2
200oC
14
O
CH2CH CH2
190-220C 6h
OH CH2CH CH2
CH2CH=CH2
O H3C
CH2CH CH2 CH3 H3C
OH CH3
CH2CH CH2
2015/11/28
24
(3)酯的生成
难
OH + HX
对 10.00 10.26 10.21 9.81 9.38 9.26 9.20 7.15
第11章 酚和醌(食品2)

2、氯苯水解 、
Cl
+
NaOH
Cu ,20MPa 350~370℃
ONa
HCl
OH
优点: 操作简便,副产物易分离; 优点: 操作简便,副产物易分离; 缺点: 需要高温、 高压反应, 缺点 : 需要高温 、 高压反应 , 且碱对设备的腐蚀严 重,反应困难。 反应困难。 若苯环上连有强吸电子基,水解较易。 若苯环上连有强吸电子基,水解较易。 强吸电子基
OH
H3C CH3 C CH2
OH
+
CH3
浓 H2SO4
(CH3)3C
C(CH3)3
4-甲基 甲基-2,6-二 甲基 二 叔丁基苯酚
20
CH3
酚也较容易发生酰基化反应, 酚也较容易发生酰基化反应,但酚羟基上易发生酯 容易发生酰基化反应 化反应,而使酚的酰基化反应产率较低。 化反应,而使酚的酰基化反应产率较低。
二、酚的制法 1、异丙苯氧化法
O OH
OH
O2 / 过过酸过 110~120℃
稀 H2SO4 75~80℃
O
+
氢过氧化异丙苯 聚合橡胶的引发剂
此法是目前工业生产苯酚最主要 最好的方法 最主要和 的方法, 此法是目前工业生产苯酚最主要和最好的方法, 原料廉价易得,可连续化生产, 原料廉价易得,可连续化生产,副产品丙酮也是常用 的有机试剂、有机溶剂之一。 的有机试剂、有机溶剂之一。
酚过量: 酚过量:
OH
HCHO
2
H or OH
+
-
HO
CH2
OH CH2 或
OH
OH
23
以上中间产物与甲醛、苯酚继续作用, 以上中间产物与甲醛、苯酚继续作用,就可得到 线型酚醛树脂: 线型酚醛树脂:
最新中国药科大学有机化学课件—酚和醌PPT课件

O
OH
O
Cl
Cl
Cl
Cl
O
+ 2H+ + 2e-
O
对苯醌
OH
氢醌
登柳州城楼寄漳汀封连四州
柳宗元
城上高楼接大荒,海天愁思正茫茫。 惊风乱飐芙蓉水,密雨斜侵薜荔墙。 岭树重遮千里目,江流曲似九回肠。 共来百越文身地,犹自音书滞一乡。
作者简介
唐代文学家、哲学家,唐宋八大家之一。字子厚。 祖籍河东,后迁长安,世称柳河东。因官终柳州刺史, 又称柳柳州。与韩愈共同倡导唐代古文运动,并称韩 柳。
NaOH H+
SO3HNaOH H+
SO3Na OH
OH
(二)卤代芳烃的水解
C l+N a O H3 C 0 0 u o C
2 8 M P a
(三)重氮盐的水解
N+2HSO-4 H2O
O N aH +
OH
O H
HBF4 N+2B- F4 CH3COOH
H2O OCOCH3
(五)格氏试剂——硼酸脂法
苯环上的取代基对酚酸性强弱的影响 (1)电子效应的影响: 吸电子基团使酸性增强,给电 子基团使酸性减弱。 (2)空间效应的影响: 空阻减弱溶剂化作用(溶剂化 作用有利于酚羟基的离解),从而使酸性减弱。
OH
>
NO 2
pka 7.15
Oபைடு நூலகம் NO 2 >
OH
NO 2 O2N
NO2 OH
7.22
8.39
4.09
OH CC
OH
2、氧化反应
OH
O
[O]
OH
OH [O]
酚和醌

Cl
Cl
有机合成中用来保 护酚羟基 P493 用途:( )用于暂时保护酚羟基,反应完了, 用途:(1)用于暂时保护酚羟基,反应完了,再分解 :( (2)定量测定甲基含量 p238 )
5. 酚的氧化
OH [O] O OH OH [O] O O
O
[抗氧剂 抗氧剂] 抗氧剂
OH HO O
OH
OH
OH
HO
第十一章
I 酚
酚和醌 Phenol and Quinone
11.1. 结构、命名与物性 结构、 酚系指羟基(―OH)与苯环直接相连的化合物。 与苯环直接相连的化合物。 酚系指羟基 与苯环直接相连的化合物
sp2 H . O
1.6D
p-π共轭 π
.
①苯环上电子云密度增加; 苯环上电子云密度增加; ②酚羟基氢的离解能力增强。 酚羟基氢的离解能力增强。
OH + HBr Br
而醇却可以, 而醇却可以,如:
OH
H2SO4 消 除 HBr 取 代
Br
11.4.1 酚羟基的反应
• 酚具有酸性的原因——氧原子以 2(与醇醚不同)杂化轨道 氧原子以SP 与醇醚不同) 氧原子以 参与成键,它的一对未共用电子的P轨道与苯环的 轨道与苯环的6个 轨道平行 轨道平行, 参与成键 , 它的一对未共用电子的 轨道与苯环的 个 P轨道平行, 并且共轭,氧原子的负电荷分散到整个公轭体系中, 并且共轭, 氧原子的负电荷分散到整个公轭体系中,氧的电子云 密度降低,减弱了O-H键,氢原子容易离解成为质子。 密度降低,减弱了 键 氢原子容易离解成为质子。
因酚羟基和环易被浓硝酸氧化,产率很低,所以在氧化 酚羟基和 易被浓硝酸氧化,产率很低, 浓硝酸氧化 ) 时要对酚羟基进行保护(P493)ν 时要对酚羟基进行保护( 酚羟基进行保护
第11章 酚和醌
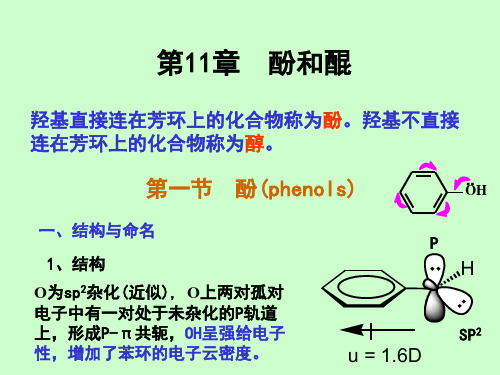
克莱森重排本质上是乙烯基烯丙基的重排
CH2 CH O CH2CH CH2 CH2 CH CH2 CH CH OH 互变
CH2 CH CH2 CH2 CHO
4、与三氯化铁显色 凡具有烯醇式结构的化合物遇FeCl 烯醇式结构的化合物遇 凡具有烯醇式结构的化合物遇FeCl3溶液都有显色反应
NO2
NO2
NO2
苦味酸
Pka = 7.22
4.00
0.71
吸电子基团越多,酸性越强。 吸电子基团越多,酸性越强。
OH
OH < <
OH OCH3 <
OH
吸电子诱导 给电子共轭
OCH3
OCH3
Pka =
10.21
10.0
9.98
9.65
另外,酚的邻位上如有体积很大的取代基,由于苯氧负离 另外,酚的邻位上如有体积很大的取代基, 子的溶剂化受到阻碍,其酸性特别弱。 子的溶剂化受到阻碍,其酸性特别弱。如2,4,6-三新戊 基苯酚中液氨中与金属钠不起反应。 基苯酚中液氨中与金属钠不起反应。
OH (CH3)3C H2C CH2 C(CH3)3 CH2 C(CH3)3
2、酚酯的生成及傅瑞斯(Fries)重排 酚酯的生成及傅瑞斯(Fries)重排 (Fries) 由于酚中存在P 由于酚中存在P-π共轭,降低了氧周围的电子云密度,使其 共轭,降低了氧周围的电子云密度, 亲核性比醇弱。所以酚类不能直接与酸成酯, 亲核性比醇弱。所以酚类不能直接与酸成酯,而要与酸酐或 酰氯作用才能成酯。 酰氯作用才能成酯。
醇钠在水中几 乎全部水解
绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液, 绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液,又 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。
第十一章 酚和醌

O C O + C O AlCl3 C
O H2SO4,SO3 -H2O COOH
O
O
本章重点
1.掌握苯酚的制法(3种方法): 2.掌握酚的化学性质:1.酚羟基的反应(酚的酸性、 酚醚的生成、酯的生成) 2.芳环上的亲电取代反应(鲁化、磺化、硝化、烷基化和酰 基化) 3.与三氯化铁的显色反应 3.掌握苯醌、萘醌和蒽醌的制法:
(5)与三氯化铁的显色反应 OH 6 + FeCl3
不同的酚呈现不同的颜色。 不同的酚呈现不同的颜色。如:
[(ArO)6Fe]H3
紫色络合物
该反应不是酚类独有,对于具有烯醇式结构(-OH与 杂化碳相连) 该反应不是酚类独有,对于具有烯醇式结构(- 与sp2杂化碳相连)的化合物都 (- 可以进行该显色反应。 可以进行该显色反应。
乙醇 回流,80%
O CH2(CH2)2CH3
OH
+
(CH3)2SO4
OCH3
11.4 酚的化学性质
(3)酯的生成 )
11.4 酚的化学性质
2. 芳环上的亲电取代反应
(1) 卤化
OH OH
+
Br2
H2O
Br
Br
+
Br
HBr
意义:①检出微量C OH; 意义:①检出微量C6H5OH; ②定量分析C OH(重量法)。 ②定量分析C6H5OH(重量法)。 邻、对位上有磺酸基团时,可同时被取代,例如:
酚环上的C、O均为sp2杂化,O上的孤对电子与苯环发生p-π共轭:
p-π共轭
①苯环上电子云密度增加; 苯环上电子云密度增加; 酚羟基氢的离解能力增强。 ②酚羟基氢的离解能力增强。
第十一章 酚和醌
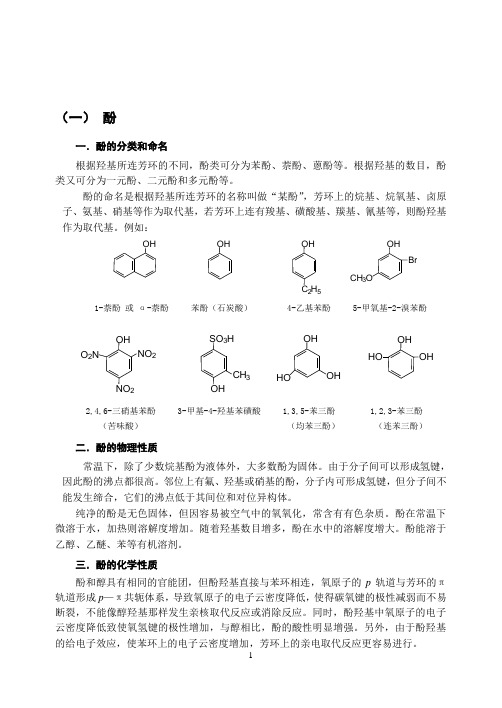
(一) 酚一.酚的分类和命名根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。
根据羟基的数目,酚类又可分为一元酚、二元酚和多元酚等。
酚的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代基。
例如:1-萘酚 或 α-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚2,4,6-三硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯三酚 1,2,3-苯三酚 (苦味酸) (均苯三酚) (连苯三酚)二.酚的物理性质常温下,除了少数烷基酚为液体外,大多数酚为固体。
由于分子间可以形成氢键,因此酚的沸点都很高。
邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔合,它们的沸点低于其间位和对位异构体。
纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。
酚在常温下微溶于水,加热则溶解度增加。
随着羟基数目增多,酚在水中的溶解度增大。
酚能溶于乙醇、乙醚、苯等有机溶剂。
三.酚的化学性质酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p 轨道与芳环的π轨道形成p —π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能像醇羟基那样发生亲核取代反应或消除反应。
同时,酚羟基中氧原子的电子云密度降低致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。
另外,由于酚羟基的给电子效应,使苯环上的电子云密度增加,芳环上的亲电取代反应更容易进行。
OH OH OH 2H 5OHBrCH 3OOHOHOHNO 2O 2N2SO 3H CH 3HOOHHOOH苯酚中p-π共轭示意图综上所述,酚的主要化学性质可归纳如下:1.酸性酚类化合物呈酸性,大多数酚的pKa 都在10左右,酸性强于水和醇,能与强碱溶液苯酚的酸性比碳酸弱,能溶于碳酸钠溶液,但不能溶于碳酸氢钠溶液,在苯酚钠的溶液中通入二氧化碳能使苯酚游离出来。
有机化学十一酚和醌

OH NO2
俗称苦味酸,强酸性,有腐蚀 性,易爆,是一爆炸品。
OH
OH
OH OH
邻苯二酚 1,2-苯二酚
HO
间苯二酚 1,3-苯二酚
HO
OH
OH
均苯三酚 偏苯三酚
1,3,5-苯三酚 1,2,4-苯三酚
第8页/共42页
11.3 酚的制法
1. 异丙苯氧化法
该方法以苯及丙烯为原料,先经傅氏烷基化反应得 到异丙苯,再经空气氧化为氢过氧化异丙苯后,与硫 酸作用就分解为两种重要的化工原料苯酚和丙酮。
第11页/共42页
• 间苯二酚的制备方法
SO3Na 固体NaOH 加热熔融
SO3Na
ONa
H3+O
ONa
OH OH
• 萘酚的制备方法
SO3Na 固体NaOH 加热熔融
ONa
OH H3+O
第12页/共42页
• 酚的沸点和熔点较高都比相对分子质量相近的烃高, 这是由于酚分子之间可发生氢键缔合。
第14页/共42页
1. 酚羟基的酸性
苯酚的水溶液显酸性,使指示剂石蕊变红,其酸性 ( pKa≈10 ) 比 醇 和 水 的 酸 性 强 , 但 比 碳 酸 弱 (pKa=6.38)。可与强碱NaOH反应生成酚钠,但不 能与NaHCO3反应,用此性质可区别醇、酚和羧酸。
OH + NaOH
ONa + H2O
第19页/共42页
Cu,20MPa
HCl
Cl + NaOH 350~370℃
ONa
OH
此法操作简便,副产物易分离,但需要高压反应,且
碱对设备的腐蚀严重,反应困难。若苯环上连有强吸
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
31
2.芳环上的亲电取代反应(Electrophilic Aromatic Substitution) 3)磺化反应
苯酚与浓硫酸发生磺化反应生成羟基苯磺酸,磺化条件不同,产物不同。
苯酚分子中引入两个磺酸基后,苯环被钝化而不易 被氧化,再与浓硝酸作用,两个磺酸基可同时被臵换 而生成2,4,6-三硝基苯酚(苦味酸)。
11.4 酚的化学性质
酚的主要 化学性质
20
11.4 酚的化学性质
1.酚羟基的反应 1)酸性 问题1:酚的酸性到底有多大?
说明酚的酸性比碳酸弱
说明酚的酸性比醇强
21
钝化基团越强, pKa越小,活化基团越强,pKa越大。也就是说,拉电子基团降 低亲电取代反应的活性增强了酸性,相反供电子基团增强了亲电反应的活性,降 低了酸性。
1)定义: 含有共轭环己二烯酮结构的一类化合物称为醌。
2)结构:
c
121.2 pm
C
O
醌为脂环化合物不饱和环二酮,不是芳香化合物 ,没有芳香性。
121.9 pm
3)物性:
醌为结晶固体,都具有颜色;对位醌多呈黄色,邻位醌则常为红色或橙色. 对位醌具有刺激性气味,邻位醌没有气味。
45
11.6 醌
2.醌的命名
第十一章 酚和醌
(PHENOLS AND QUINONES)
李晓川 化学&化工学院
1
学习要求:
1. 掌握酚、醌的分类及其命名方法;
2. 掌握酚、醌的结构特点与化学性质;▲
3. 掌握酚、醌的制备方法; 4. 理解酚及取代酚的酸性, 比较醇和酚的酸性;▲ 5. 了解重要酚的制法和用途; 6. 了解重要的醌。
34
Kolbe-Schmitt reaction
Adolph Wilhelm Hermann Kolbe 1818 –1884
阿斯匹林 aspirin 阿斯匹林具有很多特性使得它成为一个常用药。它是止痛剂,可以有效的缓解 头痛。它也是一个消炎药,可以缓解关节炎或小手术的肿状痛。它也是一个退 热剂,可以退烧。每年美国要生产四千万磅的阿斯匹林。相当于每个人(包括 妇女和儿童)每年消耗三百片阿斯匹林。
结构特点:两个羰基,两个碳碳共轭双键。
特征反应:C=C双键加成,羰基加成,1,4-加成,双烯反应,还原反应。
熔点
沸点(1 atm)
溶解度(水, 25 ℃)
-95 ℃
111℃ 0.05g/100mL
43℃
132℃ 9.3g/100mL
-41℃
85℃ 0.2g/mL
5.IR谱: 游离O-H伸缩振动:3611-3603 cm-1(不定、尖峰) 缔合O-H伸缩振动:3500-3100 cm-1(强峰、宽峰) C-O伸缩振动:~1230 cm-1 (R-OH伸缩振动:1200 ~1050 cm-1 ) 苯环C=C伸缩振动:1600(中)、1580、1500(强)、1450(弱)cm-1
羟基是强活化基团。酚易在邻、对位上发生卤化、硝化、磺化、烷基化
等亲电取代反应。
28
2.芳环上的亲电取代反应(Electrophilic Aromatic Substitution) 1)卤化反应
苯酚与溴水作用,在室温下就能生成2, 4, 6-三溴苯酚的白色沉淀。如溴 水过量,则生成黄色的四溴衍生物沉淀。
对羟基苯磺酸
7
11.2 酚的物理性质
1.物质形态: 大多数酚为无色结晶固体,但易被空气氧化成有色杂质。
2.熔、沸点: 沸点和熔点高于质量相近的烃(氢键)。邻位上有卤素、羟基
或硝基等基团的酚,可形成分子内氢键,但分子间不能发生 缔合,它们的沸点低于其间位和对位异构体。
3.溶解性能: 微溶于水,能溶于酒精、乙醚等有机溶剂。
26
1.酚羟基的反应 3)酯的生成 酚与羧酸反应比较难,可以用两种方式来催化。 一种是通过其中一个羧基氧把酸酐转化为更强的酰化试剂。通常是加几滴硫酸 就可以充分进行反应; 另一种方法是增强酚的亲核性,通过在碱性环境中把酚转化为酚氧负离子
27
2.芳环上的亲电取代反应(Electrophilic Aromatic Substitution)
芳环上有供电子基时,酸性减弱!有吸电子基时,酸性增强!邻对位上吸电子 基越多,酸性越强!
24
1.酚羟基的反应 2)酚醚的生成 酚金属与烷基化剂(卤烷或硫酸酯)在弱碱性溶液中作用可得酚醚。
不能用脱水的方法来制备酚醚(p-π共轭,使C-O键带有部分双键性质)!
二芳基醚需在铜催化下加热制得。
25
烷基卤必须是 易于进行 SN2反应的卤代烃。因此甲基和一级卤代烃是有效的烷基化试剂。 用二级卤代烃时,消除反应与取代反应是竞争反应,用三级卤代烃时,消除反应将是反 应中唯一的反应。
11.3 酚的制法
1. 从芳磺酸制备(最早采用的方法)
这是最古老的制备酚的方法。苯磺化后得到苯磺酸,苯磺酸与熔融的氢氧 化钠一起加热,酸化反应混合物后得到酚。
优点:设备要求简单,产率高,纯度好。
缺点:工序长,劳动强度大,难以自动化,酸碱需求量大。
当芳环上有-COOH、-Cl、-NO2时,副反应严重。
酚过量时,缩合产物是不含羟甲基的4,4ˊ-二羟基二苯甲烷和2,2ˊ-二羟基 二苯甲料等.酚醛塑料又 称电木,广泛用于电绝 缘器材及日用品的制造。
38
酚与三氯化铁的显色反应
酚类与三氯化铁生成有颜色的络合物:
不同的酚其相应的络合物呈现不同颜色,例如:
蓝紫
深绿
暗绿
11.3 酚的制法
2. 从异丙苯制备(采用最广泛的方法)
工业上应用最广泛的制酚主法是以异丙苯作为起始原料的。 美国几乎所有的苯酚都是用此方法制备的。
11.3 酚的制法
3. 从芳卤衍生物制备
当卤原子的邻位或对位有强吸电子基团时,水解反应较易进行。
邻、对位上的吸电子基 团有利于增加此亲核取 代反应所形成的中间体 迈森海默络合物的稳定 性。
蓝
蓝绿
棕红
这种特殊的显色反应可用来检验酚羟基的存在。除酚类外,凡具有烯醇结构 的化合物与FeCl3都有显色反应。
39
★氧化反应
酚易被氧化为醌等氧化物,氧化物的颜色随氧化程度的深化而逐渐加深.由 无色而呈粉红色、红色以致深褐色。多元酚更易被氧化。
121.9 pm
对苯醌 棕黄色
40
11.5 重要的酚
41
11.5 重要的酚
2. 甲苯酚
1)物性: 简称甲酚,有邻、间和对三种异构体. 沸点相近,不易分离。邻、对甲酚 均为无色晶体,间甲酚是无色或淡黄色液体。 2)用途: 制备染料、炸药、农药、电木的原料 ;甲酚杀菌能力比苯酚强,可用作 木材、铁路枕木的防腐剂,医药上用作消毒剂(来苏尔、来苏水:47-53% 三种甲酚的肥皂水溶液)。 3)制法: 甲苯磺酸盐碱熔法、氯甲苯水解(加压加热)法。
1Å = 10-10m
4
11.1 酚的构造、分类和命名
2.酚的分类 -OH是酚的官能团,称为酚羟基。 按-OH所连芳环的不同分为:苯酚、萘酚、蒽酚等。
1-萘酚(α-萘酚)
9-蒽酚
苯酚 石炭酸
3-甲基苯酚
按-OH的数目分为:一元酚、二元酚、三元酚等。
邻硝基苯酚
间硝基苯酚
对硝基苯酚
5
二元酚
邻苯二酚
间苯二酚
32
2.芳环上的亲电取代反应(Electrophilic Aromatic Substitution) 4)烷基化和酰基化反应
酚的烷基化反应是用醇或烯烃作烷基化剂,浓硫酸为催化剂.较少用AlCl3作 催化剂,因酚羟基与AlCl3可形成络合物(ArOAlCl2)而失活。
33
酰氯为酰化试剂
Fries rearrangement(机理选读)
42
11.5 重要的酚
3. 对苯二酚(氢醌)
1)物性: 无色固体,熔点170℃,溶于水、乙醇、乙醚,极易被氧化为醌。 2)用途:
强还原剂,可用作显影剂,亦可作防止单体聚合的阻聚剂。
3)制法:
对苯二酚可由苯胺氧化成对苯醌后,再经缓和还原剂还原而得。
43
11.5 重要的酚
4. 萘酚
1)物性: α-萘酚是白色针状结晶,受光变玫瑰色;β-萘酚是白色至红色片状结晶, 空气中久臵颜色变深;能溶于醇、醚等有机溶剂。 两种萘酚均能升华。
邻苯醌:红色结晶固体,不很稳定,无一定的熔点,60℃以上分解。
对苯醌:简称苯醌,金黄色结晶固体,m.p.116℃,易升华,有刺激臭味,能随 水蒸汽挥发,溶于乙醇、乙醚,易溶于热水。
48
11.6 醌
3)制法:邻苯醌和对苯醌可由相应的二元酚氧化制得。
苯胺氧化也可制得对苯醌:
49
11.6 醌
4)化学性质
2)用途:
重要的染料中间体(偶氮染料);β-萘酚还可用作杀菌剂、抗氧剂。 3)化性: 其羟基比苯酚的羟基活泼:弱酸性,同FeCl3发生颜色反应(α-萘酚呈紫色 絮状沉淀,β-萘酚呈绿色 ),易发生硝化、磺化,易成醚和酯。 4)制法: 萘磺酸钠经碱熔可得相应的萘酚。
44
a b
11.6 醌
1. 醌的定义、结构和物性
1. 苯酚(石炭酸)
1)物性:
无色棱形晶体,在空气中放臵易因氧化而呈红色;微溶于冷水,在65℃以上 可与水混溶,易溶于乙醇、乙醚和苯等有机溶剂。
2)用途:
有机合成的重要原料,多用于制造塑料、医药、农药、染料等;有毒性, 可用作防腐剂,在医学上可用作消毒剂。
3)制法: 异丙苯氧化法、卤苯水解法、苯磺酸盐碱熔法等。
对苯二酚
三元酚
1,2,3-苯三酚
1,3,5-苯三酚
1,2,4-苯三酚
6
