第11章酚和醌
第十一章酚和醌

O CH2COOH Cl Cl
2,4-二氯苯氧乙酸(2,4-D) 酚醚化学性质比酚稳定,不易氧化,而且与HI作 用,分解为酚,此反应可用来保护酚羟基。
OCH3 OH
+
2015/11/28
HI
+
习题13
CH3I
23
克莱森重排
定义:烯丙基芳基醚在高温下可以重排为邻烯 丙基酚或对烯丙基酚,这称为克莱森重排。
X
X
亲核性比醇弱
O O CH3
成酯:
OH + CH3COOH + CH3COCl + (CH3CO)2O
OH + CH3COOH
O
98%H2SO4 4h/55%
O C CH3
乙酸苯酯
2015/11/28
25
在酸催化下,酚与羧酸作用也能生成酯,但比醇 难。通常采用酰氯或酸酐与酚反应。例如:
O C Cl + HO
14
OCH2CH=CH2
OH
200oC
14
OH
CH2CH=CH2
200oC
14
O
CH2CH CH2
190-220C 6h
OH CH2CH CH2
CH2CH=CH2
O H3C
CH2CH CH2 CH3 H3C
OH CH3
CH2CH CH2
2015/11/28
24
(3)酯的生成
难
OH + HX
对 10.00 10.26 10.21 9.81 9.38 9.26 9.20 7.15
徐寿昌《有机化学》(第2版)配套题库【名校考研真题】(下册)-第1~20章【圣才出品】

第一部分名校考研真题第11章酚和醌一、选择题1.下列化合物碱性最强的是()。
[中国科学院-中国科学技术大学2001研]【答案】(A)【解析】酚的碱性与酚羟基上氧的孤对电子有关,氧原子上的电子云密度越大,碱性越强。
氰基、溴原子都为吸电子基,使氧原子上电子云密度降低。
2.下列化合物中,酸性最强的是()。
[天津大学2000研]【答案】(D)【解析】硝基为吸电子基,使邻、对位的电子云密度降低,使酚羟基的酸性增强。
3.下列物种作为离去基团时最易离去的是()。
[大连理工大学2004研]【答案】(A)【解析】硝基为吸电子基,使负电荷得以分散,故(A)最稳定,作为离去基团,最易离去。
二、简答题1.为什么?[上海大学2004研]答:甲氧基的给电子共轭效应使对位电子云密度增大,从而使对位酚羟基的酸性减弱,而间位甲氧基只有吸电子的诱导效应而无给电子的共轭效应,故间甲氧基苯酚的酸性比对甲氧基苯酚强。
2.从反应机理说明为什么烷芳混合醚(ArOR)在与氢碘酸共热时,只得到RI和ArOH,而不是ArI和ROH。
[南京大学2002研]答:醚与氢碘酸共热时先生成烊盐,然后发生碳氧键的断裂,生成醇和碘代烷。
对于混合醚,碳氧键断裂的顺序为:三级烷基>二级烷基>一级烷基>芳基,芳基与氧的孤对电子共轭,因此烷芳混合醚与氢碘酸共热时,芳基与氧相连的碳氧键没有断裂,烷基与氧相连的碳氧键断裂,产物为酚和碘代烷。
3.化合物(A)和(B)中哪个酸性较强?(C)和(D)相比较呢?简述理由。
[华东理工大学2003研]答:硝基的吸电子共轭效应,使邻、对位电子云密度降低,酚羟基的酸性增强,故酸性(B)>(A);甲基的立体效应使(C)中硝基的π-π共轭效应减弱。
化合物(A)和(B)中酸性(B)>(A);化合物(C)和(D)中酸性(D)>(C)。
甲基的立体效应使(C)中硝基的共轭效应减弱。
4.以苯以及必要的有机、无机试剂为原料合成3,4,5-三溴苯酚。
[武汉大学2002研]答:酚羟基为邻对位定位基,若先合成苯酚,再溴化将得到2,4,6一三溴苯酚,而题目要求合成3,4,5一三溴苯酚,故必须借助氨基的定位效应来定位,然后通过重氮化来完成目标产物的合成。
第11章 酚和醌(食品2)

2、氯苯水解 、
Cl
+
NaOH
Cu ,20MPa 350~370℃
ONa
HCl
OH
优点: 操作简便,副产物易分离; 优点: 操作简便,副产物易分离; 缺点: 需要高温、 高压反应, 缺点 : 需要高温 、 高压反应 , 且碱对设备的腐蚀严 重,反应困难。 反应困难。 若苯环上连有强吸电子基,水解较易。 若苯环上连有强吸电子基,水解较易。 强吸电子基
OH
H3C CH3 C CH2
OH
+
CH3
浓 H2SO4
(CH3)3C
C(CH3)3
4-甲基 甲基-2,6-二 甲基 二 叔丁基苯酚
20
CH3
酚也较容易发生酰基化反应, 酚也较容易发生酰基化反应,但酚羟基上易发生酯 容易发生酰基化反应 化反应,而使酚的酰基化反应产率较低。 化反应,而使酚的酰基化反应产率较低。
二、酚的制法 1、异丙苯氧化法
O OH
OH
O2 / 过过酸过 110~120℃
稀 H2SO4 75~80℃
O
+
氢过氧化异丙苯 聚合橡胶的引发剂
此法是目前工业生产苯酚最主要 最好的方法 最主要和 的方法, 此法是目前工业生产苯酚最主要和最好的方法, 原料廉价易得,可连续化生产, 原料廉价易得,可连续化生产,副产品丙酮也是常用 的有机试剂、有机溶剂之一。 的有机试剂、有机溶剂之一。
酚过量: 酚过量:
OH
HCHO
2
H or OH
+
-
HO
CH2
OH CH2 或
OH
OH
23
以上中间产物与甲醛、苯酚继续作用, 以上中间产物与甲醛、苯酚继续作用,就可得到 线型酚醛树脂: 线型酚醛树脂:
徐寿昌《有机化学》(第2版)配套题库【章节题库】(下册)-第11~14章【圣才出品】

第三部分章节题库第11章酚和醌一、选择题1.下列化合物发生溴化反应,反应速率最快的是()。
A.苯B.苯甲酸C.苯酚【答案】C【解析】羧基是钝化苯环的,难发生亲电取代反应;羟基是活化苯环的,易发生亲电取代反应。
二、简答题1.写出下列化合物的名称。
答:(1)间-苯二酚(1,3-苯二酚)(2)4-硝基-1,3-苯二酚(3)2-硝基-5-羟基苯甲酸(4)2-甲基-6-羟基-1,4-萘二磺酸(5)7-氨基-3-氯-1-萘酚2.有毒常春藤和栎木中具有刺激气味的物质叫漆酚,根据如下实验报告,写出漆酚A 的结构和反应中间体B~I的结构。
答:3.。
答:4.2,4,6-三叔丁基苯酚在醋酸溶液中与溴反应,生产化合物A(C18H29BrO),产率差不多是定量的。
A的红外光谱图中在1630cm-1和1650cm-1处有吸收峰,1HNMR 谱图中有3个单峰δH=1.19、1.26和6.90,其面积比为9:18:2。
试推测A的结构。
答:A.5.完成下列合成反应,可用其他任何必要的试剂。
(1)由均三甲苯(1,3,5-三甲苯)合成2,4,6-三甲基苯酚;(2)由苯酚合成对叔丁基苯酚;(3)由苯酚合成2-溴乙基苯基醚;(4)由间甲苯酚合成2,6-二硝基-4-叔丁基-3-甲基茴香醚。
答:6.用化学方法把下列混合物分离成单一组分。
(1)苯酚和环己醇混合物;(2)2,4,6-三硝基苯酚和2,4,6-三硝基甲苯混合物。
答:7.按酸性由大到小的顺序排列下列各组中的化合物。
(1)苯甲酸,环己醇,苯酚,碳酸,硫酸,水;(2)苯酚,间氯苯酚,间甲基苯酚,间硝基苯酚;(3)对溴苯酚,间溴苯酚,3,5-二溴苯酚。
答:(1)硫酸>苯甲酸>碳酸>苯酚>水>环己醇;(2)间硝基苯酚>间氯苯酚>苯酚>间甲基苯酚(取代基在间位时,主要考虑诱导效应;吸电子取代基有利于羟基质子的解离,使酸性增加);(3)3,5-二溴苯酚>间溴苯酚>对溴苯酚(溴在对位时,表现吸电子诱导效应和给电子共轭效应;在间位时,只表现吸电子诱导效应)。
有机化学课后习题答案11第十一章酚醌
2)
SO3H 浓H2SO4 NaOH ONa H+ OH
OH 浓H2SO4 Cl2 Cl
OH Cl H+ Cl
OH Cl
SO3H
SO3H
OCH3 浓 H2SO4 SO3H 浓HNO3 O2N OCH3 NO2
3.
1)
OH CH3I OCH3
SO3H
NO2
2)
OH
+
OH CH3COOH BF3 CH3COCl
OC2H5 H
+
OC2H5
CH2CH2MgBr
CH2CH2OH
123
习题 C 一. 1. 4. 7. 蒽醌 4-硝基萘酚 4-羟基-2-溴苯乙酮 2. 5. 8. 2-萘酚 4-溴萘酚 对羟基苯乙酮 3. 6. 9. 4-羟基-3-甲氧基苯甲醛 3-甲基-4-羟基苯甲酸 对苯醌
二. 1. A 2. C 3. C 4. A 5. C 6. D 7. C 三.完成下列反应式
5.
O 1,4-环己二肟
6.
COCH3
7.
4-甲基-2,6-二羟基-α-苯乙醇
OH
8.
9.
1,4-环己二酮
10. H2N 二.
OH
1.
CH2CH2CH2Br,
OCH2CH=CHCH3 OH
O
2. ,
O
CHCH=CH2 CH3
3.
O
,
三. 1. C>A>B
2. A>C>B
四. (1) 1.溴水处理,有白色沉淀生成为苯酚;2.加入金属钠,有气体生成为丁醇;3.剩余两种化 合物中,溶于浓硫酸的是丁醚,不溶的则为己烷。 (2) 用氢氧化钠水溶液处理,苯酚溶于氢氧化钠水溶液,苯甲醇不溶。 (3) 用氢氧化钠水溶液处理,对甲苯酚溶于氢氧化钠水溶液,苯甲醚不溶。 (4) 与溴水处理,生成白色沉淀为含酚的水溶液,无沉淀则为纯水。 五. 1.
第11章 酚和醌
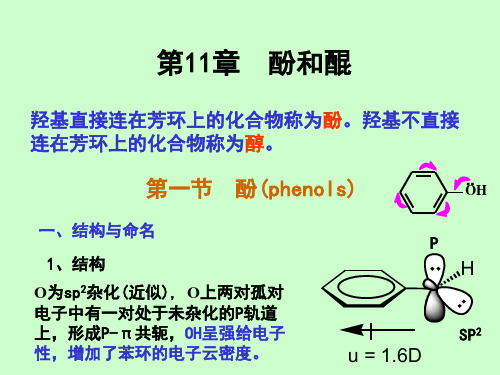
克莱森重排本质上是乙烯基烯丙基的重排
CH2 CH O CH2CH CH2 CH2 CH CH2 CH CH OH 互变
CH2 CH CH2 CH2 CHO
4、与三氯化铁显色 凡具有烯醇式结构的化合物遇FeCl 烯醇式结构的化合物遇 凡具有烯醇式结构的化合物遇FeCl3溶液都有显色反应
NO2
NO2
NO2
苦味酸
Pka = 7.22
4.00
0.71
吸电子基团越多,酸性越强。 吸电子基团越多,酸性越强。
OH
OH < <
OH OCH3 <
OH
吸电子诱导 给电子共轭
OCH3
OCH3
Pka =
10.21
10.0
9.98
9.65
另外,酚的邻位上如有体积很大的取代基,由于苯氧负离 另外,酚的邻位上如有体积很大的取代基, 子的溶剂化受到阻碍,其酸性特别弱。 子的溶剂化受到阻碍,其酸性特别弱。如2,4,6-三新戊 基苯酚中液氨中与金属钠不起反应。 基苯酚中液氨中与金属钠不起反应。
OH (CH3)3C H2C CH2 C(CH3)3 CH2 C(CH3)3
2、酚酯的生成及傅瑞斯(Fries)重排 酚酯的生成及傅瑞斯(Fries)重排 (Fries) 由于酚中存在P 由于酚中存在P-π共轭,降低了氧周围的电子云密度,使其 共轭,降低了氧周围的电子云密度, 亲核性比醇弱。所以酚类不能直接与酸成酯, 亲核性比醇弱。所以酚类不能直接与酸成酯,而要与酸酐或 酰氯作用才能成酯。 酰氯作用才能成酯。
醇钠在水中几 乎全部水解
绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液, 绝大部分酚类化合物不溶或微溶于水,但能溶于碱性水溶液,又 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。 能被酸从碱液中析出。利用这一性质可分离和提纯酚类化合物。
有机化学第十一章 酚和醌
SO3Na
NaOH熔 融
ONa
酸 化
OH
330~340℃
此法是较早的生产方法,苯酚的收率高、质 量好、生产设备简单,但反应流程复杂、且生产 不连续,消耗大量的硫酸和烧碱,不宜大规模生 产,目前,仅用来生产萘酚和间苯二酚。
OH C C OH
用于定性分析
11.4.2 芳环上的亲电取代反应
羟基是强的邻对位定位基,由于羟基与苯环的P-π 共
轭,使苯环上的电子云密度增加,亲电反应容易进行。 1. 卤代 苯酚在室温下与溴水反应,生成2,4,6-三溴苯酚的 白色沉淀,反应定量进行,常用于酚的定量、定性 分析试验。
Br
OH
Br2/H2O
OH +
H
OH (20%)
25℃
OH NO2 + NO2
=
O
= N
O O HO
N
O
HO
=
N O 分子间氢键 (沸点较高)
O
O
分子内氢键 (沸点较低)
故可借助水蒸气蒸馏将二者分开。
浓硝酸的氧化性很强,如用浓硝酸进行硝化, 则易将苯酚氧化,所以多硝基苯酚不能用苯酚直接硝
化的方法制备。如2,4-二硝基苯酚是由2,4-二硝基
• 酚的沸点和熔点较高都比相对分子质量相近的烃高, 这是由于酚分子之间可发生氢键缔合。
酚易溶于醚等有机溶剂,有腐蚀性、毒性、杀菌性。 如苯酚和甲酚。在十七世纪的欧洲,没有发明青霉 素之前,很多人因不小心弄出个小口子,都可能因 感染而死,那时人们用石炭酸(苯酚)消毒,但它 不仅杀死了细菌,连正常的组织也被破坏,有时甚 至不如不用。 •将甲酚(甲基苯酚的混合物)用肥皂水溶解成 40%的溶液,即医院中消毒常用的“来苏水”。
徐寿昌《有机化学》(第2版)课后习题(酚和醌)【圣才出品】
(8)2,6-二叔丁基-4-硝基苯酚
(9)2,6-二氯ห้องสมุดไป่ตู้酚
(10)4-乙基-2-溴苯酚
答:(1)间苯三酚:
+ 3 SO3
HO3S
SO3H NaOH
SO3H
H+ HO
OH OH
(2)4-乙基-1-3-苯二酚
(3)对亚硝基苯酚
(4)苯乙醚
OH + (C2H5)SO4 NaOHaq
OC2H5
(5)2,4-二氯苯氧乙酸
答:化合物(A)丌溶于氢氧化钠,遇 FeCl3 无颜色反应,由此可以判断化合物(A) 丌含有酚羟基。但是该化合物能不一个或两个羟氨分子结合,说明化合物(A)含有两个羰
基。化合物(A)的可能结构为:
。化合物(B)能溶于氢氧化钠,且不 FeCl3 有
(6)对羟基苯磺酸
(7)1-甲基-2-萘酚
(8)9-蒽酚
(9 )1 ,2 ,3-
苯三酚
(10)5-甲基-2-异丙基苯酚 (11)5-硝基-1-萘酚
(12)β-氯蒽醌
1 / 11
圣才电子书 十万种考研考证电子书、题库视频学习平台
2.写出下列各化合物的构造式: (1)对硝基苯酚 (2)对氨基苯酚 (3)2,4,二氯苯氧(基)乙酸(2,4-D) (4)2,4,6-三溴苯酚 (5)邻羟基苯乙酮 (6)邻羟基乙酰苯 (7)4-甲基-2,6-二叔丁基苯酚(二六四抗氧剂) (8)1,4,萘醌-2-磺酸钠 (9)2,6,蒽醌二磺酸(ADA) (10)醌氢醌 (11)2,2-(4,4′-二羟基二苯基)丙烷(双酚 A) (12)对苯醌单肟 答:
答:
3 / 11
圣才电子书 十万种考研考证电子书、题库视频学习平台
第十一章 酚和醌
(一) 酚一.酚的分类和命名根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。
根据羟基的数目,酚类又可分为一元酚、二元酚和多元酚等。
酚的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代基。
例如:1-萘酚 或 α-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚2,4,6-三硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯三酚 1,2,3-苯三酚 (苦味酸) (均苯三酚) (连苯三酚)二.酚的物理性质常温下,除了少数烷基酚为液体外,大多数酚为固体。
由于分子间可以形成氢键,因此酚的沸点都很高。
邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔合,它们的沸点低于其间位和对位异构体。
纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。
酚在常温下微溶于水,加热则溶解度增加。
随着羟基数目增多,酚在水中的溶解度增大。
酚能溶于乙醇、乙醚、苯等有机溶剂。
三.酚的化学性质酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p 轨道与芳环的π轨道形成p —π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能像醇羟基那样发生亲核取代反应或消除反应。
同时,酚羟基中氧原子的电子云密度降低致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。
另外,由于酚羟基的给电子效应,使苯环上的电子云密度增加,芳环上的亲电取代反应更容易进行。
OH OH OH 2H 5OHBrCH 3OOHOHOHNO 2O 2N2SO 3H CH 3HOOHHOOH苯酚中p-π共轭示意图综上所述,酚的主要化学性质可归纳如下:1.酸性酚类化合物呈酸性,大多数酚的pKa 都在10左右,酸性强于水和醇,能与强碱溶液苯酚的酸性比碳酸弱,能溶于碳酸钠溶液,但不能溶于碳酸氢钠溶液,在苯酚钠的溶液中通入二氧化碳能使苯酚游离出来。
有机化学第二版第11章酚和醌
本章主要内容
1. 酚的构造、分类与命名. 2. 酚的制备方法与重要的酚. 3. 酚的化学性质及结构对性质的影响. 4. 苯醌的结构特点与性质. 5. 萘醌、蒽醌的结构特点与应用.
编辑ppt
(一)酚
11.1 酚的结构、分类和命名
◆ 酚是羟基(-OH)直接和苯环相连的化合物,官能 团为酚羟基.
Br
ArN2Cl H3+O ArOH
N2HSO4
H3+O
△ Br
OH Br
编辑ppt
1.如何从苯出发合成间苯二酚?
2.从萘出发合成 -萘酚及其衍生物?
H+
H
165℃
编辑ppt
11.3 酚的物理性质
◆酚大多数为结晶固体,微溶于水。 ◆酚分子中含有羟基,酚分子间、酚与水分子间有
氢键缔合,其沸点和溶点高于质量相近的烃. ◆邻、间、对苯二酚的熔、沸点渐高.
与羟胺反应
苯 醌 单 肟 ( wo) 与 对 亚硝基苯酚的互变
编辑ppt
互变异构体
(4)还原反应 ☺对苯醌与对苯二酚可通过还原与氧化反应互变。
(黄色) 熔点 116℃
醌氢醌(暗绿色) 171 ℃
无色
☺对苯醌与对苯二酚可生成分子络合物,称为醌氢醌,
其缓冲溶液可用作标准参比电极。
☺对苯二酚的水溶液中加入FeCl3,溶液先呈绿色,再 变棕色,最后也析出暗绿色的醌氢醌晶体。
◆碱催化先形成苯氧负离子,苯氧负离子比苯酚有 更强的亲核性.
编辑ppt
羟甲基苯氧负离子
3.醛过量时形成羟甲基较多的中间产物:
2,4--二羟甲基苯酚
2,6--二羟甲基苯酚
4.酚过量时形成不含羟甲基的中间产物:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NaNO2/H2SO4
NaNO2/HCl
ArN2Cl
N2HSO4
H3+O
ArOH
OH
H3+O
Br
Br
△
Br
9. 由苯或甲苯和必要的无机或有机试剂合成下列化合物:
(1) 间苯二酚
(9)2,6-二氯苯酚
OH H2SO4 OH 2 Cl2 OH CL H2O,HCl Cl OH Cl
Cl
SO3H
SO3H
11.5.1 苯酚
俗名石炭酸,有机合成的重要原料,用于制造酚醛树脂 及其他高分子材料、药物、染料、炸药等。
例1:苯酚催化加氢生成环己醇,可用于生产尼龙-66:
[O]
己二酸
例2:鸡眼膏:苯酚与乙酰水杨酸的混合膏体。
11.5.2 甲苯酚 甲苯酚(简称甲酚)有邻、间、对位三种异构体,存 在于煤焦油中,沸点相近,不易分离。邻、对甲酚为 无色晶体,间甲苯酚为无色或淡黄色液体,用于制备 农药、染料、炸药、电木等。 工业上甲酚可由甲苯磺酸钠盐制备:
苯酚与FeCl3络合显紫色
11.4.2 芳环上的亲电取代反应
羟基是强邻对位定位基,使苯环活化。本质原因是酚氧结 构的P- π共轭增加了苯环的电子云密度,芳环亲电活性增强。
①卤化反应—酚很容易发生卤化。 •苯酚与溴水作 用,生成2,4,6三溴苯酚白色 沉淀 •溴水过量,生成黄色 的四溴苯酚析出 •邻、对位上有磺酸基 团时,可同时被取代
例如: OH
OH
OH
SO 3 H
CH3 H SO 2OH 对羟基苯甲醇
OCH3 SO 3 H 对甲氧基苯酚
对羟基苯磺酸
1. 用系统命名法命名下列化合物:
OH (1) CH3 OH (2) C 2H 5 OH (3) OH CH3 CH3
间甲酚
OH NO2 (5)
4-乙基-1,3-苯二酚
CH3 (7) OCH3 (6)
11.4.3 与三氯化铁的显色反应
大多数酚与FeCl3溶液作用能生成带颜色的络离子,被用来鉴定酚。
与FeCl3的颜色反应并不限于酚,具有烯醇式结构的脂肪族化合物 也有这个反应。酚具有类似烯醇式的结构,所以表现了相似的性质。
CH2OH
如何证明在邻羟基苯甲醇(水杨醇)
一个酚羟基和一个醇羟基? (P270-7)
甲苯酚的肥皂溶液: 医院消毒剂-来苏尔。
11.5.3 对苯二酚 无色固体,易氧化成醌。可由苯胺氧化成对苯醌 后,再还原制备。
[O]
对苯二酚极易氧化成醌。对苯二酚是强还原剂, 用作显影剂和高分子合成的阻聚剂。
11.5.4 萘酚 萘酚有-萘酚和-萘酚两种异构体,由相应的萘磺 酸钠经碱熔制备,是重要的染料中间体。 -萘酚用作 杀虫剂,抗氧剂。
11.2.3 从芳磺酸制备 –碱熔法
苯磺酸钠
酚钠 苯酚
优点:设备简单,产率高,产品纯度高。
缺点:工序多,强度大,难自动化,消耗大量酸碱,成本高;温度 高, 当环上有-COOH、-Cl、-NO2等基团时,副反应多。
11.2.4 从芳胺制备 –重氮盐法
芳伯胺与亚硝酸(NaNO2/HCl)在低温下反应 生成芳基重氮盐(重氮化反应),重氮盐受热水解 得到酚. ArNH2 例如:
◆酚的分类:按所含羟基的数目多少,分为一元酚和多元酚. ◆酚的命名:以苯酚作为母体,其他基团作为取代基.
例如:
一元酚
二元酚
三元酚
◆带有优先序列取代基的命名: 按取代基的排列次序的先后来选择母体,当取代基
的序列优于酚羟基时,酚羟基作为取代基。 取代基的先后排列次序为:
-COOH, -SO3H, -COOR, -COX, -CONH2, -CN, -CHO, >C=O, -OH(醇), -OH(酚), -SH, -NH2, -OR, R烷基, -NO2, -X
稀硝酸,室温
浓硝酸,室温
◆因酚羟基和环易ቤተ መጻሕፍቲ ባይዱ浓硝酸氧化,产率很低.
通常在氧化时要对酚羟基先进行保护.
◆邻硝基苯酚和对硝基苯酚可通过水蒸汽蒸馏分开.
邻位-氢键
邻硝基苯酚通过分子内氢键形成六元环螯合物,可随水蒸汽挥发. 对硝基苯酚只能通过分子间的氢键缔合,不能随水蒸汽挥发.
下列化合物哪些能形成分子内氢键?
◆醇与酚不同,没有电子的离域现象,难于离解.
◆酸性比较: 碳酸:pKa=6.4 强 增 性 酸 苯酚:pKa=10
乙醇:pKa=17
环己醇:pKa=18
• 苯酚能溶解于氢氧化钠水溶液
工业上利用苯酚能溶 于碱,而又可用酸分 离的性质来处理和回 收含酚废水。
• 通入二氧化碳,苯酚即游离出来
酸性:碳酸>苯酚
苯酚 酚羟基中的氧原子为sp2杂化,其中1个未参与杂化的p轨道 含有孤对电子,可参与苯环的大π键,形成p-π共轭体系, 氧原子上的电子云向苯环转移。
酚的结构
p-π共轭其结果是: 1. 环上的电子云密度相对增大,环上的亲电取代
反应容易进行;
2. C-O键的极性减少,不易断裂,-OH不易被取代; 3. 氧原子上的电子云密度相对降低,O-H 键间的电 子云向氧原子转移,O-H 键极性增强,H较活泼, 表现出酸性。
黄色沉淀
白色沉淀 (~100%)
◆反应条件不同,卤代产物不同:
低温,非极性溶 剂,一元取代物
对溴苯酚
水溶液 2,4,6 -三氯苯酚
催化剂 2,4-二氯苯酚 不同温度和氯用量,无溶剂 五氯苯酚 橡胶制品,杀虫剂,药物
如何从苯酚出发合成除草剂 2,4-D?
(2,4-二氯苯氧基乙酸)
OH
NaOH
②硝化反应——酚很容易硝化
④烷基化和酰基化反应
由于酚羟基的活化,酚比芳烃容易进行傅-克反应。 催化剂一般不用AlCl3 (易形成络合物ArOAlCl2).
烷基化剂:醇或烯烃
酰基化剂:羧酸
对羟基苯乙酮
酰氯为酰基化剂时--Fries重排:
重排 乙酸苯酯
热力学控制 动力学控制
对羟基苯乙酮
哪个过程Ea小,反应速度快?哪种产物稳定?
酚与水分子之间的氢键
酚与酚分子之间的氢键
常见酚类化合物的理化常数
◆酚的红外吸收光谱 同醇一样,由于O-H的伸缩振动,在3520 -3100 cm-1 有一个强而宽的吸收带(缔和羟基)。但酚与醇的C-O 伸缩振动不同:酚 ;醇
苯酚的红外光谱
11.4 酚的化学性质
•氧上未共用电子对 (有亲核性)
O
第十一章
酚和醌
本章主要内容
1. 酚的构造、分类与命名.
2. 酚的制备方法与重要的酚.
3. 酚的化学性质及结构对性质的影响.
4. 苯醌的结构特点与性质. 5. 萘醌、蒽醌的结构特点与应用.
(一)酚 11.1 酚的结构、分类和命名
◆ 酚是羟基(-OH)直接和苯环相连的化合物,官能团为酚羟
基.
O H
O H
OH
中含有
答:
(1)加入与FeCl3,显蓝色,表明有酚羟基存在;
(2)将邻羟基苯甲醇分别与NaHCO3和NaOH作用,该 物质不溶于NaHCO3 而溶于NaOH,酸化后又能析出, 表明该物质显弱酸性(进一步证明有酚羟基)。 (3)与卢卡斯试剂反应生成混浊(证明有醇羟基,酚微 溶于水).
11.5 重要的酚
苯酚溶于NaOH,但不溶于NaHCO3。工业上利 用苯酚能溶于碱,而又可用酸分离的性质来处理和回
收含酚废水; 酚的提纯分离.
影响苯酚酸性因素: 考虑负离子的稳定性 吸电子基,酸性 A、取代基种类 给电子基,酸性
B、取代基数目 吸电子基数越多,酸性越强 给电子基数越多,酸性越弱
OH O2N
>
OH
>
OH
>
OH
>
OH
NO2
NO2
Cl
CH3
NH2
C. 取代基位置
a. 对硝基苯酚 >邻硝基苯酚 >间硝基苯酚 >吸电子基团(硝基)使 苯酚
O -
O
-
O
羟基氧上负电荷更好地 离域移向苯环(诱导和 共轭效应),生成更稳 定的对硝基苯氧负离子, 酸性增强。
ONO2
NO2
N O
+
O
N O
+
O
-I
O -
-C -I 无共轭效应,共轭效应只传邻对位, 不传间位
•活化的芳环 (易发生亲电取代)
H
•活泼氢 (有酸性)
•烯醇式片断 (有烯醇的性质)
R
OH H
醇 芳烃
酚
Ar
OH Ar
11.4.1 酚羟基的反应
①酚的酸性:O-H键容易离解。 ◆ 酚显酸性的原因 ——氧原子以sp 2 (与醇醚不同)杂化轨 道参与成键,含有未共用电子对的P轨道与苯环大π键共轭,氧 原子的负电荷分散到整个共轭体系中,酚氧负离子非常稳定, 减弱了O-H键,氢原子容易离解成为质子。
OH
OH Br Br
OH
COCH 3
OH
OH
Br
COCH 3 COCH 3
CO
Br
Br
11.2 酚的制法
11.2.1 从异丙苯制备
H2SO 4
CH3 CH CH3
+ CH3 CH=CH2
CH3 CH3
O2
绿色的合成 路线
OH
C O-O-H
空气,110~120℃
稀 H2SO 4 75~78℃
过氧化物
羟甲基苯氧负离子
3.醛过量时形成羟甲基较多的中间产物:
2,4--二羟甲基苯酚
2,6--二羟甲基苯酚
4.酚过量时形成不含羟甲基的中间产物:
4,4’--二羟基二苯甲烷
2,2’--二羟基二苯甲烷
