水质饱和+稳定指数的计算
华北理工水质工程学教案10循环冷却水水质稳定处理

补充水带进盐:S B (P 1+P 2+Pa+P 1)风吹、排污渗漏及生产耗水带走的盐量:S(P 2+P 3+P 4)系统运行一定时间后,带进盐、带走盐系统中的含盐量趋于一个稳定值,用SP 表示,即:S B (P 1+P 2+P3+P4)=S P (P2+P3+P4)Sp=:+/+.+/二P 二qSBm+BP —a PFκ一一浓缩倍数。
由于有B-K 大于l-Sp>Su-系统有可能结垢。
4、溶解度与温度的关系:单位:mg/L水温变化的影响:(1)热交换器中:t 升高,Ca-Mg2'的盐类溶解度降低。
当C /、Mg?.及HC(V 、OFT 含量高于溶解度时。
水失去稳定性(可能)产生结垢。
(2)冷却塔:t 下降;Ca/Mg'的盐类溶解度升高。
即有HCO3水显酸性产生腐蚀。
令其为:K- - 1 ÷SB5(3)系统由温度引发的:低温区(设备冷水进口)一一腐蚀高温区(设备热水出口)一一结垢(二)金属化学腐蚀:化学已学过:是电位差使电子迁移的过程。
1、电池阳极:铁失去了2个电子:Fe-2e-Fe2,2、电池阴极:电子沿铁中电阻小的途径达到阴极部位。
(1)酸性水或中性水:H'2H++2e^-H2而Fe2++20H^-Fe(OH)2Fe(OH)2致密层,保护铁不再被氧化。
由比和Fe(OH)2的生成而引起电位差的变化称为极化。
极化的作用一一抑制金属腐蚀。
(阻兰;烤兰)(2)当水中有溶解氧时H2^^O2→H2O阴极继续:2Fe(θH%+;5+ f2Fe(θH)3+OH」Fe(OH)3一铁锈,起去极化作用,继续腐蚀金属。
(3)碱性水中:阴极直接产生OIFH2O+^O2+2e~→20H-→F*→Fe{θH∖3、凡是金属表面的两部位间存在差异(电位差),就会发生腐蚀。
电位低的成为阳极,受腐蚀。
电位高的成为阴极,产生沉积物。
4、形成差异的原因:PH值(H∖0H);溶解氧;溶解盐;悬浮物;沉积物微生物等。
地层水配伍性研究

注入水与地层水及储层配伍性研究在注入开发油田中,当注入水和不配伍的地层水相遇时,使原有的地层水和储层矿石之间的离子化学平衡被破坏,岩石和混合水之间,注入水和地层水之间随注入水不断介入将逐渐建立一个新的化学平衡。
在打破旧的平衡建立新的平衡过程中,只要流体中遇到两种以上不配伍的水存在或在流动过程中随压力和温度或流体的化学组分不平衡,都存在结垢的可能,不可避免的造成对储层的一定损害。
在导致严重水敏的同时,在注水速度过快时,还将产生严重的速敏伤害,低渗、特低渗的水敏更为严重。
本文下面主要从两方面进行配伍性实验研究:注入水与地层水的配伍性以及注入水与储层的配伍性。
【吉林油田低渗透油藏注入水水质实验研究】1 注入水与地层水的配伍性【油田注入水源与储层的化学配伍性研究】油气田进入中后期开发后,普遍采用注水采油、排水采气、排水找气等新工艺,由于压力、温度等条件的变化以及水的热力学不稳定性和化学不相容性,往往造成注水地层、油套管、井下、地面设备以及集输管线出现结垢,造成油气田产量下降,注水压力上升,井下以及地面设备甚至油气井停产。
1.1油田水质分析对该油田地层水及注入水的离子浓度进行分析,统计得到下表:(下表)1.2注入水的自身稳定性常温及地层温度下注入水的自身稳定性反映了注入水在注水管柱、采油管柱及储层中结垢状况。
在常温(20℃)和地层温度(70℃)的条件下,通过测定在密闭容器里分别放置不同时间的水中主要成垢离子Ca2+、Ba2+、Mg2+等的浓度变化研究水源水自身的稳定性以及结垢趋势。
在常温和地层温度下分别检测放置20天、30天时水源水中成垢离子浓度。
统计数据如下表所示:【商河油田注水配伍性及增注措施实验研究】1.3 配伍性研究方法1.3.1静态配伍性实验研究【大港北部油田回注污水结垢性与配伍性研究】注入水与地层流体不配伍主要表现在两者按不同比例混合后是否产生沉淀。
将地层水与注入水过滤后分别按不同体积比例混合(1: 9、2: 8、3: 7、4: 6、5:5、6:4、7:3、8:2、及9:1),并在85C下密闭加热恒温不同时间,测其浊度。
COD与BOD计算公式

有机污染物种类繁多,结构复杂,化学稳定性差,易被水中生物分解。
在环境监测中,对有机耗氧污染物,一般是从各个不同侧面反映有机物的总量,如COD、OC、BOD、TOD、TOC等,前四种参数称为氧参数,TOC称为碳参数。
对于单一化合物,可以通过化学反应方程进行计算,以求得其理论需氧量(ThOD)或理论有机碳量(ThOC)。
各耗氧参数在数值上的关系有:ThOD>TOD>CODcr>OC>BOD5。
一化学需氧量(COD) Chemical Oxygen Demand化学需氧量是指水样在一定条件下,氧化1升水样中还原性物质所消耗的氧化剂的量,以氧的mg/L表示。
化学需氧量反应了水中受还原性污染的程度。
基于水体被有机物污染是很普遍的现象,该指标也作为有机物相对含量的综合指标之一。
对废水化学需氧量的测定,我国规定用重铬酸钾法,也可以用与其测定结果一致的库仑滴定法或各种专用仪器(COD快速测定仪1 2 3)测定。
重铬酸钾法:在强酸性溶液中,用重铬酸钾将水中的还原性物质(主要是有机物)氧化,过量的重铬酸钾以试亚铁灵作指示剂,用硫酸亚铁铵溶液回滴,根据所消耗的重铬酸钾量算出水样中的化学需氧量,以氧的mg/L表示。
计算公式:CODcr=(V0-V1)×c×8×1000/V二高锰酸盐指数(OC) Permanganate Index以高锰酸钾溶液为氧化剂测得的化学耗氧量。
我国新的环境水质标准中,已把该指标改称高锰酸盐指数,而仅将酸性重铬酸钾法测得的值称为化学需氧量。
国际标准化组织(ISO)建议高锰酸钾法仅限于地表水、饮用水和生活污水。
按测定溶液的介质不同,分为酸性高锰酸钾法和碱性高锰酸钾法。
当Cl-含量高于300mg/L 时,应采用碱性高锰酸钾法;对于较清洁的地面水和被污染的水体中氯化物含量不高(Cl-<300mg/L)的水样,常用酸性高锰酸钾法。
当OC超过5mg/L时,应少取水样并经稀释后再测定。
水质指数计算方法

水质指数计算方法水质指数是衡量水体质量的一个综合评价指标,它能够反映水体中污染物的浓度和对生态环境及人体健康的影响程度。
水质指数的计算方法包括多个指标的综合评估,下面将介绍几种常用的水质指数计算方法。
一、污染指数法污染指数法是通过将水样中各种污染物的浓度与相应的国家或地方标准进行对比,计算得到水质指数。
通常,根据水样中不同污染物的浓度,分别计算各个污染物的污染指数,然后将各个污染物的污染指数加权平均得到水质指数。
这种方法简单直观,能够综合考虑多种污染物对水质的影响,但需要准确测量各种污染物的浓度,并参考相应的标准。
二、综合污染指数法综合污染指数法是在污染指数法的基础上,引入了不同污染物对水质的毒性等级,通过对各种污染物的毒性等级进行加权计算,得到水质指数。
这种方法能够更加准确地评估水质的综合污染情况,但需要对不同污染物的毒性等级有较为准确的了解,并进行合理的加权计算。
三、变异系数法变异系数法是一种基于统计学方法的水质指数计算方法,它主要通过计算水样中各种污染物的变异系数,来评估水质的稳定性和污染程度。
变异系数是衡量数据变异程度的一个指标,可以反映出水样中污染物的分布情况和浓度变化趋势。
通过对水样中各种污染物的变异系数进行加权计算,得到水质指数。
这种方法能够较为客观地评估水质的变异性和污染程度,但需要较多的数据支持和统计学知识。
四、灰色关联度法灰色关联度法是一种基于灰色系统理论的水质指数计算方法,它通过对水样中各种污染物的浓度序列进行灰色关联度分析,得到水质指数。
灰色关联度是一种衡量序列相关性的指标,可以反映出不同污染物对水质的综合影响程度。
通过对水样中各种污染物的灰色关联度进行加权计算,得到水质指数。
这种方法能够较好地反映不同污染物之间的相互关系和综合影响,但需要较为复杂的计算和较长的序列数据。
水质指数的计算方法有污染指数法、综合污染指数法、变异系数法和灰色关联度法等。
每种方法都有其优缺点和适用范围,选择合适的计算方法需要根据具体情况和目的来确定。
管网水质化学稳定性的评价指标分析

时 代 农 机TIMES AGRICULTURAL MACHINERY第 45 卷第 4 期2018 年 4 月 Apr.2018 Vol.45 No.42018年第4期38管网水质化学稳定性的评价指标分析赵程伟摘 要:文章针对当前管网水质化学稳定性的现状,阐述了水质化学稳定性的定义,管网水质化学稳定性的评价体系。
所谓化学稳定性的改变就是指管网水在输配水过程中,水中各种化合物之间或者化合物与管道内壁之间发生反应,使得管网水水质恶化和管道内壁结垢或腐蚀。
管网水的化学稳定性较好,在水工业中被定义为既不溶解也不沉积CaCO3。
给水管网的化学稳定性能在较长时间内表现的较为稳定,但水流状态和离子浓度的改变会引起稳定性的波动,特别是水中的腐蚀性离子。
因此,完善供水管网的水质化学稳定性评价体系,对控制管网的腐蚀、保护管网和提高管网水质具有重大意义。
关键词:管网水质;指标分析;化学稳定性(四川大学 建筑与环境学院,四川 成都 610000)作者简介:赵程伟,研究方向:土木工程。
1 管网水质化学稳定性的评价给水化学稳定性的判定指数通常被分成两类:基于碳酸钙溶解平衡理论的指数和基于其它水质参数的指数。
1.1 基于碳酸钙溶解平衡的指数1.1.1 Langelier饱和指数饱和指数LSI 由Langelier 提出,其计算方法为:LSI=pH-pHs,其中pHs 称作饱和pH 值,指在CaCO 3 饱和平衡时的pH 值。
其判定方法为:当LSI<0 时,CaCO 3 未饱和,有腐蚀趋势;LSI>0 时,CaCO 3 过饱和,有结垢趋势;LSI=0 时,既无结垢也无腐蚀趋势。
该指数认为在某一水温下水体达到碳酸钙饱和状态时,pHs 是一个定值。
这样就可以根据pHs 判断水中CaCO 3 的溶解平衡,还能通过LSI 值来调整实际pH 值来控制水质稳定。
但该理论没有考虑到水中悬浮杂质和腐蚀产物对结晶的诱导作用,也没有考虑到天然阻垢剂对结晶成长的阻碍和分散作用。
雷兹纳稳定指数

水质的稳定性的判断雷兹纳稳定指数可利用如下公式进行计算:1.利用雷兹纳稳定指数判断水质的稳定性:2pHs-pH7.5严重腐蚀2.pHs(碳酸钙饱和pH的计算)pHs=(9.3+A+B)-(C+D)式中:A-总溶解固体的函数;B-温度的函数;C-钙硬度的函数;D-总碱度的函数。
问:循环水加酸控制pH值,加酸量如何计算?答:系统中首次加酸量G′、经常加酸量G可由下式计算:G′=V×(M-M′)×98/(100×a×1000)(kg/h)G=BT×(M-M′)×98/(100×a×1000)(kg/h)式中:V--保有水量,m3;BT--总排污水量,m3/hM--浓缩一定倍数是时pH值下的总碱度(以CaCO3计),mg/L;M′--该浓缩水调节至所要求pH值下的总碱度(以CaCO3计),mg/L;98--硫酸的分子量;a--商品硫酸的纯度,%。
M,M′均与补充水的pH值和碱度无关,可由现场实测得到。
为防止加酸过多事故发生,应在贮酸罐和冷却塔水池之间增加一个缓冲罐,缓冲罐只能存贮一天的加酸量,通过这个罐把酸加到系统中,即使控制系统失误而加酸过多,也不会超过一天的加酸量,降低危害。
问:循环水缓蚀阻垢剂加药量如何计算?答:①首次药剂投入量G1,也称之为基础投加量,G1=VC1/10a (kg)式中:V-保有水量,m3;C1-循环水中药剂浓度,mg/L;a-商品药剂的纯度,%;②连续排污并连续加药,系统的维持药剂投入量G2,G2=BTC2/10a (kg)式中:BT-总排污量,m3/h;C2-循环水达到的管理浓度,mg/L;a-商品药剂的纯度,%;③连续排污但间断加药,系统的维持药剂投入量G3,G3=(C0-C3)V/10a (kg)式中:C0-循环水中药剂初始浓度,mg/L;C3-经过t小时后的循环水中药剂浓度,mg/L;V-保有水量,m3;a-商品药剂的纯度,%;经过t小时后的循环水中药剂浓度C3,G3=C0·e- BT·t/V (kg)什么是稳定指数(S)它有什么局限性?1944年,赖兹纳指出,利用饱和指数(Is)判断水质时,经常出现错误,因此,他提出用经验S=2PHs--PH来代替饱和指数(Is)作为判断水质的依据,并把2PHs--PH的差值称作稳定指数。
水质饱和+稳定指数的计算
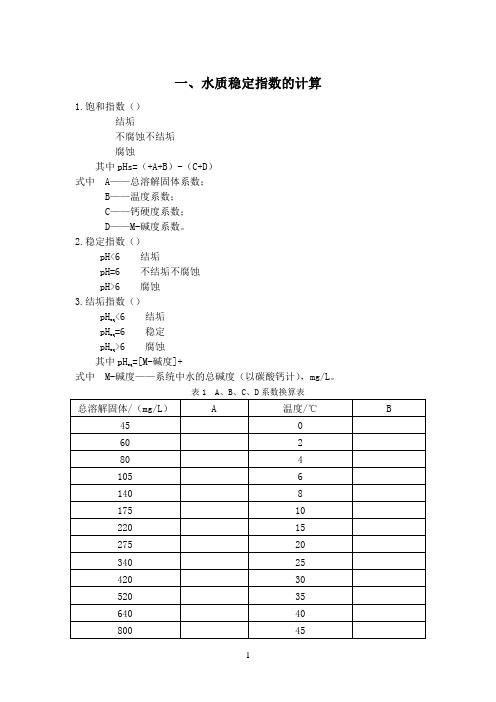
一、水质稳定指数的计算1.饱和指数()结垢不腐蚀不结垢腐蚀其中pHs=(+A+B)-(C+D)式中 A——总溶解固体系数;B——温度系数;C——钙硬度系数;D——M-碱度系数。
2.稳定指数()pH<6 结垢pH=6 不结垢不腐蚀pH>6 腐蚀3.结垢指数()pH<6 结垢eq=6 稳定pHeq>6 腐蚀pHeq其中pH=[M-碱度]+eq式中 M-碱度——系统中水的总碱度(以碳酸钙计),mg/L。
二、水质稳定判断1.Langelier 饱和指数= pH - pHs> 0 结垢= pH - pHs= 0 不腐蚀不结垢= pH - pHs<0 腐蚀其中: pHs =PKz- PKs+ Pca + PM-碱度+μKz、Ks以活度表示的碳酸的二级电离常数和碳酸钙的溶度积 M碱度以甲基橙为指示剂所测定的总碱度μ离子强度也可将上式进行简化如下:pH s =(+A+B)-(C+D)A总溶解固体系数; B温度系数; C钙硬度系数; DM碱度系数.A、B、C、D系数换算表:2.Ryznar 稳定指数是由雷兹纳在实际工作中总结出的一个经验公式,计算式如下:= 2pH– pH < 6 结垢s– pH = 6 不腐蚀不结垢= 2pHs= 2pH– pH > 6 腐蚀s同相比,更接近实际,但同一样未考虑水处理因素对结垢的影响,因此也只能对未作处理的原水作判断。
3.Puckorius 结垢指数是帕科拉兹在稳定指数的基础上提出来的一个经验公式,他用平衡pH,即PHeq代替计算公式中的实测pH。
比更接近实际。
PHeq的计算公式如下:PHeq= lgM += 2pHs – pHeq< 6 结垢= 2pHs – pHeq= 6 不腐蚀不结垢= 2pHs – pHeq> 6 腐蚀M系统中水的总碱度(以CaCO3 计),mg/l由于只是用总碱度对进行修正,也未考虑到人为的水处理措施对结垢的影响,因此在实际应用中具有较大的局限性。
水质稳定判断

水质稳定判断结垢指数自来水的结垢与否,与水质、温度、流速等有关。
其中水质是主要的因素,可用以下几个指数进行判断:(1)Langelier朗格利尔饱和指数L.S.I.= pH - pHs>0结垢L.S.I.= pH - pHs= 0不腐蚀不结垢(水质稳定的概念)L.S.I.= pH - pHs <0腐蚀(2) Ryznar 稳定指数R.S.I.= 2pHs – pH = 4.0 ~5.0严重结垢R.S.I.= 2pHs – pH = 5.0 ~6.0轻度结垢R.S.I.= 2pHs – pH = 6.0 ~7.0基本稳定R.S.I.= 2pHs – pH = 7.0 ~7.5轻微腐蚀R.S.I.= 2pHs – pH = 7.5 ~9.0严重腐蚀R.S.I.= 2pHs – pH >9.0极严重腐蚀(3) Puckorius 结垢指数pHeq = 1.465lgM + 4.54R.S.I. = 2pHs –pHeq<6结垢R.S.I. = 2pHs –pHeq=6不结垢不腐蚀R.S.I. = 2pHs –pHeq>6腐蚀温度对上述起加速作用。
1.Langelier 饱和指数L.S.I. = pH - pHs> 0 结垢L.S.I. = pH - pHs= 0 不腐蚀不结垢L.S.I. = pH - pHs<0 腐蚀其中: pHs =PKz- PKs+ Pca + PM-碱度+ 2.5μKz、Ks以活度表示的碳酸的二级电离常数和碳酸钙的溶度积 M碱度以甲基橙为指示剂所测定的总碱度μ离子强度也可将上式进行简化如下:pH s =(9.7+A+B)-(C+D)A总溶解固体系数; B温度系数; C钙硬度系数; DM碱度系数.A、B、C、D系数换算表:2.Ryznar 稳定指数R.S.I是由雷兹纳在实际工作中总结出的一个经验公式,计算式如下:R.S.I. = 2pHs– pH < 6 结垢R.S.I. = 2pHs– pH = 6 不腐蚀不结垢R.S.I. = 2pHs– pH > 6 腐蚀同L.S.I相比,R.S.I更接近实际,但同L.S.I一样未考虑水处理因素对结垢的影响,因此也只能对未作处理的原水作判断。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、水质稳定指数的计算
1.饱和指数(L.S.I.)
L.S.I.=pH-pHs>0 结垢
L.S.I.=pH-pHs=0 不腐蚀不结垢
L.S.I.=pH-pHs<0 腐蚀
其中pHs=(9.70+A+B)-(C+D)
式中A——总溶解固体系数;
B——温度系数;
C——钙硬度系数;
D——M-碱度系数。
2.稳定指数(R.S.I.)
R.S.I.=2pHs- pH<6 结垢
R.S.I.=2pHs- pH=6 不结垢不腐蚀
R.S.I.=2pHs- pH>6 腐蚀
3.结垢指数(P.S.I.)
P.S.I.=2pHs- pH eq<6 结垢
P.S.I.=2pHs- pH eq=6 稳定
P.S.I.=2pHs- pH eq>6 腐蚀
其中pH eq=1.465lg[M-碱度]+4.54
式中M-碱度——系统中水的总碱度(以碳酸钙计),mg/L。
二、水质稳定判断
1.Langelier 饱和指数
L.S.I. = pH - pH
s
> 0 结垢
L.S.I. = pH - pH
s
= 0 不腐蚀不结垢
L.S.I. = pH - pH
s
<0 腐蚀
其中: pH
s =PK
z
- PK
s
+ Pca + PM-碱度+ 2.5μ
Kz、Ks以活度表示的碳酸的二级电离常数和碳酸钙的溶度积 M碱度以甲基橙为指示剂所测定的总碱度
μ离子强度
也可将上式进行简化如下:
pH s =(9.7+A+B)-(C+D)
A总溶解固体系数; B温度系数; C钙硬度系数; DM碱度系数.
A、B、C、D系数换算表:
2.Ryznar 稳定指数
R.S.I是由雷兹纳在实际工作中总结出的一个经验公式,计算式如下:
R.S.I. = 2pH
– pH < 6 结垢
s
– pH = 6 不腐蚀不结垢
R.S.I. = 2pH
s
R.S.I. = 2pH
– pH > 6 腐蚀
s
同L.S.I相比,R.S.I更接近实际,但同L.S.I一样未考虑水处理因素对结垢的影响,因此也只能对未作处理的原水作判断。
3.Puckorius 结垢指数
P.S.I是帕科拉兹在稳定指数R.S.I的基础上提出来的一个经验公式,他用平衡pH,即PH
eq
代替R.S.I计算公式中的实测pH。
P.S.I比R.S.I更接近实际。
PHeq的计算公式如下:
PH
eq
= 1.465 lgM + 4.54
R.S.I. = 2pH
s – pH
eq
< 6 结垢
R.S.I. = 2pH
s – pH
eq
= 6 不腐蚀不结垢
R.S.I. = 2pH
s – pH
eq
> 6 腐蚀
M系统中水的总碱度(以CaCO3 计),mg/l
由于P.S.I只是用总碱度对R.S.I进行修正,也未考虑到人为的水处理措施对结垢的影响,因此在实际应用中具有较大的局限性。
pH
eq
= 1.465lgM + 4.54
4. 临界pH结垢指数
临界PH结垢指数是由法特诺提出来的。
他用实验的方法测出结垢时水的真实PH值,即PHc。
用PHc与日常运行时的PH比较,当PH大于PHc时,水就要结垢,当PH小于PHc时,不结垢,但是否腐蚀还要考虑其它因素。
临界PH结垢指数由于是由实验方法得出来的,已考虑了结垢所有影响因素,准确度较高。
但工作量大,对实验条件及工作人员的要求也较高,因此临界PH结垢指数在日常运用中也受到限制。
