物理化学考前复习:基础知识+重点(考前必备)
物理化学复习重点
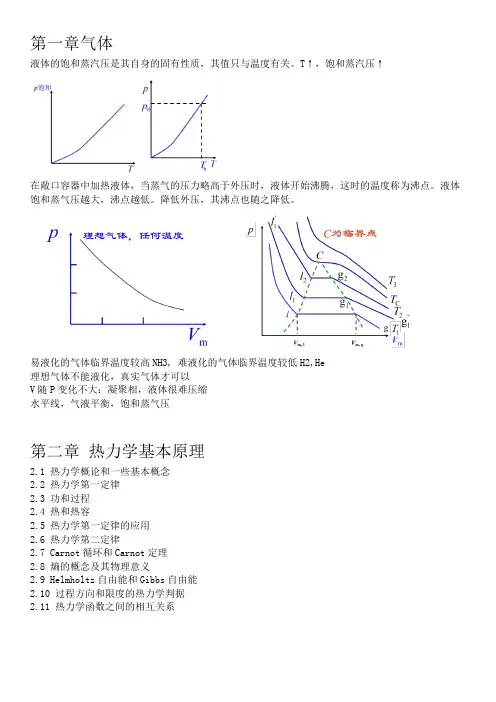
第一章气体液体的饱和蒸汽压是其自身的固有性质,其值只与温度有关。
T↑,饱和蒸汽压↑在敞口容器中加热液体,当蒸气的压力略高于外压时,液体开始沸腾,这时的温度称为沸点。
液体饱和蒸气压越大,沸点越低。
降低外压,其沸点也随之降低。
易液化的气体临界温度较高NH3, 难液化的气体临界温度较低H2,He理想气体不能液化,真实气体才可以V随P变化不大:凝聚相,液体很难压缩水平线,气液平衡,饱和蒸气压第二章热力学基本原理2.1 热力学概论和一些基本概念2.2 热力学第一定律2.3 功和过程2.4 热和热容2.5 热力学第一定律的应用2.6 热力学第二定律2.7 Carnot循环和Carnot定理2.8 熵的概念及其物理意义2.9 Helmholtz自由能和Gibbs自由能2.10 过程方向和限度的热力学判据2.11 热力学函数之间的相互关系2.1 热力学概论和一些基本概念(1) 系统与环境:系统+环境=大的孤立系统(2) 系统的(宏观)性质广度性质具有加和性,强度性质不具有。
(3) 热力学平衡态热平衡、力平衡、相平衡、化学平衡(4) 状态与状态函数状态函数在数学上具有全微分的性质,当系统的状态发生了一个无限小的变化,状态函数 Z 的变化记为dZ ,状态函数 Z 的变化为,非状态函数不能积分,变化用δ,区别于状态函数的d.(5) 过程与途径(6) 热和功热和功是系统和环境间能量交换的两种不同形式。
都与过程相联系,即使始态和终态相同,过程不同,交换的热和功也会不同。
不是状态函数! 微小变化用δ表示,以区别于d ;某一过程的热(或功)交换用Q (或W)表示,不用ΔQ (或ΔW )。
热是大量分子无规则运动的一种表现。
由于温差,系统与环境之间传递的能量称为热符号Q 单位J ,系统吸热 Q > 0 系统放热 Q < 0除热外,系统与环境间传递的其他能量称为功,是大量分子(或粒子)有序运动的一种表现。
符号W 单位J ,系统得到功W > 0,系统做功W < 0热和功的特点1. 是传递的能量,一定要与过程相联系2. 不是状态函数膨胀功(体积功) We ;非膨胀功Wf :电功 表面功2.2 热力学第一定律系统的总能量(E )由T(动能)、V (势能)和系统内部的能量U 三部分构成。
物理化学高二考必背知识点

物理化学高二考必背知识点在高二物理化学学科中,有一些必备的知识点,它们构成了我们学习的基础。
下面将逐一介绍这些知识点,希望能帮助大家更好地掌握这门学科。
1. 摩尔定律摩尔定律是化学中的基本概念,它表明在一定温度和压力下,气体的体积与其所含粒子数成正比。
公式为V=nRT/P,其中V表示气体的体积,n表示气体粒子数,R为气体常数,T表示温度,P表示压力。
2. 摩尔质量摩尔质量是指物质的摩尔质量与其相对分子质量之间的关系。
在化学计算中,通常以g/mol为单位表示。
摩尔质量的计算公式为M=m/n,其中m表示物质的质量,n表示物质的摩尔数。
3. 热力学第一定律热力学第一定律也被称为能量守恒定律,它表明能量可以从一个形式转化为另一个形式,但总能量守恒不变。
公式为ΔU=q+w,其中ΔU表示内能的改变,q表示热量的变化,w表示功的变化。
4. 热力学第二定律热力学第二定律阐明了能量转化的方向性,它指出热量自发地从高温物体传递到低温物体,并不会自发地由低温物体传递到高温物体。
热力学第二定律的表达方式有多种,如卡诺定理、熵增原理等。
5. 化学平衡化学平衡是指在封闭系统中,化学反应达到动态平衡的状态。
在平衡状态下,正反应和逆反应的速度相等,反应物的浓度保持不变。
平衡常数是判断化学反应平衡位置的重要参数。
6. 化学动力学化学动力学研究化学反应速率及其影响因素。
它包括反应速率的定义、速率方程、活化能、反应机理等内容。
通过实验数据的分析,可以确定化学反应的速率常数和反应级数。
7. 光的性质和光的传播光是一种电磁波,具有波粒二象性。
它可以在真空中传播,也可以在介质中发生折射、反射、干涉、衍射等现象。
光的传播可以通过光的折射定律和菲涅尔公式进行计算和描述。
8. 电磁感应和电磁波电磁感应是指通过改变磁场的强度或方向,产生感应电动势。
电磁感应现象广泛应用于电磁发电、电磁感应加热等方面。
电磁波是由振荡的电场和磁场相互耦合产生的,包括无线电波、微波、可见光等。
物化生考试常见知识点总结

物化生考试常见知识点总结在物化生考试中,有一些常见的知识点是我们需要重点掌握的。
本文将对这些知识点进行总结,以便大家在考试中能够更好地应对。
一、物理知识点总结1. 力学:包括运动学和静力学两个方面,其中运动学涉及物体的运动、速度、位移等内容,静力学则包括力的合成、分解以及平衡条件等知识点。
2. 电磁学:主要包括电路和电磁感应两大内容,电路方面需熟悉电流、电阻、电势差等基本概念,电磁感应部分则涉及法拉第电磁感应定律、电磁感应现象等知识点。
3. 光学:主要包括光的传播、反射、折射、干涉和衍射等内容,对光的波动性和粒子性有一定的了解。
4. 热学:包括热力学和热传导两个方面,热力学涉及温度、热量、热容等基本概念,热传导则关注热能在物体中的传递方式。
二、化学知识点总结1. 元素与化合物:需要熟悉元素周期表中的元素及其基本属性,了解元素的周期性规律和化合物的成分及化学式。
2. 反应与平衡:了解化学反应的基本类型,掌握化学方程式的撰写和平衡反应方程式的解法。
3. 酸碱与盐:掌握酸碱溶液的性质和常见的化学反应,包括中和反应和盐的生成等内容。
4. 氧化还原反应:了解氧化还原反应的基本概念和规律,熟悉常见的氧化还原反应类型,如金属与酸反应等。
5. 键与化学键:熟悉原子间的化学键的形成和类型,明白离子键、共价键和金属键的特点及区别。
6. 配位化学:了解过渡金属离子和配体之间的配位作用,掌握配合物的结构和性质。
三、生物知识点总结1. 细胞生物学:掌握细胞的基本结构和功能,了解细胞膜的结构与功能、细胞器的组成与作用,以及细胞分裂和细胞周期等内容。
2. 遗传与分子生物学:熟悉基因与染色体、DNA的结构与功能,了解基因突变和基因表达的调控机制,以及遗传变异和突变等知识点。
3. 生物分类学:熟悉生物的分类等级和分类依据,了解不同分类单位的特征和区别,掌握常见生物类群的特点。
4. 生态学:了解生态系统的组成和结构,掌握生态位、食物链和食物网的构建,以及生态系统的物质和能量流动等内容。
物理化学复习资料

物理化学复习资料物理化学是一门综合性的学科,它要求学生掌握一定的物理和化学基础知识,同时还需要具备一定的分析和实验能力。
为了帮助大家更好地复习物理化学,以下是一些复习资料和建议,供大家参考。
第一部分:物理化学基础知识复习物理化学基础知识包括物质的性质、结构和变化规律等内容。
在复习时,应着重掌握以下几个方面的知识:1. 基本概念和计量单位:理解物质、能量和化学反应的基本概念,并熟悉各种物质质量、浓度、压强、温度等计量单位。
2. 摩尔概念:理解摩尔的概念,并能够在计算中灵活运用。
3. 热力学:掌握物质的热力学性质,包括热容、焓、焓变等,并能够解决与热力学相关的计算问题。
4. 化学平衡:理解化学平衡的条件和规律,包括平衡定律、平衡常数等,并能够应用它们解决与化学平衡相关的问题。
5. 化学动力学:了解化学反应速率的概念和计算方法,以及影响反应速率的因素,并能够解决与化学动力学相关的问题。
第二部分:物理化学实验技巧复习物理化学实验是物理化学学科中的重要组成部分,它要求学生具备一定的实验技能和数据处理能力。
在复习时,应注意以下几个方面的内容:1. 实验仪器的使用:掌握常用的物理化学实验仪器的使用方法,包括天平、电子天平、分光光度计、热量计等。
2. 实验操作步骤:了解常用的物理化学实验的操作步骤,包括称量、配制溶液、加热、过滤、测量等,并严格按照实验操作规范进行实验。
3. 数据处理和分析:学会对实验数据进行整理、分析和处理,包括计算平均值、标准偏差、相对误差等,并能够根据实验结果进行合理的推理和判断。
4. 安全注意事项:了解物理化学实验中的安全注意事项,包括实验室的安全规定、对实验操作的正确性要求等,并养成良好的实验习惯和安全意识。
第三部分:物理化学习题推荐通过做一些物理化学习题,可以帮助巩固和应用所学的物理化学知识。
推荐如下类型的习题:1. 计算题:包括物质的质量计算、摩尔计算、化学反应平衡计算、热力学计算等。
物理化学高考必备知识点

物理化学高考必备知识点物理化学作为高中化学的重要组成部分,是理科生在高考中不可忽视的一环。
掌握物理化学的基本知识点,不仅能够帮助我们在高考化学卷中取得好成绩,还能够为我们未来的学习和研究提供坚实的基础。
本文将介绍一些,希望能够对广大学子有所帮助。
1. 原子结构与化学键:原子结构是物理化学的基础,它包括原子的组成、电子的排布以及核与电子之间的相互作用等。
掌握好原子结构,能够帮助我们理解化学键的形成和性质。
化学键分为离子键、共价键和金属键等多种类型,它们的特点和应用都是高考必考的内容。
2. 热力学:热力学是物理化学的一个重要分支,它探讨了物质的能量转化和热力学过程的规律。
热力学所研究的内容包括热力学系统的状态、热力学平衡和热力学定律等。
同时,热力学还有一个重要的应用,即化学反应的热力学计算。
了解热力学的基本概念和计算方法,能够帮助我们分析和预测化学反应的发生和趋势。
3. 化学平衡与化学计量:化学平衡是物理化学的重要内容,它研究了化学反应在达到平衡时的特性和规律。
了解化学平衡的条件和计算方法,对于高考题目的解答至关重要。
同时,化学计量也是化学平衡的基础,包括化学方程式的平衡和计算、摩尔比例等内容。
4. 酸碱与溶液:酸碱与溶液是物理化学的实际应用领域,它们涉及到日常生活和工业生产中广泛存在的问题。
掌握酸碱的理论基础和酸碱溶液的性质,能够帮助我们正确处理酸碱反应和溶液浓度的计算。
5. 化学反应动力学:化学反应动力学是物理化学的一个重要分支,它研究了化学反应速率与反应条件之间的关系。
了解化学反应速率的计算和影响因素,能够帮助我们预测和控制化学反应的进行。
6. 电化学与电解:电化学是物理化学的一门重要学科,它研究了电与化学之间的相互作用。
了解电化学的基本原理和应用,能够帮助我们理解电解过程和电化学反应的机理。
7. 物质分析与测试:物质分析与测试是物理化学的重要应用领域,它涉及到化学实验和检测的各个方面。
掌握物质分析的基本方法和测试原理,能够帮助我们正确进行化学实验和数据分析。
考研必备物理化学核心知识点

考研必备物理化学核心知识点关键信息姓名:____________________________考研年份:______________________1、热力学第一定律11 基本概念111 系统与环境112 热力学平衡态113 状态函数114 过程与途径12 热力学第一定律的表述121 内能的变化与热和功的关系122 热力学第一定律的数学表达式13 体积功的计算131 恒外压过程体积功132 可逆过程体积功14 热的计算141 定容热142 定压热143 绝热过程热的计算2、热力学第二定律21 热力学第二定律的表述211 克劳修斯表述212 开尔文表述22 熵的概念221 熵的定义222 熵的物理意义23 熵变的计算231 简单物理变化过程熵变的计算232 相变过程熵变的计算233 化学反应熵变的计算24 热力学第三定律241 热力学第三定律的表述242 规定熵和标准熵3、多组分系统热力学31 偏摩尔量311 偏摩尔量的定义312 偏摩尔量的集合公式32 化学势321 化学势的定义322 化学势的判据33 理想气体混合物331 道尔顿分压定律332 阿马格分体积定律34 稀溶液的两个经验定律341 拉乌尔定律342 亨利定律35 理想稀溶液351 溶剂的化学势352 溶质的化学势36 非理想溶液361 活度和活度系数362 超额函数4、化学平衡41 化学反应的等温方程411 标准摩尔反应吉布斯函数412 化学反应的等温方程的推导42 平衡常数的表达式421 气相反应平衡常数422 液相反应平衡常数43 平衡常数的测定和计算431 平衡组成的测定432 平衡常数的计算方法44 温度对平衡常数的影响441 范特霍夫方程442 平衡常数与温度的关系图45 其他因素对化学平衡的影响451 压力的影响452 惰性气体的影响453 反应物配比的影响5、相平衡51 相律511 相律的表达式512 相律的应用52 单组分系统相图521 水的相图522 二氧化碳的相图53 二组分系统相图531 气液平衡相图532 液固平衡相图533 生成稳定化合物的相图534 生成不稳定化合物的相图54 三组分系统相图541 等边三角形坐标表示法542 部分互溶三组分系统的相图6、电化学61 电解质溶液611 法拉第定律612 离子的电迁移613 电导、电导率和摩尔电导率614 离子独立运动定律和离子的摩尔电导率615 电导的测定及其应用62 可逆电池621 可逆电池的条件622 可逆电池的热力学623 常见的可逆电池63 不可逆电池631 不可逆电池的热力学632 电极极化633 电解时的电极反应7、表面现象71 表面张力和表面能711 表面张力的定义和单位712 表面能的概念72 弯曲液面的附加压力721 附加压力的产生原因722 拉普拉斯方程73 毛细现象731 毛细现象的原理732 毛细现象的应用74 吸附741 物理吸附和化学吸附742 吸附等温线743 朗缪尔吸附理论8、化学动力学81 化学反应速率的表示方法811 反应进度812 反应速率的定义82 浓度对反应速率的影响821 速率方程822 反应级数823 一级反应824 二级反应825 零级反应83 温度对反应速率的影响831 阿仑尼乌斯方程832 活化能84 催化剂对反应速率的影响841 催化剂的特点842 催化作用的原理9、胶体化学91 胶体的制备和净化911 分散法912 凝聚法913 胶体的净化方法92 胶体的性质921 丁达尔效应922 布朗运动923 电泳和电渗93 胶体的稳定性和聚沉931 胶体稳定性的原因932 胶体的聚沉方法933 电解质对胶体聚沉的影响以上内容涵盖了考研物理化学的核心知识点,您应根据自身实际情况有针对性地进行学习和掌握。
物化必备知识点总结
物化必备知识点总结下面就来总结一下物化必备知识点,主要包括物理化学的基本概念、物质的结构与性质、化学反应和化学平衡、物态变化、溶液和溶解度、化学动力学和电化学等方面。
一、物理化学的基本概念1. 物理化学的基本概念物理化学是研究物质结构、性质、变化规律及能量变化的科学。
它是物理和化学的交叉学科,涉及热力学、动力学、统计力学等理论。
2. 物理化学的基本单位物理化学的基本单位有摄氏度(C)、千克(kg)、焦耳(J)、摩尔(mol)、千帕(kPa)等。
3. 物理化学的基本量物理化学的基本量有温度、质量、焓,摩尔等。
温度是物质分子热运动的强弱度量,质量是物质的固有属性,焓是系统吸放热量的性质,摩尔是物质的量单位。
二、物质的结构与性质1. 物质结构物质的结构指的是物质内部原子或分子的排列方式和相互作用方式。
包括晶体、分子、离子和原子共价结构等。
2. 物质的性质物质的性质包括物理性质和化学性质。
物理性质是物质固有的性质,如密度、颜色、相态等;化学性质是物质在化学反应中的性质,如反应活性、化学稳定性等。
三、化学反应和化学平衡1. 化学反应化学反应是指物质发生化学变化的过程。
化学反应包括氧化还原反应、酸碱中和反应、置换反应、加和反应等。
2. 化学平衡化学平衡是指化学反应的速率达到一定的平衡状态。
化学平衡的特征包括不可逆性、浓度不变、速率相等等。
四、物态变化1. 固液气三态物质在一定的温度和压力下可以存在三种不同的状态,即固态、液态和气态。
液体向气体的转化称为汽化,气体向液体的转化称为凝结,固体向液体的转化称为熔化。
2. 混合和分离混合是指将两种或两种以上的相互接触的物质整合在一起,分离是指将一个混合物的成分分开。
常见的分离方法有过滤、蒸馏、结晶、离心、萃取等。
五、溶液和溶解度1. 溶液溶液是指溶质和溶剂混合在一起形成的物质。
溶质是指被溶解的物质,溶剂是指溶解溶质的物质。
2. 溶解度溶解度是指在一定温度和压力下,溶质在溶剂中的溶解量。
物理化学复习资料
《物理化学复习资料》物理化学是化学中研究物质的物理性质和物理变化的学科,它是研究物质与能量转化关系的重要学科。
为了帮助大家复习此学科,本文为大家总结了相关知识点。
一、热力学热力学是研究热现象与功、能的关系的分支学科。
其中最重要的两条定律是热力学第一定律和第二定律。
热力学第一定律表述了能量守恒原理,即能量可以转化,但不能被创造或毁灭。
公式为ΔE=q+w,其中ΔE为内能的变化量,q为热量,w为功。
热力学第二定律描述了热量不可能自发地从低温向高温区域转移,并表明了热量和功的可逆性不同。
主要是指熵增加的原理,公式为ΔS=q/T。
二、动力学动力学研究物质变化的速率和机理。
其中化学动力学研究化学反应过程中反应速率、反应机理和物质的组成等方面的内容。
反应速率通常通过反应速率常数k来表示,反应速率常数与温度有关。
反应机理是指反应过程中反应物和反应产物之间的相互作用,并可以通过速率常数和反应级数等参数来确定。
三、热力学平衡热力学平衡是指物质达到热力学平衡状态时,它的化学势、摩尔熵和摩尔焓等物理量的均匀分布。
在理想气体中,物质达到热力学平衡时,系统的化学势、摩尔熵和摩尔焓分别满足μ=μ0+RTln(p/p0)、S=S0+Rln(p/p0)和H=H0+RTln(p/p0),其中μ0、S0和H0为标准状况下的化学势、摩尔熵和摩尔焓,p为系统中某种气体的分压。
四、电化学电化学主要研究化学反应与电子传递的关系。
其中最重要的概念是电动势,也就是化学反应所造成的电势差。
电动势可以用Nernst方程和Faraday定律来计算。
Nernst方程为E=E0-(RT/nF)lnQ,其中E为电动势,E0为标准电动势,T为温度,n为电子转移数,F 为法拉第常数,Q为热力学平衡常数。
根据Faraday定律,通过电解反应所产生的电荷数与反应物之间的化学计量数之间是等比例的关系。
总之,物理化学作为研究物质与能量转化关系的重要学科,内容涵盖了热力学、动力学、热力学平衡和电化学等多个方面。
高三物理化学基础知识点
高三物理化学基础知识点高三物理化学基础知识点是学生在高中最后一年需要掌握的重要基础知识。
本文将简要介绍一些物理化学领域的核心概念和知识点,供高三学生复习使用。
一、物理基础知识点1. 运动力学运动力学是物理学的基础,主要研究物体的运动规律。
其中包括位移、速度、加速度、力、质量、牛顿三定律等重要概念。
学生需要熟悉运动方程、力学定律等,以便能够解决各种运动问题。
2. 热学热学是研究热现象及其规律的学科,其中包括温度、热量、热传导、热膨胀、理想气体等概念。
理解热学基本定律,如热传导定律、热平衡定律等,并能应用于实际问题。
3. 光学光学是研究光的传播和光现象的学科。
其中包括光的反射、折射、光的波动性和粒子性、光的干涉和衍射等知识点。
学生需要理解光的传播规律,并能解决与光相关的问题。
4. 电磁学电磁学是研究电和磁现象及其相互关系的学科。
包括电荷、电场、电势、电流、电路等概念。
学生需要掌握静电、电流、电路等基本知识,并能解决与电磁学相关的问题。
二、化学基础知识点1. 原子结构原子结构是化学的基础,涉及原子、元素周期表、元素化合价等概念。
学生需要理解原子的组成,了解电子结构、原子序数、质子数和中子数等知识,并能解决与原子结构相关的问题。
2. 化学键及分子结构化学键是由原子之间的相互作用力形成的,主要包括共价键、离子键和金属键。
了解不同类型的化学键的特点和形成规律,并能理解分子的三维结构。
3. 化学反应与化学方程式化学反应是指物质之间转化为其他物质的过程。
学生需要了解化学反应的基本类型,如氧化还原反应、酸碱中和反应等,并能根据化学方程式解决与化学反应相关的问题。
4. 化学计量和化学计算化学计量是指在化学反应中物质的量的关系。
需要掌握摩尔质量、化学计量关系、反应的计算等内容,并能应用到实际问题中。
总结:高三物理化学基础知识点是学生在高中最后一年需要掌握的重要知识,包括物理学和化学学科的核心概念和知识。
通过理解和掌握这些基础知识,学生可以更好地应对高考物理化学考试,并为进一步深入学习相关领域打下坚实的基础。
高考化学物理化学基础知识清单
高考化学物理化学基础知识清单一、基本概念和原理1. 原子结构:元素、原子核、电子云2. 元素周期表:元素周期性、主族元素、副族元素、过渡元素3. 化学键:离子键、共价键、金属键、氢键4. 化学方程式:物质的化学变化、摩尔比例、化学计量5. 氧化还原反应:氧化剂、还原剂、氧化态、还原态6. 酸碱中和反应:酸、碱、pH值、酸碱指示剂二、物质的性质和变化1. 固体:晶体结构、晶体缺陷、固体的力学性质2. 液体:表面张力、黏度、液体的蒸发3. 气体:理想气体状态方程、气体的扩散、气体的压力4. 溶液:溶解度、溶解过程、饱和溶液、稀释溶液5. 热力学:焓变、熵变、自由能变化、平衡常数三、化学反应与能量变化1. 反应速率:活化能、反应速率的影响因素、反应速率定律2. 化学平衡:平衡常数、化学平衡的移动、平衡浓度的影响3. 热化学:焓变、熵变、吉布斯自由能、热化学方程式四、电化学1. 电解质溶液:电离程度、强电解质、弱电解质、非电解质2. 电池:电化学电池、电动势、电解质溶液的浓度对电池电动势的影响3. 电解:电解质溶液中放电与电解质溶液中电流五、化学分析1. 离子反应:阳离子分析、阴离子分析、络合物2. 仪器分析方法:质谱、红外光谱、核磁共振等六、化学工业和实际应用1. 有机化学:烃类、醇类、酮类、醛类、酸类等2. 高分子化合物:聚合反应、聚合物的性质与应用3. 化学肥料与农药:氮肥、磷肥、钾肥、杀虫剂、除草剂等4. 化学能源与环境:石油、煤炭、天然气、核能、清洁能源以上是高考化学物理化学基础知识清单。
希望这份清单能帮助你复习和掌握化学知识,为高考取得好成绩打下坚实的基础。
祝你成功!。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
定义:则 称为B的“偏摩尔量”。
(2)偏摩尔量的集合公式: …… 2、(1)化学势定义: (2)物理意义:决定物质传递方向和限度的强度因素。 (3)定温定压下: ,也就是说是定温度定压条件下一多组分均相系统在
发生状态变化时所能做出的最大有效功。 (4)在不做其他功的条件下,是能够进行的过程;,过程即达平衡。 3、理想气体化学势表达式: 4、对于理想气体混合物来说,其中某种气体的行为与该气体单独占有混合
在定温定容条件下,系统亥姆霍兹函数的减少等系统所能做的最大 有效功(绝对值)。 (3) ,表示能够发生的不可逆过程。
,表示可逆过程(或平衡) ,表示不可能发生的过程 11、定温定压系统-----------吉布斯函数G (1)定义: (2) 等式表示可逆,不等式表示不可逆。 在定温定压条件下,系统亥姆霍兹函数的减少等系统所能做的最大 有效功(绝对值)。 (3) ,表示能够发生的不可逆过程。 ,表示可逆过程(或平衡) ,表示不可能发生的过程 12、热力学的基本公式: 当系统只做体积功不做其他功时
不会超过三个。 固体:如果系统中的不同固体达到分子程度的均匀混合,形成固溶体,一
种固溶 体是一个固相;否则,不论固体有多碎,系统中有多少固
体,就有多少个 固相。 2、 物种数S:系统中所含的化学物质。 3、 组分数K:足以表示系统中各相组成所需要的最少独立物种数。 4、 独立化学平衡数R,独立溶度关系数R’ 5、 6、 自由度:在不引起旧相消失和新相形成的前提下,可以在一定范 围内独立变动的强度性质。 7、 相律:(只考虑温度和压力)为相数 普遍式:
14、在发生一绝热过程时,由于,于是 理想气体的绝热可逆过程,有:
>1. 15、: >0 经节流膨胀后,气体温度降低;
<0 经节流膨胀后,气体温度升高; =0 经节流膨胀后,气体温度不变。 16、气体的节流膨胀为一定焓过程,即。 17、化学反应热效应:在定压或定容条件下,当产物的温度与反应物的温 度相同而在反应过程中只做体积功不做其他功时,化学反应所吸收或 放出的热,称为此过程的热效应,或“反应热”。 18、化学反应进度: (对于产物v取正值,反应物取负值)
为最大。否则将违
(2)卡诺热机的效率只与两个热源的温度有关,而与工作物质无关。否 则也将违反热力学第二定律。
4、热力学第二定律人数学表达式--------克劳修斯不等式
是系统的熵变,是实际过程中传递的热,T是热源温度,是实际过 程中的热温商。该式的等号适用于可逆过程;大于号适用于不可逆 过程。它的含义是:
4、电导测定应用: (1)求弱电解质的电离度和电离平衡常数:
(2)求微溶盐的溶解度和溶度积:
饱和溶液的溶度:, 溶解度: 溶度积(): 5、溶液中的离子的活度和活度系数:
(1)电解质的化学势可用各个离子的化学势之和表示:
(2)离子平均活度,与离子平均质量摩尔溶度和离子平均活度系数 的关系:
(3)对强电解质来说,令,定义离子平均活度 , 离子平均活度系数 ,离子平均质量摩尔溶度 。 (4) 在稀溶液情况下,影响强电解质离子平均活度系数的主 要因素是浓度和离子价数,而且离子价数比浓度的影响 更加显著。溶液离子强度定义: (m是离子的质量摩 尔浓度,z是离子价数,B是某种离子)
8、能斯特方程: 反应温度为T时,电池反应: 方程: (n是电极反应中得失电子数,是反应物质B的活度) 9、求算电池标准电动势: 10、电动势E及其温度系数与电池反应热力学量的关系:
定温条件,反应的可逆热效应: 11、在任何温度下,的标准摩尔生成吉布斯函数 、标准摩尔生成焓及
标准摩尔熵均为零。 电极电势的表示: 12、电极电势及其电池电动势的应用: (1)判断反应趋势:电势越低,越易失去电子;电势越高,越易得到 电子。
任意浓度下均遵守拉乌耳定律的液态混合物。 (2)理想液态混合物中物质的化学势:液态混合物与蒸气相达成平衡时,有:
8、亨利定律:一定温度时,稀溶液中挥发性溶质的平衡分压与溶质 在溶液中的摩尔分数成正比: , 是与溶液平衡的溶质蒸气的分压,是溶质在溶液中的摩尔分数,是比例常
数, 称为亨利系数。其数值在一定温度下不仅与溶质性质有关,还有溶剂性质有关,
(2)强度性质:如压力,温度,粘度,密度。 数值与物质的量无关;不具有加和性,整个系统的强度性质的数
值与各部分的相同。
特征:往往两个容量性质之比成为系统的强度性质。
3、热力学四大平衡: (1)热平衡:没有热隔壁,系统各部分没有温度差。 (2)机械平衡:没有刚壁,系统各部分没有不平衡的力存在,即压力 相同
、热力学第二定律的经典表述:人们不可能设计成这样一种机器,这种机器能不断
循环工作,它仅仅从单一热源吸热变为功而没有任
何其他变化。
、卡诺循环:
2定温可逆膨胀。故
绝热可逆膨胀。由于系统不吸热,,故
1定温可逆压缩。故
绝热可逆压缩。故
卡诺热机的效率:
制冷效率:
、卡诺定理:
(1)在两个不同温度的热源之间工作的任意热机,以卡渃热机的效率
气体总体积时的 行为相同。即 5、实际气体的化学势:
定义逸度 校正因子称为逸度系数或逸度因子。 6、拉乌尔定律:一定温度时,溶液中溶剂的蒸气压与溶剂在溶液中的
物质的量分数成正比,其比例是纯溶剂在该温度时的蒸气压(上 标“*”表示纯物质)。即: (溶液蒸气压的降低与溶质在溶液中的摩尔分数成正比) 7、(1)理想液态混合物:在一定的温度和压力下液态混合物中任意一种物质在
(3)化学平衡:没有化学变化的阻力因素存在,系统组成不随时间而 变化。
(4)相平衡:在系统中各个相(包括气、液、固)的数量和组成不随 时间而变化。
4、热力学第一定律的数学表达式: U = Q + W Q为吸收的热(+),W为得到的功(+)。
定容
定温
定压
绝热
得到的功 0
或
吸收的热
内能增量
0
焓变
0熵变或或源自0亥姆霍兹 (定温定 容)
吉布斯(定 温定压)
12、在通常温度下,对理想气体来说,定容摩尔热容为: 单原子分子系统 = 双原子分子(或线型分子)系统 = 多原子分子(非线型)系统 定压摩尔热容: 单原子分子系统 双原子分子(或线型分子)系统 多原子分子(非线型)系统 可以看出:
13、的两种经验公式: (T是热力学温度,a,b,c,c’ 是经 验常数,与物质和温度范围有关)
两个电极进行比较时,在值相差较大,或活度相近的情况下,可以用数 据直接判断反应趋势,否则,均必须比较值方可判断。
(2)求化学反应的平衡常数: ,则= (3)求微溶盐活度积:微溶盐活度积实质就是微溶盐溶解过程的平衡常
数。 (4)求离子平均活度系数:测定一电池的电动势,再由求得后,依据能斯
特方程求算电池电解质溶液的离子平均活度及离子平均活度系数。 13、(1)当有电流通过电极时,发生的必然是不可逆的电极反应,此时的电
可以大于 或小于纯溶质的饱和蒸汽压 。 9、理想稀溶液的定义:一定的温度和压力下,在一定的浓度范围内,溶剂遵守
拉乌尔定律、溶质遵守亨利定律的溶液称为理想稀溶液。 10、不挥发性溶质理想稀溶液的依数性: 凝固点降低: (与温度无关) = ,其中是溶液中溶质的质量摩尔浓度。
是凝固点降低常数(是溶剂的摩尔质量,单位) (2)沸点升高:
(与温度、压力有关)=
总结: (2)液相反应:
理想液态混合物: 理想稀溶液: 非理想稀溶液: (3)复相反应:
3、(1)温度对平衡常数的影响: (2)压力、惰性气体的影响:
第四章 多相平衡 :系统中,物理及化学性质完全均一的部分。 体:一个系统中,无论有多少气体,都只能形成一个气相。 体:由于不同液体的相互溶解的程度不同,一个系统中可以有一个或两个液相,但
极电势与可逆电极电势不同。 (2)电极在有电流通过时所表现的电极电势与可逆电极电势产生偏差
的现象称为“电极的极化”;偏差的大小(绝对值)称为“过电势” (3)电极极化,阳极电势升高,阴极电势降低:
;
第六章 化学动力学基本原理 1、反应速率的表示法:
对于任意化学反应: , 其反应速率:
8、 有许多的速率公式:… 定义反应级数:… 3、对于基元反应: , 其速率公式: 4、 速率常数 ,n是反应级数。 5、几种简单级数反应的速率公式:(是反应物的起始浓度,x为t时刻 反应物已反应掉的浓度)
沸点升高常数 则
(3)半透膜两边平衡时,纯溶剂的压力为 、溶液的压力为,则 ,压力差称为渗透压, 渗透压
(4)求算活度:
第三章 化学平衡 1、理想气体的化学反应: 标准平衡常数 活度商 标准吉布斯函数变化 当时,,反应能够正向进行。 当时,,反应能够逆向进行。 当时,,反应达到平衡。。 2、平衡常数的表示法: (1)气相反应: ()
物理化学考前复习:基础知识+重点(考前
必备)
第一章 热力学第一定律
1、热力学三大系统: (1)敞开系统:有物质和能量交换; (2)密闭系统:无物质交换,有能量交换; (3) 隔绝系统(孤立系统):无物质和能量交换。 2、状态性质(状态函数): (1)容量性质(广度性质):如体积,质量,热容量。
数值与物质的量成正比;具有加和性。
20、反应焓与温度的关系-------基尔霍夫方程
即产物热容小于反应物热容,则 ,即温度升高时反应焓减小。 即产物热容大于反应物热容,则 ,即温度升高时反应焓增大。 或很小时,反应焓将不随温度而改变。 21、基尔霍夫方程的应用:
适用条件:温度变化范围不大时,将 近似看作常数,与温度无关。
第二章 热力学第二定律
(1) 假如某一过程的发生将使系统的熵变大于热温商,则该过 程是一个不违反热力学第二定律的、有可能进行的不可逆 过程。
(2) 假如某一过程发生时,系统的熵变为热温商相等地,则该 过程是一个可逆过程。
