离子及离子结构示意图演示文稿
合集下载
原子结构示意图与离子结构示意图

九年级化学学科知识—原子结构示意图
一、前20号元素原子结构示意图:
氢(H)氦(He) 锂(Li)铍(Be)硼(B)碳(C)
氮(N)氧(O)氟(F)氖(Ne) 钠(Na) 镁(Mg)
铝(Al)硅(Si)磷(P)硫(S)氯(Cl)
氩(Ar)钾(K)钙(Ca)
注:
原子序数=核电荷数=核内质子数=核外电子数(原子不显电性)
原子失去电子形成阳离子,得到电子形成阴离子。
二、部分离子结构示意图:
氢离子H+氧离子O2-氟离子F-硫离子S2-氯离子Cl-
钠离子Na+镁离子Mg2+铝离子Al3+钾离子K+钙离子Ca2+
三、原子的结构
核外电子(每个电子带1个单位负电荷)
原子
原子核质子(每个质子带1个单位正电荷)
中子(不带电)(有些原子没有中子)
1。
离子及离子结构示意图

+11
2 8 Na+
Al
+13
283
易失3个电子
+13
2 8 Al3+
原子
失电子
带正电
阳离子
R
失n电子
Rn+
举例分析:
Cl
+17
287
易得1个电子
+17
2 8 8 Cl-
S
+16
286
易得2个电子
+16
2 8 8 S2-
原子
得电子 得n电子
带负电
阴离子 Rn-
R
原子中: 核电荷数 = 质子数
阳离子: 核电荷数 = 质子数 阴离子: 核电荷数 = 质子数
核外电子数 =
> 核外电子数
< 核外电子数
练习2、判断下列是原子结构图、离子结构图?
+16 2 8 6 +11 2 8 1
+17
2 8 8
S
+8 2 8
Na
+10 2 8
Cl+11 2 8
O2-
Ne
Na+
离子的形成
2-、SO 2-。 带电的原子或原子团,如 S 1、概念: 4 离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。
原子
阳离子
阴离子
微粒结构
微粒电性
质子数=电子数
质子数>电子数 质子数<电子数
不显电性
用元素符号表示,如 H、Na、Cl
显正电性
先负电性
符号
用阳离子符号表示,用阴离子符号表示, 如Na+,Ca2+等,数 如S2-、Cl-,数字在前, 字在前,符号在后。符号在后。
初三化学--离子课件

稀有气 体元素
等于8(氦=2)
难于得失电子 (为稳定结构)
不易形成离子
原子和离子的联系和区别
联系:
阳离子 失电子 原子 得电子 阴离子
得电子
失电子
原子中:质子数=电子数(原子不带电)
区 别
阳离子中:质子数>电子数(带正电)
阴离子中:质子数<电子数(带负电)
+13 2 8
+16 2 8 8
+8 2 6
同一类原子的总称
宏观 组成
只论种类 不论个数
微观 构成
既论种类 又论个数
【基础练习】
1.要能够分清原子结构示意图、离子结构示意图 2.要能够根据示意图写出对应的符号
Na
Mg
S
Cl
+11 2 8 1
+12 2 8 2
+16 2 8 6
+17 2 8 7
原子:核电荷数=核外电子数
Na+ +11 2 8
Mg2+ +12 2 8
S2- +16 2 8 8
Cl- +17 2 8 8
离子:核电荷数≠核外电子数
判断下列原子结构示意图是否正确?
+16 2 6 8 +8 2 8 硫原子 氧原子
+12 2 8 2 镁原子
请写出下列示意图的名称
+2 2 氦原子
+8 2 8 氧离子
+17 2 8 7 +13 2 8
符号是____,该离子的结构示意图
是:
+13 2 8
❖根据右边的结构图回答:
❖如__果_,该该图原表子示N的e的符是号原是子_,__X_1值。0 为
初中化学原子结构示意图和离子 PPT课件 图文
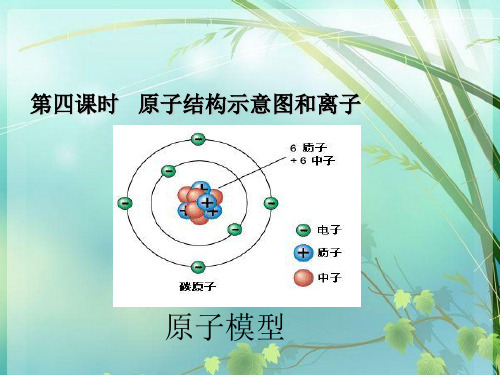
第四课时 原子结构示意图和离子
原子模型
核外电子排布
• 电子在核外是怎么作高速运动的?电子多了会不会 出现“撞车”现象?会不会被原子核吸掉?会不会 飞到原子的外面来?
• 原子核的半径约为原子半径的十万分之一,电子在 核外作高速运动。
核外电子是分层排布的
• 第一电子层离核最近、能量最低,最多能容纳2 个电子。
离子——带电荷的原子或原子团
阳离子——带正电荷的原子或原子团
Na+ Ca2+ Mg2+ Al3+ H+ NH4+
阴离子——带负电荷的原子或原子团
Cl- O2- F- OH- SO42- NO3- CO32-
常见的离子
谢谢! 学妹给我打电话,说她又换工作了,这次是销售。电话里,她絮絮叨叨说着一年多来工作上的不如意,她说工作一点都不开心,找不到半点成就感。 末了,她问我:学姐,为什么想 找一份 自己热 爱的工 作这么 难呢? 我问她上一份工作干了多久,她 说不到 三个月 ,做的 还是行 政助理 的工作 ,工作 内容枯 燥乏味 不说, 还特别 容易得 罪人, 实在不 是自己 的理想 型。 我又问了她前几份工作辞职的原 因,结 果都是 大同小 异,不 是因为 工作乏 味,就 是同事 不好相 处,再 者就是 薪水太 低,发 展前景 堪忧。 粗略估计,这姑娘毕业不到一年 ,工作 却已经 换了四 五份, 还跨了 三个行 业。 但即使如此频繁的跳槽,她也仍 然没有 找不到 自己满 意的工 作。 2 我问她,心目中理想型的工作是 什么样 子的。 她说, 姐,你 知道苏 明玉吗 ?就是 《都挺 好》电 视剧里 的女老 大,我 就喜欢 她样子 的工作 ,有挑 战有成 就感, 有钱有 权,生 活自由 ,如果 给我那 样的工 作,我 会投入 我全部 的热情 。 听她说完
原子模型
核外电子排布
• 电子在核外是怎么作高速运动的?电子多了会不会 出现“撞车”现象?会不会被原子核吸掉?会不会 飞到原子的外面来?
• 原子核的半径约为原子半径的十万分之一,电子在 核外作高速运动。
核外电子是分层排布的
• 第一电子层离核最近、能量最低,最多能容纳2 个电子。
离子——带电荷的原子或原子团
阳离子——带正电荷的原子或原子团
Na+ Ca2+ Mg2+ Al3+ H+ NH4+
阴离子——带负电荷的原子或原子团
Cl- O2- F- OH- SO42- NO3- CO32-
常见的离子
谢谢! 学妹给我打电话,说她又换工作了,这次是销售。电话里,她絮絮叨叨说着一年多来工作上的不如意,她说工作一点都不开心,找不到半点成就感。 末了,她问我:学姐,为什么想 找一份 自己热 爱的工 作这么 难呢? 我问她上一份工作干了多久,她 说不到 三个月 ,做的 还是行 政助理 的工作 ,工作 内容枯 燥乏味 不说, 还特别 容易得 罪人, 实在不 是自己 的理想 型。 我又问了她前几份工作辞职的原 因,结 果都是 大同小 异,不 是因为 工作乏 味,就 是同事 不好相 处,再 者就是 薪水太 低,发 展前景 堪忧。 粗略估计,这姑娘毕业不到一年 ,工作 却已经 换了四 五份, 还跨了 三个行 业。 但即使如此频繁的跳槽,她也仍 然没有 找不到 自己满 意的工 作。 2 我问她,心目中理想型的工作是 什么样 子的。 她说, 姐,你 知道苏 明玉吗 ?就是 《都挺 好》电 视剧里 的女老 大,我 就喜欢 她样子 的工作 ,有挑 战有成 就感, 有钱有 权,生 活自由 ,如果 给我那 样的工 作,我 会投入 我全部 的热情 。 听她说完
离子及离子结构示意图

+17 2 8 8
Cl-
+11 2 8
Na+
离子的形成
1、概念:带电的原子或原子团,如S2-、SO42-。
离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。
2、离子的形成:
阳离子( + )
失电子
得电子
原子
阴离子( - )
3、离子的表示方法构图
+17 2 8 8
Na+
举例分析: Na +11 2 8 1
易失1个电子
+11 2 8 Na+
Al +13 2 8 3
易失3个电子
+13 2 8 Al3+
原子 失电子 R 失n电子
阳离子 Rn+
带正电
举例分析: Cl +17 2 8 7 易得1个电子 +17 2 8 8 Cl-
S
+16 2 8 6
易得2个电子
+16 2 8 8 S2-
原子 得电子 阴离子
带负电
R 得n电子 Rn-
原子中: 核电荷数 = 质子数 阳离子: 核电荷数 = 质子数 阴离子: 核电荷数 = 质子数
核=外电子数 核>外电子数
核<外电子数
练习2、判断下列是原子结构图、离子结构图?
+16 2 8 6
S
+8 2 8
O2-
+11 2 8 1
Na
+10 2 8
Ne
3、元素分类、原子结构与元素化学性质的关系
金属 元素
一般少于 4个
易失去最外 不稳定结构
层电子
非金属 元素
人教版九年级化学课件:3.2 原子的结构——离子 (共23张PPT)

数为13,该离子的核外电子数为
_1_0___,该离子的名称是铝__离__子__,
符号是_A_l_3_+ ,该离子的结构示意图
是:
+13 2 8
• 根据右边的结构图回答:
• 如果该图表示的是原子,X值为___,
该10原子的符号是____。Ne
• 如果该图表示的是带两个单位正电
荷的阳离子,X值为_1_2_,符号是 _Mg_2_+_。
书写离子的方法
Mg2+ Cl-
镁离子
氯离子
离子用离子符号表示:
在元素符号的右上角标出离子所带的电荷的多少及电 荷的正负,当离子所带电荷数为1时,1可以不写。
离子符号的意义: Mg2+上的2表示每个镁离子带2个单位的正电荷 O2-上的2表示每个氧离子带2个单位的负电荷
每个铝离子
3个 铝离
3Al 3+
带三个单位 正电荷
子
铝离子或 一个铝离 子
指出下列符号中数字“2 ”
的意义
2Mg2+ 、2 S2-
离子符号前面的系数只表示 离子的个数。
构成物质的粒子:原子、分子、离子
某些单质由原子直接构成。如:金属 另一些单质由分子构成。如:气态非金属
化合物由分子或离子构成。 一般情况下,有金属阳离子(或铵 根离子NH4+ )的化合物由离子构成, 否则由分子构成。
原子结构 示意图
电子层
S +16 2 8 6
核内质子数
电子层上 的电子数
+1 1
氢H
+2 2
氦He
+3 2 1 +4 2 2 +5 2 3 +6 2 4 +7 2 5 +8 2 6 +9 2 7 +10 2 8
离子及离子结构示意图

易失1个电子
+11 2 8 Na+
Al +13 2 8 3
易失3个电子
+13 2 8 Al3+
原子 失电子 R 失n电子
阳离子 Rn+
带正电
举例分析: Cl +17 2 8 7 易得1个电子 +17 2 8 8 Cl-
S
+16 2 8 6
易得2个电子
+16 2 8 8 S2-
原子 得电子 阴离子
带负电
+11 2 8
钠原子(Na)
钠离子( Na+ ) 阳离子
+17 2 8 7 得到1个电子 +17 2 8 8
氯原子(Cl )
氯离子( Cl- )阴离子
离子
相对稳定结构:
只有一个电子层:最 外层为2个电子
多个电子层时:最外 层为8个电子
每一种原子在化学反应中,形成化合物 时:都要形成相对稳定结构
举例分析: Na +11 2 8 1
失电子
得电子
联系 如何构成物质的呢?
钠原子Na
氯原子Cl
不稳定 +11 2 8 1
+17 2 8 7 不稳定
稳定
+11 2 8
钠离子Na+
+17 2 8 8 稳定 氯离子Cl-
相互作用
Na+ Cl-
NaCl
离子是构成物质的粒子么?
【知识拓展 】
像氯化钠这种由阴离子和阳离子相互作用 而形成的化合物,叫做离子化合物。 离子化合物:由阴离子和阳离子结合的化合物 (典型的金属和非金属结合的化合物)。
离子符号的意义mg2表示每个镁离子带2个单位的正电荷2表示2个镁离子离子和原子的关系微粒种类原子阳离子阴离子微粒结构质子数电子数质子数电子数质子数电子数微粒电性不显电性显正电性先负电性符号用元素符号表示如hnacl知识拓展像氯化钠这种由阴离子和阳离子相互作用而形成的化合物叫做离子化合物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
离子
相对稳定结构:
只有一个电子层:最 外层为2个电子
多个电子层时:最外 层为8个电子
每一种原子在化学反应中,形成化合物 时:都要形成相对稳定结构
举例分析: Na +11 2 8 1
易失1个电子
+11 2 8 Na+
Al +13 2 8 3
易失3个电子
+13 2 8 Al3+
原子 失电子 R 失n电子
核=外电子数 核>外电子数
核<外电子数
练习2、判断下列是原子结构图、离子结构图?
+16 2 8 6
S
+8 2 8
O2-
+11 2 8 1
Na
+10 2 8
Ne
+17 2 8 8
Cl-
+11 2 8
Na+
离子的形成
1、概念: 带电的原子或原子团,如S2-、SO42-。
离子带的电荷数等于该原子(或原子团) 失去或得到电子的数目。
元素
(He为2个)
稳定结构
一般不参加 化学反应
元素的种类由原子的核电荷数(质子数)决定。 元素的化学性质主要决定于原子的最外层电。子数
+11 2 8 1 失去1个电子
+11 2 8
钠原子(Na)
钠离子( Na+ ) 阳离子
+17 2 8 7 得到1个电子 +17 2 8 8
氯原子(Cl )
氯离子( Cl- )阴离子
离子
核电 荷数
电子层
电子 数
钠原子结构示意图
⑴第一层最多容纳2个电子,第二层最多容纳8个电子。
(2)最外层不超过8个电子。 ⑶电子先排满能量较低的电子层,然后再排能量稍高的 电子层。
1-18号元素的原子结构示意图
稳定结构
氢(H)
氦(He)
锂(Li) 铍(Be) 硼(B) 碳(C) 氮(N) 氧(O) 氟(F) 氖(Ne )
2、离子的形成:
阳离子( + )
失电子
得电子
原子
阴离子( - )
3、离子的表示方法:
+11 2 8
离子结构图
+17 2 8 8
Na+
离子符号
Cl-
1.离子
• 阳离子-带正电荷的粒子 • 阴离子-带负电的粒子
2.离子符号的意义
2 Mg2+
表示,每个镁离子带2个单位的正电荷
表示2个镁离子
微粒种类 离原子子和原子阳的离关子 系 阴离子
离子及离子结构示意图
原子核外电子的排布(又叫分层运动)
1、电子能量的高低与离核远、近的关系:
电子层 一 二 三 KL M
离核远近 近
四 五 六七
NOPQ
远
能量高低 低
高
原子结构示意图
1、画法:圆圈标核电,电子分弧线, 数字一条线 。
2、表示意义: 以氧原子结构示意图为例 ⑴ 弧线表示电子层, ⑵ “2” 表示第一层上排有2个电子。 ⑶“6” 表示第二层上排有6个电子。 ⑷ +8 表示原子核内有8个质子 。
阳离子 Rn+
带正电
举例分析: Cl +17 2 8 7 易得1个电子 +17 2 8 8 Cl-
S
+6 2 8 8 S2-
原子 得电子 阴离子
带负电
R 得n电子 Rn-
原子中: 核电荷数 = 质子数 阳离子: 核电荷数 = 质子数 阴离子: 核电荷数 = 质子数
钠原子Na
氯原子Cl
不稳定 +11 2 8 1
+17 2 8 7 不稳定
稳定
+11 2 8
钠离子Na+
+17 2 8 8 稳定 氯离子Cl-
相互作用
Na+ Cl-
NaCl
离子是构成物质的粒子么?
【知识拓 展】
像氯化钠这种由阴离子和阳离子相互作用 而形成的化合物,叫做离子化合物。 离子化合物:由阴离子和阳离子结合的化合物 (典型的金属和非金属结合的化合物)。
微粒结 质子数=电子 质子数>电 质子数<电子
构
数
子数
数
微粒电性 不显电性 显正电性 先负电性
符号
用 示 Cl 元 ,素 如符H、号失N表a电、子用号N数符a阳表字号+,C离示在在a2子,前后+等符如,。,得电子用 表 C符l-,阴 示 号数离 , 在字子 如 后在S符 。前2-号、,
得电子
失电子
离子是如何构成物质的呢?
NaCl MgCl2 KCl
钠(Na) 镁(Mg) 铝(Al) 硅(Si) 磷(P) 硫(S) 氯(Cl) 氩(Ar)
3、元素分类、原子结构与元素化学性质的关系
元素分类 最外层电数 结构的稳性 化学性质
金属 元素
非金属 元素
一般少于 4个
一般多于或 等于 4个
易失去最外 不稳定结构
层电子 不稳定结构 易得到电子
稀有气体 8个电子
