第十二章镧系元素选编
镧系元素
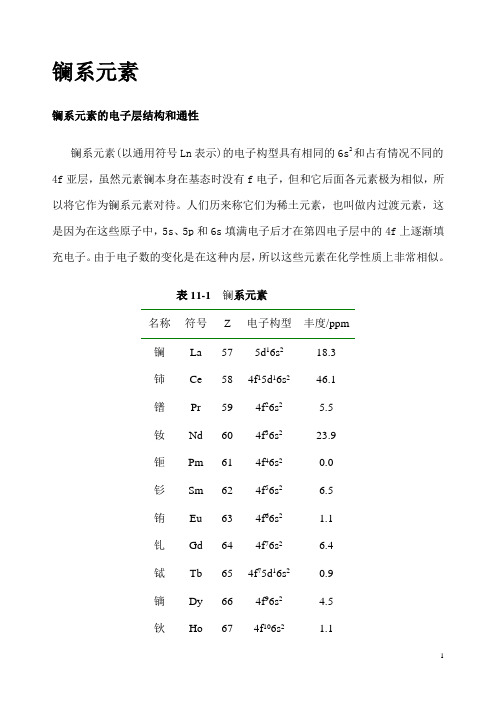
镧系元素镧系元素的电子层结构和通性镧系元素(以通用符号Ln表示)的电子构型具有相同的6s2和占有情况不同的4f亚层,虽然元素镧本身在基态时没有f电子,但和它后面各元素极为相似,所以将它作为镧系元素对待。
人们历来称它们为稀土元素,也叫做内过渡元素,这是因为在这些原子中,5s、5p和6s填满电子后才在第四电子层中的4f上逐渐填充电子。
由于电子数的变化是在这种内层,所以这些元素在化学性质上非常相似。
表11-1 镧系元素名称符号Z 电子构型丰度/ppm镧La 57 5d16s218.3铈Ce 58 4f15d16s246.1镨Pr 59 4f26s2 5.5钕Nd 60 4f36s223.9钷Pm 61 4f46s20.0钐Sm 62 4f56s2 6.5铕Eu 63 4f66s2 1.1钆Gd 64 4f76s2 6.4铽Tb 65 4f75d16s20.9镝Dy 66 4f96s2 4.5钬Ho 67 4f106s2 1.1铒Er 68 4f116s2 2.5铥Tm 69 4f126s20.2镱Yb 70 4f136s2 2.7镥Lu 71 4f145d16s20.8它们性质上的微小差别,主要是由“镧系收缩”引起的。
因为核内每增加一个质子,相应进入4f亚层的电子却太分散,不象定域程度更高的内层电子那样能有效地屏蔽核电荷,所以随着镧系元素原子序数的增加,原子核对最外层电子的引力就不断地增大,这就使得原子体积从镧到镥依次减小。
三价阳离子的收缩是十分规则的,从La3+的106pm收缩到Lu3+的35pm。
图11.1A所示金属半径,虽然总的趋向是减小,但Eu和Yb的半径比其余原子的要大得多。
它们是形成二价阳离子的倾向最大的两个镧系元素。
在固体中,这两种原子可能只将两个电子给予导带,而所形成的2+离子和其余镧系金属的3+离子相比,其半径较大、离子间的结合力较弱。
金属铕(Eu)和镱(Yb),与表中相邻的金属比,显然具有较低的密度,较低的熔点(图11.1B)和较低的升华能。
镧系-锕系元素-2011.4

rM 3+
K稳
r/pm 97.9 △/pm 1.5
96.4 1.4
95.0
93.8 1.2
92.3 1.5
90.8 1.5
类似的现象还出现在镧系元素的配位
64Gd
化合物的稳定常数中。 这种现象被称之为Gd断效应。
原子序数
64Gd位于15个镧系元素所构成的序列的正中央,其+3价离 子有半充满的 f7 稳定结构,这种结构的电子屏蔽效应大,有效
镧系元素除以上原子半径的“双峰”变化外,还有一些规律 性
1、镧系元素存在的奇偶变化
镧系元素在地壳中的丰度随原子 序数的增加而出现奇偶变化的规律: 原子序数为偶数的元素,其丰度总 是比紧靠它的原子序数为奇数的大。
除丰度之外, 镧系元素的热中子
吸收截面也呈现类似的奇偶变化规 律性。
2、Gd断效应
在镧系元素的离子半径的变化中,在具有f7的中点64Gd3+处 微有不连续性, 由其相邻离子半径的差值的大小可以看出:
第二十二章
Chapter 22
镧系-锕系元素
The Lanthanide Series and
Actinide Elements (2010级使用)
本章教学要求
1. 掌握镧系元素的电子层结构及其与性质的关系; 2. 通过与镧系元素对比了解锕系元素的特性;
3. 掌握镧系收缩的实质及其影响;
4. 熟悉镧系元素的主要化合物; 5. 了解稀土元素的分布及其应用。
特点
原子半径缩小缓慢,相邻元素 递减1pm,总的缩小 约14pm。
57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
镧系元素

原子半径/pm
187.7 182.4 182.8 182.1 181.0 180.2 204.2 180.2 178.2 177.3 176.6 175.7 174.6 194.0 173.4
Ln3+半径 /pm E q /V
106.1 -2.38
103.4 -2.34
101.3 -2.35
99.5 -2.32
97.9
-2.29
96.4
-2.30
95.0
-1.99
93.8 -2.28
92.3
-2.31
90.8
-2.29
89.4
-2.33
88.1
-2.32
86.9
-2.32
85.8
-2.22
84.8
-2.30
7Hale Waihona Puke 从上图中可以看出,镧系元素的原子半径和
离子半径在总的趋势上都随着原子序数的增加而
缩小的幅度很小,这叫做
2
3 Li
锂
4 Be
铍
5 B 6 C 7 N 8 O 9 F 10 Ne
硼 碳 氮氧 氟 氖
3
11 Na
钠
12 Mg
镁
IIIB
IVB
VB
VIB VIIB
VIII
13 Al 14 Si 15 P 16 S 17 Cl 18 Ar
IB IIB 铝 硅 磷 硫 氯 氩
4 19 K 20 Ca 21 Sc 22 Ti 23 V 24 Cr 25 Mn 26 Fe 27 Co 28 Ni 29 Cu 30 Zn 31 Ga 32 Ge 33 As 34 Se 35 Br 36 Kr
整个电子壳层依次收缩的积累造成总的镧系收缩
d,f区元素

12.1.1 d区元素的特殊性
d区元素显示出许多区别于主族元素的性质:
• 熔沸点高、硬度密度大的金属大都集中在这一区 • 同一周期从左到右,元素化学性质的变化远不如s区p区
显著。
• 不少元素形成有颜色的化合物 • 许多元素形成多种氧化态从而导致丰富的氧化还原行为 • 形成配合物的能力比较强 ,参与工业催化过程和酶催
化过程的能力强
12.2 钒
• 钒的价电子层结构为3d34s2,5个电子都有成键作用,所以 • 在酸性介质中,钒的元素电势图为
A / V
VO2+ 主要氧化态为+5,但也存在+4,+3,+2。
-0.25 -1.2 1.0 VO2+ 0.36 V3+ V2+ V -0.25
所以V2+、V3+具有还原性,VO2+是稳定的,而VO2+具有氧化 性。 不同的氧化态的钒具有不同的颜色。例如: VO2+(黄色)可 被Fe2+、H2C2O4等还原为VO2+(蓝色)
[Cr(H2O)6]Cl3 紫色
[Cr(H2O)5Cl]Cl2· H2O 浅绿 [Cr(H2O)4Cl2]Cl· 2H2O 深绿
2. Cr(VI)的化合物
Cr(VI)的化合物通常是由自然界存在的铬铁矿Fe(CrO2)2,
借助于碱熔法制得的,即把铬铁矿和Na2CO3混合,并在空 气中煅烧。用水浸取煅烧后的熔体,Na2CrO4进入水中,浓 缩,得黄色晶体Na2CrO4;酸化得红色晶体。 4Fe(CrO2)2 + 8Na2CO3 + 7O2 8Na2CrO4 + 2Fe2O3 + 8CO2
电子分别填充在3d 亚层4d 亚层和5d 亚层上.
镧系元素【-】

硫酸盐 将镧系元素的氧化物或氢氧化物溶于硫酸 中可生成硫酸盐。除了硫酸铈是九水合物外,其 余的由溶液中都可以结晶出八水合物 Ln2(SO4)3·8H2O。无水硫酸盐可从水合物直接加 热脱水制得:
L n 2 ( S O 4 ) 2 n H 2 O 4 2 8 ~ 5 3 3 K L n 2 ( S O 4 ) 3 + n H 2 O
5. 标准电电极极电电势势数据可以看出,镧系金属是较强的
还原剂,其还原能力仅次于碱金属和碱土金属, 而且随着原子序数的增加,其还原能力逐渐减弱。
数据还表明,Ln2+也是强还原剂。Ce4+是强 氧化剂,能被水缓慢地还原。Pr4+的氧化能力比 Ce 4+强,Pr 4+能够氧化水,因此不能在水溶液中 存在。
3. 原子半径和离子半径 这种镧系元素的原子半径和离子半径随着原子序数的增 大而逐渐减小的现象称为镧系收缩。这是因为4f电子对 核的屏蔽作用不如内层电子,因此随着原子序数增加, 有效核电荷增加,核对最外层电子的引力增强,使得原 子半径和离子半径逐渐减小。
La
Lu
原子半径/pm
210.0 205.0
NO3-(碱式) PO43CO32C2O42-
易溶 不溶 不溶于M2SO4溶液 中等溶解 不溶 不溶;不溶于过量CO32-溶液 不溶;不溶于过量C2O42-溶液
易溶 不溶 溶于M2SO4溶液 微溶 不溶 不溶;溶于过量CO32-溶液 不溶;溶于过量C2O42-溶液
卤化物 向镧系金属氧化物、氢氧化物或碳酸盐中加入 盐酸即可得到氯化物。氯化物易溶于水,在水溶液中结 晶出水合物。从La到Nd常结晶出七水合氯化物,而从 Pm到Lu(包括Y)常以六水合物析出。加热水合物不能得 到无水氯化物,因为氯化物受热脱水时会发生水解生成 氯氧化物LnOCl。制备无水LnCl3最好是将氧化物放在 COCl2或CCl4蒸汽中加热。也可采用加热氧化物与 NH4Cl的混合物制得。
第十二章镧系元素介绍

溶液中Ln3+的颜色
镧系元素离子为何具有颜色?
4f亚层半充满的镧系元素离子,其颜色主要是由4f 亚层 中的电子跃迁引起的。(f-f 跃迁)
如果金属处于高氧化态而配位体又具有还原性的话,就 能产生配位体到金属的电荷迁移跃迁。
Ce4+离子的橙红色是由电荷迁移跃迁还是由f-f 跃迁所引 起?(电荷迁移跃迁)
镧系元素化学性质的差异
从La3+到Lu3+, 因电子结构单调变化使+3价离子的半径作有 规律的变化,结果导致镧系元素化学性质上的微细差异作有 规律的收缩。 e.g. 镧系元素+3价离子的碱度随着原子序数的递增而依次减 弱,并且同原子的电负性的变化平行。其离子碱度相对强弱 可以用以判断离子水解程度、配位化合物的稳定性和金属离子 形成氢氧化物沉淀的pH大小。
• 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No
12.1 镧系元素的性质
1.引言
镧系元素包括从镧(57)到镥(71)的15个第六周期
的内过渡元素;
锕系元素包括从锕(89)到铹(71)的15个第七周期
的内过渡元素;
(内过渡元素:有电子填充在内层的(n-2)f 能级。但对于镧系和锕系 来讲并不规则,电子也会填入5d或6d能级:这是由于4f和5d, 5f和6d能 级的能量较为接近的原因)
稀土元素
镧系元素的化学性质十分相似而又不完全 相同。包括镧系元素以及与镧系元素在化学性 质上相近的钪(Sc)和钇(Y),共17个元素总称为
从上图中可以看出,镧系元素的原子半径和离子 半径在总的趋势上都随着原子序数的增加而缩小,这 叫做镧系收缩现象. 镧系收缩的结果,使金属原子半 径从La (187.7 pm) 到Lu (173.4 pm)共缩小~15 pm, 平均1 pm/核电荷.
镧系元素和锕系元素

经过高温灼烧的 Ln2O3 在强酸
中的溶解性较差,灼烧温度较低的溶
解性较好。 镧系的氧化物与酸反应形成镧系
的盐类 。
例如
La2O3 + 6 HNO3 —— 2 La (NO3) 3 + 3 H2O Dy2O3 + 6 HCl —— 2 DyCl3 + 3 H2O 将溶液浓缩后,均可得到结晶水合物
具有 f3,f4,f5 和 f10,f11 结构的
+3 价离子呈现浅红色和黄色; 具有 f6,f7,f8 结构的 +3 价离子, 吸收峰全部或大部分在紫外区,所以 无色或略带粉红色。
镧系元素的一些简单化合物,如
Ln2O3 和 Ln (OH) 3 等的颜色基本与对
应的 Ln3+ 相同,这是因为它们的显色
HCl —— △
LnCl3 + 6 H2O
采用氧化物氯化的方法制备纯无 水盐,需要在反应体系中加入碳粉, 通过热力学耦合,使反应进行完全。
HCl Ln2O3 + 3 C + 3 Cl2 —— △
2 LnCl3 + 3 CO
制备无水氯化物的最佳方法 应是金属的直接氯化 。
(2) 含氧酸盐
硫酸与镧系金属,镧系氧化物、 氢氧化物反应,均可得到镧系的硫 酸盐。硫酸与镧系碳酸盐等弱酸盐 反应,亦可得镧系的硫酸盐。
化学反应的实质总是与酸或碱有关 。
氢氧化钠分解法和硫酸分解法
的反应实质分别为
△
LnPO4 + 3 NaOH ——
Ln (OH) 3↓ + Na3PO4
△ 2 LnPO4 + 3 H2SO4 ——
( )3 + 2 H3PO4 Ln 2 SO4
镧系元素和锕系元素

镧系配合物的特点
特征配位原子:O 成键能力:O>N>S
Ln3+硬酸
例:水合硝酸镧
La(NO3)3·6H2O 配位数:11
[La(H2O)5(NO3)3]H2O
(3个NO3-双齿配位,5个H2O单齿配位)
水分子配位的水合焓较大: -3278~-3722 kJ·mol-1(计算值)
→非水溶剂或无溶剂条件下 才能得只含N、S配位原子配体的配合物
“中东有石油,中国有稀土”——稀土是公认的战略元素
§ 9-1 镧系元素
二. 稀土金属
1. 稀土金属元素的性质
物理性质:
银白色、柔软金属,具延展性,导电性好 m.p. :La→Lu↑(Eu、Yb除外)
化学性质:Eo(Ln3+/Ln) 约–2.4 V
活泼性仅次于碱金属、碱土金属
室温在空气中:4Ln + 3O2 → 2Ln2O3 重稀土生成致密氧化膜
§ 9-1 镧系元素 三. 镧系元素的重要化合物
Ln2O3
Ln、Ln(OH)3、Ln2(CO3)3、Ln2(C2O4)3 + O2 灼烧
氢气氛中加热得Ce2O3、Pr2O3、Tb2O3 Ln2O3:高m.p.,不溶于水,溶于无机酸
Ln2O3
Ln(OH)3
不溶于水 (Ln3+易水解)
盐 LnX3
大多数溶于水,硫酸盐、草酸盐难溶
……
重要的β–二酮: 二苯甲酰甲烷DBM 噻吩甲酰三氟丙酮TTA
O SC
R = R ́ = C6H5 R = 2-噻吩基 R ́ = CF3
§ 9-1 镧系元素
四. 镧系元素的光谱性质
2. 镧系元素的电子结构
镧系收缩——镧系元素随f电子数增加,原子半径和 离子半径总体上逐渐减小的现象
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
从上图中可以看出,镧系元素的原子半径和离子 半径在总的趋势上都随着原子序数的增加而缩小,这
叫做镧系收缩现象. 镧系收缩的结果,使金属原子半
径从La (187.7 pm) 到Lu (173.4 pm)共缩小~15 pm, 平均1 pm/核电荷.
镧系收缩的原因
镧系元素相继填充处于内层的4f能级,为什么还发生
5. 镧系元素的离子和化合物的磁性
4f 0构型的离子La3+和Ce4+以及4f 14构型
的离子Yb2+和Lu3+: 没有未成对电子反磁性磁矩=0
f 1-13构型的原子或离子:
有未成对电子顺磁性磁矩 0
镧系元素的磁性与d区过渡元素的磁性有何不同?
d区过渡元素的磁性主要是由未成对电子的自旋运动产生 的,d轨道受晶体场的影响较大,轨道运动对磁矩的贡献 被周围配位原子的电场所抑制,几乎完全消失。
的内过渡元素;
(内过渡元素:有电子填充在内层的(n-2)f 能级。但对于镧系和锕系 来讲并不规则,电子也会填入5d或6d能级:这是由于4f和5d, 5f和6d能
级的能量较为接近的原因)
稀土元素
镧系元素的化学性质十分相似而又不完全 相同。包括镧系元素以及与镧系元素在化学性 质上相近的钪(Sc)和钇(Y),共17个元素总称为
Ln(OH)2 、 Ln(OH)4 、 Ln(OH)3的碱性和氧化还原性 有较大差别 微酸性介质中如何分离出Ce?
Ce(OH)4 Ce(OH)3
溶度积(Ksp) 10-54 1.5 x 10-20
沉淀所需pH 0.7-1.0 中性
在微酸性介质中Ce4+离子的平衡浓度极小,而Ce3+离子的
平衡浓度相对较大,所以Ce(III)较易被氧化成Ce(IV), 用
Ce4+离子的橙红色是由电荷迁移跃迁还是由f-f 跃迁所引
起?(电荷迁移跃迁)
4. 镧系元素的电离能和电极电势
镧系元素电离能是从La到Eu的轻镧系元素和从Gd到Yb的重 镧系元素逐渐增大,而Lu减小。
Eu和Yb的高电离能可能归因于4f 7、4f 14的稳定。
镧系元素的升华热、水合能变化也较规律,所以镧系元素 的离子化倾向的变化也很有规律,电极电势相近。
• 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No
12.1 镧系元素的性质
1.引言
镧系元素包括从镧(57)到镥(71)的15个第六周期
的内过渡元素;
锕系元素包括从锕(89)到铹(71)的15个第七周期
2) 镧系元素草酸盐都含有结晶水,其中十水合物最为常见,
此外还有6,7,9,11水合物。
3) 镧系元素草酸盐受热最终分解为氧化物,而且在加热过
程中生成相应的碳酸盐。
4) 镧系元素草酸盐可溶于碱金属草酸盐溶液中,但溶解度 有明显的区别。
(2) 镧系元素的碳酸盐
镧系元素的碳酸盐的溶解度,溶度积都小于相应的草酸盐。 镧系元素碳酸盐含有结晶水:Ln2(CO3)3.xH2O。 镧系元素的碳酸盐易溶于酸。Ln3+和易溶碱金属碳酸盐或碳酸氢盐 反应,得到难溶Ln2(CO3)3。 碳酸镧和碳酸钠作用形成溶解度较小的复盐。工业上有碳酸铈钠复 盐产品。 碳酸镧较易溶于碳酸钾中,且溶解度按镧<铈<镨<釹的顺序增加, 重镧系元素碳酸盐的溶解度更大。 Ln2(CO3)3受热分解为碱式盐,最终产物为氧化物。
1. 为什么钇与镧系元素的化学性质相近?
2. 为什么锆与铪,铌与钽,钼与钨这三对元素 的互相分离较为困难?
3. 第VIII族中两排铂系元素在性质上极为相似, 为何?
镧系收缩的影响
使钇Y3+(88 pm)在离子半径的序列中落在铒Er3+(88.1 pm)的附近, 因而在自然界中常同镧系元素共生,成为稀土元素的一员.
比较Eu2+、Yb2+和Sm2+的还原性;Ce4+和Pr4+的氧化性。 (f层全空、半充满、全充满较稳定)
溶液中Ln3+的颜色
镧系元素离子为何具有颜色?
4f亚层半充满的镧系元素离子,其颜色主要是由4f 亚层 中的电子跃迁引起的。(f-f 跃迁)
如果金属处于高氧化态而配位体又具有还原性的话,就 能产生配位体到金属的电荷迁移跃迁。
第VIII族中两排铂系元素在性质上的极为相似,也是镧系收缩所带 来的影响.
3. 镧系元素的化合价和离子的颜色
镧系元素的特征氧化态为+3。镧系元素在水溶液中容 易形成+3价离子,是较强的还原剂,其还原能力仅次于碱 金属和碱土金属。
(参考:酸性介质和碱性介质中的E0Ln(III)/Ln )
某些镧系元素还能形成+2价和+4价的离子。
使镧系后面各族过渡元素的原子半径和离子半径分别与相应同族上 面一个元素的原子半径和离子半径极为接近: e.g. IV B族的Zr4+(80 pm)和Hf4+(79 pm); V B族的Nb5+(70 pm)和 Ta5+(69 pm);VI B族的Mo6+(62 pm)和W6+(62 pm),离子半径极为接近, 化学性质相似。结果造成锆与铪,铌与钽,钼与钨这三对元素在分离 上的困难.
除Yb(OH)3和Lu(OH)3外,其余Ln(OH)3不溶于过量的 氢氧化钠溶液中。
Ln(OH)3的溶解度随温度的升高而降低。
Ln3+和NaOH或NH3·H2O反应都能生成Ln(OH)3沉淀。 欲使Ln(OH)3完全沉淀,用NaOH和NH3·H2O何种沉淀剂更好?
Ln3+ + 3OH- = Ln(OH)3 Ln3+ + 3NH3·H2O = Ln(OH)3 + 3NH4+
Ln 和O2的反应非常剧烈。Ce 、Pr、Nd的燃点依次为 165 ゚C、290゚C、270゚C。因此铈-铁合金可被用做来制 造打火石。
氢氧化物、草酸盐、碳酸盐、硝酸盐、硫酸盐在空气 中灼烧,或将镧系金属直接氧化-> Ln2O3。 但Ce生成白
色CeCOe2O、2P,rOP2r比生A成l2黑O3色、SPirO6O2还11,要T稳b定生。成(暗从棕色的fTGb4mO判7。断)
由于Ln(OH)3的Ksp值不是很小,所以Ln3+和NH3·H2O 反应的平衡常数不太大:
K
(KNH3
)3
H2O
Ksp
由K值可知,用NH3·H2O作沉淀剂沉出Ln(OH)3 (尤其是轻镧 元素的氢氧化物)的反应,受到反应所生成的NH4+微弱抑制, 因此欲使Ln(OH)3完全沉淀,用NaOH更好。
第十二章 镧系元素和锕系元素
目录
12.1 镧系元素的性质 12.2 镧系元素的化合物 12.3 镧系元素的分离 12.4 镧系金属的制备 12.5 镧系元素的用途 12.6 锕系元素简介 小结
*Lanthanoids •Actinoids
* 21 Sc
* 39 Y
* 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb
整个电子壳层依次收缩的积累造成总的镧系收缩
铕和镱的反常
在镧系元素原子半径总的收缩趋势中,铕和镱的原子 半径比相邻元素的原子半径大很多,而铈的原子半径又较 小。为什么?这在其物理性质和化学性质上分别有何体现?
因为在铕和镱的电子层结构中,分别有半充满的4f7和4f14
电子,这种结构比起4f电子层没有充满的其他状态来对原子核 有较大的屏蔽作用,所以其半径突出地增大。基于此, Eu和 Yb的密度、熔点比它们各自左右相邻的两个金属都小;它们的 性质同Ca、Sr、Ba相近,如都能溶于液氨形成深蓝色溶液。
2. 镧系元素的性质及镧系收缩
15个镧系元素位于周期表第IIIB族,第六周期的同一格 内。为什么镧系元素的化学性质十分相似?
由上表可以看出,镧系元素最外两个电子层结构很接
近并且将4f轨道很好地屏蔽了起来,尽管4f电子结构不同, 但镧系元素的化学性质受4f电子数的影响很小,因而性质
十分相似。
镧系收缩
镧系元素化学性质的差异
从La3+到Lu3+, 因电子结构单调变化使+3价离子的半径作有 规律的变化,结果导致镧系元素化学性质上的微细差异作有 规律的收缩。
e.g. 镧系元素+3价离子的碱度随着原子序数的递增而依次减 弱,并且同原子的电负性的变化平行。其离子碱度相对强弱 可以用以判断离子水解程度、配位化合物的稳定性和金属离子 形成氢氧化物沉淀的pH大小。
金属活泼性:钪、钇、镧递增,由镧->镥递减。 稀土金属在空气中慢慢被氧化,与冷水缓慢作用,与热 水作用较快,可置换氢。所以稀土金属需要保存在煤油中。 稀土金属易溶于稀酸,与酸反应强烈,但与碱不作用。 轻稀土金属的燃点很低。如铈的合金可用做引火材料。
12.2 镧系元素的化合物
1 氧化物
Ln 和O2的反应:
因此,Ln能发生下列反应:
镧系元素的密度、熔点除Eu和Yb外,基本上都随着原子 序数的增加而增加(见前面Eu和Yb的反常性)。 镧系金属一般较软,随原子序数的增加而渐渐变硬;除 Yb外,所有镧系金属的顺磁性都相当强,Gd在298K以下具 有磁性。
从 fG m来看,镧系金属的还原性同金属镁相近。其
Ln2O3难溶于水和碱性介质中,但是易溶于强酸中。
Ln2O3在空气中吸收二氧化碳而形成碱式碳酸盐。
2 氢氧化物
根据上表,说明如何控制pH值使Ln(OH)3沉淀出来?
考虑Ln3+离子的碱度。Ln3+离子的碱度是随离子半径 的缩小而减弱的。离子碱度越弱,对阴离子OH-的引力 越强,因此需要越少的OH-,即pH值越小,Ln(OH)3开 始从溶液中沉淀出来。
