6金属局部腐讲义蚀重要s02
合集下载
第6章 金属的局部腐蚀

(6)水线腐蚀;(7)杂散电流腐蚀;(8)应力腐蚀;(9)腐蚀疲劳;
(10)磨损腐蚀; (11)氢脆;(12)晶间腐蚀
局部腐蚀的主要类型
小孔腐蚀(孔蚀)
缝隙腐蚀 电偶腐蚀
晶间腐蚀
应力腐蚀
局部腐蚀的危害性
局部腐蚀破坏有如下特征 : (1) 复杂性 (2) 集中性 (3) 突发性
6.2 小孔腐蚀(pitting corrosion)
6.3.1 缝隙腐蚀的概念
金属与金属或金属与非金属之间形成特别小的缝隙(一般 在0.025mm~0.1mm范围内),使缝隙内介质处于滞留 状态,引起缝隙内金属的加速腐蚀,这种局部腐蚀称为缝 隙腐蚀(crevice corrosion)。
(1) (2)
缝隙种类 机器和设备上的结构缝隙
固体沉积(泥沙、腐蚀产物
轮船上的青铜螺旋桨
6.4.1
电偶腐蚀的概念
由于同电极电位较高的金属接触而引起的腐蚀速度增大的 现象叫做电偶腐蚀(galvanic corrosion)。
H2O Fe Cu
电偶腐蚀也称为双金属腐蚀 (bimetallic corrosion),或接触腐蚀。
(1)
发生电偶腐蚀的几种情况 异金属 ( 包括导电的非金属材料,如石墨 ) 部 件的组合。 有时是设计不合理
孔核的“生灭” 过程
Ig / mA
t / min
镁合金在NaCl溶液中的电流振荡
(2)孔蚀的发展——闭塞电池自催化
孔外金属:钝化 孔内金属:活化
闭塞电池模型
小孔内部发生的反应:
为保持孔内的电 中性,孔外的Cl离子向孔内扩散
Fe → Fe2+ +2e
局部腐蚀PPT课件

第26页/共78页
• 当水的温度高于80℃时,电偶的极性就发生逆转,钢成为阳极而被腐蚀,而锌上的腐蚀产物使锌的电位提 高成为了阴极。溶液pH值的变化也会影响电极反应,甚至也会改变电偶电池的极性。例如,镁与铝偶合在 稀的中性或弱酸性氯化钠水溶液中,铝是阴极,但随着镁阳极的溶解,溶液变为碱性,导致两性金属铝成 为阳极。
第18页/共78页
• 定义金属M1作为阳极形成电偶后的腐蚀电流密 度 i ’cMl 和 它 单 独 存 在 时 的 腐 蚀 电 流 密 度 i cM 1 之
比,称为电偶腐蚀效应,一般用γ表示:该公式
表示金属M1和M2偶接后,阳极金属M1溶解腐 蚀速度增加的程度。γ越大,电偶腐蚀越严重。
(6-1)
• 一种金属与另一种电位较低的金属在腐蚀介质
• (3)存在电子导电回路。即低电位金属与电位 高的金属或非金属之间要么直接接触,要么通 过其他导体实现电连接,构成腐蚀电池的电子 导电回路。
第11页/共78页
• 在第二章中介绍了金属的标准电极电位和电位 序的概念,根据标准电极电位的高低可以从热 力学的角度判断金属变成离子进入溶液的倾向 大小,但是标准电极电位只给出了金属的理论 电位值,它是指无膜的金属浸在该金属盐的溶 液中且金属离子的活度处在标准态时用热力学 公式计算得到的。此外标准电位序也未考虑腐 蚀产物的作用,且没有涉及合金的排序,而含 两种或两种以上活性成分的合金是不可能建立 起标准电极电位的。因此标准电位序仅能用来 判断金属在简单腐蚀体系中产生腐蚀的可能性, 不能判断金属材料在某一特定腐蚀电解质中电 偶腐蚀倾向的大小,为了方便地判断金属材料 在某一特定腐蚀电解质中电偶腐蚀倾向的大小 而引入了电偶序。
第13页/共78页
• 在电偶序中腐蚀电位低的金属与离它越远的高 电位金属接触,电偶腐蚀的驱动力越大,电偶 腐蚀的倾向越高。然而,电偶腐蚀的速率除与 电极电位差有密切关系外,还受腐蚀金属电极 极化行为等因素的影响。由于金属材料的腐蚀 电位受多种因素影响,其值通常随腐蚀反应时 间而变化,即金属在特定电解质溶液中的腐蚀 电位不是一个固定值,而是有一定变化范围, 因此,电偶序中一般仅列出金属稳定电位的相 对关系或电位变化范围,而很少列出具体金属 的稳定电位值。另外,某些材料(如不锈钢和 Inconel合金等)有第活14页化/共和78页钝化两种状态,因此
• 当水的温度高于80℃时,电偶的极性就发生逆转,钢成为阳极而被腐蚀,而锌上的腐蚀产物使锌的电位提 高成为了阴极。溶液pH值的变化也会影响电极反应,甚至也会改变电偶电池的极性。例如,镁与铝偶合在 稀的中性或弱酸性氯化钠水溶液中,铝是阴极,但随着镁阳极的溶解,溶液变为碱性,导致两性金属铝成 为阳极。
第18页/共78页
• 定义金属M1作为阳极形成电偶后的腐蚀电流密 度 i ’cMl 和 它 单 独 存 在 时 的 腐 蚀 电 流 密 度 i cM 1 之
比,称为电偶腐蚀效应,一般用γ表示:该公式
表示金属M1和M2偶接后,阳极金属M1溶解腐 蚀速度增加的程度。γ越大,电偶腐蚀越严重。
(6-1)
• 一种金属与另一种电位较低的金属在腐蚀介质
• (3)存在电子导电回路。即低电位金属与电位 高的金属或非金属之间要么直接接触,要么通 过其他导体实现电连接,构成腐蚀电池的电子 导电回路。
第11页/共78页
• 在第二章中介绍了金属的标准电极电位和电位 序的概念,根据标准电极电位的高低可以从热 力学的角度判断金属变成离子进入溶液的倾向 大小,但是标准电极电位只给出了金属的理论 电位值,它是指无膜的金属浸在该金属盐的溶 液中且金属离子的活度处在标准态时用热力学 公式计算得到的。此外标准电位序也未考虑腐 蚀产物的作用,且没有涉及合金的排序,而含 两种或两种以上活性成分的合金是不可能建立 起标准电极电位的。因此标准电位序仅能用来 判断金属在简单腐蚀体系中产生腐蚀的可能性, 不能判断金属材料在某一特定腐蚀电解质中电 偶腐蚀倾向的大小,为了方便地判断金属材料 在某一特定腐蚀电解质中电偶腐蚀倾向的大小 而引入了电偶序。
第13页/共78页
• 在电偶序中腐蚀电位低的金属与离它越远的高 电位金属接触,电偶腐蚀的驱动力越大,电偶 腐蚀的倾向越高。然而,电偶腐蚀的速率除与 电极电位差有密切关系外,还受腐蚀金属电极 极化行为等因素的影响。由于金属材料的腐蚀 电位受多种因素影响,其值通常随腐蚀反应时 间而变化,即金属在特定电解质溶液中的腐蚀 电位不是一个固定值,而是有一定变化范围, 因此,电偶序中一般仅列出金属稳定电位的相 对关系或电位变化范围,而很少列出具体金属 的稳定电位值。另外,某些材料(如不锈钢和 Inconel合金等)有第活14页化/共和78页钝化两种状态,因此
金属的常见腐蚀形态及其保护措施

电动序和电偶序
电动序: 按照金属标准电极电位大小排列的顺序表。标准电极电位是纯 金属与介质中所含该金属离子的处于平衡状态时的电极电位。 电动序只能粗略地判定金属腐蚀的倾向性,在实际腐蚀体系实 用时有局限性;
电偶序: 金属和合金在实际使用条件下的腐蚀电位(非平衡电极电位) 的相对大小 排列而成的序列表;
5. 全面腐蚀造成金属的大量损失,所造成金属的损失量大 ;
6. 从技术的观点来看,这类腐蚀并不可怕,一般不会造成 突然事故。根据测定和预测的腐限的要求,涂覆不同的覆盖层,包括 金属喷镀、电镀、热浸镀和各种涂料涂装体系以防止设 备的过早腐蚀破坏。
蚀倾向就越大
2.介质条件 金属的电极电位因介质条件(成分、浓度、pH、温度等)
的不同而异,当介质条件发生变化时,金属的电偶腐蚀行为有 时会因出现电位逆转而发生变化。
通常阳极金属腐蚀电流的分布是不均匀的,距结合部越远 ,电流传导的电阻越大,腐蚀电流就越小。溶液电阻对电偶腐 蚀作用的“有效距离”影响显著。溶液的电阻越大,“有效距离”越 小。
•青铜
•Cu •黄铜 •Ni(活化) •海军黄铜
•Sn
•Pb •316、317不锈钢(活化)
•304不锈钢(活化) •铸铁
•钢或铁 •2024铝合金
•Cd •1100铝合金
•Zn •Mg和Mg合金
•↑ •阳极(贱)
•海水中的电偶序
电偶腐蚀的影响因素
1.电化学因素 电位差:两种金属在电偶序中的起始电位差越大,电偶腐
例如:晶间腐蚀导致晶粒间失去结合力,材料 的强度下降;点蚀导致金属制品穿孔而报废
电偶腐蚀的推动力: 电偶腐蚀与相互接触的金属在溶液中的电位有关,正是由
于接触金属电位的不同,构成了电偶腐蚀原电池,接触金属的 电位差是电偶腐蚀的推动力。
第六章 局部腐蚀

蚀孔形核敏感位置
金属材料表面成分和组织的不均匀性,表面钝化膜在某些部位较为薄弱, 这些部位成为蚀孔容易形核的部位: 晶界:晶界析出碳化铬导致晶界贫铬;位错,金属材料表面露头的位错是产 生点蚀的敏感部位 非金属夹杂:硫化物 硫化物夹杂是碳钢、低合金钢、不锈钢以及Ni等材料萌生点蚀最敏感的位 置。
在Cl-、Br- 、I-三种离子中,Cl-对点蚀电位的影响最大。
3) 介质温度的影响: 随介质温度的提高,不锈钢点蚀电位降低; 在含氯介质中,各种不锈钢都存在临界点蚀温度 (CPT ),在这一温度点蚀几率增大,随温度升高,点蚀 易产生并趋于严重。 4) 溶液pH的影响: 当pH<10时,影响较小;当pH>10后,点蚀电位上升。 5) 介质流速的影响: 静止或滞留的溶液,易产生孔蚀。流速增大,点蚀倾 向降低。 对不锈钢有利于减少点蚀的流速为1m/s左右。当流速进 一步增大,出现湍流时,钝化膜被破坏,孔蚀随之严重。
点蚀发生的条件
点蚀的发生要满足材料、介质和电化学 三个方面的条件: 1)材料条件:
点蚀多发生在表面容易钝化的金属材料上(如不锈钢、 Al及Al合金)或表面有阴极性镀层的金属上(如镀Sn、Cu或 Ni的碳钢表面)。 原因:当钝化膜或阴极性镀层局部发生破坏时,未破坏 区和破坏区的金属形成了大阴极、小阳极的“钝化-活化腐 蚀电池”,使腐蚀向基体纵深发展而形成蚀孔。
(3) 面积效应:
对于氧浓差极化控制的吸氧腐蚀,电偶电流ig与阴 极金属的面积S2成正比,阴极金属的面积S2越大,则 电偶电流越大
大阴极加速电偶腐蚀示意图
4. 防止电偶腐蚀的措施
★设计和组装: *首先应避免“小阳极-大阴极”的组合; *其次是尽量选择在电偶序中位置靠近的金属进行 组装; *在不同的金属部件之间采取绝缘措施; *可以选择价廉的材料做成易于更换的阳极部件。
第六章 局部腐蚀

从循环阳极化线上的特征电位来看:不锈钢缝隙腐蚀的发生与成长电位范
围比小孔腐蚀的要宽,比如,孔蚀的 Eb 值高于缝隙腐蚀的 Eb 值,说明缝
隙腐蚀更易发生。在 Eb ~ Ep 区间,对小孔腐蚀而言,原有的蚀孔可以发 展,但新的蚀孔不会产生。对裂缝腐蚀却既可以产生,也可以成长。
从腐蚀形态上:小孔腐蚀的蚀孔窄而深,缝隙腐蚀则较广而浅。
小孔的形状取决于腐蚀溶液、金属的性质、组织、结构。
二、小孔腐蚀的机理 小孔腐蚀的过程包括:①在钝态金属表面的成核;②小孔的成长。在某些条 件下,小孔内的金属表面重新钝化。 (一)小孔腐蚀的诱导
小孔腐蚀的初始阶段称为诱导阶段
如果金属表面的钝化膜吸附了溶液中的活性阴离子(如氯离子),氯离子
能优先地吸附在钝化膜上,把氧原子排挤掉,即所谓的竞争吸附,结果与
对于具有自钝化特性的不锈钢,在含 Cl 的中性介质中,其缝隙腐蚀的敏感 性比铁、碳钢更高。腐蚀机理与碳钢大同小异。如1Cr13不锈钢在含氧的氯 化物中性溶液中的缝隙腐蚀分为四个阶段。 (1)初期,在缝隙内外不锈钢表面发生如下反应:
随后 O2 扩散进入缝隙的速度愈来愈慢,而缝隙内的不锈钢表面为了维持 其钝态电流,很快耗尽缝内溶液中的 O2 ,此时,仍处于钝化状态。 (2) O 耗尽后,阴极反应移到缝隙外部,使缝外与缝内不锈钢表面组成闭
FeCl2 H2O Fe(OH) 2H 2Cl 2
缝隙内溶液PH值下降 溶液酸化+氯离子
缝内金属的阳极溶解
更多的氯离子迁入
氯化物的水解
氯化物的浓度增大
如此循环往复,形成了一个闭塞电池自催化过程,使缝内金属的溶解不断 加剧。当缝隙内腐蚀增加时,使邻近表面的阴极过程(氧的还原)速度增 加,故此外部表面得到阴极保护。
《金属局部腐蚀》PPT课件

不均一性。
(2) 阳极区和阴极区的电化学条件差异在腐
蚀过程中一直保持下去。
精选PPT
返回
11
1.电 偶 腐 蚀
发生电偶腐蚀的几种情况 电偶腐蚀的影响因素 防止电偶腐蚀的措施
精选PPT
12
电偶腐蚀 :由电极为不同材料的双金 属组成原 池的作用引起的。
• 1.1发生电偶腐蚀的几种情况 (1)异金属部件的组合。 (2)金属镀层。
精选PPT
返回
8
主要类型
(1)晶间腐蚀、缝隙腐蚀 (2)电偶腐蚀、氢损伤、细菌腐蚀、杂散电流腐蚀 (3)小孔腐蚀、选择性腐蚀 (4)应力腐蚀、磨损腐蚀
精选PPT
返回
9
危害性
局部腐蚀破坏有如下特征 : • 复杂性 • 集中性 • 突发性
精选PPT
返回
10
发生局部腐蚀的条件
(1) 金属方面或溶液方面存在较大的电化学
以奥氏体系类的钢由18%铬-8%镍为基本组成,各元素
的加入量变化的不同,而开发各种用途的钢种。
1. 以化学成分分类:
①. Cr系列:铁素体系列、,
• 2. 以金相组织的分类: ①. 奥氏体不锈钢 Cr18Ni9(304) 又称:18-8型 ②. 铁素体不锈钢 Cr17、 Cr25Ti
极面积。 • (4)设计时还要安装一块比电偶接触的两块金属更负
的第三种金属,把容易更换的部分作为阳极。
精选PPT
27
2.点 腐 蚀
2.1现象和特性
定义:在一定介质条件下,腐蚀集中于 金属表面上的个别点或很小区域内,并深 入到金属内部,一般孔深大于孔径 —称 点腐蚀(孔腐蚀)。
精选PPT
28
精选PPT
精选PPT
(2) 阳极区和阴极区的电化学条件差异在腐
蚀过程中一直保持下去。
精选PPT
返回
11
1.电 偶 腐 蚀
发生电偶腐蚀的几种情况 电偶腐蚀的影响因素 防止电偶腐蚀的措施
精选PPT
12
电偶腐蚀 :由电极为不同材料的双金 属组成原 池的作用引起的。
• 1.1发生电偶腐蚀的几种情况 (1)异金属部件的组合。 (2)金属镀层。
精选PPT
返回
8
主要类型
(1)晶间腐蚀、缝隙腐蚀 (2)电偶腐蚀、氢损伤、细菌腐蚀、杂散电流腐蚀 (3)小孔腐蚀、选择性腐蚀 (4)应力腐蚀、磨损腐蚀
精选PPT
返回
9
危害性
局部腐蚀破坏有如下特征 : • 复杂性 • 集中性 • 突发性
精选PPT
返回
10
发生局部腐蚀的条件
(1) 金属方面或溶液方面存在较大的电化学
以奥氏体系类的钢由18%铬-8%镍为基本组成,各元素
的加入量变化的不同,而开发各种用途的钢种。
1. 以化学成分分类:
①. Cr系列:铁素体系列、,
• 2. 以金相组织的分类: ①. 奥氏体不锈钢 Cr18Ni9(304) 又称:18-8型 ②. 铁素体不锈钢 Cr17、 Cr25Ti
极面积。 • (4)设计时还要安装一块比电偶接触的两块金属更负
的第三种金属,把容易更换的部分作为阳极。
精选PPT
27
2.点 腐 蚀
2.1现象和特性
定义:在一定介质条件下,腐蚀集中于 金属表面上的个别点或很小区域内,并深 入到金属内部,一般孔深大于孔径 —称 点腐蚀(孔腐蚀)。
精选PPT
28
精选PPT
精选PPT
金属腐蚀与防护课件——局部腐蚀

(2) 极化性能
一般说来,在阴极性金属M1上去极化剂还 原反应愈容易进行,即阴极反应极化性 能愈弱,阳极性金属M2的电偶腐蚀效 应愈大,造成的破坏愈严重。 析氢腐蚀 在发生析氢腐蚀的环境,与低氢过电位的 阴极性金属接触,将造成阳极性金属发生 严重的电偶腐蚀。
●●
E
io
c
(io )` c
E
lgig
1100
温 度 摄 氏 度 (0 )
1000
900
800
700
600
不发生晶间腐蚀区
500
400 0.015 0.15 1.5 15 150 1500
加热时间(小时)
0.05%C-18.48%Cr-9.34%Ni不锈钢的晶间腐蚀范围(TTS曲线)
(根据Cihal et al.)试验方法:CuSO4+H2SO4+Cu屑,24小时
Cr-Ni不锈钢管
钢
钢上镀锌进行阴极 保护
工作介 质侧 管板 胀管部位
水侧
电偶腐蚀应用于金 属防护
用碳钢进行阴极保护,防止Cr-Ni不锈 钢热交换管发生应力腐蚀破裂 表示易产生破裂部位
3. 晶间腐蚀
晶间腐蚀指腐蚀主要发生在金属材料的晶 粒间界区,沿着晶界发展,即晶界区溶解 速度远大于晶粒溶解速度。 • 发生晶间腐蚀的电化学 条件 (1)晶粒和晶界区的组织不同,因而电化 学性质存在显著差异。——内因 (2)晶粒和晶界的差异要在适当的环境下 才能显露出来。 ——外因
• 孔蚀的引发
孔蚀的形成可分为引发和成长(发展)两个阶段。 在钝态金属表面上,蚀孔优先在一些敏感位置上 形成,这些敏感位置(即腐蚀活性点)包括: (1) 晶界(特别是有碳化物析出的晶界),晶格缺 陷。 (2) 非金属夹杂,特别是硫化物,如FeS、MnS, 是最为敏感的活性点。 (3) 钝化膜的薄弱点(如位错露头、划伤等)。
第六章局部腐蚀ppt课件
(4) 溶液的电阻
通常阳极金属腐蚀电流的分布是不均匀的,距离接合部愈 远,腐蚀电流越小,原因是电流流动要克服电阻,所以溶液电 阻大小影响“有效距离〞效应。电阻越大则“有效距离〞效应
越小(5。) 介质的电导率
介质电导率的高低直接影响阳极区腐蚀电流分布的不均匀性。 因为电流总是趋向于沿电阻最小的路径流动。实际观察电偶腐蚀 破坏的结果表明,阳极体的破坏最严重处是在不同金属接触处附 近。距离接触处越远,腐蚀电流越小,腐蚀就越轻。
• (d〕pH值
在较宽的pH值范围内,孔蚀电位Eb与溶液pH值 关系不大。当pH﹥10,随pH值升高,孔蚀电位
增大,即在碱性溶液中,金属孔蚀倾向较小。 (e〕温度 温度升高,金属的孔蚀倾向增大。当温度低于某 个温度,金属不会发生孔蚀。这个温度称为临界 孔蚀温度(CPT) ,CPT愈高,则金属耐孔蚀性能 愈好。
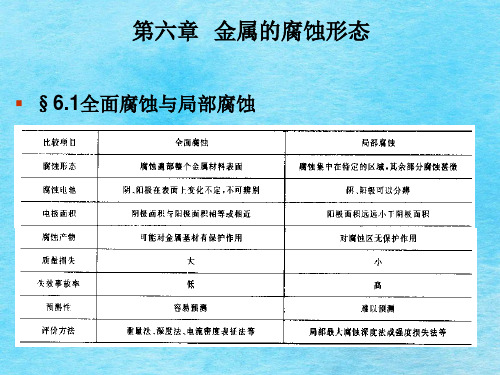
第六章 金属的腐蚀形态
▪ §6.1全面腐蚀与局部腐蚀
§6-2 电偶腐蚀〔Galvanic corrosion)
▪ 1.电偶腐蚀现象及概念 ▪ (1〕景象
示 意 图
▪ (2〕概念
▪ 异种金属在同一介质中接触,由于腐蚀电位 不相等有电偶电流流动,使电位较低的金属 溶解速度增加,造成接触处的电位较低的金 属溶解速度增大而发生的局部腐蚀的现象。
▪ 几乎所有金属和合金。
▪ 几乎所有溶液介质都可以引起缝隙腐蚀。
▪ 与孔蚀比,同种材料的缝隙腐蚀更容易发生。
2.缝隙腐蚀的机理
缝隙腐蚀可分为初期阶段和后期阶段。
初期阶段,缝内外的全部表面上发生金属的溶解和阴极的氧还原为氢氧离子的反应。
阳极反应: M→Mn++ ne 阴极反应 :O2+2H2O+4e→4OH -
(3〕金属材料 几乎所有的金属材料都会发生缝隙腐蚀 , 钝态的金属对缝隙钝态的金属材料在含氯 化物的溶液中容易发生,造成典型的局部腐蚀。 ②孔蚀和缝隙腐蚀成长阶段的机理都可以用闭 塞电池自催化效应说明。
通常阳极金属腐蚀电流的分布是不均匀的,距离接合部愈 远,腐蚀电流越小,原因是电流流动要克服电阻,所以溶液电 阻大小影响“有效距离〞效应。电阻越大则“有效距离〞效应
越小(5。) 介质的电导率
介质电导率的高低直接影响阳极区腐蚀电流分布的不均匀性。 因为电流总是趋向于沿电阻最小的路径流动。实际观察电偶腐蚀 破坏的结果表明,阳极体的破坏最严重处是在不同金属接触处附 近。距离接触处越远,腐蚀电流越小,腐蚀就越轻。
• (d〕pH值
在较宽的pH值范围内,孔蚀电位Eb与溶液pH值 关系不大。当pH﹥10,随pH值升高,孔蚀电位
增大,即在碱性溶液中,金属孔蚀倾向较小。 (e〕温度 温度升高,金属的孔蚀倾向增大。当温度低于某 个温度,金属不会发生孔蚀。这个温度称为临界 孔蚀温度(CPT) ,CPT愈高,则金属耐孔蚀性能 愈好。
第六章 金属的腐蚀形态
▪ §6.1全面腐蚀与局部腐蚀
§6-2 电偶腐蚀〔Galvanic corrosion)
▪ 1.电偶腐蚀现象及概念 ▪ (1〕景象
示 意 图
▪ (2〕概念
▪ 异种金属在同一介质中接触,由于腐蚀电位 不相等有电偶电流流动,使电位较低的金属 溶解速度增加,造成接触处的电位较低的金 属溶解速度增大而发生的局部腐蚀的现象。
▪ 几乎所有金属和合金。
▪ 几乎所有溶液介质都可以引起缝隙腐蚀。
▪ 与孔蚀比,同种材料的缝隙腐蚀更容易发生。
2.缝隙腐蚀的机理
缝隙腐蚀可分为初期阶段和后期阶段。
初期阶段,缝内外的全部表面上发生金属的溶解和阴极的氧还原为氢氧离子的反应。
阳极反应: M→Mn++ ne 阴极反应 :O2+2H2O+4e→4OH -
(3〕金属材料 几乎所有的金属材料都会发生缝隙腐蚀 , 钝态的金属对缝隙钝态的金属材料在含氯 化物的溶液中容易发生,造成典型的局部腐蚀。 ②孔蚀和缝隙腐蚀成长阶段的机理都可以用闭 塞电池自催化效应说明。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
精品jing
6金属局部腐蚀重要s02
局部腐蚀形式多样性 — 电偶腐蚀、缝隙腐蚀、小孔腐 蚀(点腐蚀)、晶间腐蚀、应力腐蚀开裂等。
局部腐蚀普遍性 —工业中局部腐蚀很常见(全面腐蚀 10%),局部腐蚀(化工)80%,因此对局部腐蚀的 研究和防护尤为重要。
局部腐蚀危害性 — 腐蚀集中在个别位置急剧发生、腐 蚀破坏快速、隐蔽性强、难以预计、控制难度大、危害 大,易突发灾难事故
• 温度上升, 点腐蚀数增加,达到90℃溶解氧减少,点蚀 速度下降
• 介质流动能降低点蚀速度,氧浓度增加,钝化加强
• 改善传质可消除闭塞效应和自催化作用,减缓点蚀发展。
(2)材料因素
• 不同金属耐点蚀能力显著不同,Al Fe Ni Zr Cr Ti • 钝性金属对点蚀比较敏感 • 合金元素:Cr、Mo、Si、Cu、Ni等能有效提高耐点蚀性 • C、Mn、S 可使点蚀敏感性增大 • 固溶处理,消除缺陷、夹杂、二次相、晶间相,可提高耐点蚀性 • 敏化处理,则导致点蚀倾向性增大 • 表面状态对点蚀发生影响很大,粗糙、表面夹杂、机械损伤、位 错露头等对耐点蚀不利。
2.晶间腐蚀理论 (1)贫化理论 在敏化温度,过饱和C化合物 Cr23C6 在晶界析出,其周 围形成贫Cr 区,因Cr在晶界扩散比在晶粒扩散速快,使晶 界Cr很快耗尽(阳极),与晶粒形成活化/ 钝化电偶电池,发 生阳极选择性腐蚀,促使晶间腐蚀的发生。
(2)晶界杂质或第二相选择性溶解理论
贫化理论不能解析全部现象,如:温度、超低碳不锈钢 等。又提出:FeCr 金属间化合物 相,在一定条件下在晶 界沉淀, 相在过钝化电位可发生严重选择性腐蚀。如Al- Zn-Mg合金,晶界析出MgZn2,Mg5Al3而发生选择溶解。
两种理论相互补充,能解释较多晶间腐蚀形象。奥氏体 不锈钢在氧化性介质(充气海水)、MgCl2(普遍,严重)、 强氧化性介质-HNO3(浓),Na2Cr2O7等容易发生晶间腐蚀。
4..晶间腐蚀控制
(1)降低合金含碳量, 如发展超低碳不锈钢(成本高);
(2)加入稳定元素, 如Ti,Nb,对碳亲合力大,优先形成 碳化物;
(2) 晶界析出易溶相,如Al3Mg2,Mg2Si等溶解,产生晶 间腐蚀;
(3)位错或空位在晶界积累,导致杂质或缺陷集中; (4)晶界应力较大; (5)多晶金属材料晶界活性较大,易于发生晶界吸附、 晶界沉积等反应;
(6)热加工处理过程在晶界新相生成。
电化学因素: • 晶界与晶粒平衡电位差异,造成电化学腐蚀速度不一; • 晶界与晶粒阳极极化率不一, 或腐蚀阻力不一; • 介质中氧化剂在晶界和晶粒位置还原行为差异或腐蚀阻 力不一。
5. 点腐蚀控制
(1)选择耐点蚀合金/ 增加有利合金元素; (2)电化学保护/ 控制电位低于Ep; (3)表面处理/ 改变表面状态; (4)添加缓蚀剂,如:NO3-,CrO42-,Cr2O72-,SO42-等 (5)消除侵蚀性阴离子,如Cl—等。
缝隙腐蚀影响因素
• 金属材料 — 钝化能力/再钝化能力。 • 环境因素 — 含Cl- 浓度越高,越易发生缝隙腐蚀,卤素离子是引起缝隙 腐蚀危险离子,敏感性为 Cl- > Br- > I-。 溶解氧大于0.5ppm, 即可引起缝隙腐蚀。 一般温度越高,发生缝隙腐蚀倾向性越大。
§5.4 晶间腐蚀 晶间腐蚀 — 晶粒边界比晶粒本体腐蚀快得多,危害性大。 晶间腐蚀在宏观上不易察觉,金属甚至保持光泽,但强度可完 全消失。不锈钢,Al,Ni,Cu合金等易发生晶间腐蚀。
1.晶间腐蚀条件 金属学因素:
(Байду номын сангаас) 晶界异相析出,元素贫乏区形成,如:不锈钢因形 成 (Cr,Fe)23C6而导致贫Cr区;铜合金CuAl2,导致贫Cu;
- 不锈钢 -铝
• 氧化性金属离子促进点蚀,如:Fe3+、Cu2+、Hg2+(FeCl3, CuCl2)加速金属离子还原,相当于施加阳极电位; • 含氧阴离子抑制点蚀,如:OH—、SO2—4、NO3—,可排 斥Cl—吸附,抑制点蚀能力:OH— NO3— SO2—4 ClO4— • pH对点蚀发生过程影响较大,而对发展过程影响较小
影响点蚀因素
• 材料因素— 金属或合金的性质、缺陷状态、表面特性等 • 环境因素— 介质性质、pH、温度、流速等
(1)环境因素
腐蚀介质类型:NaCl,CaCl2可促进溶解氧还原(阴极过 程),Cl—侵蚀性强,诱发促进点腐蚀发生/发展
卤素(侵蚀性)离子浓度影响大, 存在临界离子浓度:
Ep = -0.088 lg a Cl— + 0.108 (V) Ep = -0.124 lg a Cl— - 0.0504 (V)
电偶腐蚀
• 在同一介质中,异种金属相互接触,电偶电势 差异 — 电偶腐蚀
• 电偶腐蚀在化工/日常生活中很普遍现象
• 电偶腐蚀 — 金属电极构成宏观腐蚀电池
• 电位较低的金属腐蚀增大,电位较高的金属腐 蚀速度减小
3. 电偶腐蚀的控制
正确选材,避免异种金属或电偶序差大金属接触 保持阴/阳极面积合适比例,避免大阴极、小阳极 异种金属接触时应加以绝缘; 表面处理、涂覆可使电偶效应减少; 应用缓蚀剂,可有效防止电偶腐蚀。
点腐蚀 (孔腐蚀)
▪ 最常见的一种局部腐蚀形式 ▪ 点蚀随机分布,孔径:微米-毫米 ▪ 孔口有腐蚀产物覆盖或开放式 ▪ 点蚀失重甚微,但对设备破坏很严重 ▪ 点蚀可诱发其它形式的局部腐蚀, SCC、晶间腐蚀的起源 ▪ 点蚀一般发生在具钝性的金属表面(如不锈钢、铝…) ▪ 表面缺陷、硫化物夹杂可诱发点蚀 —— 材料 ▪ Cl—等阴离子对点蚀可产生直接促进作用 —— 环境。
缝蚀与点蚀特点/区别
(1)所有金属/介质体系均可发生缝蚀 (2)缝隙腐蚀起源是几何因素和氧浓差 (3)缝蚀比点腐蚀一般更易发生 (4)缝蚀与点蚀发展过程类似,但发生过程不同 (5)点蚀可成为缝蚀源
缝隙腐蚀的控制
(1)合理设计和施工,避免缝隙,连接处密封、涂覆、妥善 排流,清除沉积物。
(2)电化学保护 (3)缓蚀剂 (4)改善介质环境 (5)选择耐缝蚀合金
(3)固溶处理,使碳化物溶解(1050-1100℃),然后快速冷 却,特别是对焊件处理(快焊快冷);
6金属局部腐蚀重要s02
局部腐蚀形式多样性 — 电偶腐蚀、缝隙腐蚀、小孔腐 蚀(点腐蚀)、晶间腐蚀、应力腐蚀开裂等。
局部腐蚀普遍性 —工业中局部腐蚀很常见(全面腐蚀 10%),局部腐蚀(化工)80%,因此对局部腐蚀的 研究和防护尤为重要。
局部腐蚀危害性 — 腐蚀集中在个别位置急剧发生、腐 蚀破坏快速、隐蔽性强、难以预计、控制难度大、危害 大,易突发灾难事故
• 温度上升, 点腐蚀数增加,达到90℃溶解氧减少,点蚀 速度下降
• 介质流动能降低点蚀速度,氧浓度增加,钝化加强
• 改善传质可消除闭塞效应和自催化作用,减缓点蚀发展。
(2)材料因素
• 不同金属耐点蚀能力显著不同,Al Fe Ni Zr Cr Ti • 钝性金属对点蚀比较敏感 • 合金元素:Cr、Mo、Si、Cu、Ni等能有效提高耐点蚀性 • C、Mn、S 可使点蚀敏感性增大 • 固溶处理,消除缺陷、夹杂、二次相、晶间相,可提高耐点蚀性 • 敏化处理,则导致点蚀倾向性增大 • 表面状态对点蚀发生影响很大,粗糙、表面夹杂、机械损伤、位 错露头等对耐点蚀不利。
2.晶间腐蚀理论 (1)贫化理论 在敏化温度,过饱和C化合物 Cr23C6 在晶界析出,其周 围形成贫Cr 区,因Cr在晶界扩散比在晶粒扩散速快,使晶 界Cr很快耗尽(阳极),与晶粒形成活化/ 钝化电偶电池,发 生阳极选择性腐蚀,促使晶间腐蚀的发生。
(2)晶界杂质或第二相选择性溶解理论
贫化理论不能解析全部现象,如:温度、超低碳不锈钢 等。又提出:FeCr 金属间化合物 相,在一定条件下在晶 界沉淀, 相在过钝化电位可发生严重选择性腐蚀。如Al- Zn-Mg合金,晶界析出MgZn2,Mg5Al3而发生选择溶解。
两种理论相互补充,能解释较多晶间腐蚀形象。奥氏体 不锈钢在氧化性介质(充气海水)、MgCl2(普遍,严重)、 强氧化性介质-HNO3(浓),Na2Cr2O7等容易发生晶间腐蚀。
4..晶间腐蚀控制
(1)降低合金含碳量, 如发展超低碳不锈钢(成本高);
(2)加入稳定元素, 如Ti,Nb,对碳亲合力大,优先形成 碳化物;
(2) 晶界析出易溶相,如Al3Mg2,Mg2Si等溶解,产生晶 间腐蚀;
(3)位错或空位在晶界积累,导致杂质或缺陷集中; (4)晶界应力较大; (5)多晶金属材料晶界活性较大,易于发生晶界吸附、 晶界沉积等反应;
(6)热加工处理过程在晶界新相生成。
电化学因素: • 晶界与晶粒平衡电位差异,造成电化学腐蚀速度不一; • 晶界与晶粒阳极极化率不一, 或腐蚀阻力不一; • 介质中氧化剂在晶界和晶粒位置还原行为差异或腐蚀阻 力不一。
5. 点腐蚀控制
(1)选择耐点蚀合金/ 增加有利合金元素; (2)电化学保护/ 控制电位低于Ep; (3)表面处理/ 改变表面状态; (4)添加缓蚀剂,如:NO3-,CrO42-,Cr2O72-,SO42-等 (5)消除侵蚀性阴离子,如Cl—等。
缝隙腐蚀影响因素
• 金属材料 — 钝化能力/再钝化能力。 • 环境因素 — 含Cl- 浓度越高,越易发生缝隙腐蚀,卤素离子是引起缝隙 腐蚀危险离子,敏感性为 Cl- > Br- > I-。 溶解氧大于0.5ppm, 即可引起缝隙腐蚀。 一般温度越高,发生缝隙腐蚀倾向性越大。
§5.4 晶间腐蚀 晶间腐蚀 — 晶粒边界比晶粒本体腐蚀快得多,危害性大。 晶间腐蚀在宏观上不易察觉,金属甚至保持光泽,但强度可完 全消失。不锈钢,Al,Ni,Cu合金等易发生晶间腐蚀。
1.晶间腐蚀条件 金属学因素:
(Байду номын сангаас) 晶界异相析出,元素贫乏区形成,如:不锈钢因形 成 (Cr,Fe)23C6而导致贫Cr区;铜合金CuAl2,导致贫Cu;
- 不锈钢 -铝
• 氧化性金属离子促进点蚀,如:Fe3+、Cu2+、Hg2+(FeCl3, CuCl2)加速金属离子还原,相当于施加阳极电位; • 含氧阴离子抑制点蚀,如:OH—、SO2—4、NO3—,可排 斥Cl—吸附,抑制点蚀能力:OH— NO3— SO2—4 ClO4— • pH对点蚀发生过程影响较大,而对发展过程影响较小
影响点蚀因素
• 材料因素— 金属或合金的性质、缺陷状态、表面特性等 • 环境因素— 介质性质、pH、温度、流速等
(1)环境因素
腐蚀介质类型:NaCl,CaCl2可促进溶解氧还原(阴极过 程),Cl—侵蚀性强,诱发促进点腐蚀发生/发展
卤素(侵蚀性)离子浓度影响大, 存在临界离子浓度:
Ep = -0.088 lg a Cl— + 0.108 (V) Ep = -0.124 lg a Cl— - 0.0504 (V)
电偶腐蚀
• 在同一介质中,异种金属相互接触,电偶电势 差异 — 电偶腐蚀
• 电偶腐蚀在化工/日常生活中很普遍现象
• 电偶腐蚀 — 金属电极构成宏观腐蚀电池
• 电位较低的金属腐蚀增大,电位较高的金属腐 蚀速度减小
3. 电偶腐蚀的控制
正确选材,避免异种金属或电偶序差大金属接触 保持阴/阳极面积合适比例,避免大阴极、小阳极 异种金属接触时应加以绝缘; 表面处理、涂覆可使电偶效应减少; 应用缓蚀剂,可有效防止电偶腐蚀。
点腐蚀 (孔腐蚀)
▪ 最常见的一种局部腐蚀形式 ▪ 点蚀随机分布,孔径:微米-毫米 ▪ 孔口有腐蚀产物覆盖或开放式 ▪ 点蚀失重甚微,但对设备破坏很严重 ▪ 点蚀可诱发其它形式的局部腐蚀, SCC、晶间腐蚀的起源 ▪ 点蚀一般发生在具钝性的金属表面(如不锈钢、铝…) ▪ 表面缺陷、硫化物夹杂可诱发点蚀 —— 材料 ▪ Cl—等阴离子对点蚀可产生直接促进作用 —— 环境。
缝蚀与点蚀特点/区别
(1)所有金属/介质体系均可发生缝蚀 (2)缝隙腐蚀起源是几何因素和氧浓差 (3)缝蚀比点腐蚀一般更易发生 (4)缝蚀与点蚀发展过程类似,但发生过程不同 (5)点蚀可成为缝蚀源
缝隙腐蚀的控制
(1)合理设计和施工,避免缝隙,连接处密封、涂覆、妥善 排流,清除沉积物。
(2)电化学保护 (3)缓蚀剂 (4)改善介质环境 (5)选择耐缝蚀合金
(3)固溶处理,使碳化物溶解(1050-1100℃),然后快速冷 却,特别是对焊件处理(快焊快冷);
