高中化学竞赛专题考试--氧化还原反应、电化学
氧化还原反应和电化学反应

氧化还原反应和电化学反应氧化还原反应是化学反应中最为重要和常见的反应之一。
它涉及到物质中的电子转移过程。
在氧化还原反应中,物质可以同时发生氧化和还原。
与之相伴随的是电化学反应,电化学反应是指在化学反应中涉及电子的转移和电流的流动的反应。
一、氧化还原反应氧化还原反应中,氧化和还原是同时进行的。
氧化是指物质失去电子;还原则是指物质获得电子。
这一过程中,电子从一个物质转移到另一个物质。
氧化和还原总是同时发生,因为电子不能独立存在。
例如,当铁和氧气发生反应时,铁原子(Fe)失去两个电子,被氧(O2)接受,生成氧化铁(Fe2O3)。
这里,铁原子发生了氧化,而氧气发生了还原。
氧化还原反应在日常生活中非常常见。
例如,金属的生锈、水的电解、电池的工作原理等都是氧化还原反应的例子。
二、电化学反应电化学反应是指在化学反应中涉及电子的转移和电流的流动的反应。
它是由氧化还原反应导致的。
电化学反应可以分为两种类型:电解反应和电池反应。
1. 电解反应电解反应是指在电解池中,通过外加电压使化学反应发生。
在电解过程中,正极(阳极)接受电子,发生氧化反应;负极(阴极)释放电子,发生还原反应。
电解反应在工业生产和实验室中广泛应用。
例如,电解盐水时,氯离子(Cl-)在阳极上接受电子,发生氧化反应生成氯气(Cl2),而阳离子(Na+)在阴极上释放电子,发生还原反应生成氢气(H2)。
2. 电池反应电池反应是指在电化学电池内,将化学能转化为电能的反应。
电池由两个半电池组成,每个半电池都有一个氧化反应和一个还原反应。
半电池之间通过电子流进行电荷平衡。
常见的电池包括干电池、蓄电池和燃料电池等。
干电池是通过将氧化剂和还原剂隔离,以阻止反应直接进行,并通过电子在电路中流动来提供电能。
蓄电池是通过可逆的氧化还原反应来存储和释放电能。
燃料电池是通过将燃料和氧气直接反应生成电能。
总结:氧化还原反应和电化学反应密切相关,涉及到电子转移和电流的流动。
氧化还原反应是物质中的电子转移过程,分为氧化和还原。
化学竞赛专题考试--电化学
高中化学竞赛专题考试氧化还原反应、电化学(本卷共130分。
考试时间3小时)班级: 姓名:1.008Zr Nb Mo T cRu Rh Pd Ag Cd In S n S b T e I Hf T a W Re OsIr Pt Au Hg T l Pb Bi Po At Ac-Lr HLi BeB C N O F NaMg Al S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e BrRb Cs Fr S r Ba RaY LaLu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt一 选择题(每题只有1个正确选项,每题1.5分,共30分。
)1、医学专家提出人体中细胞膜内的葡萄糖和细胞膜外的富氧液体与细胞膜构成了微型的生物原电池,有关该原电池的下列说法中,正确的是 ( )A.正极的电极反应可能是O 2+4e →2O 2-,且正极附近溶液的pH 值升高。
B.正极的电极反应可能是O 2+2H 2O +4e →4OH -,且正极附近溶液的pH 值降低。
氧化还原反应、电化学
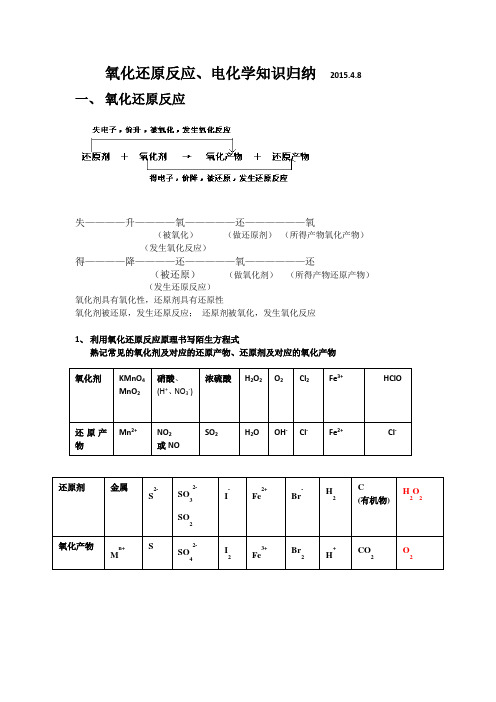
氧化还原反应、电化学知识归纳 2015.4.8一、 氧化还原反应失————升————氧—————还——————氧(被氧化) (做还原剂) (所得产物氧化产物)(发生氧化反应)得————降————还—————氧——————还(被还原) (做氧化剂) (所得产物还原产物) (发生还原反应)氧化剂具有氧化性,还原剂具有还原性氧化剂被还原,发生还原反应; 还原剂被氧化,发生氧化反应1、 利用氧化还原反应原理书写陌生方程式熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物氧化剂 KMnO 4 MnO 2 硝酸、 (H +、NO 3-) 浓硫酸 H 2O 2 O 2Cl 2 Fe 3+ HClO还原产物Mn 2+ NO 2 或NO SO 2 H 2O OH - Cl - Fe 2+ Cl - 还原剂 金属S 2- SO 32- SO 2I - Fe 2+ Br - H 2 C (有机物) H 2O 2氧化产物M n+ S SO 42- I 2 Fe 3+ Br 2 H + CO 2 O 22、建立氧化还原反应方程式的书写模型二、电化学(一)原电池1、原电池正负极的判断:① 、据电极材料:较活泼的电极材料——负极;较不活泼的电极材料——正极(一般规律)②、据电极发生的反应:失电子——负极;负——失——氧(氧化反应)得电子——正极;正——得——还(还原反应)③、根据电流方向或电子流向:电流(外电路),由正极流向负极;电子则由负极经内电路流向原电池的正极。
④ 、、据内电路离子的迁移方向:阳离子流向电池正极.阴离子流向原电池负极。
2、电极反应式的书写(1)根据总反应或者题目的提示,找出氧化剂、还原剂以及对应的产物(2)正极发生还原反应,氧化剂+ n e-==还原产物负极发生氧化反应,还原剂—n e-== 氧化产物(3)利用化合价升降守恒推出正确的转移电子数(4)反应式两端添加电解质中存在的离子,使反应式电荷守恒(5)利用元素守恒写出完整的电极反应式(二)、电解池1、电解池阴阳极的判断:① 、据电源的正负极判断:阳极——与电源的正极相连;阴极——与电源的负极相连②、据电极发生的反应:失电子——阳极;阳(极)——失——氧(氧化反应)得电子——阴极;阴(极)——得——还(还原反应)③、据内电路离子的迁移方向:阳离子流向电解池阴极.阴离子流向电解池阳极。
化学竞赛辅导--氧化还原反应规律和应用
例:2H2S+SO2=3S+2H2O 例:4XNH3+6NOX=催=△化=剂==(3+2X)N2+6XH2O 例:NaH+H2O=NaOH+H2↑
例:C+CO2△=2CO 例:Fe+2Fe3+=3Fe2+ 例:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O 上述反应中氧化产物与还原产物的物质的量 之比分别是多少?
CD
2、先强后弱规律
同一氧化剂(或还原剂)同时与不同还原剂 (或氧化剂)反应,当还原剂(或氧化剂) 的浓度差别不大时,总是先与还原性(或氧 化性)强的反应,然后再与还原性(或氧化 性)弱的反应。即按照强弱顺序依次进行。
“五大”还原性离子及还原性的强 弱S2->SO32->I->Fe2+>Br-
写出溴化亚铁和碘化亚铁混合溶液中逐滴 加入Cl2水时的离子方程式
C
二、强弱规律
1、前强后弱规律
对于自发的氧化还原反应(除高温、电解 条件等),总是强氧化性物质和强还原性 物质反应生成弱氧化性物质和弱还原性物 质。即氧化剂的氧化性强于氧化产物的氧 化性,还原剂的还原性强于还原产物的还 原性。
例:根据反应式: (1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+, 可判断离子的还原性从强到弱的顺序是
⑶升高温度,氧化性、还原性增强
浓硫酸加热有明显的氧化性
例如: KMnO4在酸性介质中,还原成Mn2+ (无色)
KMnO4在中性介质中,还原成MnO2 (棕黑色)
KMnO4在碱性介质中,还原MnO42(绿色)
全国高中生化学竞赛试题4 氧化还原反应与电化学

氧化还原反应与电化学(全国初赛)第1题(8分)Mn 2+离子是KMnO 4溶液氧化H 2C 2O 4的催化剂。
有人提出反应历程为:Mn(VII) Mn(VI) Mn(IV) Mn(III) Mn (C 2O 4)n 3 2n Mn 2+ + CO 2Mn(II)Mn(II)Mn(II) C 2O 42请设计2个实验方案来验证这个历程是可信的(只需给出设计思想)。
(2001年第6题)第2题(11分)设计出燃料电池使汽油氧化直接产生电流是21世纪最富有挑战性的课题之一。
最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入汽油蒸气,电池的电解质是掺杂了Y 2O 3的ZrO 2固体,它在高温下能传导O 2-离子。
回答如下问题:2-1以丁烷代表汽油,这个电池放电时发生反应的化学方程式是。
2-2这个电池的正极发生的电极反应式是①;负极发生的电极反应式是②;固体电解质里的O 2–的移动方向是③;向外电路释放电子的电极是④。
2-3人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是______。
2-4你认为在ZrO 2晶体里掺杂Y 2O 3,用Y 3+代替晶体里部分的Zr 4+对提高固体电解质的导电能力会起什么作用?其可能的原因是什么?(2001年第12题)2-5汽油燃料电池最大的障碍是氧化反应不完全,产生堵塞了电极的气体通道。
有人估计,完全避免这种副反应至少还需10年时间,这正是新一代化学家的历史使命。
第3题(5分)镅(Am )是一种用途广泛的錒系元素。
241Am 的放射性强度是镭的3倍,在我国各地商场里常常可见到241Am 骨密度测定仪,检测人体是否缺钙;用241Am 制作的烟雾监测元件已广泛用于我国各地建筑物的火警报警器(制作火警报警器用的1片241Am 批发价在我国仅10元左右)。
镅在酸性水溶液里的氧化态和标准电极电势(E /V )如下,图中2.62是Am 4+/Am 3+的标准电极电势,-2.07是Am 3+/Am 的标准电极电势,等等。
化学竞赛辅导资料——氧化还原反应

氧化还原反应竞赛专题讲义一.什么叫标准电极电位?在使用标准电极电位表时应了解哪些问题?电极电位是表示某种离子或原子获得电子而放还原的趋势。
如将某一金属放入它的溶液中(规定溶液中金属离子的浓度为lm),在25℃时,金属电极与标准氢电极(电极电位指定为零)之间的电位差,叫做该金属的标准电极电位。
表7-2列出一些金属、非金属以及同一种金属具有不同价态的离子的标准电极电位,这些数值都是与标准氢电极比较而得出的。
为了能正确使用标准电极电位表(课本或化学手册上均有较详细的表),现将有关的一些问题叙述如下:(1)在M n++ne M电极反应中,M叫做物质的还原态。
M n+叫做物质的氧化态,物质的还原态和氧化态构成氧化还原电对。
电对也常用符号来表示,例如Zn2+/Zn是一个电对,Cu2+/Cu也是一个电对等。
(2)在表中所列的标准电极电位的正、负数值,不因电极反应进行的方向而改变。
例如,不管电极反应是按Zn2++2e=Zn,还是按Zn=Zn2++2e的方式进行,电对(Zn2+/Zn或Zn/Zn2+)的标准电极电位总是负号,(3)在表中,物质的还原态的还原能力自下而上依次增强;物质的氧化态的氧化能力自上而下依次增强。
具体地说,电对的电极电位数值越小,在表中的位置越高,物质的还原态的还原能力越强,电对的电极电位数值越大,在表中的位置越低,物质的氧化态的氧化能力越强。
例如电对Zn2+/Zn的标准电极电位的数值为-0.76伏较Cu2+数值+0.34伏为小,所以Zn原子较Cu原子容易失去电子,即Zn是较强的还原剂。
(4)物质的还原态的还原能力越强,其对应的氧化态的氧化能力就越弱;物质氧化态的氧化能力越强,其对应的还原态的还原能力就越弱。
例如表7—2中K是最强的还原剂,其对应的K+则是最弱的氧化剂,F2是最强的氧化剂,其对应的F-则是最弱的还原剂。
(5)只有电极电位数值较小的物质的还原态与电极电位数值较大的物质的氧化态之间才能发生氧化还原反应,两者电极电位的差别越大,反应就进行得越完全。
氧化还原反应和电化学

2006年化学竞赛讲义氧化还原反应和电化学(初赛版)化学竞赛大纲对氧化还原反应和电化学知识的要求:电化学:1、氧化态。
氧化还原的基本概念和反应的书写和配平。
2、原电池。
电极符号、电极反应、原电池符号、原电池反应。
3、标准电极电势。
用标准电极电势判断反应的方向及氧化剂与还原剂的强弱。
4、元素电势图及其应用5、电解池的电极符号与电极反应。
6、电解与电镀。
7、电化学腐蚀。
8、常见化学电源。
9、pH、络合剂、沉淀剂对氧化还原反应的影响的定性说明。
概述电化学反应可分为两类:(1)利用自发氧化还原反应产生电流(原电池),反应△G<0,体系对外做功。
(2)利用电能促使非自发氧化还原反应发生(电解),反应△G>0,环境对体系做功。
一、氧化还原反应的基本概念(一).氧化还原反应的实质1.氧化还原反应无机化学反应一般分为两大类,一类是在反应过程中,反应物之间没有电子的转移或得失,如酸碱反应、沉淀反应,它们只是离子或原子间的相互交换;另一类则是在反应过程中,反应物之间发生了电子的得失或转移,这类反应被称之为氧化还原反应。
氧化还原反应的实质是电子的得失和转移,元素氧化数的变化是电子得失的结果。
元素氧化数的改变也是定义氧化剂、还原剂和配平氧化还原反应方程式的依据。
2.氧化数1970年国际纯化学和应用化学学会(IUPAC)定义氧化数(oxidation number)的概念为:氧化数(又称氧化值)是某元素一个原子的荷电数,这种荷电数是将成键电子指定给电负性较大的原子而求得。
确定元素原子氧化数有下列原则:(1)单质的氧化数为零。
因为同一元素的电负性相同,在形成化学键时不发生电子的转移或偏离。
例如S8中的S,Cl2中的Cl,H2中的H,金属Cu、Al等,氧化数均为零。
(2)氢在化合物中的氧化数一般为I,但在活泼金属的氢化物中,氢的氧化数为-I,如NaH-I。
(3)氧在化合物中的氧化数一般为-Ⅱ,但在过氧化物中,氧的氧化数为-I,如H2O -I、BaO-I 2;在超氧化物中,氧的氧化数为-I/2,如KO-I/22;在氟的氧化物中,氧的氧2化数为Ⅱ,如OⅡF2。
高中化学竞赛课程 无机化学第十章 氧化还原和电化学

(2) 1/2Cl2 + e
Cl-
Cl- + 3H2O E10 = +1.45V E20 = +1.36V
试求(3) ClO3– + 6H+ + 5e
1/2Cl2 + 3H2O
E30 = ?
解:
反应(3) = (1) – (2)
G
0 3
=
G
0 1
–
G
0 2
0
0
0
E3 E1 – E2
– n3FE30 = – n1FE10 – (– n2FE20) 5E30 = 6E10 – E20
例
写出反应
Mg + 2H+
Mg2+ + H2
的电池符号、电极反应和电池反应。
答: 电池符号: 电极反应:
( ) Mg | Mg2+ (c1) || H+(c2) | H2(p), Pt ( + )
( ) Mg 2e ( + ) 2H+ + 2e
Mg2+ H2
惰性电极
电池反应: Mg + 2H+
Cr2O72-
2Cr3+
H2O2 + 2H+ + 2e = 2H2O
H2O2
H2O
氧化数: 指化合物中某元素的形式荷电数.
在单质或化合物中,假设把每个化学键中的电子指定给所 连接的两原子中电负性较大的一个原子,这样所得的某元 素一个原子的电荷数就是该元素的氧化数。
规定:(1) 单质中,元素的氧化数为零。如白磷P4
位反应时,必须在氧化还原半反应中表示出来。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017年学军中学高中化学竞赛专题考试氧化还原反应、电化学(本卷共130分。
考试时间3小时)班级: 姓名:1.008Zr Nb Mo T c Ru Rh Pd Ag Cd In S n S b T e I Hf T a W Re Os Ir Pt Au Hg T l Pb Bi Po At Ac-Lr H Li Be B C N O F Na Mg Al S i P Cl S K Ca S c T i V Cr Mn Fe Co Ni Cu Zn G a G e As S e Br Rb Cs Fr S r Ba Ra Y LaLu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar Kr Xe Rn 相对原子质量Rf Db Sg Bh Hs Mt一 选择题(每题只有1个正确选项,每题1.5分,共30分。
)1、医学专家提出人体中细胞膜内的葡萄糖和细胞膜外的富氧液体与细胞膜构成了微型的生物原电池,有关该原电池的下列说法中,正确的是 ( )A.正极的电极反应可能是O 2+4e →2O 2-,且正极附近溶液的pH 值升高。
B.正极的电极反应可能是O 2+2H 2O +4e →4OH -,且正极附近溶液的pH 值降低。
C.负极反应主要是C 6H 12O 6-12e →6CO +12H +,且负极附近溶液的pH 值降低。
D.负极反应主要是C 6H 12O 6+12OH --12e →6CO 2+6H 2O ,且负极附近溶液pH 值降低。
2在配平P 4+CuSO 4+H 2O →Cu 3P+H 3PO 4+ H 2SO 4时,H 2O 前面的化学计量数应为 ( )A.60B.70C.85D.963 在配平的下列反应中,□H 3AsO 4(aq)+□Zn(s)+□H +(aq)+□H 2O(aq)→□AsH 3 (g) +□Zn(H 2O)42+(aq), H 2O 前面的系数为A.8B.12C.16D.204某温度下,将Cl 2通入NaOH 溶液,反应后得到NaCl 、NaClO 、NaClO 3的混合物。
经测定ClO -与ClO 3-的浓度之比为1:3,则Cl 2与NaOH 溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为A.21:5B.11:3C. 3:1D.4:15.2003年2月1日,美国哥伦比亚号航天飞机在返回地面的途中坠毁,举世震惊。
该航天飞机用铝粉和高氯酸铵(NH 4C1O 4)的混合物为固体燃料,点燃时铝粉氧化放热,引发高氯酸铵反应,产生N 2、Cl 2、O 2和H 20并放出大量的热。
下列对此反应的叙述中正确的是 ( )A .上述反应瞬间产生大量的高温气体推动飞机飞行B .在反应中高氯酸铵只起氧化剂作用C .其方程式可表示为2 NH 4C1O 4=N 2↑+4H 20+C12↑ +O 2↑D .上述反应中反应物的总能量小于生成物的总能量6 三聚氰酸[C 3N 3(OH)3]可用于消除汽车尾气中的NO 2。
其反应原理为:C 3N 3(OH)3−→−∆HNCO HNCO +NO 2−→−∆N 2+CO 2+H 2O 下列说法中正确的是A. C 3N 3(OH)3与HNCO 为同一种物质B. HNCO 是一种很强的氧化剂C . 反应中NO 2是还原剂D .1mol NO 2在反应中转移4mol 电子7. 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200o C 左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。
电池总反应为:C 2H 5OH +3O 22CO 2 +3H 2O ,电池示意如右图,下列说法不正确...的是 A.a 极为电池的负极B.电池工作时电流由b 极沿导线经灯泡再到a 极C.电池正极的电极反应为:4H + + O 2 + 4e -== 2H 2OD.电池工作时,1mol 乙醇被氧化时就有6mol 电子转移8、据报道,美国正在研究用锌蓄电池取代目前广泛使用的铅蓄电池,它具有容量大的特点,其电池反应为2Zn+O 2==2ZnO 其原料为锌粉、电解液和空气。
则下列叙述正确的是( )。
A .锌为正极,空气进入负极B .负极反应为+=-22Zn e ZnC .电解液肯定不是强酸D .正极发生氧化反应9.目前人们正研究开发一种高能电池——钠硫电池,它是以熔融的钠、硫为两极,以Na +导电的β-Al 2O 3陶瓷作固体电解质,反应为:2Na +xS Na 2S x ,以下说法正确的是 A .放电时,钠作负极,硫作正极 B .放电时,钠极发生还原反应C .充电时,钠极与外电源的正极相连,硫极与外电源的负极相连D .充电时,阴极发生的反应是:S x 2--2e =xS10. 下列电对中,E θ值最小的是:A: Ag +/Ag ; B: AgCl/Ag ; C: AgBr/Ag ; D: AgI/Ag11. E θ(Cu 2+/Cu +)=0.158V ,E θ(Cu +/Cu)=0.522V ,则反应 2 Cu + Cu 2+ + Cu 的K θ为:A: 6.93×10-7 B: 1.98×1012 C: 1.4×106 D: 4.8×10-1312. 下列都是常见的氧化剂,其中氧化能力与溶液pH 值的大小无关的是:A: K 2Cr 2O 7 B: PbO 2 C: O 2 D: FeCl 313. 下列电极反应中,有关离子浓度减小时,电极电势增大的是:A: Sn 4+ + 2e- = Sn 2+ B: Cl 2+2e- = 2Cl - C: Fe - 2e- = Fe 2+ D: 2H + + 2e- = H 214. 下列电极反应,其它条件不变时,将有关离子浓度减半,电极电势增大的是( )A. Cu 2++2e -=CuB. I 2+2e -=2I -C. Fe 3+ +e -=Fe 2+D. Sn 4++2e -=Sn 2+15. 当溶液中增加〔H +〕时,氧化能力不增强的氧化剂是( )A. NO 3-B. Cr 2O 72-C. O 2D. AgCl16. 对于银锌电池:(-)Zn │Zn 2+(1mol ·L -1)‖Ag +(1mol ·L -1)│Ag(+),已知E °Zn 2+/Zn =-0.76V, E °Ag+/Ag =0.799V,该电池的标准电动势是( )A. 1.180VB. 0.076VC. 0.038VD. 1.56V17. 原电池 (-)Pt │Fe 2+(1mol ·L -1),Fe 3+(0.0001mol ·L -1)‖I -(0.0001mol ·L -1),I 2│Pt (+) 电动势为( )已知:E °Fe 3+/Fe 2+=0.77V , E °I /I =0.535VA. 0.358VB. 0.239VC. 0.532VD. 0.412V18. 电池反应为:2Fe 2+(1mol ·L -1)+I 2=2Fe 3+(0.0001mol ·L -1)+2I - (0.0001mol ·L -1)原电池符号正确的是( )A.(-)Fe │Fe 2+(1mol ·L -1),Fe 3+(0.0001mol ·L -1)‖I -(0.0001mol ·L -1),I 2│Pt(+)B.(-)Pt │Fe 2+(1mol ·L -1),Fe 3+(0.0001mol ·L -1)‖I -(0.0001mol ·L -1)│I 2(s)(+)C.(-)Pt │Fe 2+(1mol ·L -1),Fe 3+(0.0001mol ·L -1)‖I -(0.0001mol ·L -1),I 2│Pt(+)D.(-)Pt │I 2,I -(0.0001mol ·L -1)‖Fe 2+(1mol ·L -1),Fe 3+(0.0001mol ·L -1)│Pt(+)19. 元素电势图E A °: 1.15 1.29┌———ClO 2——┐1.19 ┃ 1.21 ┃ 1.64ClO 4-————ClO 3-——————HClO 2————HClO判断发生歧化反应倾向最大的物质是( )A. ClO 4-B. ClO 3-C. HClO 2D. ClO 220. 利用E A °:1.21 1.645 1.63ClO 3-————HClO 2——————HClO ————Cl 2求E °ClO3-/Cl2的计算式正确的是( )A. E °ClO3-/Cl2=(5×1.21+3×1.645+1×1.63)/9B. E °ClO3-/Cl2=(2×1.21+2×1.645+1×1.63)/5C. E °ClO3-/Cl2=(1.21+1.645+1.63)/3D. E °ClO3-/Cl2=(2×1.21+2×1.645+1×1.63)/3二 填空题、计算题、简答题。
(共100分)21、(10分)配平下列离子氧化–还原反应(1) A n + B x - → A y - + B m(2) Cl 2 + OH - → ClO -n + Cl -+ H 2O (3) BiO -3 + Mn 2+ + H + → Bi 3++ MnO -4 + H 2O (4) VO +2 + H 2C 2O 4·2H 2O + H + → VO 2++ CO 2↑+ H 2O (5)MnO -4 + C 3H 7OH → Mn 2+ + C 2H 5COOH (酸性介质)22、(5分)有一原电池:Zn(s) | Zn 2+(aq)‖MnO -4 (aq),Mn 2+(aq) | Pt若pH =2.00,c (MnO -4)=0.12mol ·L -1, c (Mn 2+)=0.001mol ·L -1, c (Zn 2+)=0.015mol ·L -1, T =298K 。
