温度和气体动理论
第四章气体动理论总结

第四章⽓体动理论总结第四章⽓体动理论单个分⼦的运动具有⽆序性布朗运动⼤量分⼦的运动具有规律性伽尔顿板热平衡定律(热⼒学第零定律)实验表明:若 A 与C 热平衡 B 与C 热平衡则 A 与B 热平衡意义:互为热平衡的物体必然存在⼀个相同的特征--- 它们的温度相同定义温度:处于同⼀热平衡态下的热⼒学系统所具有的共同的宏观性质,称为温度。
⼀切处于同⼀热平衡态的系统有相同的温度。
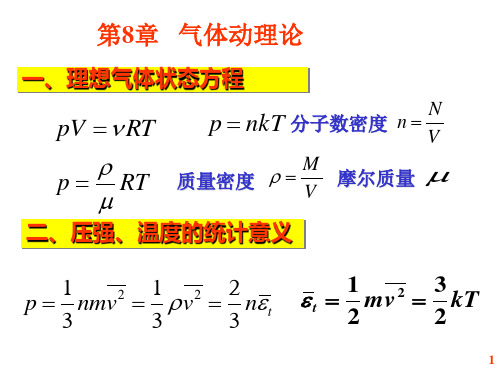
理想⽓体状态⽅程: 形式1:mol M PV =RT =νRTM形式2:222111T V p T V p =形式3: nkT P =n ----分⼦数密度(单位体积中的分⼦数) k = R/NA = 1.38*10 –23 J/K----玻⽿兹曼常数在通常的压强与温度下,各种实际⽓体都服从理想⽓体状态⽅程。
§4-2 ⽓体动理论的压强公式VNV N n ==d d 1)分⼦按位置的分布是均匀的2)分⼦各⽅向运动概率均等、速度各种平均值相等kj i iz iy ix iv v v v ++=分⼦运动速度单个分⼦碰撞器壁的作⽤⼒是不连续的、偶然的、不均匀的。
从总的效果上来看,⼀个持续的平均作⽤⼒。
2213212()323p nmvp n mv n ω===v----摩尔数R--普适⽓体恒量描述⽓体状态三个物理量: P,V T 压强公式122ω=mv理想⽓体的压强公式揭⽰了宏观量与微观量统计平均值之间的关系,说明压强具有统计意义;压强公式指出:有两个途径可以增加压强 1)增加分⼦数密度n 即增加碰壁的个数2)增加分⼦运动的平均平动能即增加每次碰壁的强度思考题:对于⼀定量的⽓体来说,当温度不变时,⽓体的压强随体积的减⼩⽽增⼤(玻意⽿定律);当体积不变时,压强随温度的升⾼⽽增⼤(查理定律)。
从宏观来看,这两种变化同样使压强增⼤,从微观(分⼦运动)来看,它们有什么区别?对⼀定量的⽓体,在温度不变时,体积减⼩使单位体积内的分⼦数增多,则单位时间内与器壁碰撞的分⼦数增多,器壁所受的平均冲⼒增⼤,因⽽压强增⼤。
气体的温度与分子运动

气体的温度与分子运动气体是物质存在的状态之一,其特点是分子之间的间隔较大,分子运动自由而混乱。
气体的温度与分子运动之间存在着密切的关系,温度的升高会使气体分子的运动速度增加,而温度的降低则会导致气体分子的运动速度减慢。
本文将探讨气体的温度与分子运动之间的关系,并从微观角度解释这一现象。
一、气体的分子运动气体分子是以高速无规则运动的方式存在的。
根据动理论,气体分子不断地做无规则的热运动,具有三种基本运动状态:平动、转动和振动。
其中平动是最主要的运动形式,指的是分子在容器内的直线运动。
分子的平动速度与运动趋势是完全随机的,没有特定的方向。
二、气体温度的概念气体温度是指气体中分子热运动状态的一种表征,它反映了气体分子的平均动能。
温度的高低决定了分子热运动的剧烈程度。
通常,我们使用摄氏度(℃)或开尔文(K)来表示气体的温度。
三、温度与分子平均动能的关系根据气体动理论,气体分子的平均动能与温度成正比。
具体来说,当温度升高时,气体分子的平均动能也会增加;反之,温度降低时,气体分子的平均动能减少。
这是因为温度的增加意味着气体分子获得更多的热能,分子的平均速度也会增加。
在恒定体积下,气体分子的速度增加意味着分子碰撞的频率增加,分子间碰撞的力量也会增强。
同时,分子速度的增加也增加了分子与容器壁之间的碰撞频率和力量,从而增加了气体的压力。
四、温度与分子速度的关系温度与气体分子速度之间存在一定的关系。
根据麦克斯韦-玻尔兹曼分布定律,分子速度与温度之间的关系可以用以下公式表示:v = √(2kT/m)其中,v代表气体分子的速度,k为玻尔兹曼常数,T为温度,m为气体分子的质量。
由于速度与温度成正比,所以当温度升高时,分子速度也会增加。
这与我们前面提到的气体分子的平均动能与温度成正比的结论相一致。
五、温度对气体性质的影响温度的变化对气体性质有着明显的影响。
温度的升高会使气体分子的运动更加剧烈,气体分子之间碰撞的频率和力量增加,导致气体的压力增大。
气体动理论

17
§2.1.3理想气体的温度
1.宏观意义:冷热程度,是决定某一系统 与另一系统是否处于热平衡的宏观标志。
2.微观意义:由状态方程可得
pV = N RT NA
状态方程:
p=
N V
R NA
T = nkBT
波尔兹曼常数:
kB
=
R NA
= 1.38 10-23 J
K -1
18
温度的统计意义
p = 2 nω 3
p = nkT
ω = 3 kT 2
此式称为理想气体分子温度公式. 温度的统计意义:
(1)温度是分子平均平动动能的量度,反映无 规则热运动的剧烈程度;
(2)温度是大量分子集体表现,对个别分子 温度没有意义。
相等。
2.气体分子沿各方向运动的概率相等 即分子速度在各方向上分量的各种平均值相
等。
在直角坐标系中有: vx2 = vy2 = vz2
vx2 + vy2 + vz2 = v2
vx2
=
vy2
=
vz2
=
1 v2 3
11
§2.1.2理想气体的压强
1.产生
固体、液体的 :重力原因 气体压强:大量分子不断碰撞的结果。
单个分子碰撞器壁的作用力是不 连续的、偶然的、不均匀的。从 总的效果上来看,分子碰撞对器 壁产生一个持续的平均作用力。
PA=F/SA
12
2 .理想气体压强公式的导出
公式导出 见图:
PA=F/SA
长方形容器内分子总数为N。
设分子质量为m,速率为vx、vy、vz;
气体动理论公式总结

气体动理论公式总结气体动理论是研究气体分子在微观层面上的运动规律的一门学科。
它主要研究气体分子的速度、能量、碰撞等方面的性质。
气体动理论公式是描述气体分子运动规律的数学表达式,可以用来计算气体分子的平均速度、平均能量等参数。
下面将总结一些常见的气体动理论公式。
1. 理想气体状态方程理想气体状态方程描述了理想气体在一定温度、压力和体积下的状态关系。
它的数学表达式为:PV = nRT其中,P为气体的压力,V为气体的体积,n为气体的摩尔数,R为气体常数,T为气体的温度。
2. 平均动能公式平均动能公式描述了气体分子的平均动能与温度之间的关系。
它的数学表达式为:K = (3/2)kT其中,K为气体分子的平均动能,k为玻尔兹曼常数,T为气体的温度。
3. 动量-速度关系动量-速度关系描述了气体分子的动量与速度之间的关系。
它的数学表达式为:p = mv其中,p为气体分子的动量,m为气体分子的质量,v为气体分子的速度。
4. 均方根速度公式均方根速度公式描述了气体分子的速度分布规律。
它的数学表达式为:v = √(3kT/m)其中,v为气体分子的均方根速度,k为玻尔兹曼常数,T为气体的温度,m为气体分子的质量。
5. 平均自由程公式平均自由程公式描述了气体分子在运动过程中与其他分子或壁面碰撞的平均距离。
它的数学表达式为:λ = (1/√2πd^2n)其中,λ为气体分子的平均自由程,d为气体分子的直径,n 为气体分子的密度。
6. 分子碰撞频率公式分子碰撞频率公式描述了气体分子碰撞的频率与气体分子数密度之间的关系。
它的数学表达式为:Z = 4πn(d^2)v其中,Z为气体分子的碰撞频率,n为气体分子的数密度,d 为气体分子的直径,v为气体分子的速度。
以上是一些常见的气体动理论公式总结,它们可以用来描述气体分子的运动规律和性质。
利用这些公式,我们可以进行气体的热力学计算和分析,深入理解气体的特性和行为。
同时,这些公式也为相关实验提供了理论基础,促进了气体动理论的发展。
大学物理学第7章气体动理论(Temperature)

4
研究对象:大量无规则热运动气体分子构成的系统 研究内容:物质与冷热有关的性质及这些性质的变化
对象特点:单个分子 无序性、偶然性、遵循力学规律 整体(大量分子):服从统计规律
mvx
l2
立直角坐标系。
a
O
-mvx
X
(2)选任意一个分子a作为研
究对象,求其对A1面的压力 Z
l1
分子“a” 的速度:
分子“ a”碰撞器壁A1面一次所受的冲量:
由牛顿第三定律可知,器壁A1面受分子碰撞一次所受的冲量:
23
分子“ a”相继碰撞器壁A1面两次所用的时间为: 单位时间内,分子“ a”与器壁A1面碰撞的次数为: 单位时间内,分子“ a”对器壁A1面的冲量即冲力为:
如压强 p、体积 V、温度 T等 .
平衡态:一定量的气体,在不受外界的影响下, 经过一 定的时间, 系统达到一个稳定的, 宏观性质不随时间变 化的状态称为平衡态 .(理想状态)
平衡态的特点
( p,V ,T )
p
*( p,V ,T )
o
V
1)单一性(
处处相等);
2)物态的稳定性---与时间无关;
3)自发过程的终点;
(2)在平衡态下,分子按位置的分布是均匀的 n dN N
则各处分子数密度是相同的。
dV V
(3) 分子速度指向任何方向的机会是一样, 或分子速度按方向的分布是均匀的。
vx2 vy2 vz2
各个方向的速度分量的平均值相等。
vx 2
v1 x 2
理想气体分子平均平动动能与温度的关系

(2)M m 一 N A 32 10”6.02 1023-5.31 10 kg 四、理想气体分子平均平动动能与温度的关系 (可以用一个公式加以概括)1 ~ 3;k = mv kT 2 2 1 -2 3所以:-mv 2 = 3 kT2 2 这就是理想气体分子的平均平动动能与温度的关系,是气体动理论的另一个基本公式。
它表明分子的平均平动动能与气体的温度成正比。
气体的温度越高,分子的平均平动动能越 大;分子的平均平动动能越大, 分子热运动的程度越剧烈。
因此,温度是表征大量分子热运 动剧烈程度的宏观物理量,是大量分子热运动的集体表现。
对个别分子,说它有多少温度, 是没有意义的。
从这个式子中我们可以看出2.温度的统计意义该公式把宏观量温度和微观量的统计平均值(分子的平均平动动能)联系起来,从而揭示了温度的微观本质。
关于温度的几点说明 ,1 — 3^ _ 1 — 一一 亠1•由一mv kT 得T =0, ; = — mv 0 ,气体分子的热运动将停止。
然而事实上是绝2 2 2对零度是不可到达的(热力学第三定律),因而分子的运动是用不停息的。
2.气体分子的平均平动动能是非常小的。
T =300K, .;. =10 ② JT =108K,I =10 45J 5例1. 一容器内贮有氧气,压强为 P=1.013 X 10 Pa ,温度t=27 C ,求(1 )单位体积内的分 子数;(2)氧分子的质量;(3)分子的平均平动动能。
解:(1 )有 P=nkT2.45 10 m kT 1.38 10寰 27 273 1.简单推导:理想气体的物态方程: PV RT NmN A E RT而 p ,n ^m/丄 mV 2 3 12 丿 3V 12 丿 n=N/V 为单位体积内的分子数,即分子数密度,k =RN A =1.38 X 10-23J K-1称为玻尔斯曼常量。
关键:1) 把m 与M 用单个分子的 质量表示; 2) 引入分子数密度; 3) 引入Boltzmann 常量1.013 1053 3 23 21(3)「尹 r 1.38 10一(27 273) =6.21 1°一J例2.利用理想气体的温度公式说明Dalton分压定律。
气体动理论公式总结
1.自由度i=t+r
单原子分子 i=t=3
刚性双原子 i=t+r=3+2 刚性三原子i=t+r=3+3
2.分子平均平动动能
t
t 2
kT
3 2
kT
3.分子平均转动动能
r
r 2
kT
4.分子平均动能
k
i kT 2
5.气体内能
E
i RT
2
i pV 2
2
四、麦克斯韦速率分布律
1.速率分布函数: f (v) dN Ndv
3、均匀带电无限长直导线
E 2 0 r
4.半径为R的均匀带电球面
E外
q
4 0r 2
E内 0
q
q
U外 4 0r U内 40R
5.无限大均匀带电平面
E
2 0
15
七、静态平衡时的导体 1. 导体内部场强为0。导体表面附近场强方向与导
体表面垂直。 2.导体为等势体(电势处处相等)。
3. 导体内无电荷,所有电荷分布于表面。
(1)
D dS q0 电场的高斯定律
(2)
E dl
L
S
B
d
S
电 场 的
环路定理
t
(变化的磁场激发电场)
(3) B d S 0
磁场的高斯定律
(4)
S
H dl
L
Ic
d D
dt
Ic
D dS t
磁 场 的 环 路 定 理 (变化的电场激发磁场)
27
第13 章量子物理
一、黑体辐射
v2 b v2 f (v)dv / b f (v)dv
a
6-1平衡态 温度 理想气体状态方程

6–1平衡态 温度 理想气体状态方程 1 2、宏观状态和微观状态 、 (1)宏观描述 )
第六章 气体动理论
宏观状态: 宏观状态:由大量微观粒子所组成的系统整体在 大范围内所体现的状态。 大范围内所体现的状态。 宏观量: 宏观量: 所有可观测的反映了大量分子的集体特 性的物理量, 性的物理量,称之为宏观 量。如:P、 、 V、T。 、 。
热力学
气体动理论
6–1平衡态 温度 理想气体状态方程 1
第六章 气体动理论
教学基本要求
了解气体分子热运动的图像 理解平衡态、 理解平衡态 一 了解气体分子热运动的图像 .理解平衡态、 平衡过程、理想气体等概念. 平衡过程、理想气体等概念 理解理想气体的压强公式和温度公式 理想气体的压强公式和温度公式, 二 理解理想气体的压强公式和温度公式, 通 过推导气体压强公式,了解从提出模型、 过推导气体压强公式,了解从提出模型、进行统计 平均、建立宏观量与微观量的联系, 平均、建立宏观量与微观量的联系,到阐明宏观量 的微观本质的思想和方法 . 能从宏观和微观两方面 理解压强和温度等概念 . 了解系统的宏观性质是微 观运动的统计表现 .
2 体积 V : 气体所能达到的最大空间(几何 气体所能达到的最大空间( 描述) 描述). 3 3 3 3 单位: 单位: 1m = 10 L = 10 dm 3 温度 T : 气体冷热程度的量度(热学描述). 气体冷热程度的量度(热学描述 描述) 单位: 单位:温标 K 开尔文). (开尔文) T = 273 + t
宏观量
实验经验总结, 给出宏观物体热现象的规律, 实验经验总结, 给出宏观物体热现象的规律, 从能量观点出发, 从能量观点出发,分析研究物态变化过程中热功转 换的关系和条件 . 特点 1)具有可靠性; )具有可靠性; 2)知其然而不知其所以然; )知其然而不知其所以然; 3)应用宏观参量 . )
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Temperature
本章主要内容
§17-1 平衡态 §17-2 温度的概念 §17-3 理想气体温标 §17-4 理想气体状态方程 §17-5 气体分子的无规则运动 §17-6 理想气体的压强 §17-7 温度的微观意义 §17-8 能均分定理 §17-9 Maxwell速率分布律 §17-10 Boltzmann分布律 §17-11 实际气体等温线 §17-12 Van der Waals方程 §17-13 平均碰撞频率和平均自由程 §17-14输运过程
Ttr 273.16K 设有一定量理想气体,它在水的三相点温度下的压强和
体积分别为ptr和Vtr,则有
pV ptrVtr (一定量)
T
Ttr
h
T
pV ptrVtr
Ttr
273 .16
pV ptrVtr
(K)
定体温度计 V = Vtr T 273 .16K ptr p
定压温度计 p = ptr T 273 .16 K Vtr V
1K = 水的三相点的热力学温度的1/273.16。 可以证明,理想气体温标在其所能确定的温度范围内,与 热力学温标完全一致。都用T 表示、K 作单位。
摄氏温标 (Celsius): t(C) T - 273.15 华氏温标 (Fahrenherit):t(F) 32 5 t(C)
9
1C 1K 1F 5 K 9
理想气体——严格遵从Boyle定律的气体,是一种理想
模型。(p 0 时实际气体的近似)。
理想气体温标
对于理想气体,可以规定:pV T (一定量),于是有
pV 常量 (一定量)
T
§1-3 理想气体温标
规定一个标准温度定点——纯水的三相点,即:冰、水、 汽共存的系统所达到的平衡态。统一规定三相点的温度为:
Concept of Temperature
压强和体积不是热学特有的物理量(力学量和几何量), 而温度是。(当两个具有相同压强和体积的气体,但它们的热 力学性质并不完全相同。)因此,必须引入一个新的描述气体 热力学性质的物理量,即温度。
温度是平衡态的参量,也是区别不同平衡态的重要标志。 因此先引入热平衡概念:
共同热力学性质,可以引入一个物理量来描述这种物理性质,即:
温度——决定一个系统是否与其他系统处于热平衡的宏观性质。
说明:
借助热力学第零定律引入温度概念,这是宏观上对 温度的定性定义。 处于热平衡的诸个系统具有相同的温度。 温度的测量也是基于热力学第零定律实现的。
§1-2 温度的概念
§17-3 理想气体温标
第17章 温度和气体动理论
热力学系统 在热学中,通常把与热现象相关的宏观物体称为热力学 系统。 系统以外的物体称为外界。
从统计物理的角度说,热力学系统必须由大量分子原子组 成,它们服从统计规律。
第一章 温度
§17-1 平衡态
Equilibrium State
宏观量与微观 量
描述宏观系统状态的物理量称为宏观量,也称为状态参 量。如:气体的状态参量有压强、体积和温度。
Temperature Scale of an Ideal Gas
为对温度定量测量,就必须用数值来表示温度。标定温度
数值的方法称为温标。理想气体温标是其中的一种。
Boyle定律和理想气体
Boyle定律:当压强很小时,对于一定量气体,在温度不
变的条件下,它的压强与体积成反比,即
pV = 常量 (一定量,T 不变)
理想气体温标存在一个最低温度的极限。如选择氦气He 最低极限为1K。
§1-3 理想气体温标
热力学温标 摄氏和华氏温标
气体温标虽不依赖于气体的个性,但毕竟依赖于某种测 温物质,而温度本身并不要求如此。在热力学第二定律的基础
上,可以引入一种不依赖于任何测温物质特性的温标,即热 力学温标(也称Kelvin温标),用此温标确定的温度称为热 力学温度。单位:K(Kelvin)
中,只有两个是独立的,状态参量之间必定满足一个函数——
气体的状态方程。
p
Fp,V ,T 0
理论上常用(p, V)来表示某
平衡态的状态,因此可以用图上的
实点来代表确定的平衡态。
O
.(p, V) V
从一个平衡态到另一个平衡态的变化过程,称为热力学过 程。 准静态过程 非准静态过程
§1-1 平衡态
§17-2 温度的概念
质不随时间改变的状态。(如气体的压强、体积和温度不随时间变) 宏观稳定但微观运动不停息,且纷乱无规——动态平衡 平衡态时热学中一个十分重要的概念。 《大学物理》课程中涉及的热学,主要是讨论气体在平衡
态下的性质及其变化规律。
§1-1 平衡态
气体的状态方程
实验表明,气体处于平衡态时,三个状态参量 p、V、T
热平衡的概念
两个原为孤立系统分别达到了平衡态,相互接触(容器的 导热面接触,可相互交换能量)后,各自的状态会发生变化,
经足够长时间又达到新的平衡态,称这两个系统处于热平衡。
导热板
导热板
绝热板
抽去绝热隔板
§1-2 温度的概念
热力学第零定律与温度
定律:如果系统A与系统C处于热平衡,同时B系统也与
系统C处于热平衡,则系统A与系统B也处于热平衡。 定律表明,任意两个系统处于热平衡,意味着它们具有某种
§1-3 理想气体温标
§17-4 理想气体状态方程
Equation of State气体(p 0),取标准状态(p0, T0)为参考:
p0 1atm 1.01325105 Pa T0 273.15K (水的冰点温度)
描述分子原子运动状态的物理量称为微观量。如:分子
的运动速率、动量、动能等。
Avogadro常数:NA = 6.0221023 / mol (1mol任何物质
的分子数)。一般分子的限度在10-9m以下。因此,一个热力 学系统包含大量的微观粒子。
“宏观小微观大”是指当宏观量(如体积)取很小值时, 仍包含大量的微观粒子,大到仍可以用统计方法处理。
宏观量往往相对稳定,而微观量相对随机;宏观量可以用 微观量的统计平均值来表示。
§1-1 平衡态
气体的状态参量有压强、体积和温度。定义:
压强——气体对单位面积容器壁的作用力。单位:Pa 体积——气体占据空间(容器)的体积。单位:m3
温度的概念下节讨论
平衡态
平衡态——在不受外界影响的条件下,一个系统的宏观性
