氮的氧化物优秀课件
合集下载
氮气和氮氧化物-高中化学必修二课件

氮的氧化物溶于水的计算(工业生成硝酸的启示)
2. NO2和O2混合气体通入水中
3NO2+H2O===2HNO3+NO
①
2NO+O2===2NO2
②
①×2+② 总的化学方程式为 4NO2+O2+2H2O===4HNO3
一氧化氮和二氧化氮
氮的氧化物溶于水的计算(工业生成硝酸的启示) 3. NO,NO2,O2三种气体通入水中
(2)打开弹簧夹,快速吸入10 mL空气后夹上弹 簧夹 无色气体变为红棕色,注射器活塞向左移动, 说明NO与O2 反应生成红棕色的 NO2 (3)振荡注射器 红棕色气体变为无色,NO2
溶于水生成无色的NO。
一氧化氮和二氧化氮
一氧化氮和二氧化氮
2.化学性质
NO的强还原性:
NO2与水反应:
2NO + O2 === 2NO2 遇空气立即变为红棕色
①3体积②4体积③5体积④5.5体积⑤2体积
A. ③
B. ④或⑤
C. ⑤
D. ②或⑤
一氧化氮和二氧化氮
练习
2. 在容积为672 mL的烧瓶中充满NO和NO2的混合气体,将其倒立在水槽里, 去塞后再通入280 mL氧气,恰好完全反应,且液体充满烧瓶(气体体积都已折 合为标准状况下的体积),下列有关叙述正确的是( B ) A. 总反应为NO+NO2+O2+H2O === 2HNO3 B. 总反应为4NO+8NO2+5O2+6H2O === 12HNO3 C. 生成硝酸的物质的量浓度均为0.030 mol·L-1 D. 生成硝酸的物质的量浓度约为0.060 mol·L-1
3NO2+H2O===2HNO3+NO
①
《氮的氧化物》高一必修一PPT课件(第4.3.2课时)

y>4∶3
O2过量并剩余 恰好完全反应 NO过量并剩余
高一化学精品课程(人教版)
PART FOUR
实训与提升
Please enter the table of contents text herePlease enter the table of contents text here
一、典例分析
一、氮气
1.氮气 (1)物理性质
颜色 _无__色___
气味 _无__味___
溶解性 __难____溶于水
密度 与空气接近
(2)化学性质 ①通常状况下较稳定,与其他物质不反应。 ②高温或放电时能与O2反应生成NO,化学方程式为
____________________________。
二、一氧化氮和二氧化氮
毒性
_有__毒__ _
_有__毒__ _
二、一氧化氮和二氧化氮
(3)化学性质 ①常温下,NO不稳定,易与O2化合生成NO2,化学方程式 为___2_N__O_+__O_2_=_2_N_O__2__; ②NO2溶于水时与水发生反应,化学方程式为 _3_N_O__2+__H_2_O__=_2_H_N_O__3+__N_O__。
高一化学精品课程(人教版)
第四章 非金属及其化合物
第三节 硫和氮的氧化物
第2课时 氮的氧化物
高一化学精品课程(人教版)
01 学习的目标 01 氮和氮的氧化物 01 氮的氧化物溶于水的计算 01 实训与提升
高一化学精品课程(人教版)
PART ONE
学习的目标
Please enter the table of contents text herePlease enter the table of contents text here
氮氧化物的产生及转化课件优秀课件

氮氧化物的产生及转化课件
第二单元
生产生活中的含氮化合物
空气中氮气的体积分数78%,氧气的体积分 数22%,还有少量的CO2及稀有气体。氮气 是空气的主要成分,氮元素是组成蛋白质的
必需元素,是生命的重要组成元素。但空气
中氮元素的化学性质稳定,只有少数豆科植 物能够直接吸收转化加以利用。直到1919
列说法中正确的是 A.NO2 是氧化剂,H2O 是还原剂
( C)
B.此反应不是氧化还原反应
C.NO2 既是氧化剂又是还原剂
D.每当有 1 mol NO2 参加反应转移 2 mol 电子
9.用仪器 A、B、C 和胶管组成装置收集 NO 气体并测定产 物 NO 气体的体积(①仪器 A 气密性已经检查;②除水外 不能选用其他试剂)。
(2)化学性质
+2
得2×2e-
0
+4 -2
2NO 22N2O 失2×2e-
(3)用途: 在生物学方面有独特作用,人体中极少量的NO 会促进血管扩张,防止血栓塞等。
2.二氧化氮(NO2)
(1)物理性质: 常温下为红棕色、有刺激性气味的气体, 与水反应。在大气中达到一定浓度时有毒。
(2)化学性质
得1×2e-
N2O2 放电2NO
N23M点 g 燃 M3N g2
2。氮的氧化物的化学性质:
2NO O22N2O
3N 2O H 2O 2H3 N NO O
4N 2 O O 22H 2O4H3NNO 2O5
4N3 O O 22H 2O4H3NO
造成光化学烟雾的有害气体主要是 A.二氧化碳、碳氢化合物 B.一氧化氮和二氧化氮 C.二氧化硫 D.氟氯烃
+4
+5
+2
3N 2H O 2 O 2H 3 N NO O
第二单元
生产生活中的含氮化合物
空气中氮气的体积分数78%,氧气的体积分 数22%,还有少量的CO2及稀有气体。氮气 是空气的主要成分,氮元素是组成蛋白质的
必需元素,是生命的重要组成元素。但空气
中氮元素的化学性质稳定,只有少数豆科植 物能够直接吸收转化加以利用。直到1919
列说法中正确的是 A.NO2 是氧化剂,H2O 是还原剂
( C)
B.此反应不是氧化还原反应
C.NO2 既是氧化剂又是还原剂
D.每当有 1 mol NO2 参加反应转移 2 mol 电子
9.用仪器 A、B、C 和胶管组成装置收集 NO 气体并测定产 物 NO 气体的体积(①仪器 A 气密性已经检查;②除水外 不能选用其他试剂)。
(2)化学性质
+2
得2×2e-
0
+4 -2
2NO 22N2O 失2×2e-
(3)用途: 在生物学方面有独特作用,人体中极少量的NO 会促进血管扩张,防止血栓塞等。
2.二氧化氮(NO2)
(1)物理性质: 常温下为红棕色、有刺激性气味的气体, 与水反应。在大气中达到一定浓度时有毒。
(2)化学性质
得1×2e-
N2O2 放电2NO
N23M点 g 燃 M3N g2
2。氮的氧化物的化学性质:
2NO O22N2O
3N 2O H 2O 2H3 N NO O
4N 2 O O 22H 2O4H3NNO 2O5
4N3 O O 22H 2O4H3NO
造成光化学烟雾的有害气体主要是 A.二氧化碳、碳氢化合物 B.一氧化氮和二氧化氮 C.二氧化硫 D.氟氯烃
+4
+5
+2
3N 2H O 2 O 2H 3 N NO O
氮气及氮的氧化物课件
• [例1] 工业上利用氨氧化获得的高浓度NOx气体(含NO、NO2)制备NaNO2、NaNO3, 工艺流程如下:
• 已知:Na2CO3+NO+NO2===2NaNO2+CO2。
• (1)中和液所含溶质除NaNO2及少量Na2CO3外,还有____________(填化学式)。
• (2)中和液进行蒸发Ⅰ操作时,应控制水的蒸发量,避免浓度过大,目的是 _________________。蒸发Ⅰ产生的蒸气中含有少量NaNO2等有毒物质,不能直 接排放,将其冷凝后用于流程中的____________(填操作名称)最合理。
• ②NO与NO2按物质的量之比1:1被足量的NaOH溶液完全吸收后只得到一种钠盐, 该钠盐的化学式是______N_a_N__O_2_。
解析 (1)V(NO)+V(NO2)=3.0 L,23V(NO)+43V(NO2)=3.5 L,则 V(NO)=0.75 L, V(NO2)=2.25 L,V(NO)∶V(NO2)=1∶3。(2)②NO 中氮的化合价为+2,NO2 中氮 的化合价为+4,利用电子守恒,二者按 1∶1 混合时与 NaOH 反应生成盐的化合价 必然为+3 价,即为 NaNO2。
• (4)标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA。 ( ×)
• (5)常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA。(
)√ ×
• (6)溴蒸气和NO2都为红棕色气体,用湿润的淀粉-KI试纸可以鉴别。( )
• 2.下列说法正确的是 ( )B • A.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 • B.NO可用于某些疾病的治疗 • C.常温下,N2既能与O2反应又能与H2反应 • D.汽车尾气的主要污染成分包括NO、CO和N2
氮的氧化物上课课件 必修一(共26张PPT)

工业上常用生石灰—CaO和含硫的煤混合燃烧 主要反响为:
SO2 + CaO = CaSO3
2CaSO3 + O2 =2 CaSO4
总反响:2CaO + 2SO2 + O2 =2 CaSO4
【问题探究1】
环保部门检测收集酸雨时,pH值 在一段时间内会有什么变化?
实验步骤
现象
(1)
(2)
……
解释
科学探究
现给你一试管二氧化氮,其他药品和仪器自选。
1、请你设计实验,要求尽可能多地NO2被水吸收。
实验步骤
1
将充满NO2的试 管倒立在水槽
现象
反应方程式
红棕色逐渐消失,试3NO2+H2O=
管水位上升到2/3处2HNO3+NO
2 往试管中通入O2
无 色;色水气位体继变续成上红升棕,2NO+O2=2NO2 红棕色又消失
去污染空气,请利用今天学过的知识设计一个
合理方案来减少煤燃烧时SO2的排放量,并写 出有关方程式?
往煤中加石灰—Ca(OH)2,煤燃烧产生的SO2和石灰 产生反响生成CaSO3, CaSO3再被氧化成CaSO4, 从而减少了SO2排放量,主要反响为:
SO2 + Ca(OH)2 = CaSO3 + H2O 2CaSO3 + O2 =2 CaSO4
O2 1体积
练习:将7体积NO2和1体积O2充分混合于某烧瓶中,
然后倒立于水槽中,待液面不再变化,剩余气体是什么? 体积是多少?
NO 1体积
• 练习:同温同压下,在3支相同体积的试管
中分别充有等体积混合的2种气体,它们是 N2+3H2
2NH3
必修一第四章第三节硫和氮的氧化物全优秀课件

氯水和二氧化硫漂白性的比较
氯水
原 理 氯物水质氧中氧化H化C成漂lO无将白色有物色质
实质
氧化还原反应
效果 范围
永久性
可漂白大多数有色物 质,能使紫色石蕊试 液先变红后褪色
二氧化硫
S质O直2化溶接于结合水合漂与生有白成色不物稳
定的无色物质
非氧化还原反应
暂时性 漂白某些有色物质,不 能使紫色石蕊试液褪色 (石蕊变红)
①澄清石灰水 ②H2S溶液
③KMnO4酸性溶液 ④氯水 ⑤品红溶液
A、①②③
B、②③④
C、除①以外
D、全部
二氧化硫
练习2、下列实验能证明一定有二氧化硫存在的是
⑤ __________________________
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红溶液褪色 ④通入足量的氢氧化钠溶液,再加BaCl2溶液有白色沉淀 产生,该沉淀溶于稀盐酸 ⑤通入溴水能使溴水褪色,再滴加Ba(NO3)2溶液有白色 沉淀产生
与水 反应
二氧化碳 CO2+H2O H2CO3
二氧化硫 SO2+H2O H2SO3
与碱 CO2+Ca(OH)2=CaCO3↓+H2O SO2+Ca(OH)2=CaSO3↓+H2O 反应 CO2+NaOH =Na2CO3+H2O SO2+NaOH =Na2SO3+H2O
与碱 性氧 化物 反应
高温
CO2+CaO==CaCO3
N2占空气体 积的4/5左 右,通常情 况下不与氧 气反应。
NO不溶于 水,常温下 易于氧气结 合生成NO2
放电或高温
N2 + O2 =======2NO
氯水
原 理 氯物水质氧中氧化H化C成漂lO无将白色有物色质
实质
氧化还原反应
效果 范围
永久性
可漂白大多数有色物 质,能使紫色石蕊试 液先变红后褪色
二氧化硫
S质O直2化溶接于结合水合漂与生有白成色不物稳
定的无色物质
非氧化还原反应
暂时性 漂白某些有色物质,不 能使紫色石蕊试液褪色 (石蕊变红)
①澄清石灰水 ②H2S溶液
③KMnO4酸性溶液 ④氯水 ⑤品红溶液
A、①②③
B、②③④
C、除①以外
D、全部
二氧化硫
练习2、下列实验能证明一定有二氧化硫存在的是
⑤ __________________________
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红溶液褪色 ④通入足量的氢氧化钠溶液,再加BaCl2溶液有白色沉淀 产生,该沉淀溶于稀盐酸 ⑤通入溴水能使溴水褪色,再滴加Ba(NO3)2溶液有白色 沉淀产生
与水 反应
二氧化碳 CO2+H2O H2CO3
二氧化硫 SO2+H2O H2SO3
与碱 CO2+Ca(OH)2=CaCO3↓+H2O SO2+Ca(OH)2=CaSO3↓+H2O 反应 CO2+NaOH =Na2CO3+H2O SO2+NaOH =Na2SO3+H2O
与碱 性氧 化物 反应
高温
CO2+CaO==CaCO3
N2占空气体 积的4/5左 右,通常情 况下不与氧 气反应。
NO不溶于 水,常温下 易于氧气结 合生成NO2
放电或高温
N2 + O2 =======2NO
氮的氧化物PPT教学课件

B.N2 D. O2
梅花
病梅馆记
龚自珍
◇检查预习◇
1.介绍作者龚自珍和本文写作 背景。
2.这是一篇什么体裁的文章? 3.写了什么内容?表达了怎样的思 想感情?
◇检查预习◇
1.龚 自 珍(1792-1841)
字 璱人 ,号 定盦 ,清 代仁和 (浙江杭州市)人。我国近代杰出 的 思想 家、 文学家,是资产阶 级 改良主义的先驱者之一。散文有 三百多篇,诗词近八百首。
2NO+O2=== 3NO2+H2O===
2NO2
2HNO3+NO
用途
①合成氨、制硝酸; ②作保护气
工业制硝酸
3.自然界中氮肥的形成过程(“雷雨发庄稼”)。 (1)电闪雷鸣时:N2+O2 2NO (2)2NO+O2===2NO2 (3)下雨时:3NO2+H2O===2HNO3+NO (4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作 用生成能被植物吸收的硝酸盐。
言志—— 揭露社会黑暗,人
才被埋没、扭曲;要求 政治改革,追求个性解 放。
问题三:概括本文的主题。
• 本文通过谴责人们对梅花的摧残, 形象地揭露和抨击了清朝封建统治阶 级束缚人民思想,压制摧残人才的罪 行,表达了要求改革政治、渴望人才、 追求个性解放的强烈愿望。
总结
谢谢大家 再见!
一、氮气及氮的氧化物 1.物理性质。
项目 颜色 气味 毒性
N2 无色 NO 无色
无味 无味
无毒 有毒
NO2 红棕色 有刺激性 有毒
密度(比空气) 溶解性
小
难溶于水
大
难溶于水
大
与水反应
2.化学性质及用途。
物质
N2
NO
NO2
氮的氧化物(PPT)5-4
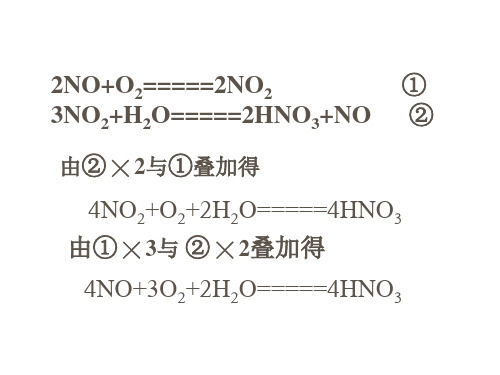
2NO+O2=====2NO2
①
3NO2+H2O=====2HNO3+NO ②
由② ╳ 2与①叠加得
4NO2+O2+2H2O=====4HNO3 由① ╳ 3与2O=====4HNO3
漕运:~粮|~渠|~船(运漕粮的船)。 【漕渡】动军事上指用船、筏子等渡河。 【漕河】名运漕粮的河道。 【漕粮】名漕运的粮食。 【漕运】动旧时 指国家从水道运输粮食,供应京城或接济军需。 【槽】①名盛牲畜饲料的长条形器具:猪~|马~。②名盛饮料或其他液体的器具:酒~|水~。③(~儿) 两边高起,中;李贝斯特 / 李贝斯特;间凹下的物体,凹下的部分叫槽:河~|在木板上挖个~。④〈方〉量门窗或屋内隔 断的单位:两~隔扇|一~窗户。⑤〈方〉量喂猪从买进小猪到喂大卖出叫一槽:今年他家喂了两~猪。 【槽床】名安放槽的架子或台子。 【槽坊】?ɑ名酿 酒的作坊。 【槽钢】名见页〖型钢〗。 【槽糕】〈方〉名用模子制成的各种形状的蛋糕。也叫槽子糕。 【槽头】名给牲畜喂饲料的地方。 【槽牙】名磨牙 ()的通称。 【槽子】?名槽???。 【??】斫??(),地名,在湖南。 【螬】见页[蛴螬]。 【艚】〈书〉一种木船。 【艚子】?名载货的木船,有货舱, 舵前有住人的木房。 【草】(艸、④騲)①名高等植物中栽培植物以外的草本植物的统称:野~|青~|割~。②名指用作燃料、饲料等的稻、麦之类的茎 和叶:稻~|~绳|~鞋。③旧指山野、民间:~贼|~野。④〈口〉雌性的(多指家畜或家禽):~驴|~鸡。 【草】(艸)①形草率;不细致:潦~| 字写得很~。②文字书写形式的名称。a)汉字形体的一种:~书|~写|真~隶篆。)拼音字母的手写体:大~|小~。③初步的;非正式的(文稿):~ 案|~稿。④〈书〉起草:~拟。 【草案】’名拟成而未经有关机关通过、公布的,或虽经公布而尚在试行的法令、规章、条例等:土地管理法~|交通管 理条例~。 【草包】名①用稻草等编成的袋子。②装着草的袋子,比喻无能的人:这点儿事都办不了,真是~一个! 【草本】形属性词。有草质茎的(植 物)。 【草本】名文稿的底本。 【草本植物】有草质茎的植物。茎的地上部分在生长期终了时多枯死。 【草编】名①一种民间手工艺,用玉米苞叶、小麦 茎、龙须草、金丝草等编成提篮、果盒、杯套、帽子、拖鞋、枕席等。②用这种工艺制成的产品。 【草标儿】名旧时集市中插在比较大的物品(多半是旧货) 上表示出卖的草棍儿,有时也插在人身上作为卖身的标志。 【草草】副草率;急急忙忙:~了事|~收场|~地看过一遍。 【草测】动工程开始之前,对地 形、地质进行初步测量,精确度要求不很高:新的铁路线已开始~。 【草场】名用来放牧的大片草地,有天然的和人工的两种。 【草虫】名①栖息在
①
3NO2+H2O=====2HNO3+NO ②
由② ╳ 2与①叠加得
4NO2+O2+2H2O=====4HNO3 由① ╳ 3与2O=====4HNO3
漕运:~粮|~渠|~船(运漕粮的船)。 【漕渡】动军事上指用船、筏子等渡河。 【漕河】名运漕粮的河道。 【漕粮】名漕运的粮食。 【漕运】动旧时 指国家从水道运输粮食,供应京城或接济军需。 【槽】①名盛牲畜饲料的长条形器具:猪~|马~。②名盛饮料或其他液体的器具:酒~|水~。③(~儿) 两边高起,中;李贝斯特 / 李贝斯特;间凹下的物体,凹下的部分叫槽:河~|在木板上挖个~。④〈方〉量门窗或屋内隔 断的单位:两~隔扇|一~窗户。⑤〈方〉量喂猪从买进小猪到喂大卖出叫一槽:今年他家喂了两~猪。 【槽床】名安放槽的架子或台子。 【槽坊】?ɑ名酿 酒的作坊。 【槽钢】名见页〖型钢〗。 【槽糕】〈方〉名用模子制成的各种形状的蛋糕。也叫槽子糕。 【槽头】名给牲畜喂饲料的地方。 【槽牙】名磨牙 ()的通称。 【槽子】?名槽???。 【??】斫??(),地名,在湖南。 【螬】见页[蛴螬]。 【艚】〈书〉一种木船。 【艚子】?名载货的木船,有货舱, 舵前有住人的木房。 【草】(艸、④騲)①名高等植物中栽培植物以外的草本植物的统称:野~|青~|割~。②名指用作燃料、饲料等的稻、麦之类的茎 和叶:稻~|~绳|~鞋。③旧指山野、民间:~贼|~野。④〈口〉雌性的(多指家畜或家禽):~驴|~鸡。 【草】(艸)①形草率;不细致:潦~| 字写得很~。②文字书写形式的名称。a)汉字形体的一种:~书|~写|真~隶篆。)拼音字母的手写体:大~|小~。③初步的;非正式的(文稿):~ 案|~稿。④〈书〉起草:~拟。 【草案】’名拟成而未经有关机关通过、公布的,或虽经公布而尚在试行的法令、规章、条例等:土地管理法~|交通管 理条例~。 【草包】名①用稻草等编成的袋子。②装着草的袋子,比喻无能的人:这点儿事都办不了,真是~一个! 【草本】形属性词。有草质茎的(植 物)。 【草本】名文稿的底本。 【草本植物】有草质茎的植物。茎的地上部分在生长期终了时多枯死。 【草编】名①一种民间手工艺,用玉米苞叶、小麦 茎、龙须草、金丝草等编成提篮、果盒、杯套、帽子、拖鞋、枕席等。②用这种工艺制成的产品。 【草标儿】名旧时集市中插在比较大的物品(多半是旧货) 上表示出卖的草棍儿,有时也插在人身上作为卖身的标志。 【草草】副草率;急急忙忙:~了事|~收场|~地看过一遍。 【草测】动工程开始之前,对地 形、地质进行初步测量,精确度要求不很高:新的铁路线已开始~。 【草场】名用来放牧的大片草地,有天然的和人工的两种。 【草虫】名①栖息在
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A. 28.1 B. 27.7 C. 28.8 D. 29.9
解 :M m n((总 总 ))2.4 6g2.4 1 2L.7 1 m 3L .6 6 3 lo 1l3g2mo 1l2.8 8gm1o
2.4 2lmo 1l
9
(七)隐含“2NO2 N2O4”型 原理 在低温下存在平衡2NO2 N2O4。 例7 铜与某一浓度的硝酸反应放出混合气
符合4:3、4:1时恰好完全被水吸收,无气体剩余。 例4 将充有m mL NO和n mL NO2的量筒倒立于
水槽中,然后通入m mL O2,若m<n,则充分反 应后,量筒内气体体积为( )。
A. 3(n-m)mL B. (m+n/3)mL
C. (n-m)/3 mL D. (4n-m)/12 mL
说明 a NO+b NO2+( 剩余
NO2在其中的体积分数为x,试求混合气体缓缓通
过盛有水的洗气瓶后所得气体的体积V(同温同压),
并在V-x坐标系中作出相应曲线。(不考虑N2O4,
空气中以V(N2):V(O2)=4:1计算)
此题与例2是一种题型。注意空气中有
O2占空气体积的 。 1
5
答案:
V
4 5
9
9
x
V 9 45 x
4 5
的N2,
例8 根据硝酸尾气处理的反应原理,下列气体
中不可能被过量的NaOH溶液吸收的是( D)。
A. 1 mol O2和4 mol NO2
B. 1 mol NO和4 mol NO2
C. 1 mol O2和4 mol NO
D. 4 mol NO和1 mol NO2
11
(九)“NO2+空气”型
例9 现有NO2与空气的混合气体共9L,其中
4NO2 ~ O2 3NO2+H2O=2HNO3+NO
4(10-x) 10-x x-4(10-x)
y=
5
x 3
40
5 x40 3
5
(三)“NO+O2+H2O”型
原理 4NO+3O2+2H2O 4HNO3
例3 盛有a体积NO的试管倒置在水中,欲使最
后气体体积为
a 2
体积,则通入的O2体积(同温同
压)为(
8
(六)“NH3+NO2+O2+稀HNO3 (或稀H2SO4)”型 原理 NH3+H+ == NH4+
4NO2+O2+2H2O ==4HNO3 例6 将NO2、NH3、O2的混合气体33.6L,通过 稀H2SO4后,溶液质量增重26.4g,气体体积缩小 为11.76L(气体体积均在标况下测定),剩余气 体能使带余烬的木条复燃,则原混合气体的平均 相对分子质量为( )。
A. a 解:最后
B)a2 .体。83积a气体C.可54 能a 是DO.2或43 Na O。若为O2
4NO ~ 3O2
a
V(O2)= 若为NO
3 4
3 4
a
a+
a 2
=
5a 4
4NO ~
a
2
V(O2)=
3 8
3O2
3 8
a
a
6
(四)“NO+NO2+O2+H2O”型 原理 NO、NO2分别与O2和H2O反应 规律 当NO、NO2分别与O2的物质的量之比
4
V 24 9 x
5
12
(十)其它类型 如“NOx+NH3”型、“NOx+Fe”型。 例10 4NxOy+3yFe=yFe3O4+2XN2 2mol
NxOy通过500g灼热Fe粉,完全反应生成 1mol N2和1mol Fe3O4,则NxOy是______。
例5 a L CO2气体通过足量Na2O2,所得气体与 b L NO混合,可得c L气体(相同状况),如果忽 略2NO2 N2O4,以下表达式错误的是( ) A. 若a<b,则c<(a+b)/2 B. 若a<b,则C>(a+b)/2 C. 若a>b,则C=(a+b)/2 D. 若a=b,则c=(a+b)/2
3
解:按反应物恰好反应找出x的值,然后让x大 于此值和小于此值求出y值。
因为V(NO2):V(O2)=4:1时恰好反应。
所以当x= 好反应。
4 5
×10mL=8mL时,NO2、O2恰
4ቤተ መጻሕፍቲ ባይዱ
(1)当0<x≤8时 NO2完全反应
4NO2 ~ O2
4
1
y=10
–
x
-
1 4
x=10
-
5 4
x
x
1 4
x
(2)当8<x<10时 NO2过量剩余NO
10
(八)“NO+NO2+NaOH溶液”型
原理 NO+NO2+2NaOH 2NaNO2+H2O
2NO2+2NaOH NaNO3+NaNO2+H2O
规律 当V(NO2)≥V(NO)时,混合气能被NaOH
溶液完全吸收;当V(NO2)<V(NO)时,混合气体中
NO过量,被NaOH吸收后,剩余气体为NO。
3
2
X
X=
3 5
V(NO):V(NO2)=
2 5
:3 5
1
3 5
=2:3
2
(二)“NO2+O2+H2O”型
原理 4NO2+O2+2H2O=4HNO3 规律 V(NO2)/V(O2)=4:1时,恰好完全反应。
V(NO2)/V(O2)>4:1时,剩余气体为NO。 V(NO2)/V(O2)<4:1时,剩余气体为O2。 例2 在一支10mL试管中充满NO2和O2,将其 倒立在盛有足量水的水槽中,若完全反应后,试 管内剩余气体为y mL,假设原混合气中NO2的体 积为x mL,试求x取值范围不同时,y与x的函数关 系式。
3 4
a+
b 4
)O2通入水中气体无
7
(五)“CO2+NO+Na2O2”型 原理 CO2+NO+Na2O2 Na2CO3+NO2 规律 CO2与NO的混合气体通过足量固体
Na2O2后:(1)若V(CO2) ≥V(NO)时,反应后气 体的总体积为原混合气体体积的一半;(2)若 V(CO2)<V(NO),反应后气体缩小的体积就是原来 CO2的体积。
1
(一)“NO2+NO+H2O”型 原理 3NO2+H2O=2HNO3+NO
例1 在一定温度和压强下,装有NO和NO2混合
气的试管倒立于水中,充分反应后,试管内气
体体积缩小为原体积的3/5,则原混合气中NO和
NO2的体积比为( )。
A. 5:3 B. 2:3 C. 3:2 D. 3:5
解:3NO2+H2O=2HNO3+NO △V
体100mL(忽略水蒸气),该混合气的密度 是相同状况下氢气密度的26.7倍,将此气体
在密闭条件下和水充分反应后,体积还有 70mL(体积均在标况下测定)。(1)计算 混合气体中各组分的体积。(2)放出这些气 体需被还原的硝酸是多少克?
提示:气体为NO、NO2、N2O4的混合气 体。 答案:NO230ml、N2O430ml、NO40ml
