分子晶体
【知识解析】分子晶体

分子晶体温故1.晶体中的粒子可以是分子、原子或离子;粒子间的相互作用可以是共价键、离子键、金属键或分子间作用力。
2.根据晶体中粒子间的相互作用及排列方式,可把晶体分为分子晶体、共价晶体、离子晶体和金属晶体。
1 分子晶体的定义只含分子的晶体,或者分子间以分子间作用力结合形成的晶体叫分子晶体。
如I2、H2O、NH3、H3PO4、萘等在固态时都是分子晶体。
名师提醒(1)定义中的“分子”指真实存在的小分子、分子的聚集体、缔合分子、大分子(高分子),因此,H2SO4、H2O2、C4H10等既是化学式也是分子式。
(2)离子化合物、金属单质、原子间相互结合形成空间网状结构(如金刚石、SiO2)的物质中没有分子,因此,Na2O2、Fe、SiO2等是化学式而不是分子式。
(3)稀有气体的分子是单原子分子,因此,由稀有气体单质形成的晶体也是分子晶体。
2 分子晶体中的粒子及粒子间的相互作用3 常见的典型分子晶体(1)所有非金属氢化物:H2O、H2S、NH3、CH4、HX(卤化氢)等。
(2)部分非金属单质:X2(卤素单质)、O2、H2、S8、N2、P4、C60、稀有气体等。
(3)部分非金属氧化物:CO2、SO2、NO2、P4O6、P4O10等。
(4)几乎所有的酸:H2SO4、HNO3、H3PO4、H2SiO3等。
(5)绝大多数有机物:苯、四氯化碳、乙醇、冰醋酸、蔗糖等。
4 分子晶体的物理性质(1)分子晶体具有较低的熔、沸点和较小的硬度。
分子晶体熔化时要破坏分子间作用力,由于分子间作用力很弱,所以分子晶体的熔、沸点一般较低,部分分子晶体易升华(如干冰、碘、红磷、萘等),且硬度较小。
(2)分子晶体不导电。
分子晶体在固态和熔融状态下均不存在自由移动的离子或电子,因而分子晶体在固态和熔融状态下都不能导电。
有些分子晶体的水溶液能导电,如HI、乙酸等。
(3)分子晶体的溶解性一般符合“相似相溶”规律,即极性分子易溶于极性溶剂,非极性分子易溶于非极性溶剂。
分子晶体

BC
A组 Cl键键 Ⅰ.H—I键键能大于H—Cl键键 I键键能大于H Cl 能 C1键键 Ⅱ.H—I键键能小于H—C1键键 I键键能小于H C1 能 HI分子间作用力大于 分子间作用力大于HCl Ⅲ.HI分子间作用力大于HCl 分子间作用力 HI分子间作用力小于 分子间作用力小于HCl Ⅳ.HI分子间作用力小于HCl 分子间作用力
5,关于下列常见晶体说法正确的是
2 60
冰中每个水分子周围有12 12个紧邻的水分子 B.冰中每个水分子周围有12个紧邻的水分子 C.水在固态时密度一定比液态小 干冰中, 个分子周围有12的紧邻分子, 12的紧邻分子 D.干冰中,1个分子周围有12的紧邻分子, 密度比冰小. 密度比冰小.
有下列两组命题,B组中命题正确,且能用A ,B组中命题正确 6,有下列两组命题,B组中命题正确,且能用A组 命题加以正确解释的是 A. Ⅰ ① B. Ⅱ ② C. Ⅲ ③ D. Ⅳ ④
B组 ①HI比HCI稳定 HI比HCI稳定 ②HCl比HI稳定 HCl比HI稳定 ③HI沸点比HCl高 HI沸点比HCl 沸点比HCl高 ④HI沸点比HCl低 HI沸点比HCl 沸点比HCl低
�
5,典型的分子晶体
(1)所有非金属氢化物: (1)所有非金属氢化物: H2O,H2S,NH3,CH4,HX 所有非金属氢化物 (2)部分非金属单质:X (2)部分非金属单质:X2,O2,H2, S8,P4, C60,稀有气体 部分非金属单质 60, (除硼,金刚石,晶体硅) 除硼,金刚石,晶体硅) (3)部分非金属氧化物: CO2, SO2, NO2, P4O6, P4O10 (3)部分非金属氧化物: 部分非金属氧化物 (除二氧化硅) 除二氧化硅) (4)几乎所有的酸: (4)几乎所有的酸:H2SO4,HNO3,H3PO4 几乎所有的酸 (5)大多数有机物的晶体:冰醋酸, (5)大多数有机物的晶体:冰醋酸,蔗糖 大多数有机物的晶体
分子晶体_课件

典型分子晶体
典型的分子晶体有哪些 ?(1)所有_非__金___属__氢__化__物___,如H2O、NH3、CH4等 ;(2)部分__非__金__属__单___质__,如卤素、O2、S8、C60、稀有气体等 ;(3)部分_非___金__属__氧__化___物__,如CO2、SO2、P4O6、P4O10等 ;(4)几乎所有的_酸___,如HNO3、H2SO4、H3PO4等 ;(5)绝大多数__有__机__物___的晶体,如蔗糖、乙醇等 。
干冰就是CO2的晶体,外观像冰,硬度也和冰相似,而熔 点比冰低得多,易升华(想想为什么),在工业上广泛用 作制冷剂。
分子晶体的结构特征
(2)分子非密堆 积此时分子间有氢键——氢键具有方向性和饱和性,使晶体中
的空间利用率不高,留有相当大的空隙。这种晶体不具有分 子密堆积特征,如:HF、NH3、冰等。
444.6 ℃
C.熔点1400 ℃ ,可做半导体材料,难溶于水
分子晶体
练习2:下列属于分子晶体的一组物质是 B
(
)A.CaO、NO、乙醇l4、H2O2、
HeC.CO2、HNO3、NaClD.CH4、O2、Na2O
分子晶体
1、下列分子晶体,关于熔、沸点高低叙述中,正确的是(B )A.Cl2>I2 B.SiCl4>CCl4 C.NH3<PH3 D.C(CH3)4>CH3(CH2)3CH3
( A )A.CO2
B.O2
C.NH4Br
D.Ar
分子晶体
3.SiCl4的分子结构与CCl4相似,下列推测不正确的是(B )A.SiCl4晶体是分子晶体B.常温、常压下SiCl4是气体C. SiCl4的分子是由极性键形成的非极性分子D.SiCl4的熔点 高于CCl4
分子晶体
《分子晶体》课件

在生物学中的应用
分子晶体在生物学中也有着广泛的应用,如用于研究生物大分子的结构和功能。生物大分子如蛋白质 、核酸和多糖等具有复杂的结构和功能,通过研究和了解它们的结构和功能,可以更好地理解生命过 程和疾病机制。
对称面
某些分子晶体中存在对称 面,使得晶体具有对称性 。
对称中心
某些分子晶体中存在对称 中心,使得晶体具有对称 性。
03
分子晶体的分类
有机分子晶体
总结词
有机分子晶体是指由有机分子构成的晶体,其结构单元是碳原子和氢原子等有 机元素。
详细描述
有机分子晶体在自然界中广泛存在,如蛋白质、核酸等生物大分子都是有机分 子晶体。此外,许多塑料、合成纤维等高分子材料也是有机分子晶体。这些晶 体的结构和性质与构成它们的有机分子密切相关。
《分子晶体》ppt课 件
目 录
• 分子晶体简介 • 分子晶体的结构 • 分子晶体的分类 • 分子晶体的应用 • 分子晶体的未来发展
01
分子晶体简介
分子晶体的定义
01
分子晶体是由分子通过分子间作 用力(范德华力)相互结合形成 的晶体。
02
分子晶体中不存在离子或共价键 的结合,而是分子与分子之间的 相互作用。
详细描述
科研人员正在探索新型的分子晶体材 料,这些材料具有更高的稳定性、更 优秀的物理和化学性能,能够满足各 种高科技领域的需求。
分子晶体在新能源领域的应用
总结词
分子晶体在新能源领域的应用前景广 阔,如太阳能电池、燃料电池等。
详细描述
分子晶体

3、典型物质
ቤተ መጻሕፍቲ ባይዱ
(1)碘晶体
长方体
每个晶胞中有 4 个碘分子
什么体? 几个分子?
3、典型物质
(2)干冰 面心立方 每个晶胞中有 4 个二氧化碳分子
什么体? 几个分子?
3、典型物质
(3)冰 氢键具有方向 性
冰中1个水分子周围有4个水分子
冰的结构
4、物理性质 (1)分子晶体有低熔点(破坏的是分子间作用力) (2)不导电(三态下均不存在带电荷的离子,共价 键没有被破坏)(水溶液 中有些导电有些不导电) (3)相似相溶 (4)易挥发、硬度小(分子间作用力弱)
3.下列化学式既能表示物质的组成,又能表示物质 分子式的是 ( C )。 A.NH4NO3 B.SiO2 C.C2H5OH D.Fe 4.氮化铝(AlN)常做砂轮及高温炉衬材料,熔化状态 下不导电,可知它属于 ( C )。 A.离子晶体 B.分子晶体 C.原子晶体 D.金属晶体
1 .当下列物质以晶体形式存在时,其所属晶体类 型和所含化学键类型分别相同的是 ( C )。 A.氯化钠和氯化氢 B.二氧化碳和二氧化硅 C.四氯化碳和四氯化硅 D.单质铁和单质碘 2.下列有关物质的熔点高低顺序不正确的是( C ) A.HF>HCl,HCl<HBr B.CF4<CCl4<CBr4 C.I2>SiO2 D.H2O>H2S,SO2<SeO2
1、定义:分子间通过分子间作用力构成的晶体称 为分子晶体。
注意点: I 构成分子晶体的粒子是分子。 II 在分子晶体中,分子内的原子间以共价键结合, 而相邻分子靠分子间作用力相互吸引。
例 CO2 H2O 存在分子
2、结构特点:由于分子间作用力不具有 方向性 ,所以分子晶体在堆积排列时尽可能的 ________ 利用空间采取紧密堆积的方式。
常见分子晶体

常见分子晶体分子晶体是由大量的有机分子(或者有机分子和无机分子的混合)组成的三维晶体。
它们是化学物质的纯净结晶形态,具有高度定向的分子团簇结构,因此具有各种独特的化学和物理特性。
常见的分子晶体有芳烃晶体、烷烃晶体、烯烃晶体、萘烷晶体和苯烷晶体等。
芳烃晶体是指碳原子四面有同种或不同种芳基的晶体结构。
芳烃的晶体常由四面环结构所组成,这些环可以是环状的(例如苯和芘),也可以是网状的(例如吡啶)。
芳烃晶体的晶体结构的分子间的互相接触是由共价键形成的,因此它们具有非常高的熔点,比其它晶体都要高。
烷烃晶体是指由碳原子四面均附有烷基(由一个羟基和一个不饱和羟基连接而成)的晶体结构。
它们具有非常高的熔点,晶体结构的分子间由共价键构成的范式,如甲烷的「空气状(cellular)」晶体结构。
烯烃晶体也是四面均有烷基附有的晶体,但是具有一个不饱和三环(即烯烃),而不是共价键构成的范式。
烯烃晶体有大量的晶体结构类型,其中包括有萘烷(naphthalene)、芘(phenanthrene)和芪(acenaphthene)等。
萘烷晶体是指一种晶体结构,由两个连在一起的萘环(含有八个碳原子)所组成。
由于其具有古老的烯烃结构,萘烷晶体通常具有较高的熔点和灭火点,而且还具有很强的光学特性,如上转换性、荧光光谱和悬浮特性等。
苯烷晶体是指碳原子四面都附有苯基的晶体结构。
它们的分子间的相互作用是由共价键构成的,而不是烯烃晶体的烯环,因此它们的晶体结构就像甲烷一样,并且具有较高的熔点。
苯烷晶体有一种变体,称为叶绿素晶体,它由二环芳烃和两个饱和羟基所组成,具有丰富的荧光特性和传输性。
总之,常见的分子晶体有芳烃晶体、烷烃晶体、烯烃晶体、萘烷晶体和苯烷晶体等,它们均具有高度定向的分子团簇结构,因此具有各种独特的化学和物理特性。
其中,芳烃晶体是由碳原子四面有同种或不同种芳基的晶体结构组成,而烷烃晶体和烯烃晶体则是由碳原子四面均附有烷基的晶体结构,萘烷晶体是由两个连在一起的萘环构成,而苯烷晶体则是由碳原子四面都附有苯基的晶体结构。
分子晶体

分子晶体分子晶体,指分子间以范德华力相互结合形成的晶体。
大多数非金属单质及其形成的化合物如干冰(CO2)、I2、大多数有机物,其固态均为分子晶体。
分子晶体是由分子组成,可以是极性分子,也可以是非极性分子。
分子间的作用力很弱,分子晶体具有较低的熔、沸点,硬度小、易挥发,许多物质在常温下呈气态或液态,例如O2、CO2是气体,乙醇、冰醋酸是液体。
同类型分子的晶体,其熔、沸点随分子量的增加而升高,例如卤素单质的熔、沸点按F2、Cl2、Br2、I2顺序递增;非金属元素的氢化物,按周期系同主族由上而下熔沸点升高;有机物的同系物随碳原子数的增加,熔沸点升高。
但HF、H2O、NH3、CH3CH2OH等分子间,除存在范德华力外,还有氢键的作用力,它们的熔沸点较高。
分子组成的物质,其溶解性遵守“相似相溶”原理,极性分子易溶于极性溶剂,非极性分子易溶于非极性的有机溶剂,例如NH3、HCl极易溶于水,难溶于CCl4和苯;而Br2、I2难溶于水,易溶于CCl4、苯等有机溶剂。
根据此性质,可用CCl4、苯等溶剂将Br2和I2从它们的水溶液中萃取、分离出来。
物质类别及举例所有非金属氢化物:如水、硫化氢部分非金属单质:如卤素单质部分非金属氧化物:如CO2、SO2绝大多数有机物(有机盐除外)几乎所有的酸(除外:一水合高氯酸的是离子晶体)离子晶体物理学概念,指离子间通过离子键结合形成的晶体。
离子间通过离子键结合形成的晶体。
在离子晶体中,阴、阳离子按照一定的格式交替排列,具有一定的几何外形,例如NaCl是正立方体晶体,Na+离子与Cl-离子相间排列,每个Na+离子同时吸引6个Cl离子,每个Cl-离子同时吸引6个Na+。
不同的离子晶体,离子的排列方式可能不同,形成的晶体类型也不一定相同。
离子晶体中不存在分子,通常根据阴、阳离子的数目比,用化学式表示该物质的组成,如NaCl表示氯化钠晶体中Na+离子与Cl-离子个数比为1∶1,CaCl2表示氯化钙晶体中Ca2+离子与Cl-离子个数比为1∶2。
10-典型晶体简介(分子晶体)
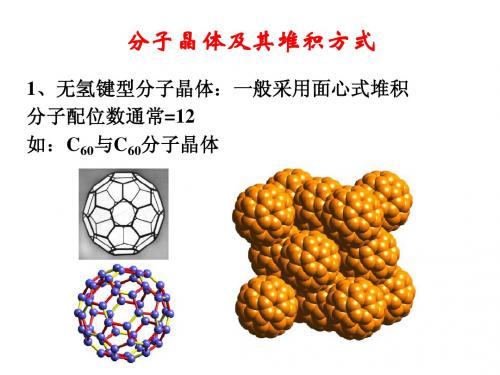
1、无氢键型分子晶体:一般采用面心式堆积 、无氢键型分子晶体: 分子配位数通常=12 分子配位数通常 如:C60与C60分子晶体
分子晶体及其堆积方式
1、无氢键型分子晶体:一般采用面心式堆积 、无氢键型分子晶体: 分子配位数通常=12 分子配位数通常 分子晶体(干冰) 如:CO2与CO2分子晶体(干冰)
分子晶体熔点的相对高低规律之四
讨论: 讨论: 实验测得气态氯化铝的相对分子质量等于267,则其分 实验测得气态氯化铝的相对分子质量等于 , 子式为 ,其结构式可能为 。
分子晶体小结
• 分子晶体的一般情况: 分子晶体的一般情况:
所有非金属氢化物、部分共价化合物 所有非金属氢化物、部分共价化合物 非金属氢化物 物质种类 少数盐类 盐类, 少数盐类,如AlCl3 单核或多核的) 晶体中的微粒 (单核或多核的)分子 微粒间的作用力 范德华力或氢键 微粒内部的 微粒内部的 无化学键 有非极性共价键或 作用力 或有非极性共价键或有极性共价键 干冰、 典型代表 氦、氢、干冰、冰 He 、 H2 、 CO2 、 H2O 化学式 较软易碎、部分可溶于水、 较软易碎、部分可溶于水、 物理共性 熔点沸点较低、晶体导电导热性差 熔点沸点较低、晶体导电导热性差
分子晶体熔点的相对高低规律之四
升华问题: 升华问题: 某些分子晶体受热时 不经过熔化直接变成气态 这种现象叫升华 这种现象叫升华 升华的条件 条件是 升华的条件是: 在一定的压强条件下物质的熔点 熔点>沸点 在一定的压强条件下物质的熔点 沸点 能升华的常见物质有: 能升华的常见物质有: 干冰、 苯甲酸、 干冰、碘、萘、苯甲酸、氯化铝等
分子晶体熔点的相对高低规律之一
参考f=k·m1·m2/r2 (1)组成与结构相似时:—二
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
说明:
分子间作用力与化学键的关系:分子间作用力不是化学
键 , 它 比 化 学 键 弱 得 多 , 如 HCl 分 子 间 的 作 用 力 为 21kJ·mol - 1 , 而 HCl 分 子 中 的 H—Cl 键 的 键 能 为 431kJ·mol - 1 。 通 常 化 学 键 的 键 能 为 120 ~ 800kJ·mol-1,而分子间作用力通常每摩尔约为几 十千焦。当破坏HCl分子间作用力时,只改变了HCl的状态, 发生了物理变化;当HCl 分子中的H—Cl键遭到破坏时,一 般发生了化学变化,但当固态或液态HCl溶于水时,虽也破
堆积。
第三章 晶体结构与性质
说明:干冰中只存在分子间作用力,其结构如图所示,
由干冰的结构模型我们可以看出:干冰晶体是一种面心立方
结构。
人 教 版 化 学
第三章 晶体结构与性质
(2)如果分子间除范德华力外还存在着氢键,晶体就 不会采取密堆积的方式。例如,我们最熟悉的冰中,水分子 间作用力主要是氢键(也存在范德华力),如图所示。由图 可知,在冰的晶体中,每个水分子周围只有4个紧邻的水分 子,形成正四面体。氢键不是化学键,比共价键弱得多,却 与共价键一样具有方向性,所以由于氢键的存在,迫使四面 体中心的每个水分子与四面体顶角方向的4个相邻水分子相 互吸引,这一排列使冰晶体空间利用率不高,有相当大的空 隙使得冰的密度减小。
人 教 版 化 学
提示:冰晶体中每个水分子通过氢键与周围4个水分子
相连,平均每个水分子形成2个氢键。
第三章 晶体结构与性质
3.结合教材干冰结构示意图,分析每个CO2分子紧邻 几个CO2分子?一个干冰晶胞中含几个CO2分子? 提示:每个CO2分子紧邻12个CO2分子,一个干冰晶 胞中含4个CO2分子。
存在,只有相应的化学式,如SiO2、Cu、NaCl等。
第三章 晶体结构与性质
3.分子晶体内微粒间的相互作用 分子晶体内部分子间靠分子间作用力相互结合成分子, 包括范德华力和氢键(范德华力广泛存在于分子晶体内部, 氢键只存在于特殊的分子晶体中,如NH3、H2O、HF)。
人 教 版 化 学
第三章 晶体结构与性质源自第三章 晶体结构与性质人 教 版 化 学
第三章 晶体结构与性质
一、分子晶体
1.分子晶体:由________构成,相邻分子
靠________相互吸引。 2.分子晶体特点:________。 3.常见分子晶体分类:(1)所有非金属的氢化物, 如________等。
人 教 版 化 学
(2)部分非金属单质,如________等。
第三章 晶体结构与性质
人 教 版 化 学
第三章 晶体结构与性质
人 教 版 化 学
第三章 晶体结构与性质
1.了解分子晶体的概念。 2.了解冰、干冰等分子晶体的晶胞,并学会分析分子 在晶胞中的空间位置关系。 3.理解冰、干冰等分子晶体中分子间作用力的类型。
人 教 版 化 学
4.掌握分子晶体关于熔、沸点等方面的物理性质。
人 教 版 化 学
第三章 晶体结构与性质
答案:
一、1.分子 分子间作用力
2.低熔点、易升华、硬度很小 3.(1)水、硫化氢、氨、氯化氢、甲烷 白磷(P4)、C60 (2) 卤素 (X2) 、氧 (O2) 、硫 (S8) 、氮 (N2) 、
人 教 版 化 学
(3)CO2、P4O6、P4O10、SO2
人 教 版 化 学
________( 也存在________) ,每个水
分子周围只有 ________ 个紧邻的水分子。特点: ________密度最大。
(3) 干 冰 : CO2 的 晶 体 。 分 子 间 存 在
________,性质特点是:________,工 业上用作________。
第三章 晶体结构与性质
4.范德华力 氢键
第三章 晶体结构与性质
5.(1)12
(2)氢键 范德华力 4
二、1.一定 不一定 2.范德华力 共价键
4
制冷制
人 教 版 化 学
(3)范德华力 熔点低,易升华 较小
较大
第三章 晶体结构与性质
人 教 版 化 学
第三章 晶体结构与性质
1.冰和干冰是同一种晶体吗?
提示:不是。冰是水的晶体,干冰是二氧化碳的晶体, 二者外观相似,所以将二氧化碳的晶体称为干冰。 2.结合教材冰晶体结构示意图,分析水分子之间的结 合力是什么样的?每个水分子周围有几个水分子相连?
人 教 版 化 学
坏了H—Cl键,但却不是化学变化,因此,分子间作用力主
要影响物质的物理性质,而化学键则主要影响物质的化学性 质。
第三章 晶体结构与性质
4.分子晶体的结构特征 (1) 大多数分子晶体具有如下特征:如果分子间作 用力只是范德华力,若以一个分子为中心,其周围通常可以
人 教 版 化 学
有12个紧邻的分子,分子晶体的这一特征被称为分子的密
人 教 版 化 学
第三章 晶体结构与性质
人 教 版 化 学
第三章 晶体结构与性质
1.分子晶体的概念
只含分子的晶体称为分子晶体。
说明:
常见的分子晶体:
①所有非金属氢化物:H2O、H2S、NH3、CH4、HX(X 代表卤素)等。
人 教 版 化 学
②部分非金属单质: X2(X 代表卤素 ) 、 N2 、 O2 、 H2 、 S8、P4、C60等。
(3)部分非金属氧化物,如________等。 (4)几乎所有的酸。 (5)绝大多数有机物。
第三章 晶体结构与性质
4 .构成分子晶体的作用力包括 ________ 和
________。
5.分子晶体结构特点: (1)________ 个 紧 邻 的 分 子 密 堆 积 , 如 O2和C60。 (2) 冰 的 晶 体 : 构 成 晶 体 的 作 用 力 是
二、分子晶体与化学键
1 .分子晶体中 ________ 存在范德华力,
________存在化学键。 2.除稀有气体分子构成的晶体以外,一般分子晶体中 分子之间存在的作用力是 ________ ,分子内部原 子之间存在的作用力是 ________ ,范德华力能量 ________,共价键能量________。
第三章 晶体结构与性质
③部分非金属氧化物: CO2 、 SO2 、 N2O4 、P4O6 、
P4O10等。
④几乎所有的无机酸:H2SO4、HNO3、H3PO4等。 ⑤大多数有机物:乙醇、冰醋酸、蔗糖等。 2.分子晶体的构成微粒 分子晶体的构成粒子为分子,只有分子晶体中才有真正
人 教 版 化 学
的分子存在,所以它的化学式就代表分子;其他晶体无分子
