酸碱平衡练习题
酸碱平衡试题及答案高一

酸碱平衡试题及答案高一一、选择题(每题2分,共20分)1. 以下哪种物质属于酸?A. NaOHB. HClC. NaClD. H2O答案:B2. 酸碱反应的实质是:A. 离子交换B. 电子转移C. 质子转移D. 能量转换答案:C3. 根据酸碱理论,下列哪种物质是碱?A. H2SO4B. NH3C. Na2CO3D. HCl答案:C4. 强酸和强碱反应生成的产物是:A. 盐和水B. 酸和水C. 碱和水D. 盐和酸答案:A5. 溶液的pH值小于7,则该溶液是:A. 碱性B. 中性C. 酸性D. 无法判断答案:C6. 以下哪种物质是两性物质?A. NaOHB. H2SO4C. Al2O3D. HCl答案:C7. 以下哪种物质属于强碱?A. KOHB. NH3·H2OC. Ca(OH)2D. Na2CO3答案:A8. 以下哪种物质属于强酸?A. H2SO4B. CH3COOHC. H2CO3D. HClO答案:A9. 以下哪种物质属于弱酸?A. HClB. H2SO4C. HNO3D. CH3COOH答案:D10. 以下哪种物质属于弱碱?A. NaOHB. NH3C. Ca(OH)2D. KOH答案:B二、填空题(每空1分,共10分)1. 酸的定义是能够释放________(质子)的物质。
答案:H+2. 碱的定义是能够接受________(质子)的物质。
答案:H+3. 溶液的pH值等于7时,该溶液是________。
答案:中性4. 溶液的pH值大于7时,该溶液是________。
答案:碱性5. 溶液的pH值小于7时,该溶液是________。
答案:酸性6. 强酸和强碱反应生成的产物是________和________。
答案:盐;水7. 两性物质是指既能表现出酸性,又能表现出碱性的物质,例如________。
答案:Al2O38. 强酸是指在水溶液中完全电离的酸,例如________。
答案:HCl9. 强碱是指在水溶液中完全电离的碱,例如________。
03章酸碱平衡习题
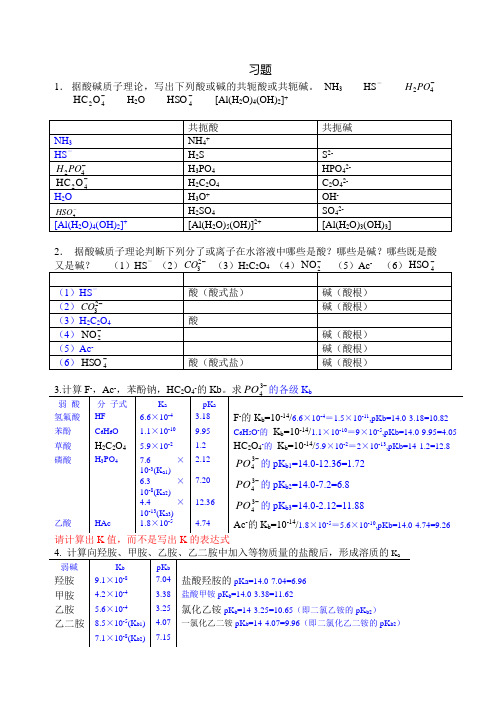
习题1. 据酸碱质子理论,写出下列酸或碱的共轭酸或共轭碱。
NH 3 HS --42PO H-42O HC H 2O -4HSO [Al(H 2O)4(OH)2]+2. 据酸碱质子理论判断下列分了或离子在水溶液中哪些是酸?哪些是碱?哪些既是酸--2-------3请计算出K 值,而不是写出K 的表达式5.人体正常血液pH 值在7.35~7.45之间变动,试计算此正常范围的[H +]是多少?因为:pH=-lg[H +], 所以pHH -+=10][ [H +]=10-7.35~10-7.45=4.5×10-8~3.55×10-86.向0.1mol/L 的磷酸溶液中加入固体NaOH (体积不变),至pH =7.0,求磷酸各型体的分布系数及平衡浓度。
3212121330][][][][a a a a a a K K K H K K H K H H +++=++++δ =13837832733737104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[----------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+=8×10-6760431081081.0][--⨯=⨯⨯==δc PO H32121213211][][][][a a a a a a a K K K H K K H K H H K +++=++++δ =138378327337273104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[106.7-----------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯=0.6130613.0613.01.0][142=⨯==-δc PO H32121213212][][][][a a a a a a a a K K K H K K H K H H K K +++=++++δ =138378327337783104.4103.6106.7]10[103.6106.7]10[106.7]10[]10[103.6106.7------------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯⨯⨯=0.3870387.0387.01.0][224=⨯==-δc HPO321212133213][][][a a a a a a a a a K K K H K K H K H K K K +++=+++δ=1383783273371383104.4103.6106.7]10[103.6106.7]10[106.7]10[104.4103.6106.7------------⨯⨯⨯⨯⨯+⨯⨯⨯+⨯+⨯⨯⨯⨯⨯=1.7×10-676334107.1107.11.0][---⨯=⨯⨯==δc PO7、计算0.2 mol ·dm -3H 2C 2O 4溶液中每种离子的浓度。
第九章 酸碱平衡 习题

第九章 酸碱平衡1根据酸碱质子理论,下列各离子中,既可作酸又可作碱的是………………………( )(A) H 3O +(B)CO 32- (C)NH 4+ (D) [Fe (H 2O)4(OH)2]2在反应BF 3 + NH 3−→−F 3BNH 3中,BF 3为…………………………………………( )(A) Arrhenius 碱(B) Br φnsted 酸 (C) Lewis 碱(D) Lewis 酸3 NH 4+的共轭碱是 …………………………………………………………………… ( )(A) OH -(B) NH 3 (C)NH 2- (D) NH 2-4不是共轭酸碱对的一组物质是………………………………………………………( )(A) NH 3、NH 2- (B) NaOH 、Na(C) OH -、O 2-(D) H 3O +、H 2O 5H PO 24-的共轭碱是 …………………………………………………………………( )(A) H 3PO 4 (B)HPO 42-(C)H PO 23-(D)PO 43- 6化学反应Ag(NH )32+ + Br -AgBr ↓ + 2NH 3按照路易斯酸碱理论,它应属于…………………………………………………………………………………………… ( )(A) 碱取代反应 (B) 置换反应(C) 酸取代反应 (D) 沉淀反应7根据软硬酸碱概念,下列物质属软酸的是……………………………………………( )(A) H (B) Ag (C) NH 3 (D) AsH 38根据酸碱的溶剂理论,在液态 SO 2 体系中的碱是…………………………………( )(A) SOCl 2 (B) Na 2SO 3 (C) Na 2SO 4 (D) PCl 39Fe 3+、Cl -、H +、SO 3 中能作路易斯酸的是 _______________,能作路易斯碱的是____________________。
酸碱平衡

第六章 酸碱平衡一、选择题1.在相同溫度下,和1%的尿素22[CO(NH )]水溶液具有相同渗透压的葡萄糖6126(C H O )溶液的浓度约为A 、2%B 、3%C 、4%D 、5%2.测得人体血液的冰点降低值0.56K f T ∆=。
已知-11.86K mol kg f K =⋅⋅。
则在体温37 C ︒时的渗透压是A 、1776 kPaB 、388 kPaC 、776 kPaD 、194 kPa3.按照酸碱质子理论,下列物质中既可以作为酸,又可作为碱的是A 、[]3+26Al(OH ) B 、[]3+26Cr(OH ) C 、[]+242Fe(OH )(OH) D 、3-4PO 4.根据质子理论,下列水溶液中碱性最弱的是哪一个 A 、-3NO B 、-4ClO C 、2-3CO D 、2-4SO 5.弱酸弱碱盐实际上是包含一种酸1A 和一种碱2B 的化合物,它的水解常数应该等于A 、2b K ϑB 、1a K ϑC 、12a b w K K K ϑϑϑD 、12w a b K K K ϑϑϑ 6.醋酸的-5 = 1.810 a K ϑ⨯,欲配制PH = 5的醋酸与醋酸钠组成的缓冲溶液,其/m m 酸碱的比应为A 、5:9B 、18:10 1:18 D 、1:36 7.已知3-5-10-5(NH )(HCN)(HAc) = 1.810 , = 4.910 , = 1.810b a a K K K ϑϑϑ⨯⨯⨯,下列哪一对共轭酸碱混合物不能配制PH = 9的缓冲溶液A 、HAc - NaAcB 、43NH Cl - NHC 、 (A)、(B)都不行D 、HCN - NaCN8.某酸溶液的pH 为9,其氢离子浓度为A 、1.0×10-10B 、1.0×10-9C 、1.0×10-8D 、1.0×10-79. 将NaAc 溶液加热之后,溶液的PH 值将A 、增大B 、减小C 、不变D 、基本不变10. NH 3的共轭酸A 、NH 2-B 、NH 2-C 、NH 4+D 、HCl11. 欲配制pH=4.50的缓冲溶液,选用下列哪种K Θa 值的酸的缓冲对最适宜A 、6.4×10–4B 、1.4×10–3C 、1.8×10–5D 、6.23×10–812. 在0.1mol·L -1的氨水中加入固体 NH 4Cl ,则氨水的电离度A 、增大B 、减小C 、不变D 、基本不变二、计算题和问答题1.已知0.01-3mol dm ⋅HAc 溶液的解离度为4.2%,试求HAc 的电离常数,并计算溶液中的[H +],pH 及0.1-3mol dm ⋅HAc 的电离度。
无机化学练习(2)酸碱平衡,答案

无机化学练习(二)酸碱平衡,沉淀溶解平衡(答案)学号 姓名 得分一. 判断题(每题1分,共15分)分)1.强酸性水溶液中不含OH -,强碱性水溶液中不含H +。
-------------------------------------------------------------(〤) 2.将pH 值等于5.0的盐酸溶液冲稀1000倍,溶液的pH 值等于8.0----------------------------------------------(〤) 3.使甲基橙显黄色的溶液一定是碱性的。
------------------------------------------------------------------------------(〤) 4.在一定温度下,在一定温度下,改变溶液的改变溶液的pH 值,水的离子积不变。
---------------------------------------------------------(√) 5.弱电解质的解离度随电解质浓度的降低而增大。
-----------------------------------------------------------------(√) 6.在0.001 mol •L -1的稀H 3PO 4溶液中,H +的浓度为0.003 mol•L -1。
-------------------------------------------(〤) 7.将HAc 和HCl 溶液各加水稀释一倍,则两种溶液中[H +]浓度均减小为原来的1/2。
-----------------------(〤) 8.在H 3PO 4溶液中,由于第一步解离出较多的H +,抑制了第二,第三步解离,使K o a2、K o a3较小。
---(〤) 9.AgCl 水溶液导电性很弱,所以AgCl 是弱电解质。
--------------------------------------------------------------(〤) 10.用水稀释含BaSO 4固体的水溶液时,BaSO 4的溶度积不变,浓度也不变。
酸碱平衡练习题

酸碱平衡练习题一、选择题(单选题)1.用电导实验测定强电解质溶液的解离度,总是达不到100%,其原因是(D)。
A、电解质本身不全部解离;B、电解质不纯;C、电解质与溶剂有作用;D、正负离子相互作用。
2.根据酸碱质子理论,下列叙述中正确的是(C)。
A、碱只能是阴离子;B、质子理论适用于水溶液和一切非水溶液;C、任何一种酸失去质子就成为碱;D、碱愈强,其共轭酸也愈强。
3.OH-的共轭酸是()。
A、H+;B、H2O;C、H3O+;D、O2-。
4.CH3OH的共轭酸是()。
A、H3O+;B、OH-;C、CH3OH2+;D、CH3O-。
5.H3O+的共轭碱是.()。
A、H+;B、OH-;C、H2O2;D、H2O。
6.根据酸碱质子理论,下列物质中可作为碱的是()。
A、NH4+;B、[Co(OH)(H2O)5]+;C、[Fe(H2O)6]3+;D、H3O+。
7.根据酸碱质子理论,对于反应HCl+NH3NH4++Cl-来说,下列各组物质都是酸的是()。
A、HCl和Cl-;B、HCl和NH4+;C、NH3和Cl-;D、NH3和NH4+。
8.根据酸碱电子理论,下列物质中,可作为Lewis碱的是()。
A、Fe3+;B、Cu2+;C、F-;D、SO3。
9.下列酸溶液浓度相同,其中c(H+)最大的是()。
A、H2S(aq);B、H2SO4(aq);C、H3PO4(aq);D、H2C2O4(aq)。
10.SbCl3水解产物为.()。
A、Sb(OH)3;B、SbOCl;C、Sb2O3;D、Sb(OH)2Cl。
11.BiCl3水解产物为()。
A、Bi2O3;B、Bi(OH)3;C、BiOCl;D、Bi(OH)Cl2。
12.SnCl2水解产物为()。
A、SnOCl;B、Sn(OH)2;C、SnO;D、Sn(OH)Cl。
13.已知:K(HCN)=6.2×10-10,则NaCN的标准水解常数为()。
A、1.6×10-6;B、6.2×10-10;C、6.2×10-24;D、1.6×10-5。
高二化学酸碱平衡专项练习题及答案

高二化学酸碱平衡专项练习题及答案一、选择题1. 下列酸溶液中,酸性最强的是:A. H2SO4B.H2CO3C.HClD.HF2. 弱电解质的电离程度较低,是因为:A. 共价键较强B. 局域化电子较多C. 极性分子较少D. 分子间作用力较强3. 当溴离子浓度增大时,下列变化中,与氢氧根离子浓度变化相反的是:A. pH值增大B. 溶液酸性增强C. 溶液呈碱性D. 溶液电导率变小4. 酸溶液和碱溶液发生中和反应时,生成的产物是:A. 氨B. 醋酸C. 水D. 氢气5. 酸性溶液的pH值是:A. 大于7B. 等于7C. 小于7D. 可以小于或大于76. 在水中加入醋酸会影响水的pH值,这是因为醋酸具有:A. 高电离能B. 低电离能C. 高溶解度D. 低溶解度7. 下列物质中,具有酸性的是:A. KClB. Na2SO4C. NaClOD. NaNO28. 酸碱中和反应的特点是:A. 氧化还原反应B. 离子交换反应C. 酸溶液与碱溶液反应D. 温度变化明显9. 在酸碱中和反应中,酸和碱的组成:A. 总是H+和OH-B. 可能含有H+或OH-C. 总是H3O+和OH-D. 通常不含H+和OH-10. NaOH和HCl溶液发生中和反应时,生成的盐是:A. NaClOB. NaClO2C. NaClO3D. NaCl二、解答题1. 写出下列酸碱平衡方程式,并标明反应物和生成物:i) HClO4 + H2O →ii) NH3 + H2O →2. 根据酸碱理论回答问题:i) Na2CO3溶液为什么能碱性?ii) HClO4为何不是酸性最强的酸?三、计算题1. 已知HCl溶液的质量浓度为0.1 mol/L,若取10 mL的HCl溶液和10 mL的NaOH溶液进行中和反应,请计算所需要的NaOH溶液的质量浓度。
四、实验题设计一个实验来测试一种酸性溶液的pH值,并写出实验步骤及原理。
答案:一、选择题答案1. C2. B3. A4. C5. C6. B7. C8. C9. B 10. D二、解答题答案1.i) HClO4 + H2O → H3O+ + ClO4-ii) NH3 + H2O → NH4+ + OH-2.i) Na2CO3溶液能碱性是因为其中含有氧化态为+2的离子Na+,它与水反应生成氢氧根离子OH-,使溶液呈碱性。
酸碱平衡习题答案

第三章 酸碱平衡习题一、选择题1、pH=1的溶液是pH=4的溶液的[H+]的倍数是〔 C 〕A.3倍B.4倍C. 1000倍D. 300倍2、某弱碱的b θK 10-9,那么其0.1 mol L -1水溶液的pH 为〔C 〕A. 3.0B. 5.0C. 9.0D.3、某缓冲溶液含有等浓度的HA 与A -,假设A - 的b θK 10-10,那么该缓冲溶液的 pH为〔 B 〕A. 10.0B. 4.0C. 7.0D.4、以下物质中是弱电解质的是〔D 〕A. NaAcB. NH 4ClC. KNO 3D. H 2S 5、以下物质的水溶液呈中性的是〔A 〕A. NaClB. K 2CO 3C. Al 2(SO 4)3D. (NH 4)2SO 4 6、0.1 m ol·L -1 H 2SO 4溶液中H + 浓度为〔B 〕A. 0.1 mol·L -1B. 0.2 mol·L -1C. 0.3 mol·L -1D. 0.4 mol·L -17、在 H 2CO 3 H + + HCO 3- 平衡体系中,能使电离平衡向左移动的条件是〔B 〕 A. 加NaOH B. 加盐酸 C. 加水 D. 升高温度8、在含有 mol·L -1 HCl 与 mol·L -1 CH 3COOH 溶液中,c (H +)同c (Ac -)关系正确的选项是〔 C 〕A. c (H +) = c (Ac -)B. c (Ac -) > c (H +)C. c (H +)>> c (Ac -)D. 无法知道9、某二元弱酸H 2A 的a1θK = 6 10-8,a2θK = 8 10-14,假设其浓度为0.05mol·L -1,那么溶液中A 2- 浓度约为〔B 〕A. 6 10-8 mol·L -1B.8 10-14 mol·L -1C. 3 10-8 mol·L-1D.4 10-14mol·L-110、以下说法正确的〔C〕A. 但凡物质都能承受质子B. 中性溶液的C. 但凡能给出质子的物质都是酸D. 酸与共轭碱只是所含质子数的不同二、判断题1、强酸性水溶液中不含OH-,强碱性水溶液中不含H+。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
酸碱平衡练习题一.是非题1.由于乙酸的解离平衡常数)()()(HAc c Ac c H c K a -+=θ,所以只要改变乙酸的起始浓度即c(HAc),aK θ必随之改变。
2.缓冲溶液的缓冲能力一般认为在pH=Pka ⊕±1范围内。
3.稀释可以使醋酸的电离度增大,因而可使其酸性增强.4.溶液的酸度越高,其pH 值就越大。
5.在共轭酸碱体系中,酸、碱的浓度越大,则其缓冲能力越强。
6.溶液的酸度越高,其pH 值就越小。
7.根据酸碱质子理论,强酸反应后变成弱酸。
8.在浓度均为0.01 mol ·L -1的HCl ,H 2SO 4,NaOH 和NH 4Ac 四种水溶液中,H + 和OH -离子浓度的乘积均相等。
9.将氨水的浓度稀释一倍,溶液中OH - 离子浓度就减小到原来的一半。
,可以组成缓冲溶液。
11.缓冲溶液中,当总浓度一定时,则c(A -)/c(HA)比值越大,缓冲能力也就越大。
12.某些盐类的水溶液常呈现酸碱性,可以用来代替酸碱使用。
13.由质子理论对酸碱的定义可知, NaHCO 3只是一种碱。
,可以组成缓冲溶液。
二.选择题1.某弱酸HA 的K a θ=1×10-5,则其0.1 mol·L -1溶液的pH 值为 A. 1.0 B.2.0 C.3.0 D.3.52.有下列水溶液:(1)0.01 mol ·L -1CH 3COOH ;(2)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L -1HCl 溶液混合;(3)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01 mol ·L -1NaOH 溶液混合; (4)0.01 mol ·L -1CH 3COOH 溶液和等体积0.01mol ·L -1NaAc 溶液混合。
则它们的pH 值由大到小的正确次序是 A.(1)>(2)>(3)>(4) B.(1)>(3)>(2)>(4) C.(4)>(3)>(2)>(1) D.(3)>(4)>(1)>(2)3.下列离子中只能作碱的是( )。
A .H 2OB .HCO -3C .S 2-D .[Fe(H 2O)6]3+ 4.在1.0LH 2S 饱和溶液中加入 mol ·L -1HCl 则下列式子错误的是 A.c(H 2S)≈0.10 mol ·L -1 B.c(HS -)<c(H +) C.c(H +)=2c(S 2-) D.(H +5. 按质子理论,下列物质中何者不具有两性A. HCO 3-B.CO 32-C.HPO 42-D.HS - 6.把100 cm 3 0.1 mol ·dm -3 HCN (K a = 4.9 ⨯ 10-1)溶液稀释到400 cm 3,[H +]约为原来的A.12B.14C. 2倍 D 4倍7.下列各组混合液中,可作为缓冲溶液使用的是( )。
8.根据酸碱质子理论,可以得出( )A.任何一种酸失去质子后就成为碱B.碱不可能是阳离子C.碱可能是电中性的分子.D.同一物质不可能既作为酸又作为碱 9.HCN 的解离常数表达式为()()()c H c CN K a c HCN θ+-⨯=,下列那种说法是正确的A.加HCl ,K a θ变大B.加NaCN ,K a θ变大C.加HCN ,K a θ变小D.加H 2O, K aθ不变10.将pH =1.0与pH =3.0的两种溶液以等体积混合后,溶液的pH 值为 A.0.3 B.1.3 C.1.5 D.2.0 11.对反应HPO 42- + H 2O ⇔ H 2PO 4- +OH -来说A.H 2O 是酸,OH -是碱B.H 2O 是酸,HPO 42-是它的共轭碱C.HPO 42-是酸,OH -是它的共轭碱D.HPO 42-是酸,H 2PO 4-是它的共轭碱 12.在纯水中加入一些酸,则溶液中A. c(H +)·c(OH -)的乘积增大B.c(H +)·c(OH -)的乘积减小C. c(H +)·c(OH -)的乘积不变D.溶液pH 增大 13.在常温下,pH=6的溶液与pOH=6的溶液相比,其氢离子浓度 A.相等 B.高2倍 C.高10倍 D.高100倍14.相同浓度的F -、CN -、HCOO -三种碱性物质的水溶液,在下列叙述其碱性强弱顺序的关系中,哪一种说法是正确的。
(HF 的pK a θ=3.18,HCN 的pK a θ=9.21,HCOOH 的pK a θ=3.74)A.F ->CN ->HCOO - ->HCOO ->F - ->F ->HCOO -D.HCOO ->F ->CN - 15.人的血液中,[H 2CO 3]=1.25×10-3mol/L(含CO 2),[HCO 3-]=2.5×10-2mol/L.假 设平衡条件在体温(37℃时H 2CO 3的pK a1=6.1),则血液的pH 值是 A.7.4 C.7.0 D.7.2 16.对于关系式()()()22122c H c S K K a a c H Sθθ+-⨯=⨯=1.23×10-20来说,下列叙述中不正确的是 A.此式表示了氢硫酸在溶液中按下式解离:H 2S ⇔2H + + S 2- B.此式说明了平衡时,H +、S 2-和H 2S 三者浓度之间的关系C.由于H 2S 的饱和溶液通常为0.1 mol ·L -1,所以由此式可以看出S 2-离子浓度受H +离子浓度的控制D.此式表明,通过调节c(H +)可以可以调节S 2-离子浓度17.欲配制pH =9的缓冲溶液,应选用下列何种弱酸或弱碱和它们的盐来配制A. HNO 2(K a θ=5×10-4)B.NH 3·H 2O(K b θ=1×10-5)C.HAc(K a θ=1×10-5)D.HCOOH(K a θ=1×10-4)mol·L -1某弱酸HA 溶液的pH =5.5,该酸的K a θ为 A. 10-10 B. 10-9 C. 10-6 D. 10-3 19.不是共轭酸碱对的一组物质是( )A .NH 3,NH 2_B .NaOH,Na +C .HS _,S -2D .H 2O,OH - 20.下列水溶液pH 最小的是( )。
A .NaHCO 3B .NaCO 3C .NH 4ClD .NH 4Ac 21.欲配制pH =9的缓冲溶液,应选用下列何种弱酸或弱碱和它们的盐来配制A.HNO 2(K a θ=5×10-4) B.NH 3·H 2O(K b θ=1×10-5) C.HAc(K a θ=1×10-5) D.HCOOH(K a θ=1×10-4) 22.相同浓度的CO 32-、S 2-、C 2O 42-三种碱性物质的水溶液,在下列叙述其碱性强弱顺序的关系中,哪一种说法是正确的(H 2CO 3:1pK a θ=6.38,2pK a θ=10.25;H 2S :1pK a θ=6.88,2pK a θ=14.15;H 2C 2O 4:1pK a θ=1.22,2pK a θ=4.19)A.CO 32->S 2->C 2O 42-B.S 2->C 2O 42->CO 32-C.S 2->CO 32->C 2O 42-D.CO 32->C 2O 42->S 2-23.欲配制pOH=4.0的缓冲溶液,对于下列四组缓冲体系,以选用( )效果最佳。
A NaHCO 3~Na 2CO 3 (PK b =3.8) B HAc~NaAc (PK a =4.7) C NH 4Cl~NH 3·H 2O (PK b =4.7) D HCOOH~HCOONa (PK a =3.8)24.乙醇胺(HOCH 2CH 2NH 2)和乙醇胺盐配制缓冲溶液的有效pH 范围是多少(乙醇胺的b pK θ=4.50)A.6~8B.4~6C.10~12D.8~10 25.+4NH 的共轭碱是( )A.-OHB.-2NHC.3NHD.2NH - 26.质子理论认为,下列物质中全部是碱的是A.HAc 、H 3PO 4、H 2OB.Ac -、PO 43-、H 2OC.HAc 、H 2PO 4-、OH -D.Ac -、PO 43-、NH 4+三.填空题1.-24SO 的共轭酸是____ ,3NH 的共轭碱是____ 。
2.按照酸减质子理论,[Fe (H 2O)5(OH)]2+的共轭酸是 。
其共轭碱是 。
3.在0.06mol·l -1HAc 溶液中,加入NaAc ,并使c(NaAc)=0.2 mol·l -1。
(已知 K a θ=1.8×10-5),混合液的c(H +)接近于 。
4. 能抵抗少量强酸、强碱的影响而保持溶液的pH 基本不变,例如体系 。
5. 在氨水溶液中加入NaOH 溶液,则溶液的OH -离子浓度 ,NH 4+离子浓 度 ,pH ,NH 3·H 2O 的解离度 。
6.下列分子或离子:HS -、CO 32-、H 2PO 4-、NH 3、H 2S 、NO 2-、HCl 、Ac -、H 2O,根据酸碱质子理论,属于酸的是 ,属于碱的是 ,既是酸又是碱的有 。
7.在0.10 mol ·L -1NH 3·H 2O 溶液中,浓度最大的物种是 ,浓度最小的物种是 。
加入少量NH 4Cl (s )后,NH 3·H 2O 的解离度将 ,溶液的pH 值将 ,H +的浓度将 . 8.已知吡啶的K b θ=1.7×10-9,其共轭酸的K a θ= 。
9.由质子理论对酸碱的定义可知,HCO 3-的共轭酸、碱是 。
10.将2.500g 纯一元弱酸HA 溶于水并稀释至500.0mL.已知该溶液的pH 值为3.15,则弱酸HA 的离解常数K aθ为 。
[M(HA)=50.0g ·mol -1]11.根据酸碱质子理论,在水溶液中的下列分子或离子:HSO 4-、C 2O 42-、H 2PO 4-、 [Al(H 2O)6]3+、NO 3-、HCl 、Ac -、H 2O 、[Al(H 2O)4(OH)2]+中,属于酸(不是碱)的 有 ;属于碱(不是酸)的有 既可作为酸又可作为碱的有 。
12.有A 、B 、C 、D 四种溶液,其中(A )pH=7.6,(B )pOH=9.5,(C )c (H +) =10-6.2,(D )c(OH -)=10-3.4,它们按酸性由弱到强的顺序是 。
