第2章第2节练习题
第二章声现象分节练习题

第1节声音的产生与传播(第一课时)一.填空题1、声音是由物体的产生的,一切发声的物体都在,停止,发声也停止。
2、我们把正在的物体叫做声源.3、声音的传播需要,声音能在、、物质中传播,但不能在中传播.隔墙有耳说明可以传声;说话声能将鱼吓跑说明可以传声;通常听到的声是靠传播的;不能传声,所以月球上不能面对面的交谈。
声音以的形式传播着,所以我们把它叫做声波.4.、悠扬的笛声是依靠__________的振动产生的.人讲话是依靠__________的振动产生的.演奏二胡时,用弓拉动琴弦,使琴弦而发声;二胡的声音是通过传播到我们耳中的.蝉的鸣叫是依靠__________的振动产生的.5.、为了探究声音产生的原因,小明和小华一起做了下面的实验,小明把手放在喉咙处大声讲话,感觉喉头振动了,小华把正在发声的音叉放在水中,水面激起了水花,通过对这两个实验现象的分析,你能得出的结论是:________________ 。
小华同学用手使劲敲桌子,桌子发出了很大的声响,但他几乎没有看到桌子的振动,为了明显地看到实验现象,你的改进方法是:_____________ 。
6、有四个实验现象:A、将正在发声的音叉接触水面,水面溅起水花;B.在鼓面上放些碎纸屑,敲鼓时可观察到纸屑在不停地跳动;C.放在真空罩里的手机当来电时,只见指示灯闪烁,听不见铃声;D、吊着的大钟上固定一支细小的笔,钟敲响后,用纸在笔尖上迅速水平拖过,纸上出现弯曲的图象;E、锣发声的时候,用手按住锣面,锣声消失.能够说明声音的产生条件的实验是:.二.选择题7、在探究"声音是由物体振动产生的"实验中,将正在发声的音叉紧靠悬线下的轻质小球,发现小球被多次弹开.这样做是为了( )A.使音叉的振动尽快停下来B.把音叉的微小振动放大,便于观察C.把声音的振动时间延迟D.使声波被多次反射形成回声8、兰兰做有关声现象的实验时,将一个正在发声的音叉贴近面颊,目的是为了【】A.感受发声音叉的振动B.体验发声音叉的温度C.估算发声音叉的质量D.判断声音的传播速度9.在敲大钟时,我们会发现,停止对大钟的敲击,大钟还余音未止,其主要原因是()A.余音是我们听到的钟声的回声 B.大钟还在振动C.钟停止了振动,但空气还在振动D.人的听觉发生了延长10.能说明“液体可以传播声音”的事例是:()A.我们听到雨滴打在雨伞上的“嗒嗒”声 B.我们听到树枝上小鸟的“唧唧”声 C.将要上钩的鱼被岸边的说话声吓跑 D.人在小溪边听到“哗哗”的流水声11、关于声源的认识正确的是( )A .凡是能发声的物体都是声源B .正在发声的物体叫做声源C .传递声音的物质也是声源D .声波就是声源12.下列属于气体振动而发出声音的是( )A.叮咚的鼓声B.哗哗的流水声C.隆隆的炮声D.悦耳的歌声三.实验探究13.如图1甲所示,用竖直悬挂的泡沫塑料球接触发声的音叉时,泡沫塑料球被弹起,这个现象说明 _____________ ;如图1乙所示,敲击右边的音叉,左边完全相同的音叉把泡沫塑料球弹起,这个现象说明 。
高一下学期化学合格考课后练习第2章第2节 电解质的电离 离子反应专项练习

第2章第2节电解质的电离离子反应专题练习一、电解质1.下列物质中能导电,但又不是电解质和非电解质的纯净物是( )A.熔融的NaClB.石墨晶体C.液氯D.盐酸2.下列叙述正确的是( )A.金属Na在熔融和溶于水时均能导电,所以Na是电解质B.SO3溶于水形成的溶液能导电,所以SO3是电解质C.通常情况下水不导电,所以水不是电解质D.氯化氢在液态时虽不导电,但溶于水后能导电,所以氯化氢是电解质3.下列说法正确的是( )A.水导电性很差,所以水是非电解质B.电解质与非电解质的本质区别,是在一定条件下自身能否电离C.酸、碱和盐类都属于电解质,其他化合物一定都是非电解质D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电4.下列水溶液中的电离方程式正确的是( )A.NaHSO4=Na++H++SO2-4B.Cu(NO3)2=Cu2++2(NO3)2-C.Ca(OH)2=Ca2++OH2-D.K2SO4=K++SO2-45.下列各组物质,前者属于电解质,后者属于非电解质的是( )A.NaCl晶体、BaSO4B.铝、二氧化硫C.液态的醋酸、酒精D.熔融的KNO3、硫酸溶液6.某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )A.MgCl2是非电解质B.MgCl2溶液是电解质C.MgCl2在水溶液中电离出了可以自由移动的离子D.MgCl2只有在溶液中才能导电7.下列电离方程式书写错误的是( )A.BaCl2= Ba2++Cl-B.Na2CO3=2Na++CO2-3C.MgCl2=Mg2++2Cl-D.Ba(OH)2=Ba2++2OH-8.下列物质中导电性最差的是( )A.0.6 mol·L-1的硫酸B.0.1 mol·L-1的盐酸C.熔融的NaClD.硝酸钾晶体9.今有一种固体化合物X,X本身不导电,但熔融状态或溶于水中均能够电离,下列关于X的说法中,正确的是( )A.X一定为电解质B.X可能为非电解质C.X只能是盐类D.X只能是碱类10.对电解质的叙述正确的是( )A.溶于水后得到的溶液能导电的物质B.熔融态能导电的物质C.电解质必须通电才能发生电离D.在水溶液中或熔融状态下能导电的化合物11.有以下10种物质:①铜②稀硫酸③氯化氢④氨气⑤空气⑥二氧化碳⑦金属汞(俗称水银)⑧氯化钠⑨硫酸钡⑩氯气12.(1)下列物质的电离方程式如下:HClO4=H++ClO-4;Ba(OH)2=Ba2++2OH-;Fe2(SO4)3=2Fe3++3SO2-4;KHSO4=K++H++SO2-4。
2020年八年级科学下册 期末复习 第2章 第二节 物质的微观粒子模型练习题 (新版)浙教版
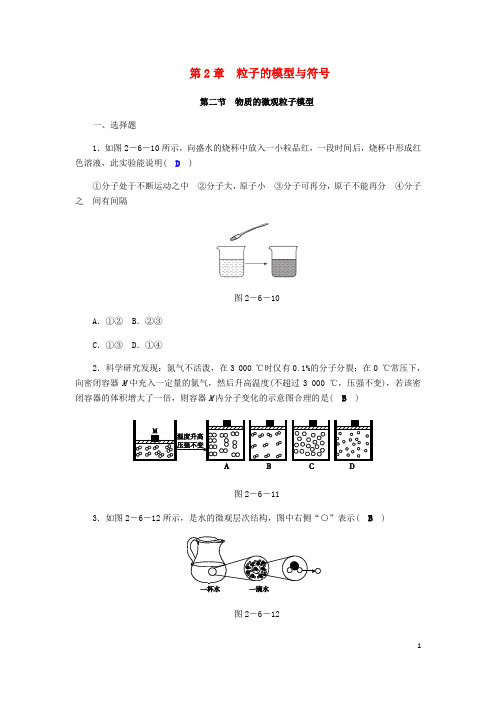
第2章粒子的模型与符号第二节物质的微观粒子模型一、选择题1.如图2-6-10所示,向盛水的烧杯中放入一小粒品红,一段时间后,烧杯中形成红色溶液,此实验能说明( D)①分子处于不断运动之中②分子大,原子小③分子可再分,原子不能再分④分子之间有间隔图2-6-10A.①② B.②③C.①③ D.①④2.科学研究发现:氮气不活泼,在3 000 ℃时仅有0.1%的分子分裂;在0 ℃常压下,向密闭容器M中充入一定量的氮气,然后升高温度(不超过3 000 ℃,压强不变),若该密闭容器的体积增大了一倍,则容器M内分子变化的示意图合理的是( B)图2-6-113.如图2-6-12所示,是水的微观层次结构,图中右侧“○”表示( B)图2-6-12A.氢元素 B.氢原子 C.氧元素 D.氧原子4.氧化汞受热时的变化可用如图2-6-13表示)。
据图得出的下列结论不正确的是( D)图2-6-13A.氧化汞受热时能分解成汞和氧气 B.原子是化学变化中的最小微粒C.分子在化学变化中可以再分 D.所有的物质都是由分子构成的5.下列粒子中不能直接构成物质的是( A)A.核外电子 B.原子 C.分子 D.离子6.下列对分子、原子、离子的认识(如图2-6-14所示),正确的是( B)图2-6-147( B)8.知识梳理有助于我们对已学知识的巩固,图2-6-15是某同学学习物质结构层次后,以氧气为例进行的梳理,下列选项中与a、b、c对应的是( A)图2-6-15A.原子、原子核、核外电子B.原子核、原子、核外电子C.原子、核外电子、原子核D.核外电子、原子核、原子图2-6-169.1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验。
如图2-6-16所示,在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:(1)大多数α粒子能穿透金箔而不改变原来的运动方向;(2)一小部分α粒子改变了原来的运动方向;(3)有极少部分α粒子被弹了回来。
工程化学基础课后习题答案

c(CO)=0.067mol/L
第四章 第四节练习题
1. (1) × (2) √ (3) × (4) √ 2. (1) c (2) a 3. Fe3+>Cu2+ >Fe2+ 4. Cl2>KMnO4>K2Cr2O7 5. (1) K θ=3.05 (2) c=0.075 6. (-) Pt / Fe3+, Fe2+ ∥ Ag+/ Ag (+)
第五章 第二节练习题
1. (1) B D (2) C 2. Ks=2.29*10-13 3. AgI沉淀生成,可能后有AgCl沉淀
[Ag] =8.52*10-11 无沉淀产生 4. [OH-] =3.98*10-10 pH=5.3 5. NH4Cl>H2O>NH3.H2O 6. c> b> a> d 7. [Ag]=7*10-6 [py]=0.8 [Ag(py)2]+=0.1
(2) 分子晶体 分子质量越大 熔沸点越高 5. (1) BaCl2 >FeCl2 >AlCl3 >CCl4
(2) SiO2 >BaO >CO2
第二章 第三节练习题
1. (1) 方向 饱和 降低 氢 氧 (2) 单位质量溶剂 (4) 8 润湿 14-18 o/w乳化剂 (5) 热致 溶致
2. (1) 降低 [H+]增加 (2) 升高 [H+]增加 (3) 下降 △T= Kf bB (4) 依次降低 (5) 一次升高
5. 组态
是否存在
1p
2s
2d
3p
5f
6s
×
√×√ຫໍສະໝຸດ √√主量子数
×
2
角量子数
×
中级经济师-知识产权-基础练习题-第二章专利申请-第二节专利授权的基本要求

中级经济师-知识产权-基础练习题-第二章专利申请-第二节专利授权的基本要求[单选题]1.以下不属于外观设计专利授权基本要求的是()。
A.是否违反国家法律与社会公德B.是否属于专利法意义下(江南博哥)的发明创造C.是否属于不授予专利权的发明创造D.是否属于现有技术正确答案:D参考解析:专利保护客体涉及三类问题:①是否违反国家法律与社会公德的审查,所依据的法条是《专利法》第5条;②是否属于专利法意义下的发明创造,其中限定了三类专利保护客体,所依据的法条是《专利法》第2条;③是否属于不授予专利权的发明创造,所依据的法条是《专利法》第25条。
是否属于现有技术属于考察发明和实用新型专利的条件,但不属于考察外观设计专利的要求。
[单选题]2.关于判断一项权利要求是否属于实用新型专利保护客体的要点,说法不正确的是()。
A.要点在于判断是否系技术方案B.要点在于判断是否系对产品或者其改进所提出的新的技术方案C.要点在于判断是否系对方法或者其改进所提出的新的技术方案D.要点在于是否系对产品的形状、构造或者其结合的改进正确答案:C参考解析:根据《专利法》第2条第二款的规定,实用新型是指对产品的形状、构造或者其结合所提出的适于实用的新的技术方案。
由此可知,实用新型仅限于对产品创新,不包括方法创新。
[单选题]3.杨教授于2019年3月1日在国际专业医学研讨会上首次公开并演示了一种新医疗器械。
胡教授独立研发出相同的产品并在2019年6月2日出版的医学期刊上详细介绍了该医疗器械的设计思路和工作原理。
胡教授和杨教授分别于2019年6月12日和2019年7月1日就该医疗器械申请专利。
下列说法正确的是()。
A.胡教授独立完成发明并且在杨教授之前提出了专利申请,因此应当由胡教授获得专利权B.杨教授和胡教授的上述专利申请均不具备新颖性C.杨教授和胡教授的上述专利申请均具备新颖性D.杨教授的专利申请享受6个月的宽限期,因此其专利申请具备新颖性正确答案:B参考解析:专利申请采用先申请原则,胡教授申请在先,杨教授的申请则丧失了新颖性。
人教版八年级物理第二章第2节《声音的特性》练习

《声音的特性》练习1.(多选)有两个发声体,第一次由甲单独发声,测得为88dB.第二次由乙单独发声,由固定在同一地方的仪器测得为56dB.下面判断中正确的是()A.甲发声体振动快快B.乙发声体距仪器可能远C.甲发声距仪器可能远D.乙发声体振幅一定大2.(多选)下列关于声音的说法中正确的是()A.“隔墙有耳”说明固体也能传声B.“响鼓也要重锤敲”表明振幅越大,响度越大C.“震耳欲聋”是指声音的音调高D.“闻其声而知其人”主要根据音色来判断的3.我们在研究“响度和什么有关”的实验中,采用了图中所示的装置。
当用小锤用更大的力敲击音叉的时候,会发现系在细绳子上的乒乓球轻触音叉后又弹开的幅度(选填“变大”、“变小”或“不变”),这说明了越大,产生的声音的响度越大。
在实验中通过观察来反映音叉振动的幅度,这是运用了物理学中的转换法来研究的。
4.如图1所示是几种声音输入到示波器上时显示的波形,其中音调相同的是和;响度相同的是和。
(填“甲”、“乙”、“丙”)如图2所示两种声音不同。
5.医生在看病时使用听诊器为病人诊病。
听诊器将来自患者的声音信息通过橡皮管传送到医生的耳朵,这说明声音能通过传播(填“固体”“液体”或“气体”);医生根据病人传过来的声音确定病症,说明人体发出的声音能(填“具有能量”或“传递信息”);医生使用听诊器目的是:为了提高声音的(填“音调”或“响度”)。
6.我国古书《梦溪笔谈》中记载:行军宿营,士兵枕着牛皮制的箭筒睡在地上,能较早听到夜袭的敌人的马蹄声,其原因是能够传声,且比空气传声的速度。
音乐会上正演奏着小提琴协奏曲《梁山泊与祝英台》,优美的音乐是由于琴弦的产生的,这动人的乐曲是通过传到观众的耳朵的。
7.在学习吉他演奏过程中,小华发现琴弦发出声音的音调高低是受各种因素影响的,他决定对此进行研究。
经过和同学们讨论,提出了以下猜想:猜想一:琴弦发出声音的音调高低,可能与琴弦的横截面积有关;猜想二:琴弦发出声音的音调高低,可能与琴弦的长短有关;猜想三:琴弦发出声音的音调高低,可能与琴弦的材料有关。
高中化学教师资格证笔试练题:第二章 第二节化学平衡

第二章化学反应速率与化学平衡第二节化学平衡练习题一、单选题(共16题)1.可逆反应223N +3H 2NH 的正、逆反应速率可用各反应物或生成物浓度的变化来表示,下列各关系中能说明反应已达到最大限度(即化学平衡)的是A .N 2将完全转化为NH 3B .N 2、H 2和NH 3的物质的量浓度相等C .N 2、H 2和NH 3的物质的量浓度不再变化D .正反应和逆反应的速率都为零2.一定温度下,在恒容密闭容器中发生反应:2NO 2(g)+O 3(g)N 2O 5(g)+O 2(g)。
当NO 2、O 3、N 2O 5、O 2的浓度不再变化时,下列说法正确的是A .该反应已达到化学平衡状态B .正、逆反应速率相等且等于零C .NO 2和O 3全部转化为N 2O 5和O 2D .NO 2、O 3、N 2O 5、O 2的浓度一定相等3.化学反应()()()223O g 2SO g 2SO g +在硫酸工业中有重要应用。
关于该反应的叙述正确的是A .无限延长化学反应的时间能改变化学反应的限度B .2O 、2SO 、3SO 的物质的量比1:2:2时达到平衡状态C .该反应达到化学平衡状态时,正反应速率和逆反应速率相等且等于零D .若开始加入2SO 和182O ,达到化学平衡时核素18O 存在于三种物质中4.t ℃ 时,反应 N 2+3H 2 催化剂高温高压2NH 3在容积固定的密闭容器中进行,达到平衡状态的标志是A .v(NH 3)= 2v(N 2)B .H 2的物质的量浓度不再发生变化C .单位时间内消耗2 mol NH 3的同时生成1mol N 2D .1molN 2和3molH 2完全转化为2molNH 35.一定温度下,在2L 恒容密闭容器中放入0.2mol NO 和0.2mol CO ,在催化剂存在条件下发生反应:2NO(g)+2CO(g)2CO 2(g)+N 2(g)。
测得NO 的物质的量变化如表:下列说法正确的是A.15min时,反应恰好达到平衡状态B.0~5min,NO的平均速率为0.016mol•L-1•min-1C.其他条件不变,升高反应温度,平衡时NO的物质的量小于0.06molD.20min时压缩容器的容积,正逆反应速率均加快,正反应速率加快幅度更大6.在一定条件下,在容积不变的密闭容器中,1molN2和3molH2发生反应N2(g)+3H2(g)2NH3(g)。
鲁科版生物-六年级上册-第二单元第二章第2节 单细胞生物 (第2课时)课时练习

单细胞的生物体一、选择题1.草履虫的呼吸是依靠()A.食物泡B.表膜C.收集泡D.纤毛2.草履虫以其他生物为食的主要原因是()A.身体为一个细胞B.体内没有叶绿素C.细胞结构不完整D.不能进行新陈代谢3. (2014烟台)右图是在显镬镜下观察到的草履虫结构示意图,草履虫运动和取食的结构分别是A.1和3 B.2和6 C.4和2 D.4和34.单细胞生物对人类()A.都是有害的B.都是有利的C.即有有利的一面,又有有害的一面D.无影响5.对人类有害的单细胞生物是()A.醋酸菌 B.酵母菌C.草履虫 D.疟原虫6.草履虫体表的纤毛分布在()A.全身的表膜B.体表一圈C.口沟内D.身体前段7.草履虫呼吸作用产生的废物排出体外的途径是()A.口沟B.胞肛C.食物泡D.伸缩泡收集管和表膜8.草履虫能够进行运动,是依靠哪一部分结构()A.收集管B.纤毛C.表膜D.细胞质二、综合题9.右图是草履虫的结构图,请读图并完成后面的填空。
(1)草履虫生活在_________ 中,靠_________ 进行运动.(2)食物在_________ 附近的_________ 的快速摆动下被送如口内,再进入_________ 内,形成_________ ,逐渐被消化.(3)草履虫通过_________ 从水中获得氧气,并通过_________ 将产生的二氧化碳排出体外。
(4)草履虫代谢的废物是由_________ 收集,进而排出体外的.(5)不能消化的食物残渣从_________ 排出。
(6)根据显微镜下的观察,草履虫不具备_________ ,不能进行光合作用,以水中的细菌、真菌和其他有营养的碎屑为_________ ,因此属于生态系统中的_________ (7)在观察草履虫的实验中,用来观察的液滴应取自培养液的_________ ,因为_________ 。
(8)草履虫体内含有遗传物质并与生殖相关的结构是_________ 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 第二节化学反应的快慢和限度练习一1.在下列影响化学反应速率的外界因素中,肯定能使化学反应速率加快的方法是( ) ①升高温度 ②加入正催化剂 ③增大反应物浓度 ④将块状固体反应物磨成粉末 ⑤增大压强 A .①②③④ B .①②④⑤C .①③④⑤D .①②③④⑤2.通过控制或改变反应条件可以加快、减缓甚至阻止反应的进行,使化学反应有利于人类的生存和提高生活质量。
下列各图所示的措施中,能加快化学反应速率的是()3.下列实验中,反应速率加快是由催化剂引起的是( )A .在炭粉中加入KClO 3,点燃时燃烧更为剧烈B .H 2O 2中加入少量MnO 2,即可迅速放出气体C .将炭块粉碎成粉末状,可使燃烧更加充分D .电解水时,加少量硫酸可使电解速率加快 4.下列各组反应(表中物质均为反应物):25.反应E +F===G 在温度t 1下进行,反应M +N===K 在温度t 2下进行,已知t 1>t 2,且E 和F 的浓度大于M 和N 的浓度(其他条件相同),则两者的反应速率( )A .前者大B .后者大C .相等D .无法判定6.实验室利用反应:Na 2S 2O 3+H 2SO 4===Na 2SO 4+S ↓+SO 2↑+H 2O ,以溶液变浑浊时间的长短来研究影响化学反应速率的因素,下列各组实验中化学反应速率最大的是( )72A .0.2 mol/(L·s) B .0.4 mol/(L·s) C .0.6 mol/(L·s)D .0.8 mol/(L·s)8.反应2SO 2+O 22SO 3经一段时间后,SO 3的浓度增加了0.4 mol·L -1,在这段时间内用O 2表示的反应速率为0.04 mol·(L·s)-1,则这段时间为( )A .0.1 sB .2.5 sC .5 sD .10 s9.100 mL 6 mol/L H 2SO 4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )A .Na 2CO 3固体B .水C .K 2SO 4固体D .KNO 3溶液10.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V )与时间(t )关系如图。
反应中镁和铝的( )A .物质的量之比为3∶2B .质量之比为3∶2C .摩尔质量之比为2∶3D .反应速率之比为2∶3 11.在下列事实中,各是什么因素影响了化学反应速率?(1)集气瓶中盛有氢气和氯气的混合气体,在瓶外点燃镁条时,混合气体爆炸: ________________。
(2)熔化的KClO 3冒出气泡速率很慢,撒入少量MnO 2很快产生气体:________________________。
(3)同浓度同体积的盐酸中放入同样大小的镁条和铝条,产生气体有快有慢:____________________。
(4)夏天食品易变质,而冬天不易发生该现象:____________________________________。
(5)同样大小的石灰石分别在1 mol·L -1盐酸和0.1 mol·L-1盐酸中反应速率不同:________________。
12.某温度时,在2 L 容器中,X 、Y 、Z 三种物质的物质的量随时间变化的曲线如图所示。
由图中数据分析:该反应的化学方程式为_______________________。
反应开始至2 min ,用Z 表示的平均反应速率为__________。
13.2SO 2(g)+O 2(g)催化剂△2SO 3(g)反应过程的能量变化如图所示。
已知该反应的正反应为放热反应。
请回答下列问题:(1)图中A 、C 分别表示________、________;(2)V 2O 5的催化循环机理可能为:V 2O 5氧化SO 2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。
写出该催化循环机理的化学方程式____________________________________;(3)如果反应速率v (SO 2)为0.05 mol·L -1·min -1,则v (O 2)=______mol·L -1·min -1,v (SO 3)=____mol·L -1·min -1。
14.下表是稀硫酸与某金属反应的实验数据:(1)实验4和5表明________对反应速率有影响,__________,反应速率越快,能表明同一规律的实验还有________(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有________(填实验序号);(3)在实验中影响反应速率的其他因素还有________,其实验序号是________________________。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15 ℃)相近,推测其原因:________________________________________________________________________。
练习二1.化学反应限度的控制在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面的说法错误的是( )A .能够节约原料和能源B .能够提高产品的产量C .能够提高经济效益D .能够提高化学反应速率 2.下列各组反应中,属于可逆反应的一组是( ) A .2H 2O 通电=== 2H 2↑+O 2↑,2H 2+O 2点燃=== 2H 2OB .NH 3+CO 2+H 2O===NH 4HCO 3,NH 4HCO 3△=== NH 3↑+CO 2↑+H 2O C .H 2与I 2在加热时生成HI ,同时HI 又分解出H 2和I 2 D .2Ag +Br 2CuO=== 2AgBr,2AgBr=====光2Ag +Br 23.在容器中充入SO 2和只由18O 原子组成的氧气(18O 2)。
在一定条件下达到平衡时,18O 存在于( ) A .只存于O 2中 B .只存在于O 2和SO 3中C .只存在于SO 2和SO 3中D .SO 3、SO 2和O 2中都有可能存在 4.下列关于化学反应限度的说法中不.正确的是( ) A .当一个可逆反应达到平衡状态时,就是这个反应在该条件下所能达到的限度B .当一个可逆反应进行到平衡状态时,那么这个反应的正向反应速率和逆向反应速率相等C .平衡状态是一种静止的状态,因此反应物和生成物的浓已经不再改变D .化学反应的限度可以通过改变条件而改变 5.对于可逆反应H2(g)+I 2(g) 2HI(g),在温度一定下由H 2(g)和I 2(g)开始反应,下列说法正确的是(双选)( )A .H 2(g)的消耗速率与HI(g)的生成速率之比为2∶1B .反应进行的净速率是正、逆反应速率之差C .正、逆反应速率的比值是恒定的D .达到平衡时,正、逆反应速率相等6.如图是某一化学反应从反应开始至达到化学平衡时的正、逆反应速率的变化情况,下列有关叙述正确的是( )A .反应开始时,只加入了反应物B .反应开始时,只加入了产物C .反应开始时,既加入了反应物又加入了产物,反应正向进行达平衡D .反应开始时,既加入了反应物又加入了产物,反应逆向进行达平衡 7.可逆反应2HI(g)H2(g)+I 2(g)在密闭容器中进行,当下列物理量不再随时间变化时,才能说明该反应已达平衡,该选项是(双选)( )A .混合气体的压强B .混合气体的颜色C .各组分的浓度D .混合气体的密度 8.在一定温度下,反应A2(g)+B 2(g)2AB(g)达到平衡的标志是( )A .单位时间生成n mol 的A 2同时生成n mol AB B .容器内的总压强不随时间变化C .单位时间生成2n mol 的AB 同时生成n mol 的B 2D .单位时间生成n mol 的A 2同时生成n mol 的B 2 9.从植物花瓣中可提取一种简写为HIn 的有机物,它在水溶液中因存在下列平衡:HIn(溶液,红色)H+(溶液)+In -(溶液,黄色)而可以用作酸碱指示剂。
往该溶液中加入Na 2O 2粉末,则溶液颜色为( ) A .红色变深 B .黄色变浅 C .黄色变深 D .退为无色10.在密闭容器中进行如下反应:X2(g)+Y 2(g)2Z(g),已知X 2、Y 2、Z 的起始浓度分别为0.1 mol/L 、0.3 mol/L 、0.2 mol/L ,在一定条件下,当反应达到平衡时,各物质的浓度有可能是(双选)( )A.Z为0.3 mol/L B.Y2为0.35 mol/L C.X2为0.2 mol/L D.Z为0.4 mol/L11.在200 ℃时,将a mol H2(g)和b mol I2(g)充入到体积为V L的密闭容器中,发生反应:I2(g)+H2(g) 2HI(g)。
(1)反应刚开始时,由于c(H2)=_________,c(I2)=___________,而c(HI)=________,所以化学反应速率________最大,而________最小(为零)。
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(H2)________,c(I2)________,而c(HI)________,从而化学反应速率v(正)________,而v(逆)________。
(3)当反应进行到v(正)与v(逆)________时,此可逆反应就达到了最大限度,若保持外界条件不变时,混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率和生成物的产率及体系的总压强(或各组分的分压)都将________。
12.在2 L密闭容器中,800 ℃时反应2NO(g)+O(g) 2NO2(g)体系中,n(NO)随时间的变化如表:(1)A点处,v(填空)。
(2)如图中表示NO2的变化的曲线是________。
用O2表示从0~2 s内该反应的平均速率v=________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变c.v逆(NO)=2v正(O2) d.容器内的密度保持不变(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体b.适当升高温度c.增大O2的浓度d.选择高效的正催化剂13.在一体积为10 L的容器中,通入一定量的CO和H2O,850 ℃时发生反应:O(g) CO2(g)+H2(g)CO(g)+H(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率v(CO)=________mol·L-1·min-1。
