淡水生物调查技术规范
淡水生物资源调查技术规范

淡水生物资源调查技术规范篇一:淡水生物调查规范宁波大学生命科学与生物工程学院2000 年 7 月一.浮游植物定量调查(一)采样点的选择由于水面大小、水深、水流等条件不同,不同水域的采集点选择也有差别,有条件时采样点可适当多设一些,一般情况下建议下列位置应设采样点:水库库心区、各湖区的中点、上游、下游、水库大坝附近及库(湖)湾等有代表的区域。
(二)采样层次、采水量及采样次数①凡水深不超过二米者,可于采样点水下0.5米处采水。
②水深2-10米以内,应于距库底0.5米处另采一个水样。
③水深超过10米时,应于中层处增采一个水样。
深水湖泊、水库可根据具体情况确定采样层次。
采样次数可多可少,有条件时可逐月采样一次,一般情况可每季采样一次,最低限度应在春季和夏未秋初各采样一次。
每一采样点应采水1000毫升,如系一般性调查,可将各层所采水样等量混合,取1000毫升水样固定;或者分层采水分别计数后取平均值。
分层采水可以了解每一采样点各层水中浮游植物的数量和种类。
采得水样后应立即加入15毫升碘液(即鲁哥氏液)固定(鲁哥氏液配制方法:将6克碘化钾溶于20毫升水中,待其完全溶解后,加入4克碘充分摇动,待碘全溶解后加入80毫升水即可)。
采水器,各种采水器均可,但一定要能分层采水,一般水深不超过10米可用1000毫升或1500的玻瓶采水器,水更深(如海洋)必须用颠倒采水器、北原式采水器或其它形式的采水器。
(三)沉淀与浓缩以采水器采得水样后,须经浓缩沉淀方适于研究和保存。
凡以碘液固定的水样瓶塞要拧紧,还要加入2-4%的甲醛固定液以利保存。
定量水样应放入1000毫升分液漏斗中,静置24-36小时后,用内径为30毫米的橡皮乳胶管,接上橡皮球,利用虹吸法将沉淀上层清液缓慢吸出(切不可搅动底部,万一动了应重新静置沉淀),剩下30-50毫升沉淀物,倒入定量瓶中以备计数。
为不使漂浮水面的某些微小生物等进入虹吸管内,管口应始终低于水面,虹吸时流速流量不可过大,吸至澄清液1/3时,应控制流速流量,使其成滴缓慢流下为宜。
淡水水生态调查方法

淡水水生态调查方法一,浮游生物部分(一)浮游植物、原生动物与轮虫1,定性样品采集与保存25号浮游生物网在水面下约0.5 m内以适当的速度作“∞”字形来回拖动1-3min,获得的浓缩样(约30-50ml)即为定性样品。
甲醛(4%)或鲁哥氏液(适量)现场固定,或活体带回实验室及时镜检。
2,定量样品采集与保存(1)采集与保存:用有机玻璃定深采水器采集表层或混合水样。
水样量:一般1000ml(贫营养水体应酌情增加水量),加入鲁哥氏液(长期保存样品也可用甲醛溶液)现场固定,避光,避热,带回实验室。
鲁哥氏液:6g 碘化钾+4g 碘+100ml水,1L水样中加入10-15ml。
浓缩鲁哥:样品量大时野外采样用,60g 碘化钾+40g 碘+100ml水,1L水样中加入1-1.5ml。
(2)沉淀浓缩处理设备:浮游生物沉淀器、吸耳球、虹吸管。
沉淀时间:24~48 h(禁止任何形式的搅动)。
沉淀完成后用虹吸管将上层清液小心吸出,下层沉淀摇动后转入50ml样品瓶用上清液冲洗三次沉淀器并转入样品瓶。
浓缩注意事项:浓缩最终体积视藻类多寡而定,藻多则最终样品体积大于50ml,藻少则小于50毫升;可以用透明度做相对的参考指标,以镜检时每个视野(40倍物镜下)有十几个藻为宜。
保存注意事项:①瓶塞要拧紧;②长期保存时加入甲醛溶液(体积分数2-4%)(二)浮游甲壳动物1,定性样品采集与保存13号浮游生物网(孔径0.112mm),水面下约0.5 m内,“∞”字形来回拖动,1-3min,加入5%甲醛固定。
2,定量样品采集与保存采不同水层水样10-50L用25号(注意,与定性网不同)浮游生物网过滤(滤缩法)——个体大,密度较低。
过滤后的生物网放在水中洗2-3次,多余的水滤过之后,网底管中的液体也放入样品瓶中。
加入甲醛(5%)固定。
二,理化参数部分总磷TP、总氮TN、正磷酸盐PO4-P、硝酸盐氮NO3-N、亚硝态氮NO2-N、氨氮NH4-N、化学需氧量COD、生化需氧量BOD、总有机碳TOC、总无机碳TIC、溶解氧DO、pH、氧化还原电位ORP、电导率CoND、水温、透明度SD、水色等,可酌情选择部分或全部参数。
淡水生物调查技术规范
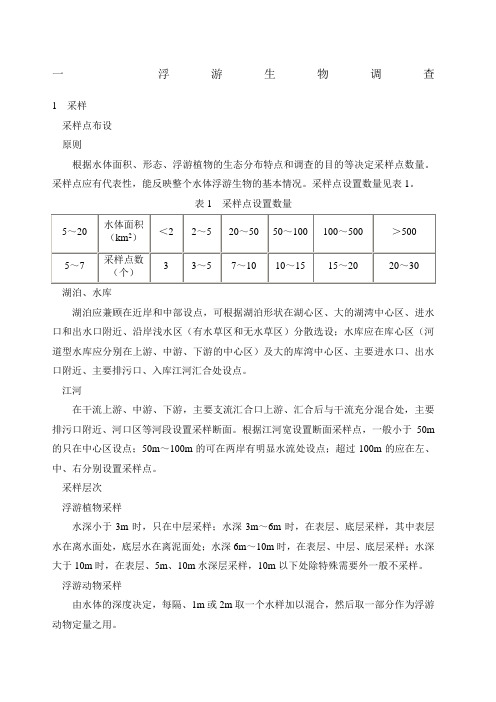
一浮游生物调查1采样采样点布设原则根据水体面积、形态、浮游植物的生态分布特点和调查的目的等决定采样点数量。
采样点应有代表性,能反映整个水体浮游生物的基本情况。
采样点设置数量见表1。
表1采样点设置数量湖泊、水库湖泊应兼顾在近岸和中部设点,可根据湖泊形状在湖心区、大的湖湾中心区、进水口和出水口附近、沿岸浅水区(有水草区和无水草区)分散选设;水库应在库心区(河道型水库应分别在上游、中游、下游的中心区)及大的库湾中心区、主要进水口、出水口附近、主要排污口、入库江河汇合处设点。
江河在干流上游、中游、下游,主要支流汇合口上游、汇合后与干流充分混合处,主要排污口附近、河口区等河段设置采样断面。
根据江河宽设置断面采样点,一般小于50m 的只在中心区设点;50m~100m的可在两岸有明显水流处设点;超过100m的应在左、中、右分别设置采样点。
采样层次浮游植物采样水深小于3m时,只在中层采样;水深3m~6m时,在表层、底层采样,其中表层水在离水面处,底层水在离泥面处;水深6m~10m时,在表层、中层、底层采样;水深大于10m时,在表层、5m、10m水深层采样,10m以下处除特殊需要外一般不采样。
浮游动物采样由水体的深度决定,每隔、1m或2m取一个水样加以混合,然后取一部分作为浮游动物定量之用。
采样频次和采样时间采集次数依研究目的而定,采样次数可逐月或按季节进行,一般按季节进行。
样品瓶必须贴上标签,标明采集时间、地点。
采样时间尽量保持一致,一般在上午8:00~10:00进行。
采样方法浮游植物采样定量样品在定性采样之前用采水器采集,每个采样点取水样1L,贫营养型水体应酌情增加采水量。
泥沙多时需先在容器内沉淀后再取样。
分层采样时,取各层水样等量混匀后取水样1L。
大型浮游植物定性样品用25号浮游生物网在表层缓慢拖曳采集,注意网口与水面垂直,网口上端不要露出水面。
浮游动物采样原生动物、轮虫和无节幼体定量可用浮游植物定量样品,如单独采集取水样量以1L 为宜;定性样品采集方法同浮游植物。
(完整版)淡水生物资源调查技术规范

淡水生物资源调查技术规范1 范围本标准规定了浮游植物和浮游动物采样、样品保存、定性及定量分析方法,着生生物的定性调查方法,底栖动物采样、样品保存和生物量计算方法,大型水生植物调查方法等。
本标准适用于湖南省水库、江河、湖泊等水体水生生物资源调查。
2 规范性引用文件下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
SC/T 9102 渔业生态环境检测规范第三部分:淡水部分SL 88 叶绿素的测定分光光度法SL 167 水库渔业资源调查3 淡水生物资源调查主要内容淡水生物资源调查主要内容见表1。
4 水体形态与自然环境调查水体形态与自然环境调查的主要内容见附录A的表A.1、A.2、A.3、A.4。
表中各项目的资料、数据,可从所属管理单位和当地水产、水利、农业、林业、气象、水文、环保等部门获取,也可通过调查访谈或独立观测方式获取。
4.1 气候需了解年、季节气候特征,年最高气温、最低气温、平均气温和气温年变化,年(月)均风速、主导风向,年(月)均降水量、年均相对湿度,年均日照时数、无霜期、冰封期等。
4.2 水体1最高水位、最低水位,水体交换量,湖(库)湾数量及主要湖(库)湾的面积和水深,底质类型及特性。
湖泊还需调查容积、湖岸线长度、湖底倾斜度,含盐量等;水库需调查总库容、兴利库容、死库容,枯水期、丰水期,入库径流,各径流流量;河流需调查源头、终点,流经地区,流速和流量,含沙量,各支流名称及特征等。
4.3 水体污染源主要调查水体沿岸工业污染源分布情况,农业(农田)污染源分布情况,人口分布与生活污水排放情况,矿山污染情况等。
4.4 周围环境需调查水体周围或集雨区的面积、地貌、土壤类型及特性;植被类型及覆盖率;水土流失情况;矿产资源的种类、分布、储量和开采情况;自然保护区面积和保护状况;风景名胜区级别、旅游情况。
(完整版)淡水生物调查技术规范

一浮游生物调查1采样1.1采样点布设1.1.1原则根据水体面积、形态、浮游植物的生态分布特点和调查的目的等决定采样点数量。
采样点应有代表性,能反映整个水体浮游生物的基本情况。
采样点设置数量见表1。
表1采样点设置数量1.1.2湖泊、水库湖泊应兼顾在近岸和中部设点,可根据湖泊形状在湖心区、大的湖湾中心区、进水口和出水口附近、沿岸浅水区(有水草区和无水草区)分散选设;水库应在库心区(河道型水库应分别在上游、中游、下游的中心区)及大的库湾中心区、主要进水口、出水口附近、主要排污口、入库江河汇合处设点。
1.1.3江河在干流上游、中游、下游,主要支流汇合口上游、汇合后与干流充分混合处,主要排污口附近、河口区等河段设置采样断面。
根据江河宽设置断面采样点,一般小于50m的只在中心区设点;50m~100m的可在两岸有明显水流处设点;超过100m的应在左、中、右分别设置采样点。
1.2采样层次1.2.1浮游植物采样水深小于3m时,只在中层采样;水深3m~6m时,在表层、底层采样,其中表层水在离水面0.5m处,底层水在离泥面0.5m处;水深6m~10m时,在表层、中层、底层采样;水深大于10m时,在表层、5m、10m水深层采样,10m 以下处除特殊需要外一般不采样。
1.2.2浮游动物采样由水体的深度决定,每隔0.5m、1m或2m取一个水样加以混合,然后取一部分作为浮游动物定量之用。
1.3采样频次和采样时间采集次数依研究目的而定,采样次数可逐月或按季节进行,一般按季节进行。
样品瓶必须贴上标签,标明采集时间、地点。
采样时间尽量保持一致,一般在上午8:00~10:00进行。
1.4采样方法1.4.1浮游植物采样定量样品在定性采样之前用采水器采集,每个采样点取水样1L,贫营养型水体应酌情增加采水量。
泥沙多时需先在容器内沉淀后再取样。
分层采样时,取各层水样等量混匀后取水样1L。
大型浮游植物定性样品用25号浮游生物网在表层缓慢拖曳采集,注意网口与水面垂直,网口上端不要露出水面。
淡水生物调查技术规范完整版

淡水生物调查技术规范 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】一浮游生物调查1 采样采样点布设原则根据水体面积、形态、浮游植物的生态分布特点和调查的目的等决定采样点数量。
采样点应有代表性,能反映整个水体浮游生物的基本情况。
采样点设置数量见表1。
表1 采样点设置数量湖泊、水库湖泊应兼顾在近岸和中部设点,可根据湖泊形状在湖心区、大的湖湾中心区、进水口和出水口附近、沿岸浅水区(有水草区和无水草区)分散选设;水库应在库心区(河道型水库应分别在上游、中游、下游的中心区)及大的库湾中心区、主要进水口、出水口附近、主要排污口、入库江河汇合处设点。
江河在干流上游、中游、下游,主要支流汇合口上游、汇合后与干流充分混合处,主要排污口附近、河口区等河段设置采样断面。
根据江河宽设置断面采样点,一般小于50m的只在中心区设点;50m~100m的可在两岸有明显水流处设点;超过100m的应在左、中、右分别设置采样点。
采样层次浮游植物采样水深小于3m时,只在中层采样;水深3m~6m时,在表层、底层采样,其中表层水在离水面处,底层水在离泥面处;水深6m~10m时,在表层、中层、底层采样;水深大于10m时,在表层、5m、10m水深层采样,10m以下处除特殊需要外一般不采样。
浮游动物采样由水体的深度决定,每隔、1m或2m取一个水样加以混合,然后取一部分作为浮游动物定量之用。
采样频次和采样时间采集次数依研究目的而定,采样次数可逐月或按季节进行,一般按季节进行。
样品瓶必须贴上标签,标明采集时间、地点。
采样时间尽量保持一致,一般在上午8:00~10:00进行。
采样方法浮游植物采样定量样品在定性采样之前用采水器采集,每个采样点取水样1L,贫营养型水体应酌情增加采水量。
泥沙多时需先在容器内沉淀后再取样。
分层采样时,取各层水样等量混匀后取水样1L。
大型浮游植物定性样品用25号浮游生物网在表层缓慢拖曳采集,注意网口与水面垂直,网口上端不要露出水面。
水生生物调查技术规范

水生生物调查技术规范1范围本标准规定了水生生物调查的对象、方法、项目及数据统计方法等内容。
本标准适用于河流、湖泊、水库等地表水域的水生生物调查。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB3838-2002地表水环境质量标准HJ710-2014生物多样性观测技术导则SL219水环境监测规范GB/T13195水质水温的测定温度计或颠倒温度计测定法HJ506水质溶解氧的测定电化学探头法GB/T6920水质pH值的测定玻璃电极法SL88水质叶绿素的测定分光光度法SL167水库渔业资源调查规范3术语和定义下列术语和定义适用于本文件。
3.1浮游植物p hytoplankton指悬浮于水中生活的微小藻类,亦称浮游藻类。
通常包括蓝藻门、隐藻门、甲藻门、金藻门、黄藻门、硅藻门、裸藻门、绿藻门等,不包括细菌和其它植物。
3.2浮游动物zooplankton指悬浮于水中的微小动物,没有游泳能力,或仅有微弱的游泳能力。
通常包括原生动物、轮虫、枝角类和桡足类等几大类。
3.3底栖动物benthic invertebrate指生活史全部或大部时间生活于水体底部体长大于0.5mm的水生无脊椎动物群落,肉眼可见。
栖息的方式多为固着于岩石等坚硬物体的表面或埋没于泥沙等较松软的表层沉积物中,以及附着于植物或其它动物体表。
淡水生底栖动物主要包括水生寡毛类、软体动物和水生昆虫幼虫等。
3.4两栖动物a mphibians指脊椎动物进化史上由水生向陆生的过渡类型,成体可适应陆地生活,但繁殖和幼体发育还离不开水。
主要的特征是:体温不恒定;卵生,幼体在水中生活,经变态后成体可适应陆地生活,用肺呼吸,皮肤裸露而湿润,无鳞片、毛发等皮肤衍生物,粘液腺丰富,具有辅助呼吸功能。
3.5爬行动物r eptile指属于脊椎动物门、四足总纲的羊膜动物,是对蜥形纲及合弓纲除鸟类及哺乳类以外所有物种的通称,包括了龟、蛇、蜥蜴、鳄及已绝灭的恐龙与似哺乳爬行动物等。
重点河流水生生物多样性调查与评估技术要求

重点河流水生生物多样性调查与评估技术要求中国环境科学研究院生物多样性研究中心2017.7一、总则(一)调查目标在长江、珠江、黄河、海河、辽河、淮河、松花江等七大重点河流干支流及附属水体开展水生生物多样性调查与评估,查明水生生物种类、分布、数量,评估重点河流水生生物多样性现状及受威胁情况,为全面开展生物多样性调查与评估提供经验,为水生生物多样性保护管理和决策制定提供科学依据。
(二)调查对象淡水鱼类、大型底栖动物(包括多毛类、寡毛类、水生昆虫、软体类、甲壳类等)、浮游生物(包括浮游动物和浮游藻类)。
(三)调查周期每个重点河流调查与评估周期为2年。
二、调查要求(一)调查准备根据调查目的、任务以及调查对象,确立调查工作所涉及的区域或范围,收集、分析与调查任务有关的文献和相关资料,初步确定调查范围内的重点物种名单。
结合调查地区的实际情况,组织调查队伍,开展必要的人员培训,准备野外作业需要的工具,包括样品采集用具、标本保存处理用具、标本防腐剂、照相设备、信息记录用具、工具书等。
在开展现场踏查和野外采样前,必须进行野外安全培训。
(二)技术要求1、调查采样频次鱼类、水生哺乳类按照丰水、枯水及平水期进行采样或调查,至少保证春季和秋季两次调查。
底栖动物、浮游生物及着生藻类等类群每季度开展一次采样调查。
各类群在经费允许和采样方便的情况下可增加调查采样频次。
2、调查采样点设置鱼类采样点为1-5km长的河段(图1),底栖动物、浮游生物和着生藻类采样点为分布在断面上的点(图2)。
图1 鱼类调查采样点设置示意图图2 底栖动物、浮游生物、着生藻类调查采样点设置示意图根据确定的调查范围,在图上预先布设采样河段与采样点,并按照以下原则进行现场踏查并确定采样点:①七大重点河流干流及一级支流上布设采样点时,相邻采样点间距不得大于100km,二级以上支流相邻采样点间距不得大于50km;鱼类、底栖动物、浮游生物和着生藻类采样点位置应尽量一致;②底栖动物、浮游生物和着生藻类每个断面上的采样点均应覆盖河道和河流两岸,每个采样点采集3次以上重复样品;③应充分考虑采样点的代表性,涵盖水生生物代表性生境类型,如急流、浅滩、深潭、河口和支流河口以及河漫滩等;同一采样点或河段的不同生境类型必须采样;④重要经济鱼类或珍稀种类的索饵、洄游及产卵场等重要栖息地必须布设样点或河段采样;⑤发现水体污染、温排水、岸线固化、挖沙等破坏水生生物栖息地活动发生地点,应当记录点位,并尽量布设样点或河段采样;⑥因地形、环境等因素影响,在地图上定为采样河段或采样点但不适宜布设的,可不予布设,但应记录地理坐标,并采集图像信息上传。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一浮游生物调查1采样采样点布设原则根据水体面积、形态、浮游植物的生态分布特点和调查的目的等决定采样点数量。
采样点应有代表性,能反映整个水体浮游生物的基本情况。
采样点设置数量见表1。
表1采样点设置数量湖泊、水库湖泊应兼顾在近岸和中部设点,可根据湖泊形状在湖心区、大的湖湾中心区、进水口和出水口附近、沿岸浅水区(有水草区和无水草区)分散选设;水库应在库心区(河道型水库应分别在上游、中游、下游的中心区)及大的库湾中心区、主要进水口、出水口附近、主要排污口、入库江河汇合处设点。
江河在干流上游、中游、下游,主要支流汇合口上游、汇合后与干流充分混合处,主要排污口附近、河口区等河段设置采样断面。
根据江河宽设置断面采样点,一般小于50m 的只在中心区设点;50m~100m的可在两岸有明显水流处设点;超过100m的应在左、中、右分别设置采样点。
采样层次浮游植物采样水深小于3m时,只在中层采样;水深3m~6m时,在表层、底层采样,其中表层水在离水面处,底层水在离泥面处;水深6m~10m时,在表层、中层、底层采样;水深大于10m时,在表层、5m、10m水深层采样,10m以下处除特殊需要外一般不采样。
浮游动物采样由水体的深度决定,每隔、1m或2m取一个水样加以混合,然后取一部分作为浮游动物定量之用。
采样频次和采样时间采集次数依研究目的而定,采样次数可逐月或按季节进行,一般按季节进行。
样品瓶必须贴上标签,标明采集时间、地点。
采样时间尽量保持一致,一般在上午8:00~10:00进行。
采样方法浮游植物采样定量样品在定性采样之前用采水器采集,每个采样点取水样1L,贫营养型水体应酌情增加采水量。
泥沙多时需先在容器内沉淀后再取样。
分层采样时,取各层水样等量混匀后取水样1L。
大型浮游植物定性样品用25号浮游生物网在表层缓慢拖曳采集,注意网口与水面垂直,网口上端不要露出水面。
浮游动物采样原生动物、轮虫和无节幼体定量可用浮游植物定量样品,如单独采集取水样量以1L 为宜;定性样品采集方法同浮游植物。
枝角类和桡足类定量样品应在定性采样之前用采水器采集,每个采样点采水样10L~50L,再用25号浮游生物网过滤浓缩,过滤物放入标本瓶中,并用滤出水洗过滤网3次,所得过滤物也放入上述瓶中;定性样品用13号浮游生物网在表层缓慢拖曳采集。
注意过滤网和定性样品采集网要分开使用。
2样品的固定浮游植物样品立即用鲁哥氏液固定,用量为水样体积的1%~%。
如样品需较长时间保存,则需加入37%~40%甲醛溶液,用量为水样体积的4%。
原生动物和轮虫定性样品,除留一瓶供活体观察不固定外,固定方法同浮游植物。
枝角类和桡足类定量、定性样品应立即用37%~40%甲醛溶液固定,用量为水样体积的5%。
3水样的沉淀和浓缩固定后的浮游植物水样摇匀倒入固定在架子上的1L沉淀器中,2h后将沉淀器轻轻旋转,使沉淀器壁上尽量少附着浮游植物,再静置24h。
充分沉淀后,用虹吸管慢慢吸去上清液。
虹吸时管口要始终低于水面,流速、流量不能太大,沉淀和虹吸过程不可摇动,如搅动了底部应重新沉淀。
吸至澄清液的1/3时,应逐渐减缓流速,至留下含沉淀物的水样20mL~25(或30~40)mL,放入30(或50)mL的定量样品瓶中。
用吸出的少量上清液冲洗沉淀器2次~3次,一并放入样品瓶中,定容到30(或50)mL。
如样品的水量超过30(或50)mL,可静置24 h后,或到计数前再吸去超过定容刻度的余水量。
浓缩后的水量多少要视浮游植物浓度大小而定,正常情况下可用透明度作参考,依透明度确定水样浓缩体积见表2,浓缩标准以每个视野里有十几个藻类为宜。
表2依透明度确定水样浓缩体积原生动物和轮虫的计数可与浮游植物计数合用一个样品;枝角类和桡足类通常用过滤法浓缩水样。
4种类鉴定优势种类应鉴定到种,其它种类至少鉴定到属。
种类鉴定除用定性样品进行观察外,微型浮游植物需吸取定量样品进行观察,但要在定量观察后进行。
5计数浮游植物计数计数框行格法计数前需先核准浓缩沉淀后定量瓶中水样的实际体积,可加纯水使其成30mL、50mL、100mL等整量。
然后将定量样品充分摇匀,迅速吸出置于计数框内(面积20mm×20mm)。
盖上盖玻片后,在高倍镜下选择3行~5行逐行计数,数量少时可全片计数。
1L水样中的浮游植物个数(密度)可用下列公式计算:N=N0N1?V1V0?P n (1)式中:N——1L水样中浮游生物的数量,个/L;N0——计数框总格数;N1——计数过的方格数;V1——1L水样经浓缩后的体积,mL;V0——计数框容积,mL;P n——计数的浮游植物个数。
目镜视野法首先应用台微尺测量所用显微镜在一定放大倍数下的视野直径,计算出面积。
计数的视野应均匀分布在计数框内,每片计数视野数可按浮游植物的多少而酌情增减,一般为50个~300个,依浮游植物数确定计算视野数见表3。
表3依浮游植物数确定计算视野数1L水样中浮游植物的个数(密度)可用下列公式计算:N=C sF s?F n ?VV0?P n (2)式中:N——1L水样中浮游生物的数量,个/L;C s——计算框面积,mm2F s——视野面积,mm2F n——每片计数过的视野数;V——1L水样经浓缩后的体积,mL;V0——计数框容积,mL;P n——计数的浮游植物个数。
浮游动物计数原生动物:吸出样品,置于计数框内,盖上盖玻片,在10×20倍显微镜下全片计数。
每瓶样品计数两片,取其平均值。
轮虫:吸出1mL样品,置于1mL计数框内,在10×10倍显微镜下全片计数。
每瓶样品计数两片,取其平均值。
枝角类、桡足类:用5mL计数框将样品分若干次全部计数。
如样品中个体数量太多,可将样品稀释50mL或100mL,每瓶样品计数两片,取其平均值。
无节幼体:如样品中个体数量不多,则和枝角类、桡足类一样全部计数;如数量很多,可把过滤样品稀释,充分摇匀后取其中部分计数,计数3片~5片取其平均值。
也可在轮虫样品中同轮虫一起计数。
计数前,充分摇匀样品,吸出迅速、准确。
盖上盖玻片后,计数框内无气泡,无水样溢出。
单位体积浮游动物的数量按下式计算N=V s?n (3)V?V a式中:N——1L水样中浮游动物的数量,个/L;V——采样的体积,L;V s——样品浓缩后的体积,mL;V a——计数样品体积,mL;n——计数所获得的个体数,个。
注意事项每瓶样品计数两片取其平均值,每片结果与平均数之差不大于±15%,否则必须计数第三片,直至三片平均数与相近两数之差不超过均数的15%为止,这两个相近值的平均数即可视为计算结果。
浮游植物计数单位用细胞个数表示。
对不易用细胞数表示的群体或丝状体,可求出平均细胞数。
浮游动物计数单位用个数表示。
某些个体一部分在视野中,另一部分在视野外,这时可规定只计数上半部分或只计数下半部分。
6生物量的测定浮游植物的比重接近1,可直接采用体积换算成重量(湿重)。
体积的测定应根据浮游植物的体型,按最近似的几何形状测量必要的长度、高度、直径等,每一种类至少随机测定50个,求出平均值,代入相应的求积公式计算出体积。
此平均值乘上1L水中该种藻类的数量,即得到1L水中这种藻类的生物量,所有藻类生物量的和即为1L水中浮游植物的生物量,单位为mg/L或g/m3。
种类形状不规则的可分割为几个部分,分别按相似图形公式计算后相加。
量大或体积大的种类,应尽量实测体积并计算平均重量。
其他种类可参照表D1。
微型种类只鉴别到门,按大、中、小三级的平均质量计算。
极小的(<5μm)为mg/104个;中等的(5μm~10μm)为104个;较大的(10μm~20μm)为104个。
原生动物、轮虫可用体积法求得生物体积,比重取l,再根据体积换算为重量和生物量。
甲壳动物可用体长一体重回归方程,由体长求得体重(湿重)。
无节幼体可按湿重/个计算。
轮虫、枝角类、桡足类及其幼体可用电子天平直接称重。
即先将样本分门别类,选择30个~50个样本,用滤纸将其表面水分吸干至没有水痕,置天平上称其湿重。
个体较小的增加称重个数。
二着生生物调查只进行定性检查。
主要刮取或剥离水中浸没物诸如石块、木桩、树枝、水草或硬底泥等表层藻膜、丝状藻和粘稠状生长物,用鲁哥试剂固定。
室内显微镜下鉴定种类组成。
采样采样点布设采样点数量依着生生物分布及丰度而定,一般5个~6个。
采样点布设在水体的浅水区、沿岸带和大型水生植物分布区等水域,一些受污染等特殊点也需采样观察。
采样方法水体中有大量大型水生植物分布,则采集整株水草,带回实验室。
在室内从水草根部起,依次刮取植株上的所有着生生物。
除此外,水底石块、木桩、树枝等基质上的着生生物可用刀片或硬刷刮(刷)到盛有蒸馏水的样品瓶中,再将基质冲洗干净,冲洗液装入样品瓶中。
现场来不及刮样时,可将基质带回室内刮取。
样品的处理着生藻类样品的处理:样品用鲁哥氏液固定,用量为水样体积的1%~%。
着生原生动物样品的处理:将样本连同基质分别放入盛有采样点水样的广口瓶内,其中一瓶用鲁哥氏液固定,另一瓶不加固定液,供活体观察用。
种类鉴定优势种类须鉴定到种,其他种类至少鉴定到属。
三水体初级生产力的测定1 浮游植物叶绿素a的测定水样的采集与保存可根据工作的需要进行分层采样或混合采样。
湖泊、水库采样500rnl,池塘300m1,采样量视浮游植物分布量而定,若浮游植物数量较少,也可采样1000ml。
采样点及采样时间同浮游杭物。
水样采集后应放在荫凉处,避免日光直射。
最好立即进行测定的预处理,如需经过一段时间( 4~48h )方可进行预处理,则应将水样保存在低温( 0~4℃)避光处。
在每升水样中加入1 %碳酸镁悬浊液lrnl,以防止酸化引起色素溶解。
水样在冰冻情况下(-20℃)最长可保存30d。
.仪器设备①分光光度计。
②真空泵。
③离心机。
④乙酸纤维滤膜(孔径μm。
⑤抽滤器。
@组织研磨器或其他细胞破碎器。
⑦碳酸镁粉末。
⑧90%丙酮。
试验程序①以离心或过滤浓缩水样,在抽滤器上装好乙酸纤维滤膜。
倒入定量体积的水样进行抽滤,抽滤时负压不能过大(约为50kPa)。
水样抽完后,继续抽I~2min,以减少滤膜上的水分。
如需短期保存1~2d时,可放入普通冰箱冷冻,如需长期保存(30d),则应放入低温冰箱(-20℃)保存。
②取出带有浮游植物的滤膜,在冰箱内低温干燥6~8h后放入组织研磨器中,加入少量碳酸镁粉末及2~3m1 90%丙酮,充分研磨,提取叶绿素a。
用离心机(3000~4000r/min)离心10rnin。
将上清液倒入5ml或l0ml容量瓶中。
③再用2~3ml的90%的丙酮,继续研磨提取,离心10min,并将上清液再转入容量瓶中。
重复1~2次,用90%的丙酮定容为5ml或10ml,摇匀。
④将上清液在分光光度计上,用lcm光程的比色皿,分别读取750nm、663nm、645nm、630nm波长的吸光度,并以90%的丙酮作空白吸光度测定,对样品吸光度进行校正。
