Ch3-本构关系
苯基的结构简式

苯基的结构简式苯基是有机化学中常见的一个官能团,由苯环上的一个氢原子被替换为基团而形成。
苯基具有稳定的结构和特殊的化学性质,广泛应用于药物、染料、塑料、橡胶等领域。
苯基的结构简式为C6H5,表示一个苯环上的一个氢原子被苯基基团取代。
苯基具有芳香性质,即具有特殊的香味。
苯基基团可以通过取代基的不同而具有不同的化学性质和应用。
苯基基团的化学性质主要取决于取代基的性质。
常见的苯基基团包括甲基基团(CH3-),乙基基团(C2H5-),羟基基团(OH-),氨基基团(NH2-)等。
这些取代基的不同可以改变苯基的溶解性、反应性以及与其他物质的相互作用。
苯基基团的溶解性主要与取代基的极性有关。
例如,甲基基团是非极性的,因此苯基甲基在非极性溶剂中溶解度较高;而羟基基团是极性的,因此苯基羟基在极性溶剂中溶解度较高。
这种溶解性的差异使得苯基基团在有机合成中具有不同的应用价值。
苯基基团的反应性与取代基的功能团有关。
例如,苯基甲基是一个亲电基团,可以参与亲电取代反应;而苯基羟基是一个亲核基团,可以参与亲核取代反应。
这种反应性的差异使得苯基基团在有机合成中可选择性地引入不同的基团。
苯基基团的相互作用可以影响化合物的物理性质和化学性质。
例如,苯基基团的引入可以增加化合物的稳定性,改变化合物的溶解性和熔点,影响化合物的活性和选择性。
这种相互作用的影响使得苯基基团在药物、染料、塑料、橡胶等领域具有广泛的应用。
苯基是有机化学中常见的一个官能团,具有稳定的结构和特殊的化学性质。
苯基基团的溶解性、反应性和相互作用主要取决于取代基的性质。
苯基基团的应用广泛,对于研究和开发新材料、新药物具有重要意义。
苯的结构命名和性质

CH3CH2COOH
苯 FeX3 取代产物 Br2
苯在结构上的不饱和性与其性质上的饱和性 发生了矛盾,苯究竟是一什么样的结构?
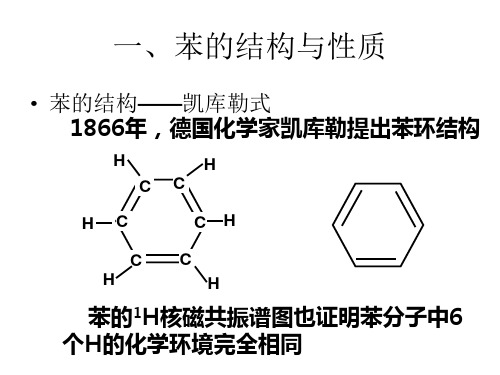
7.1.1 凯库勒结构式
凯库勒(KekuléF A 1829-1896),德国 化学家,大学时学建筑,受李比希的 影响改学化学,苯环结构创始人。
H
H
H
H
H
H
1858年,提出“碳原子四价学说”, 指出:碳原子间可以形成链状的结构 学说。1865年,由著名梦幻“六条蛇 头尾相咬”、“六只猴子头尾相咬”, 悟出苯环的结构 。
O
(2)
CH3
C
+
+
+-
CH3
C
OAlCl3 Cl
H
+ CCH3 O
O
CH3
C
+
+
AlCl4-
H
(3) + CCH3 + AlCl4O
O
(4)
C CH3
+ AlCl3
O C
CH3
+ HCl +
- AlCl3
O+ C
CH3
AlCl3
37
酰基化反应特点: 1. 不重排。 2. 产物单一,不发生多酰基化。 生成的芳酮中羰基是拉电子基团,使苯环的活性降低, 不能发生进一步取代。
苯为闭环共轭体系,π电子高度离域,体系 稳定,在一般化学反应中,芳香环不易开环。
➢芳环上下被离域的π电子所笼罩,属于电子给
予体,容易与亲电试剂发生取代反应。 缺电子或带正电的试剂
23
(一)、亲电取代反应
单环芳烃最重要的亲电取代反应有:
烷基结构式书写

烷基结构式书写
烷基,常用-R表示。
即饱和烃基,是烷烃分子中少掉一个氢原子而成的烃基,烷基是一类仅含有碳、氢两种原子的链状有机基团。
含不同烷基的化合物是一系列同系物。
例如甲基CH3-,乙基CH3CH2-等。
甲醇CH3OH、氯甲烷CH3Cl等分子都含有甲基。
1烷烃
烷烃中,每个碳原子都是四价的,只有碳碳单键,碳氢单键。
采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
连接了1、2、3、4个碳的碳原子分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原子分别叫做伯、仲、叔氢。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体。
甲烷是标准的正四面体形态,其键角为109°28′。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。
直链烷烃是最基本的结构,理论上这个链可以无限延长。
在直链上有可能生出支链,这无疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数目会迅速增长。
高二化学《苯的结构与性质》优质课件
如:
CH2CH2CH3 CH3
CH3
CH3 CH3
—CH3 —CH3
—CH2—CH3
CH3
CH3
2.苯及其同系物通式:
CnH2n-6 (n≥6)
3.二甲苯的一氯代物的同分异构体 甲苯加氢后的一氯代物的同分异构体
• 多环芳烃
多苯代脂烃:多个苯环通过脂肪烃连在一起
—CH2—
二苯甲烷(C13H12)
联苯或多联苯:苯环之间通过碳碳单键直接相连
现象
结论
苯+酸性 高锰酸钾
酸性高锰酸 钾溶液不褪色
苯不能被酸性高锰酸 钾氧化
甲苯+酸性 酸性高锰酸钾溶液 高锰酸钾 褪色(较慢)
二甲苯+酸 酸性高锰酸钾溶液 性高锰酸钾 褪色(较快)
2.苯不能使酸性高锰酸钾溶液褪色,但是甲苯和二甲苯却可 以使酸性高锰酸钾溶液褪色且二甲苯快。对比苯、甲苯、二 甲苯的结构特点,思考:可能是什么原因导致了以上现象?
2,4,6—三硝基甲苯 三硝基甲苯 TNT
三元取代物,说明 侧链对苯环也有影 响。
不溶于水的淡黄色针状 晶体, 烈性炸药
2.卤代反应
CH3 +Cl2 条件一
CH3 + Cl2 条件二
Cl
条件分别是什么? 反应二可能有几种产物?
CH2Cl CH3
• 苯的同系物的化学性质——加成反应
苯的同系物也能和氢气可以发生加成反应
苯的同系物能使酸性高锰酸钾溶液褪色,但不能 使溴水褪色。
从上组反应中我们看到甲基受苯环影响使得甲基 易被氧化;那么苯环的化学性质有没有受到甲基的影 响呢?
• 苯的同系物的化学性质——取代反应
1、硝化反应
C| H3
3有机化合物的构造、构型和构象构造构型

顺反异构产生条件
• (1)分子中存在不能自由旋转的π键或环 平面; • (2)双键两个碳原子上必须是不同的原子 或基团 • (3)环上必须有两个或两个以上带有不同 取代基或原子的碳。
A C C B B A ≡ B A C C B A
A A C C C D ≡ A C C A D C
判断下面两个化合物是否存在顺反异构?
170
- 12o
热H2SO4
139
2.93 4.23
烯 溴烷 酯
(+)-2-甲基-1-丁醇 (- )-2-甲基-1-丁醇
HBr CH3COOH
例如:抗妊娠反应的镇静药—(R)-酞胺哌啶酮 (―反应停”)
O N
H
O
N
O
1)旋光异构体具有不同的生物活性强度
H3C H COOH
(S)-萘普森
判断下列化合物是否具有光学活性
有机化合 物的构型异构
构型(configuration)是指分子中各 原子和基团在空间的相对位置
是分子结构体现的一种表观 现象, 即分子的几何形象。
能否知道一个有机分子的构型?
• 对于一个已知分子,可以根据分 子中各原子的成键方式进行判断; • 对于一个未知分子,可以如X射 线衍射等物理手段进行测量。
• 互变异构是一种动态异构,两种异构体通过官 能团的改变,使两个异构体迅速地相互转化构 成处于动态平衡的混合物,称为互变异构。这 两个异构体称为互变异构体。一般出现在溶液 中是个平衡,不能分离出来,但仪器可以检测 出来。如:
O CH3CCH2COOEt 酮式 O O 酮式 OH CH3C OH CH3C CCOCH3 H 烯醇式 CCOOEt H 烯醇式
H C COOH NH2 * CH3CHCOOH OH
苯

苯【要点梳理】要点一、苯的分子结构2、苯的空间构型:苯分子具有平面正六边形结构,六个碳原子、六个氢原子在同一平面上,键角120°。
3、苯的结构特征要点诠释:(1)六元环上碳碳之间的键长相同,键能也相同。
(2)苯环上碳碳间的键不是一般的碳碳单键,也不是一般的碳碳双键,而是一种介于单键和双键之间的独特的键,六个碳碳键是等同的,所以用来表示苯的结构简式更恰当。
要点二、苯的性质1、苯的物理性质:苯是一种无色、有特殊气味的液体,有毒、难溶于水,密度比水小,熔沸点较低,是常用的有机溶剂。
2、苯的化学性质:由于苯的结构的特殊性,使其兼具有饱和烃和不饱和烃的性质。
(1)氧化反应:C6H6+7.5O26CO2+3H2O要点诠释:a、苯在空气中燃烧,产生明亮的火焰,并带有浓烈的黑烟。
b、燃烧带浓烟是由于苯分子里含碳量很高,在空气中燃烧不充分的缘故。
c、苯易燃烧,但很难被高锰酸钾等氧化剂氧化,故在一般的条件下苯不能使酸性高锰酸钾溶液褪色。
(2)取代反应苯分子的环状结构使得环上的氢原子容易被其他原子或原子团所代替,因此使其具有了和烷烃相似的化学性质——取代反应。
①苯与溴的反应在FeBr3催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯。
要点诠释:a、该实验用的溴为液溴,苯与溴水不反应,仅发生萃取分层。
b、该反应不需加热,常温下即可反应,且放出大量的热,使反应器内充满红棕色的气体(溴蒸气),导气管口有白雾。
c、溴苯为无色液体,密度比水大,不溶于水,实验时溴苯因溶解了没反应的溴而呈褐色。
d、溴苯的提纯:用NaOH溶液洗涤(Br2+2NaOH=NaBr+NaBrO+H2O),然后再分液。
e、在催化剂存在时,苯也可以与其他卤素发生取代反应,又称卤代反应。
各类烃与液溴、溴水、溴的四氯化碳溶液、酸性KMnO溶液反应的比较②苯与硝酸的反应在浓硫酸作用下,苯在50~60℃还可以与浓硝酸发生取代反应生成硝基苯。
要点诠释:a、硝酸分子中的-NO2原子团叫做硝基,苯分子中的氢原子被-NO2所取代的反应,叫做硝化反应,硝化反应的实质属于取代反应。
烷基的结构简式

烷基的结构简式
烷基是一类有机化合物分子中的侧链,由单个碳原子或一组碳原子构成,它们与主链上的碳原子通过单个共价键连接。
烷基常用简式表示,简式的形式为R-,其中R代表烷基。
例如,甲基(一级碳)可以表示为CH3-,乙基(二级碳)可以表示为C2H5-。
烷基的结构简式是有机化学中一种常见的表示方法,它可以方便地表示有机分子中各分子中存在的侧链结构。
烷基的命名通常以主链为基础,通过在主链上选择合适的位置来添加侧链,随后将侧链的结构简式表示出来,如此一来,可以方便地表示有机分子的结构和化学性质。
在化学实验和有机合成中,烷基的结构简式常常被用来表示分子结构,以便快速地理解和计算化学反应中的计量关系。
同时,烷基的结构简式在化学教学中也是一个基本概念,学生需要了解有机分子中的各种烷基及其命名方法,以便更好地理解有机合成和反应机理。
- 1 -。
苯-结构和性质 ,同系物

C8H10
苯的同分异构体
C8H10
CH3 CH3 CH3 CH3
C 2H 5 CH3
CH3
- CH3 与 CH3 - - CH3
CH3 -
,是同分异构体吗?
练习:书写C9H12的属于苯的同系 物的同分异构体
C3H7 CH3 C 2H 5 CH3 C 2H 5 CH3 CH3 CH3
CH3 CH3
2.苯分子实际上不具有碳碳单键和碳碳双 键的简单交替结构,可以作为证据的事实 有 (
B )
A苯的间位二元取代物只有一种 B苯的邻位二元取代物只有一种 C苯的对位二元取代物只有一种
D苯的一溴代物没有同分异构体
3. 将浓溴水加入苯中,经充分振荡静置后,溴水层的
颜色变浅,甚至褪色,这是因为发生了(
D
)
CH3 CH CH3
CH3
CH3
CH3 CH3
C 2H 5
CH3
问题:
CH CH2 苯乙烯结构简式如图, 是否为苯 的同系物?所有原子是否在同一平面内?
只有苯环上的取代基是烷基时,才属于 苯的同系物。
4、苯的同系物的物理性质:
1、色态: 无色的的特殊气味的液体; 2、密度: 小于水; 3、溶解性:不溶于水,易溶于有机溶剂;
C-C 1.54×10-10m
C=C 1.33×10-10m
3.说明:苯分子中的碳碳键是一种介于单 键和双键之间的独特的键
二.苯的分子结构
分子式
H
C6H6
C C H C C C
凯库勒式
H
结构式
H
键角:1200
H C H (凯库勒式)
鲍林式
结构简式
(鲍林式)
三、苯的化学性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本构关系
一、概述
§3.4 增量理论(流动理论)
塑性本构关系 —— 材料超过弹性范围之后的本构关系。此时, 应力与应变之间不存在一一对应的关系, 只能建立应力增量与应变增量之间的关系。 这种用增量形式表示的塑性本构关系,称为增量理论或流动理论。 这种用增量形式表示的塑性本构关系,称为增量理论或流动理论。 增量理论 进入塑性阶段后,应变增量可以分解为弹性部分和塑性部分。
1 1 9 2 ν p W = W −W = W − σijεij = W − σijσij + σm 2 4G 2E
p e
(3-14)
本构关系
Drucker公设 公设: 公设 对于处于在某一状态下的材料质点(或试件),借助一个外部作用, ),借助一个外部作用 对于处于在某一状态下的材料质点(或试件),借助一个外部作用, 在其原有的应力状态之上,缓慢地施加并卸除一组附加应力, 在其原有的应力状态之上,缓慢地施加并卸除一组附加应力,在这 附加应力的施加和卸除的循环内,外部作用所做的功是非负的。 附加应力的施加和卸除的循环内,外部作用所做的功是非负的。 应力循环的过程: 应力循环的过程: 单元体在应力状态σij 下处于平衡。
(3-3)
1 εm = εkk 3 体积弹性模量 K = E / 3(1− 2 ) ν
则平均正应力与平均正应变的关系:
σ m = 3 Kε m
1 eij = sij 2G
包含5个独立方程
(3-4) (3-2)
(3-2)式用可用应力偏量 sij 和应变偏量 eij表示为 (3-5)
本构关系
1 1 由(3-5) ′ I2 = eijeij = 2
dσ 中性变载 dσ
φ = 0, φ = 0, φ = 0,
n 卸载 φ =0
dσ 加载
∂φ dσij = 0 中性变载 ∂σij ∂φ dσij < 0 卸载 ∂σij ∂φ dσij > 0 加载 ∂σij
这里,中性变载相当于应力点沿加载面切向变化, 应力维持在塑性状态但加载面并不扩张的情况。
o o σij 处于加载面的内部,即σij ≠ σij,由于dσij是高阶小量,则 当
0 p (σij −σij )dεij ≥ 0
o 当σij 正处于加载面上,即 σij = σij,则
(3-20)
o
p dσijdεij ≥ 0
(3-21)
由此可对屈服面形状与塑性应变增量的特性导出两个重要的结论。 1、屈服曲面的外凸性。 、屈服曲面的外凸性。 2、塑性应变增量向量与加载面的外法线方向一致——正交性法则。 、塑性应变增量向量与加载面的外法线方向一致 正交性法则。 正交性法则 当 ij处于加载面上,Drucker公设导致的(3-21)通常叫作 σo Drucker稳定性条件。
dε = dλ ⋅ sij
p ij
(3-36)
本构关系
一 、理想材料的加卸载准则 理想材料的加载面与初始屈服面是一样的。 由于屈服面不能扩大,所以当应力点达到屈服面上, 应力增量 dσ 不能指向屈服面外,而只能沿屈服面切线。 dσ 加载 f (σij ) < 0, 弹性状态
dσ
n 卸载
f =0
∂f 加载 df = dσij = 0 ∂σij
屈服曲面必须是凸的。 如果屈服面是凹的,则3-22式不满足。 屈服曲面必须是凸的。
本构关系
2、塑性应变增量向量与加载面的外法线方向一致——正交性法则。 、塑性应变增量向量与加载面的外法线方向一致 正交性法则。 正交性法则 n
A
n——加载面在A点的外法向。
dε p
如果dε p与n不重合,则总可以找到A0, 使3-22式不成立。
e 2、应变可分解为弹性应变和塑性应变。 εij = εij 应变可分解为弹性应变和塑性应变。 应变可分解为弹性应变和塑性应变 p + εij
3、材料的弹性变形规律不因塑性变形而改变。 材料的弹性变形规律不因塑性变形而改变。 材料的弹性变形规律不因塑性变形而改变
即 性 变 由 ij唯 确 , 塑 应 ε 无 。 弹 应 ε σ 一 定 与 性 变 关
[
]
[
]
(3-1)
[
]
其中 张量写法:
G = E / 2(1+ν )
εij =
其中
− σmδij 2G E 1 σm = σkk 为平均正应力。 3
σij 3 ν
(3-2)
本构关系
将三个正应变相加,得:
3ν 1 − 2ν ε kk = − σ mδ kk = σ kk 2G E E
记:平均正应变
σ kk
(3-25)
r dσ ⋅n ≥ 0
(3-26)
只有当应力增量指向加载面外部时,材料才能产生塑性变形。 判断能否产生新的塑性变形,需判断: (1)dσij 是否在 φ = 0上。 加卸载准则 (2)dσij 是否指向φ = 0 的外部。 加载:指材料产生新的塑性变形的应力改变。 加载:指材料产生新的塑性变形的应力改变。 卸载:指材料产生从塑性状态回到弹性状态的应力改变。 卸载:指材料产生从塑性状态回到弹性状态的应力改变。
τ yz 1 , ε x = σ x −ν (σ y + σ z ) , γ yz = E G τ zx 1 ε y = σ y −ν (σ z + σ x ) , γ zx = , E G τ xy 1 ε z = σ z −ν (σ x + σ y ) , γ xy = , E G
A0
因此,ε p必须与加载面φ = 0的外法线重合。 d φ = 0 的外法线方向即其梯度方向。
dε ijp 可表示为:
∂φ dε = dλ ∂σij
p ij
(3-23)
本构关系
§3.3 加载、卸载准则
Drucker稳定性条件 稳定性条件: 稳定性条件
dσ ⋅ dε p ≥ 0
由于 dε p与外法线n同向,上式改写成:
1 1 1 2 1 1 2 W = J2 = τγ = Gγ = σε = σ φ 2G 2 2 2 6G
e
本构关系
§3.2 Drucker公设
两类力学量 外变量:能直接从外部可以观测得到的量。如总应变,应力等。 外变量:能直接从外部可以观测得到的量。如总应变,应力等。 内变量:不能直接从外部观测的量。如塑性应变,塑性功等。 内变量:不能直接从外部观测的量。如塑性应变,塑性功等。 内变量只能根据一定的假设计算出来。 内变量只能根据一定的假设计算出来。 关于塑性应变和塑性功的假设: 关于塑性应变和塑性功的假设: 1、材料的塑性行为与时间,温度无关。 材料的塑性行为与时间,温度无关。 材料的塑性行为与时间
e p dεij = dεij + dεij
e 由Hooke定律, dεij =
(3-30) (3-31) (3-32)
dσij 2G
−
ν 3 dσmδij E
∂φ 由Drucker公设, dε = dλ ∂σij
p ij
本构关系
∂φ dε = dλ ∂σij
p ij
流动法则
p 给出了塑性应变增量dεij与加载函数φ之间的关系。
o
σij
σij + dσij
在单元体上施加一附加力,使应力达到 σij, o σij 刚好在加载面上,即开始发生塑性变形。 继续加载至σij + dσij,在这期间,将产生 dε ijp。 塑性应变 最后,将应力又卸回到 σij 。完成应力循环。
o
图3-1
σ 以 ij 表示应力循环过程中任一时刻的瞬时应力状态。 0 按Drucker公设,附加应力 σij −σij) 在应力循环中所作的功非负。 ( +
e ij p ij
p εij可以由外变量εij、σij表示出来。 根据以上假设, 表示出来。 根据以上假设,内变量
本构关系
对于各向同性材料:
p ij e ij
1 ν 3 ε = εij −ε = εij − ( σij − σmδij ) 2G E
(3-12)
将总功分解为弹性功和塑性功。 将总功分解为弹性功和塑性功。 e p W = ∫σijdεij = ∫σijdεij + ∫σijdεij (3-13) 1 e p = σijεij + ∫σijdεij 2 =We +W p 这样, 表示出来。 这样,内变量W p也可以由外变量W、σij 表示出来。 对于各向同性材料:
(3-9)
本构关系
Mises屈服条件的物理解释中将弹性应变能分解为体积应变能和 屈服条件的物理解释中将弹性应变能分解为体积应变能和 形状改变比能。这里,由弹性本构关系将三者表示为: 形状改变比能。这里,由弹性本构关系将三者表示为:
1 1 We = σijεij = (sij +σmδij )(eij +εmδij ) 2 2 3 1 = σmεm + sijeij 2 2 =We +We V φ
塑性力学
第 3 章
本构关系
塑性力学
第三章 塑性本构关系
§3.1 §3.2 §3.3 §3.4 §3.5 §3.6 弹性本构关系 Drucker公设 加载、卸载准则 增量理论(流动理论) 全量理论(形变理论) 岩土力学中的Coulomb屈服条件和 流动法则
本构关系
§3.1 弹性本构关系
在弹性阶段,材料的本构关系即广义Hooke定律:
本构关系
二、理想塑性材料与Mises条件相关联的流动法则
对于理想塑性材料,屈服函数f就是加载函数φ。 流动法则写成: Mises屈服条件: 有
∂f dε = dλ ∂σij
p ij
(3-35)
f = J2 −τ s2 = 0
