电子亚层在相同电子层中电子能量还有微小的差别
三大规则

3 保里不相容原理在一个原子中没有两个或两个以上电子具有完全相同的四个量子数(在主量子数n、角量子数l、磁量子数ml、自旋磁量子数ms表象中的表达)。
或者说一个原子轨道上(主量子数n、角量子数l、磁量子数ml 相同时)最多只能排两个电子,而且这两个电子自旋方向必须相反。
因此一个s轨道最多只能有2个电子,p轨道最多可以容纳6个电子。
按照这个原理,表1-1归纳了各个原子轨道上可容纳最多的电子数,从表中可得出第n电子层能容纳的电子总数为2n2个。
泡利不相容原理:指在原子中不能容纳运动状态完全相同的电子。
又称泡利原子、不相容原理。
一个原子中不可能有电子层、电子亚层、电子云伸展方向和自旋方向完全相同的两个电子。
如氦原子的两个电子,都在第一层(K 层),电子云形状是球形对称、只有一种完全相同伸展的方向,自旋方向必然相反。
每一轨道中只能客纳自旋相反的两个电子,每个电子层中可能容纳轨道数是n2个、每层最多容纳电子数是2n2。
核外电子排布遵循泡利不相容原理、能量最低原理和洪特规则.能量最低原理就是在不违背泡利不相容原理的前提下,核外电子总是尽先占有能量最低的轨道,只有当能量最低的轨道占满后,电子才依次进入能量较高的轨道,也就是尽可能使体系能量最低.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.后来量子力学证明,电子这样排布可使能量最低,所以洪特规则可以包括在能量最低原理中,作为能量最低原理的一个补充.自旋为半整数的粒子(费米子)所遵从的一条原理。
简称泡利原理。
它可表述为全同费米子体系中不可能有两个或两个以上的粒子同时处于相同的单粒子态。
电子的自旋,电子遵从泡利原理。
1925年W.E.泡利为说明化学元素周期律提出来的。
原子中电子的状态由主量子数n、角量子数l、磁量子数ml以及自旋磁量子数ms所描述,因此泡利原理又可表述为原子内不可能有两个或两个以上的电子具有完全相同的4个量子数n、l 、ml 、ms 。
电子亚层在相同电子层中电子能量还有微小的差别

电子亚层在相同电子层中电子能量还有微小的差别电子亚层在相同电子层中电子能量还有微小的差别,电子云形状也不相同,根据这些差别把一个电子层分为几个亚层。
在同一电子层中,电子的能量还稍有差异,电子云的形状也不相同。
因此电子层还可分成一个或n个电子亚层。
K 层只包含一个s亚层;L层包含s和p两个亚层;M层包含s、p、d三个亚层;N层包含s、p、d、f四个亚层。
电子亚层之一电子亚层可用表示,=0、1、2、3、…(n-1),n为电子层数。
即K层(n=1)有0一个亚层(s);L 层(n=2)有0、1两个亚层,即2s、2p;M层(n=3)有0、1、2三个亚层,即3s、3p、3d。
同理N层有4s、4p、4d、4f四个亚层。
不同亚层的电子云形状不同,s 亚层(=0)的电子云形伏为球形对称;p亚层(=1)的电子云为无柄哑铃形(纺锤形);d亚层(=2)的电子云为十字花瓣形等。
同一电子层不同亚层的能量按s、p、d、f序能量逐渐升高。
电子亚层之二通过对许多元素的电离能的进一步分析,人们发现,在同一电子层中的电子能量也不完全相同,仍可进一步分为若干个电子组。
这一点在研究元素的原子光谱中得到了证实。
电子亚层分别用s、p、d、f等符号表示。
不同亚层的电子云形状不同。
s亚层的电子云是以原子核为中心的球形,p亚层的电子云是纺锤形,d亚层为花瓣形,f亚层的电子云形状比较复杂。
电子亚层之三受磁量子数的控制,s层有一个轨道,p层有三个轨道,d层有五个轨道,等等,(根据自旋量子数,每个轨道可容纳2个电子)。
由于亚层的存在,使同一个电子层中电子能量出现不同,甚至出现低电子层的高亚层能量大于高电子层的低亚层,即所谓的能级交错现象。
各亚层能量由低到高排列如下:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d.......有一个公式可以方便记忆:ns<(n-2)f<(n-1)d<np只要记住其中d亚层从3d开始,f亚层从4f开始就行了。
电子亚层

电子亚层电子亚层在相同电子层中电子能量还有微小的差别,电子云形状也不相同,根据这些差别把一个电子层分为几个亚层。
在同一电子层中,电子的能量还稍有差异,电子云的形状也不相同。
因此电子层还可分成一个或n个电子亚层。
K 层只包含一个s 亚层;L层包含s和p两个亚层;M层包含s、p、d三个亚层;N层包含s、p、d、f四个亚层。
电子亚层之一电子亚层数量可用这个公式表示:x=0、1、2、3、…(n-1),n为电子层数。
即K层(n=1)有0一个亚层(s);L层(n=2)有0、1两个亚层,即2s、2p;M层(n=3)有0、1、2三个亚层,即3s、3p、3d。
同理N层有4s、4p、4d、4f四个亚层。
不同亚层的电子云形状不同,s亚层(x=0)的电子云形状为球形对称;p亚层(x=1)的电子云为无柄哑铃形(纺锤形);d亚层(x=2)的电子云为十字花瓣形等。
同一电子层不同亚层的能量按s、p、d、f序能量逐渐升高。
电子亚层之二通过对许多元素的电离能的进一步分析,人们发现,在同一电子层中的电子能量也不完全相同,仍可进一步分为若干个电子组。
这一点在研究元素的原子光谱中得到了证实。
电子亚层分别用s、p、d、f等符号表示。
不同亚层的电子云形状不同。
s亚层的电子云是以原子核为中心的球形,p亚层的电子云是纺锤形,d亚层为花瓣形,f亚层的电子云形状比较复杂。
电子亚层之三受磁量子数的控制,s层有一个轨道,p层有三个轨道,d层有五个轨道,等等,(根据自旋量子数,每个轨道可容纳2个电子)。
由于亚层的存在,使同一个电子层中电子能量出现不同,甚至出现低电子层的高亚层能量大于高电子层的低亚层,即所谓的能级交错现象。
各亚层能量由低到高排列如下:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d.......有一个公式可以方便记忆:ns<(n-2)f<(n-1)d<np 只要记住其中d亚层从3d开始,f亚层从4f开始就行了。
2016-2017年核外电子分布规律-核外电子填充优先顺序图1(总结)

核外电子分布规律-核外电子填充优先顺序图围绕在原子核外作高速运动的电子,有它特殊的运动状态。
早在本世纪初,科学实验已证明了电子是一种质量为9.11×10-28g的微小粒子,证明了电子的运动具有粒子性。
但是,以后科学实验又证明了电子的运动和光、X射线一样具有波动性(图1-4)。
这就是说,电子的运动具有波粒二象性。
电子运动的这种波粒二象性,使它难以用经典物理学的一些基本定律来描述。
现代研究核外电子运动状态的理论叫做原子波动力学。
它是在本世纪20年代末由奥地利物理学家薛定谔等人发展起来的。
它的基本方面是一些复杂的数学波动方程,叫做薛定谔方程。
核外电子的运动正是通过计算薛定谔方程的解来加以描述的。
这里,我们只能按照原子波动力学的基本观点,初步形象地去认识核外电子的运动状态,从而再寻找出原子核外电子的排布有着怎样的规律。
2-1 电子云当人造卫星环绕地球旋转时,我们可以根据一定的数据计算出它在某一时刻的准确位置,描绘出它的运动轨迹。
但是,对于核外电子,我们却无法准确计算出它在某一时刻的位置,也不能描绘出它的运动轨迹。
在描绘核外电子运动时,只能指出它在原子核外空间各处出现机会的多少。
电子在核外空间一定范围内出现,好像是带负电荷的云雾笼罩在原子核的周围。
可以形象地称它为“电子云”。
核外电子出现机会愈多的区域,电子云的密度愈大。
图1-5描绘了氢原子处于基态时的电子云。
氢原子核外只有1个电子,图中的“雾状”,说明氢原子核外电子在一个球形的空间里作高速运动。
图中表示,黑点密集处是电子出现机会多的地方,黑点稀疏处是电子出现机会少的地方2-2 描述核外电子运动状态的四个方面对于原子核外的每一个电子的运动状态,都可以从以下四个方面来描述。
(1)电子层原子核外的电子可以看作是分层排布的。
处于不同层次中的电子,离核的远近也不同。
离核愈近的电子层能级愈低,离核愈远的电子层能级愈高。
通常用n=1、2、3…等数值来表示电子层离核的远近。
物质结构与性质专题2第一单元原子核外电子的运动选择题练习三含解析

物质结构与性质专题2第一单元原子核外电子的运动选择题练习三一、单选题(本大题共10小题,共30.0分)1.下列说法错误的是()A. ns电子的能量不一定高于(n-1)p电子的能量B. 6C的电子排布式1s22s22p违反了洪特规则C. 电子排布式(21Sc)1s22s22p63s23p63d3违反了能量最低原理D. 电子排布式(22Ti)1s22s22p63s23p10违反了泡利原理2.下列有关核外电子排布的式子不正确的是()A. 29Cu的电子排布式:1s22s22p63s23p63d104s1B. K的简化电子排布式:[Ar]4s1C. N原子的轨道表示式为D. S原子的轨道表示式为3.下列说法正确的是()A. 的价电子排布式:B. 将基态P的价电子排布式写成,违反了洪特规则C. 第四周期元素原子核外未成对电子有3个的原子共有两种D. 外围电子排布为的基态原子,该元素位于周期表第五周期第Ⅷ族4.下列与原子核外电子排布规律相关的叙述中(n为能层序数),不正确...的是A. 第三周期元素的基态原子中,未成对电子数最多的是磷B. 电子填入能级的顺序是np→(n+1)s,因此原子核外最外层电子数一般不超过8C. 由3d能级有5个轨道可知,元素周期表中第四周期元素比第三周期元素多10种D. 基态原子的最外层电子排布为ns2的元素,在元素周期表中均位于第ⅡA族5.在一个基态多电子原子中,下列说法正确的是A. 不可能有2个能量完全相同的电子B. 可能有2个运动状态完全相同的电子C. K层上的电子能量比L层上的电子能量低D. 若3p能级上只有2个电子,其自旋状态不同6.下列叙述正确的是( )A. 可能存在基态核外电子排布为1s22s22p63s23p64s24p1的原子B. 在氢原子的电子云图中,小黑点的疏密程度表示电子在该区域出现的概率密度C. 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相反D. 电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取原子的发射光谱7.下列说法中正确的是()A. 3d3表示3d能级有3个轨道B. np能级全满时的电子排布图为:C. 核外电子运动的概率密度分布图(电子云)就是原子轨道D. 电子的运动状态可从能层、能级、轨道3个方面进行描述8.下列说法中不正确的是()A. 处于最低能量的原子叫做基态原子B. 表示3p能级有两个电子C. K+的电子排布式为D. 同一原子中,2p,3p,4p能级的轨道数依次增多9.某原子的核外电子排布式为,则下列说法错误的是()A. 该原子核外电子共占据5个轨道B. 该原子核外电子共有16种运动状态C. 该原子核外电子共占据三个能层D. 该原子核外电子共占据五个能级10.下列说法或有关化学用语的表述正确的是()A. 在基态多电子原子中,p能级电子能量一定高于s能级电子能量B. 基态Fe原子的外围电子排布图为C. 因O的电负性比N大,故O的第一电离能比N也大D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区答案和解析1.【答案】A【解析】【试题解析】【分析】本题考查了基本概念,明确洪特规则、泡利不相容原理、能量最低原理即可解答,难度较大。
电子亚层

电子亚层电子亚层在相同电子层中电子能量还有微小的差别,电子云形状也不相同,根据这些差别把一个电子层分为几个亚层。
在同一电子层中,电子的能量还稍有差异,电子云的形状也不相同。
因此电子层还可分成一个或n个电子亚层。
K 层只包含一个s 亚层;L层包含s和p两个亚层;M层包含s、p、d三个亚层;N层包含s、p、d、f四个亚层。
电子亚层之一电子亚层数量可用这个公式表示:x=0、1、2、3、…(n-1),n为电子层数。
即K层(n=1)有0一个亚层(s);L层(n=2)有0、1两个亚层,即2s、2p;M层(n=3)有0、1、2三个亚层,即3s、3p、3d。
同理N层有4s、4p、4d、4f四个亚层。
不同亚层的电子云形状不同,s亚层(x=0)的电子云形状为球形对称;p亚层(x=1)的电子云为无柄哑铃形(纺锤形);d亚层(x=2)的电子云为十字花瓣形等。
同一电子层不同亚层的能量按s、p、d、f序能量逐渐升高。
电子亚层之二通过对许多元素的电离能的进一步分析,人们发现,在同一电子层中的电子能量也不完全相同,仍可进一步分为若干个电子组。
这一点在研究元素的原子光谱中得到了证实。
电子亚层分别用s、p、d、f等符号表示。
不同亚层的电子云形状不同。
s亚层的电子云是以原子核为中心的球形,p亚层的电子云是纺锤形,d亚层为花瓣形,f亚层的电子云形状比较复杂。
电子亚层之三受磁量子数的控制,s层有一个轨道,p层有三个轨道,d层有五个轨道,等等,(根据自旋量子数,每个轨道可容纳2个电子)。
由于亚层的存在,使同一个电子层中电子能量出现不同,甚至出现低电子层的高亚层能量大于高电子层的低亚层,即所谓的能级交错现象。
各亚层能量由低到高排列如下:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d.......有一个公式可以方便记忆:ns<(n-2)f<(n-1)d<np 只要记住其中d亚层从3d开始,f亚层从4f开始就行了。
高中化学竞赛讲义《物质结构》
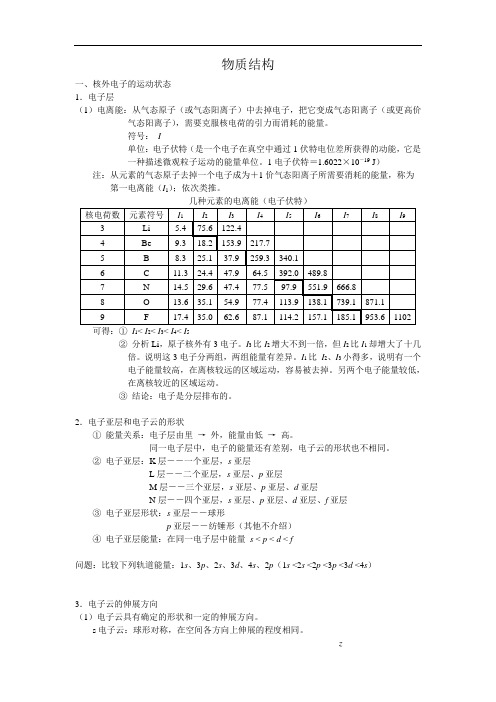
物质结构一、核外电子的运动状态1.电子层(1)电离能:从气态原子(或气态阳离子)中去掉电子,把它变成气态阳离子(或更高价气态阳离子),需要克服核电荷的引力而消耗的能量。
符号:I单位:电子伏特(是一个电子在真空中通过1伏特电位差所获得的动能,它是一种描述微观粒子运动的能量单位。
1电子伏特=1.6022×10-19 J)注:从元素的气态原子去掉一个电子成为+1价气态阳离子所需要消耗的能量,称为第一电离能(I1);依次类推。
可得:①I1< I2< I3< I4< I5②分析Li,原子核外有3电子。
I3比I2增大不到一倍,但I2比I1却增大了十几倍。
说明这3电子分两组,两组能量有差异。
I1比I2、I3小得多,说明有一个电子能量较高,在离核较远的区域运动,容易被去掉。
另两个电子能量较低,在离核较近的区域运动。
③结论:电子是分层排布的。
2.电子亚层和电子云的形状①能量关系:电子层由里→外,能量由低→高。
同一电子层中,电子的能量还有差别,电子云的形状也不相同。
②电子亚层:K层――一个亚层,s亚层L层――二个亚层,s亚层、p亚层M层--三个亚层,s亚层、p亚层、d亚层N层--四个亚层,s亚层、p亚层、d亚层、f亚层③电子亚层形状:s亚层――球形p亚层――纺锤形(其他不介绍)④电子亚层能量:在同一电子层中能量s < p < d < f问题:比较下列轨道能量:1s、3p、2s、3d、4s、2p(1s <2s <2p <3p <3d <4s)3.电子云的伸展方向(1)电子云具有确定的形状和一定的伸展方向。
s电子云:球形对称,在空间各方向上伸展的程度相同。
z2pd电子云:五种伸展方向;f电子云:七种伸展方向。
(2)轨道:在一定电子层上,具有一定的形状和伸展方向的电子云所占据的空间称为一个轨道。
则s、p、d、f四个亚层分别有1、3、5、7个轨道。
原子轨道电子排布规律(一)

这3个sp2杂化轨道中有2个轨道分别与2个H原子形成σ单键,还有1个sp2轨道则与另一个C的sp2轨道形成头对头的σ键,同时位于垂直方向的pz轨道则以肩并肩的方式形成了π键。也就是说碳碳双键是由一个σ键和一个π键组成,即双键中两个键是不等同的。π键原子轨道的重叠程度小于σ键,π键不稳定,容易断裂,所以含有双键的烯烃很容易发生加成反应,如乙烯(H2C=CH2)和氯(Cl2)反应生成氯乙烯(Cl—CH2—CH2—Cl)。
l ≤ n - 1 l = 0,1,2,…, ( n -1)
|m| ≤ l m = 0,±1,±2, … , ±l
每一组轨道量子数n、l、m,可以确定一个函数,即:
波函数Ψ(r,θ,φ ):代表电子运动的一种稳定状态,俗称原子轨道。
径向波函数R(r):由n和l决定,它描述波函数随电子离核远近(r)的变化情况.
能级交错:由于屏蔽效应和钻穿效应,使不同轨道上的电子能级发生变化,从而引起能级上的交错。———————————————————————————————————————————————
一、原子轨道和电子云
1. 薛定谔方程
薛定谔方程是描述微观粒子运动的基本方程,1927年奥地利物理学家薛定锷将光的波动方程引申来描述原子中单个电子运动规律建立起来的,是一个二阶偏微分方程。即:
另外:
核外电子排布遵循泡利不相容原理、能量最低原理和洪特规则.能量最低原理就是在不违背泡利不相容原理的前提下,核外电子总是尽先占有能量最低的轨道,只有当能量最低的轨道占满后,电子才依次进入能量较高的轨道,也就是尽可能使体系能量最低.洪特规则是在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同.后来量子力学证明,电子这样排布可使能量最低,所以洪特规则可以包括在能量最低原理中,作为能量最低原理的一个补充.能级交错是指电子层数较大的某些轨道的能量反低于电子层数较小的某些轨道能量的现象。如4s反而比3d的能量小,填充电子时应先充满4s而后才填入3d轨道。过渡元素钪的外层电子排布为4s23d1,失去电子时,按能级交错应先失去3d电子,成为4s23d0,而从原子光谱实验得知,却是先失4s上的电子成为4s13d1。这是由于3d电子的存在,削弱了原子核对4s电子的吸引而易失去的。过渡元素离子化时,大体是先失去ns电子,但也有先失去(n-1)d电子的,像钇等。能级交错的顺序不是绝对不变的,在原子序数大的原子中,3d轨道可能比4s轨道的能量低。)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
电子亚层在相同电子层中电子能量还有微小的差别,电子云形状也不相同,根据这些差别把一个电子层分为几个亚层。
在同一电子层中,电子的能量还稍有差异,电子云的形状也不相同。
因此电子层还可分成一个或n个电子亚层。
K 层只包含一个s亚层;L层包含s和p两个亚层;M层包含s、p、d三个亚层;N层包含s、p、d、f 四个亚层。
电子亚层之一电子亚层可用表示,=0、1、2、3、…(n-1),n为电子层数。
即K层(n=1)有0一个亚层(s);L层(n=2)有0、1两个亚层,即2s、2p;M层(n=3)有0、1、2三个亚层,即3 s、3p、3d。
同理N层有4s、4p、4d、4f四个亚层。
不同亚层的电子云形状不同,s亚层(=0)的电子云形伏为球形对称;p亚层(=1)的电子云为无柄哑铃形(纺锤形);d亚层(=2)的电子云为十字花瓣形等。
同一电子层不同亚层的能量按s、p、d、f序能量逐渐升高。
电子亚层之二通过对许多元素的电离能的进一步分析,人们发现,在同一电子层中的电子能量也不完全相同,仍可进一步分为若干个电子组。
这一点在研究元素的原子光谱中得到了证实。
电子亚层分别用s、p、d、f等符号表示。
不同亚层的电子云形状不同。
s亚层的电子云是以原子核为中心的球形,p亚层的电子云是纺锤形,d亚层为花瓣形,f亚层的电子云形状比较复杂。
电子亚层之三受磁量子数的控制,s层有一个轨道,p层有三个轨道,d层有五个轨道,等等,(根据自旋量子数,每个轨道可容纳2个电子)。
由于亚层的存在,使同一个电子层中电子能量出现不同,甚至出现低电子层的高亚层能量大于高电子层的低亚层,即所谓的能级交错现象。
各亚层能量由低到高排列如下:1s,2s,2p,3s,3p,4s,3d,4p,5s,4d,5p,6s,4f,5d,6p,7s,5f,6d.......有一个公式可以方便记忆:ns<(n-2)f<(n-1)d<np 只要记住其中d亚层从3d开始,f亚层从4f开始就行了。
写能级顺序时n从1开始取,f前的n>=6,d前的n>=4。
一、原子轨道和电子云二、轨道量子数与原子能级从解薛定谔方程所引进的一套参数n, l, m(称为量子数)的物理意义、取值以及取值的组合形式与核外电子运动状态的关系如下:(一)主量子数(n)描述电子离核的远近,确定原子的能级或确定轨道能量的高低。
决定轨道或电子云的分布范围。
一般,n 值越大,电子离核越远,能量越高。
主量子数所决定的电子云密集区或能量状态称为电子层(或主层)。
主量子数n 1, 2, 3, 4, 5, 6, 7, … (共取n个值)电子层符号K,L,M,N, O, P, Q , …(二)角量子数(副量子数)( l )同一电子层(n)中因副量子数(l)不同又分成若干电子亚层(简称亚层,有时也称能级)。
l确定同一电子层中不同原子轨道的形状。
在多电子原子中,与n 一起决定轨道的能量。
副量子数l = 0, 1, 2, 3, 4, …, n -1 (共可取n 个值))亚层符号s,p、d、f、g……轨道形状园球双球花瓣八瓣(三)磁量子数(m)确定原子轨道在空间的伸展方向。
m = 0, ±1, ±2, ±3, …, ±l 共可取值( 2l +1)个值s p d f轨道空间伸展方向数: 1 3 5 7 ( m的取值个数)n, l 相同,m不同的轨道能量相同。
也即同一亚层中因m不同所代表的轨道具有相同的能量。
通常将能量相同的轨道互称为等价轨道或简并轨道。
三个量子数的取值关系:L 受n 的限制:n =1 l = 0 m = 0n =2 l = 0, 1 m = 0n =3 l = 0, 1, 2 m = 0, ±1, ±2m 的取值受l 的限制:如l = 0 m = 0l = 1 m = -1, 0, +1l = 2 m = -2, -1, 0, +1, +2三个量子数的一种组合形式决定一个Ψ ,而每一个Ψ又代表一个原子轨道,所以三个量子数都有确定值时,即确定核外电子的一种电子运动状态。
(四)原子能级在多电子原子中,原子的能级除受主量子数(n)影响外,还与副量子数(l)有关,其间关系复杂。
下图表示了若干元素原子中能级的相对高低。
由图可以看出:(1)单电子原子(Z=1)中,能量只与n有关,且n↑,E↑(2)多电子原子(Z≥ 2)中,能量与n、l有关。
①n 相同,l 不同,则l↑,E↑如:Ens<Enp<End<Enf②l 相同,n 不同,则n↑,E↑如:E1s<E2s<E3s……E2p<E3p<E4p……E3d<E4d<E5d……“(3)能级交错若n和l都不同,虽然能量高低基本上由n的大小决定,但有时也会出现高电子层中低亚层(如4s)的能量反而低于某些低电子层中高亚层(如3d)的能量这种现象称为能级交错。
能级交错是由于核电荷增加,核对电子的引力增强,各亚层的能量均降低,但各自降低的幅度不同所致。
能级交错对原子中电子的分布有影响。
”三、电子的自旋与电子层的最大容量1.自旋量子数(ms)用分辨能力很强的光谱仪来观察氢原子光谱,发现一条谱线是由靠得非常近的两条线组成,为氢原子的精细结构,1925年琴伦贝克和高斯米特,根据前人的实验提出了电子自旋的概念,用以描述电子的自旋运动。
自旋量子数ms 有两个值(+1/2,-1/2),可用向上和向下的箭头(“↑”“↓”)来表示电子的两种所谓自旋状态。
结论:描述一个电子的运动状态,要用四个量子数(n,l,m ,ms ),同一原子中,没有四个量子数完全相同的两个电子存在。
2.原子核外电子排布的一般规律(1)Pauli不相容原理在同一原子中,一个原子轨道上最多只能容纳两个自旋方向相反的电子。
(2)能量最低原理电子总是最先排布(占据)在能量最低的轨道。
(3)洪特规则①在等价轨道上,电子总是尽先占据不同的轨道,而且自旋方向相同(平行)。
②当等价轨道上全充满时( p6, d10, f 14 ),半充满( p3, d 5, f 7 )和全空( p0, d0, f 0 )时,能量最低,结构较稳定。
3.电子层的最大容量根据以上的排布规则,可以推算各电子层、电子亚层和轨道中最多能容纳多少电子。
由于每一个电子层(n)中有n个电子亚层(每一个电子亚层又可以有(2l+1)个轨道),则每一电子层可能有的轨道数为n2,即:又由于每一个轨道上最多容纳两个电子,所以每一电子层的最大容量为2 n2,每一电子亚层中的电子数不超过2(2l+1)个。
电子层的最大容量(n=1-4)原子核外的电子总是有规律的排布在各自的轨道上。
原子轨道的种类主页面:原子轨道作为薛定谔方程的解,原子轨道的种类取决于主量子数(n)、角量子数(l)和磁量子数(ml)。
其中,主量子数就相当于电子层,角量子数相当于亚层,而磁量子数决定了原子轨道的伸展方向。
另外,每个原子轨道里都可以填充两个电子,所以对于电子,需要再加一个自旋量子数(ms),一共四个量子数。
n可以取任意正整数。
在n取一定值时,l可以取小于n的自然数,ml可以取±l。
不论什么轨道,ms 都只能取±1/2,两个电子自旋相反。
因此,s轨道(l=0)上只能填充2个电子,p轨道(l=1)上能填充6个,一个亚层填充的电子数为4l+2。
具有角量子数0、1、2、3的轨道分别叫做s轨道、p轨道、d轨道、f轨道。
之后的轨道名称,按字母顺序排列,如l=4时叫g轨道。
排布的规则电子的排布遵循以下三个规则:能量最低原理整个体系的能量越低越好。
一般来说,新填入的电子都是填在能量最低的空轨道上的。
Hund规则电子尽可能的占据不同轨道,自旋方向相同。
Pauli不相容原理在同一体系中,没有两个电子的四个量子数是完全相同的。
同一亚层中的各个轨道是简并的,所以电子一般都是先填满能量较低的亚层,再填能量稍高一点的亚层。
各亚层之间有能级交错现象:1s2s 2p3s 3p4s 3d 4p5s 4d 5p6s 4f 5d 6p7s 5f 6d 7p8s 5g 6f 7d 8p...有几个原子的排布不完全遵守上面的规则,如:Cr:[ Ar ]3d54s1这是因为同一亚层中,全充满、半充满、全空的状态是最稳定的。
这种方式的整体能量比3d44s2要低,因为所有亚层均处于稳定状态。
排布示例以铬为例:铬原子核外有24个电子,可以填满1s至4s所有的轨道,还剩余4个填入3d轨道:1s22s22p63s23p64s23d4由于半充满更稳定,排布发生变化:1s22s22p63s23p64s13d5除了6个价电子之外,其余的电子一般不发生化学反应,于是简写为:[Ar]4s13d5这里,具有氩的电子构型的那18个电子称为“原子实”。
一般把主量子数小的写在前面:[Ar]3d54s1电子构型对性质的影响主页面:元素周期律电子的排布情况,即电子构型,是元素性质的决定性因素。
为了达到全充满、半充满、全空的稳定状态,不同的原子选择不同的方式。
具有同样价电子构型的原子,理论上得或失电子的趋势是相同的,这就是同一族元素性质相近的原因;同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去。
元素周期表中的区块是根据价电子构型的显著区别划分的。
不同区的元素性质差别同样显著:如s 区元素只能形成简单的离子,而d区的过渡金属可以形成配合物。
三、能层(电子层)和能级(电子亚层)1、能层在多电子原子的原子核外电子的能量是不相同的。
按电子的能量不同,可将核外电子分成不同的能层,并有符号K、L、M、N、O、P、Q表示。
原子核外每一层最多容纳的电子数如下:2、能级理论研究证明,在多电子原子中,同一能层的电子能量也可能不同,还可以把它们分成能级。
就好比能层是楼层,能级就是楼的台阶。
能级的符号和所能容纳的点子数如下:五、核外电子排布原则①最低能量原理:基态原子中,电子总是优先占据能量较低的轨道。
②泡利不相容原理:一条轨道最多容纳两个自旋相反的电子。
③洪特规则(Hund’s rule):在等价轨道上,电子将尽先分占各轨道,且自旋平行。
(量子力学理论已证明:原子中自旋平行电子的增多有利于能量的降低)推知:等价轨道半充满(s1, p3, d5, f7)全充满(s2, p6, d10, f14)全空(s0, p0, d0, f0)此时体系能量较低,状态较稳定电子排布顺序:1s2 <2s2 <2p6< 3s2< 3p6< 4s2< 3d10< 4p6<5s2< 4d10< 5p6< 6s2< 4f14< 5d10< 6p6<7s2< 5f14< 6d10< 7p6…能级(电子亚层)如果用更加精细的光谱仪观察氢原子光谱,就会发现,原来的整条谱线又有裂分,这意味着量子化的两电子层之间存在着更为精细的“层次”,这被称为“能级”,每一电子层都由一个或多个能级组成,同一能级的能量相同。
