怎样确定原子的电子层排布
原子核外电子排布规律

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3、NH2、NH3、NH4、O2、OH H2O、H3O F HF、Ne、Na Mg2、Al3等。
②18电子粒子:SiH4、P3、PH3、S2、HS H2S、Cl HCl、Ar、K Ca2、PH4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na NH4、H3O F OH NH2;HS Cl前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He (3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
(完整版)核外电子排布规律总结

原子核外电子排布规律①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K 层为最外层时不能超过2个)次外层最多只能容纳18个电子(K 层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH 、N 、NH 、NH 、NH 、O、OH 、H O 、H O 、F 、HF 、Ne 、Na 、Mg 、Al 等。
4-3-23+4-2-23+-++2+3 ②18电子粒子:SiH 、P 、PH 、S 、HS 、H S 、Cl 、HCl 、Ar 、K 、Ca 、PH 等。
4-33-2-2-++2+4 特殊情况:F 、H O 、C H 、CH OH222263 ③核外电子总数及质子总数均相同的阳离子有:Na 、NH 、H O 等;阴离子有:++43+F 、OH 、NH ; HS 、Cl 等。
---2--前18号元素原子结构的特殊性:(1)原子核中无中子的原子:H11(2)最外层有1个电子的元素:H 、 Li 、Na ;最外层有2个电子的元素:Be 、Mg 、He(3)最外层电子总数等于次外层电子数的元素:Be 、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li 、P(6)电子层数与最外层电子数相等的元素:H 、Be 、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li 、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He 例外)(2)在元素周期表中,同周期的ⅡA、ⅢA 族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
电子层排布

电子层electronic shell电子层,或称电子壳,是原子物理学中,一组拥有相同主量子数n的原子轨道。
电子在原子中处于不同的能级状态,粗略说是分层分布的,故电子层又叫能层。
电子层可用n(n=1、2、3…)表示,n=1表明第一层电子层(K层),n=2表明第二电子层(L层),依次n=3、4、5时表明第三(M层)、第四(N层)、第五(O 层)。
一般随着n值的增加,即按K、L、M、N、O…的顺序,电子的能量逐渐升高、电子离原子核的平均距离也越来越大。
电子层可容纳最多电子的数量为2n^2。
电子层不能理解为电子在核外一薄层空间内运动,而是按电子出现几率最大的区域,离核远近来划分的。
亨利·莫斯莱和巴克拉首次于X-射线吸收研究的实验中发现电子层。
巴克拉把它们称为K、L和、M(以英文子母排列)等电子层(最初K 和L 电子层名为 B 和A,改为K 和L 的原因是预留空位给未发现的电子层)。
这些字母后来被n值1、2、3等取代。
电子层(electronic shell)的名字起源于波尔模式中,电子被认为一组一组地围绕著核心以特定的距离旋转,所以轨迹就形成了一个壳。
电子在原子核外排布时,要尽可能使电子的能量最低。
一般来说,离核较近的电子具有较低的能量,随着电子层数的增加,电子的能量越来越大;同一层中,各亚层的能量是按s、p、d、f的次序增高的。
这两种作用的总结果可以得出电子在原子核外排布时遵守下列次序:1s、2s、2p、3s、3p、4s、3d、4p……当原子处在基态时,原子核外电子的排布遵循三个原则:(1)泡利不相容原理(2)能量最低原理(3)洪特规则泡利不相容原理我们已经知道,一个电子的运动状态要从4个方面来进行描述,即它所处的电子层、电子亚层、电子云的伸展方向以及电子的自旋方向。
在同一个原子中没有也不可能有运动状态完全相同的两个电子存在,这就是保里不相容原理所告诉大家的。
根据这个规则,如果两个电子处于同一轨道,那么,这两个电子的自旋方向必定相反。
原子核外电子的排布

3. 从原子序数11依次增加到17,下列所叙递变关 系错误的是( AB ) A.电子层数逐渐增多 B.原子半径逐渐增大 C.最高正价数值逐渐增 D.从硅到氯负价从-4到-1 4. 原子半径由小到大,且最高正价依次降低的 ( A ) A. Al,Mg,Na B. N,O,F C. Ar,Cl,S D. l,P,Si
(3Байду номын сангаас次外层电子数不超过18个电子;
倒数第三层不超过32个。
3.核外电子排布的表示方法
3Li 11Na
+19 2 8 8 1 +3 2 1 +11 2 8 1
19K
37Rb 55Cs
+37 2 8 18 8 1
+55 2 8 18 18 8 1
2.化合价的周期性变化
3.原子半径的递变规律
微粒半径大小比较
原子核外电子的排布
一.原子核外电子排布
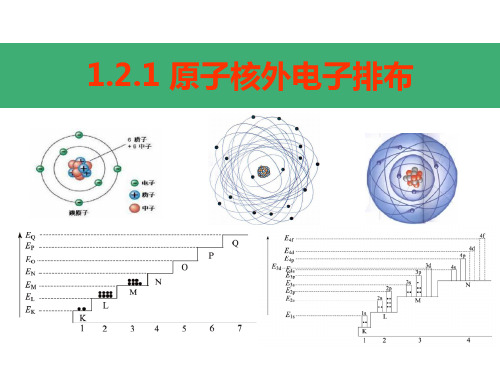
1、电子层的划分 电子层 (用n表示) 电子层符号
1 2 3 4 5 6 7
K 近 L M N O P Q 远
离核距离
电子能量高低
低
高
2、核外电子排布规律 (1)各电子层最多容纳2n2个电子; (2)最外层电子数不超过8个电子 (K层为最外层时不超过2个);
1、原子半径大小的比较
同主族,从上到下,原子半径逐渐增大 同周期,从左到右,原子半径逐渐减小 2、同种元素 (1)同种元素的原子和离子比较:阴大阳小 < 如:Cl- > Cl Na+ ______Na (2)同元素不同价态阳离子: 数大径小 < Fe3+ _____ Fe 2+ < Fe
3、同结构 序大径小 电子层结构相同的离子,核电荷数越大, 离子半径越小 r(O2-) > r(F-) > r(Na+) > r(Mg2+) > r(Al3+)
原子的电子层排布

原子的电子层排布
电子的排布规律
1、电子是在原子核外距核由近及远、能量由低至高的不同电子层上分层排布。
2、每层最多容纳的电子数为2n²个(n代表电子层数)。
3、最外层电子数不超过8个(第一层不超过2个),次外层不超过18个,倒数第三层不超过32个。
4、电子一般总是尽先排在能量最低的电子层里,即先排第一层,当第一层排满后,再排第二层,第二层排满后,再排第三层。
电子云是电子在原子核外空间概率密度分布的形象描述,电子在原子核外空间的某区域内出现,好像带负电荷的云笼罩在原子核的周围,人们形象地称它为“电子云”。
它是1926年奥地利学者薛定谔在德布罗伊关系式的基础上,对电子的运动做了适当的数学处理,提出了二阶偏微分的的著名的薛定谔方程式。
这个方程式的解,如果用三维坐标以图形表示的话,就是电子云。
电的速度虽然很快,仅次于光速,但是在没有形成电路之前,一个电子走完1米长的导线大约要1小时长,比蜗牛还慢!
核外电子的分层排布规律:
1、第一层不超过2个,第二层不超过8个;
2、最外层不超过8个。
每层最多容纳电子数为2n2个(n代表电子层数),即第一层不超过2个,第二层不超过8个,第三层不超过18个;
3、最外层电子数不超过8个(只有1个电子层时,最多可容纳2个电子)。
4、最低能量原理:电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
5、泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
6、洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
原子核外电子排布规律

①能量最低原理:电子层划分为K<L<M<O<P<Q,对应电子层能量增大;原子核外电子排布按照能量较低者低优先排布原则.②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳8个电子(K层为最外层时不能超过2个)次外层最多只能容纳18个电子(K层为次外层时不能超过2个倒数第三层最多只能容纳32个电子注意:多条规律必须同时兼顾。
简单例子的结构特点:(1)离子的电子排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同,如钠离子、镁离子、铝离子和氖的核外电子排布是相同的。
阴离子更同一周期稀有气体的电子排布相同:负氧离子,氟离子和氖的核外电子排布是相同的。
(2)等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3、NH2、NH3、NH4、O2、OH、H2O、H3O、F、HF、Ne、Na、Mg2、Al3等。
②18电子粒子:SiH4、P3、PH3、S2、HS、H2S、Cl、HCl、Ar、K、Ca2、PH4等。
特殊情况:F2、H2O2、C2H6、CH3OH③核外电子总数及质子总数均相同的阳离子有:Na、NH4、H3O等;阴离子有:F、OH、NH2;HS、Cl等。
前18号元素原子结构的特殊性:(1)原子核中无中子的原子:11H(2)最外层有1个电子的元素:H、Li、Na;最外层有2个电子的元素:Be、Mg、He (3)最外层电子总数等于次外层电子数的元素:Be、Ar(4)最外层电子数等于次外层电子数2倍的元素:C ;是次外层电子数3倍的元素:O ;是次外层电子数4倍的元素:Ne(5)最外层电子数是内层电子数一半的元素:Li、P(6)电子层数与最外层电子数相等的元素:H、Be、Al(7)电子总数为最外层电子数2倍的元素:Be(8)次外层电子数是最外层电子数2倍的元素:Li、Si元素周期表的规律:(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素,最外层电子数为1或2的元素可能是主族、副族或0族元素,最外层电子数为8的元素是稀有气体(He例外)(2)在元素周期表中,同周期的ⅡA、ⅢA族元素的原子序数差别有:①第2、3周期(短周期)元素原子序数都相差1;②第4、5周期相差11;③第6、7周期相差25(3)同主族、邻周期元素的原子序数差①位于过渡元素左侧的主族元素,即ⅠA、ⅡA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素总数;相差的数分别为2,8,8,18,18,32②位于过渡元素左侧的主族元素,即ⅢA~ⅦA族,同主族、邻周期元素原子序数之差为下一周期元素所在周期所含元素种数。
原子核外电子排布规律

Br
和81 35
Br
其近似的相对原子
质量为80.2
求
81 35
Br
物质的量分数
整理课件
【例】(2005年江苏高考题)我国的“神舟”
五号载人飞船已发射成功,“嫦娥”探月工程也
已正式启动。据科学家预测,月球的土壤中吸附
着数百万吨的32He,每百吨32He核聚变所释放的 能量相当于目前人类一年消耗的能量。在地球上,
00全国高考题 整理课件
⒈原子的构成是本节重点,掌握的关系式:
整理课件
ZAX
的含义:代表一个质量数为A、 质子数为Z的原子。
X A +d c-+-
Ze
中各个字母的含义: A:质量数; Z:质子数; e:原子个数; c:电荷数 d: 化合价
整理课件
⑵电性关系: 原子:核电荷数(Z)=核内质子数=核外电子数 阳离子:核电荷数(Z)=核内质子数>核外电子数
倒数第三层最多只能整容理课件纳32个电子
原子的构成
整理课件
阅读表1-7,质子、中子、电子的电性和电量 怎样?比较三种粒子的质量大小、带电荷情况。 什么是相对质量?
(1)收集材料:结合初中所学的有关原子结 构的初步知识填写下表:
构成原子的微粒 电子
原子核
质子
中子
电性和电量 质量/kg
负电荷
正电荷
0
核电荷数(Z)=核内电子数+电荷数 阴离子:核电荷数(Z)=核内质子数<核外电子数
核电荷数(Z)=核内电子数—电荷数 ⑶质量关系:质量数(A)=质子数(Z)+中子数(N) ⒉元素、核素、同位素
整理课件
和Na+具有相同质子数和电子数的微粒是:A来自A、NH4+ C、H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
怎样确定原子的电子层排布
一、电子层容量原理
ﻩ在原子核外电子排布中,每个电子层最多容纳的电子数为2n2,这个规律在一些无机化学教材中叫做最大容量原理。
我认为,该原理并不能全面反映原子核外电子排布的真实情况,其一,它只适合于离核近的内电子层,且不是最大,而是等于2n 2;其二,离核远的外电子层,实际排布的电子数则远远小于2n 2,根本不能用此原理来描述。
离核近的内电子层与离核远的外电子层,各有其电子容量的规律,原子的电子层排布,就是这两种规律结合而成的。
为此,我总结出内电子层和外电子层的各自的容量规律,并将两者结合起来,称为“电子层容量原理”,其内容如下:
设ω为原子的电子层数,n 为从原子核往外数的电子层数,m 为由原子最外层往里数的电子层数。
当n <22+ω时,为内电子层,每个电子层容纳的电子数=2n 2。
当n ≥22+ω时,为外电子层,每个电子层最多容纳的电子数=2(m+1)2.
核外只有k层时,最多容纳2个电子。
ﻩ由上述两个关系组成的电子层排布如下:
ﻩ从以上图示可知,原子的电子排布是两头少,中间多。
应用电子层容量原理,可使外电子层不用2n 2,避免出现太大偏差.
应用外电子层的公式,可以取代中学教材中的如下规律:
(1) 最外层电子数不超过8个(最外层为K 层,则不超过2个)。
(2) 次外层电子数不超过18个。
ﻩ(3) 外数第三层电子数不超过32个.……
因为这些规律可直接从外电子层的公式推出。
稀有气体原子的电子层排布则是很规整的相等关系,其内电子层电子数为2n2,外电子层电子数为2(m +1)2,因此,稀有气体元素原子的电子层结构是一种稳定结构.主族元素的
原子,最外层未达到2(m +1)2个电子(即8个电子),一般副族元素的原子,最外层和次外层的
电子数均小于2(m+1)2。
原子的电子层数越多,出现未填满电子数2(m+1)2的外电子层数
就越多。
它可用下式计算:未排满2(m+1)2个电子的电子层数最多为2
ω(当为偶数)或21-ω(为奇数)。
例如:核外有6个电子层的元素,没有排满2(m +1)2个电子的外电子层数最多为6
/2=3。
镧系元素的原子,一般就有4、5、6三个电子层的电子数未达到2(m +1)2。
ﻩ2n 2是由电子运动状态的四个量子数及泡利不相容原理所得出的关系,而2(m +1)2却是由能级交错现象所得出的关系。
对于多电子原子,由于电子的屏蔽作用和穿透作用,出现了原子轨道的交错现象,产生了与元素周期表中周期相对应的能级分组,能级组的通式为ns 、(n -2)f 、(n -1)d 、np 。
从第3电子层起,出现E n d>E (n +1)s ,从第4电子层起,出现E nf >E(n +2)s .因此,在次外层电子数未达到最大容量时,已出现了最外层电子的填充,而最外层电子数未达到最大容量时,又
进行次外层电子的填充;并且在更高的电子层出现之前,最外层中只可能出现s 轨道和p轨道排有电子,因而最多容纳的电子数为8个;次外层中只能出现s 轨道、p轨道和d 轨道排有电子,其容纳的电子数不超过18个;余类推。
例如,铅(Pb )原子最外层为6s 26p 2,共4
个电子;次外层为5s 25p 65d 10,共18个电子;外数第3层为4s 24p64d 104f 14,共32个电
子。
如果某原子的6d轨道上占有电子,那末,它就不是最外层,按照能级高低的顺序,7s 轨道将会排上2个电子。
若第7层是最外层,则第6层就是次外层了。
利用电子层容量原理,可以根据元素的原子序数确定原子的电子层排布,写出原子结构示意图,推断元素在周期表里的位置.
二、饱和结构和稳定结构
ﻩ饱和结构是指原子的每个电子层的电子数都达到2n 2的电子层结构,能够达到饱和结构的原子是不多的,只有氦原子(2)、氖原子(2、8)。
稳定结构则是指符合电子层容量原理的电子层排布,即内电子层的电子数都达到2n2,而外电子层的电子数都达到2(m +1)2。
稀有气体原子的电子层结构是这种稳定结构. ﻩ由上述叙述可知,原子的电子层结构中所谓的饱和结构和稳定结构是两个不同的概念,并且只能出现在稀有气体原子的电子层结构中,其它元素原子的电子层结构都不是稳定结构,
更不可能是饱和结构,因为它们的电子层结构至少有一个外层电子数未达到2(m +1)2。
但
是这些原子有失去或得到电子形成稀有气体原子的电子层结构,这是是引起化学反应的根本原因.这种具有稀有气体原子电子层结构的离子,我们把它简称为稀型离子(稀型离子在元素周期的推断题中往往是很重要的条件和解题的关键).因此,稀型离子的电子层结构是符合电子层容量原理的。
我们一般把这种稳定结构叫做2电子结构和8电子结构,这是常见的一种稳定结构.除此以外,离子的电子层结构还有最外层为18电子的,不足18电子的,以及外电子层为(18+2)电子等的稳定结构。
ﻩ三、能级交错的规律
ﻩ对于核外电子排布的能级交错现象,我总结出以下规律。
不同电子层上的能级发生交错的条件是:
亚层差=电子层差+1
即:ns <(n -1)d,ns <(n -2)f ,np <(n -1)f,……
由此可以得出核外电子排布的能级高低顺序图:
1s 2s2p 3s 3p3d 4s3d4p 5s4d5p 6s 4f 5d 6p 7s
也可以从上关系中得出:从L层才会出现能级交错现象,即s 和d的能级交错;而从P 层才会出现s和f 的能级交错;从O层才会出现p 和f的能级交错.由到组成一个能级组,目前周期表中含有七个能级组,对应周期表里的七个周期。
每一能级组中所所包含的电子数,就是对应周期的元素个数.如第6能级组为6s 4f 5d 6p,共有32个电子,对应周期表里的第六周期的32个元素。
四、推断元素
已知元素的原子序数推断元素,确定其在元素周期表中的位置,一般有三种方法。
1.利用元素周期表的结构。
用该元素的原子序数,从第一周期元素数目减起,直到减不够为止.如55号元素,55―2―8―8―18―18=1,故该元素为第六周期、第ⅠA 族元素,为铯(C s).
此方法可以确定每一个元素,但必须熟悉元素周期表的结构,记住每一周期的元素个数.
2.利用电子排布式确定元素。
如55号元素,其电子排布式为:1s22s22p 63s 23p 63d
104s 24p64d105s25p 66s 1,得出该元素为第六周期、第ⅠA 族元素,为铯(Cs )。
此方法可以确定每一个元素,但必须熟悉能级高低顺序,能正确地写出它的电子排布式。
3.利用原子结构示意图.周期序数=电子层数,主族序数=最外层电子数,由此确定元素在周期表里位置,并知道是什么元素。
利用电子层容量原理,根据元素的原子序数,可以确定稀有气体元素和Ⅳ-Ⅶ族元素原子的电子层排布,写出原子结构示意图.
ﻩ例如,Rn 原子核外有86个电子,有6个电子层。
22+ω=2
24+=4。
当n <4时,每个电子层的电子数用2n2
计算,这样,可得出K 、L 、M层的电子数依次为2,8,18.
当n≥4时,每个电子层的电子数用2(m +1)2计算:
ﻩN层,即外数第3层,m =3,电子数=2(3+1)2=32。
O 层,即次外层,m =2,电子数=2(2+1)2=18。
ﻩP层,即最外层,m =1,电子数=2(1+1)2=8。
故Rn 原子的电子层结构为:2,8,18,32,18,8。
ﻩ又如,52号元素,原子核外有5个电子层。
这是一个主族元素,最外层没有达到8个电子。
22+ω=225+=3.5。
ﻩ即n<3.5的K 、L 、M层的电子数用2n2计算,分别为2,8,18。
ﻩn >3.5的N层为次外层,用2(m+1)2计算电子数,为18,余下的电子数就应排在最外层(O 层),其电子数为52-(2+8+18+18)=6。
ﻩ故该元素原子的电子层排布为:2,8,18,18,6。
如果只知道原子序数,不知道电子层数,则可按下述方法确定原子电子层排布。
稀有气体元素的电子层结构为:① 从内层往外数,每个电子层电子数为2n 2;② 从外层往里数,每个电子层电子数为2(m+1)2;③ 以上两种关系,相交而止。
ﻩ例如,54号元素Xe ,有54个电子,按2n2确定K、L 、M 层的电子数,分别为2,8,1
8.(N 层电子数为32,前4层的总电子数将大于54,不可能)前3层的总电子数为2+8+18=28,剩余电子数为54-28=26.
ﻩ按照2(m +1)2,最外层8个电子,次外层18个电子,共26个电子,故Xe 原子的电子层结构为2,8,18,18,8.
又如主族元素114号元素的原子,按2n 2可排出:
ﻩﻩK L M N
2 8 18 32
60
ﻩ还剩114-60=54个电子。
按2(m+1)2得出:
ﻩ 外数第3层 次外层 最外层
ﻩ 32 18 x
50
ﻩ因此,最外层电子数应为x=54-50=4.该原子的电子层排布是2,8,18,32,32,18,。
