常见元素的电离能
反映元素性质的重要数据电离能与电负性

反映元素性质的重要数据—电离能与电负性一、电离能电离能是指从气态原子中去掉电子把它变成气态阳离子,需要克服核电荷的引力而消耗的能量。
符号为I,单位常用电子伏特。
从元素的气态原子去掉一个电子成为+1价气态阳离子所需消耗的能量,称为第一电离能(I1);从+1价气态阳离子再去掉一个电子成为+2价气态阳离于所需消耗的能量,叫做第二电离能(I2);依此类推。
逐级电离能逐步升高。
用元素的I1可以衡量元素金属性的强弱。
I1越小,原子越容易失去电子,该元素的金属性越强。
例1、电离能是指1mol气态原子(或阳离子)失去1mol电子形成1mol气态阳离.子(或更高价气态阳离子)所需吸收的能量。
现有核电荷数小于20的元素A,其电离能数据如下(I1表示原子失去第一个电子的电离能,In表示原子失去第n个电子的电离能。
单位:eV)序号I1I2I3I4I5I6电离能7.64415.0380.12109.3141.2186.5序号I7I8I9I10I11┈电离能224.9266.0327.9367.41761┈(1)外层电子离核越远,能量越高,电离能____(填“大”或“小”)。
阳离子电荷数越高,再失去电子时,电离能越____(填“大”或“小”)。
(2)上述11电子分属几个电子层?(3)去掉11个电子后,该元素还有____个电子。
分析:相当一部分学生看不懂题意,反映出的问题是不会应用相对量进行分析,从表中可看出,电离能的绝对量是I1〈I2〈I3┅但在此更应关注相对量。
相邻两个电离能的相对量是:,,,┈而,从相对量的变化说明I1、I2两个电子的排布与I3到I10八个电子的排布不同,而I11电子的排布又是另一回事。
所以上述11个电子分属三个电子层,最外层有2个电子,次外层有8个电子,是镁元素。
本题的分析还可以启发教育我们的学生,科学家是如何认识电子在核外是分层排布的。
答案:(1)小;大(2)3 (3)1 (4)Mg(OH)2例2、不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如下图所示。
电离能及其变化规律

ⅡA>ⅢA,
ⅤA>ⅥA
5、同周期过渡元素的I1变化不太规则,从左到右 略有增加
I1
1-36 号元素第一电离能变化趋势 号元素第一电离能变化趋势 1-36
Zn
Sc
5
10
15
20
25
30
35 原子序数
问题解决
1、根据下列五种元素的电离能数据(单位:kJ/mol),
你能得到哪些信息?
元素代 号 Q R S T U I1 2080 500 740 580 420 I2 4000 4600 1500 1800 3100 I3 6100 6900 7700 2700 4400 I4 9400 9500 10500 11600 5900
I1
He
1-36 号元素第一电离能变化趋势 号元素第一电离能变化趋势 1-36
Ne
Ar
Kr
H
Li
Na
K
5
10
15
20
25
30
35 原子序数
【规律总结】
不同元素第一电离能的变化规律:
1、同周期元素I1从左到右呈增大趋势,碱金属元 素的I1最小,稀有气体元素的I1最大。
2、同一主族元素I1从上到下逐渐减小。 3、元素的I1随原子序数的递增呈现周期性变化。 4、同周期元素I1变化存在反常现象:
元素 I1 I2 I3 I4
Mg
738
1451
7733
10540
【规律总结】
同一元素不同级电离能的变化规律: 逐级增大,且存在突跃 。
探究二
1、试推测比较Na、Mg的第一电离能大小,并从原子 半径和核电荷数角度加以解释。 据你推测,第三周期元素第一电离能的主要变化趋 势是怎样的?
元素周期表中的电离能与电负性的变化规律

元素周期表中的电离能与电负性的变化规律元素周期表是描述元素性质和组织元素信息的基本工具。
在元素周期表中,每个元素都有其特定的电离能和电负性。
电离能是指在气态下,元素失去一个电子形成阳离子所需的能量;而电负性则是元素在化学反应中对电子的亲和力。
本文将探讨元素周期表中电离能与电负性的变化规律。
1. 电离能的变化规律元素的电离能随着周期表中元素原子序数的增加而增加。
从周期表中我们可以观察到以下规律:1.1 周期性变化在同一周期中,原子半径变小,电离能增大。
这是因为同一周期中的元素核电荷数增加,吸引外层电子的力增强,故电离能增大。
1.2 族内变化同一族的元素拥有相似的化学性质,因此它们之间的电离能也存在一定的规律性。
一般来说,元素周期表中向下移动,原子半径增大,电离能减小。
这是因为原子半径增大会减少核对外层电子的吸引力,使得电子更容易被剥离。
1.3 主族元素与过渡元素的比较在主族元素中,电离能随着族号的增加而减小。
主族元素的原子外层电子数量相同,核电荷数增加,电离能增大的速度较慢。
而过渡元素的电离能变化不太明显,因为它们的电子分布在d轨道中,离核距离相对较远。
2. 电负性的变化规律电负性是描述元素吸引外层电子的能力的物理量。
元素周期表中,电负性随着原子序数的增加而变化。
2.1 周期性变化在同一周期中,电负性随着元素的原子半径减小而增加。
这是因为原子半径减小,核对外层电子的吸引力增加,元素对电子的亲和力也随之增强。
2.2 族内变化同一族的元素具有相似的原子结构和外层电子构型,因此它们之间的电负性也存在一定规律。
一般而言,族号增加,电负性增加。
这是因为随着族号的增加,原子核对外层电子的吸引力增强,元素对电子的亲和力也随之增强。
2.3 非金属元素与金属元素的比较在元素周期表中,非金属元素的电负性一般比金属元素大。
非金属元素的原子对电子的吸引力较强,因此它们更容易获得电子形成负离子。
总结:元素周期表中的电离能与电负性有其固定的变化规律。
h和c的第一电离能

h和c的第一电离能
在化学中,第一电离能是指从一个原子或离子中移除一个电子所需的能量。
对于氢原子来说,它只有一个电子,因此它的第一电离能非常低,为1312 kJ/mol。
而对于碳原子来说,它有六个电子,因此它的第一电离能比氢原子高得多,为1086 kJ/mol。
第一电离能是化学中一个非常重要的概念,因为它可以用来确定一个元素在化学反应中的活性。
如果一个元素的第一电离能很高,那么它很难失去一个电子并参与化学反应。
相反,如果一个元素的第一电离能很低,那么它很容易失去一个电子并参与反应。
此外,第一电离能还可以用来确定元素的电子排布。
对于一个原子来说,如果它的电子排布很稳定,那么它的第一电离能通常会比较高。
反之,如果一个原子的电子排布不稳定,那么它的第一电离能通常会比较低。
总之,第一电离能是化学中一个非常重要的概念,它可以用来确定元素在化学反应中的活性以及其电子排布。
对于氢原子来说,它的第一电离能非常低,而碳原子的第一电离能则比氢原子高得多。
- 1 -。
元素电离能列表
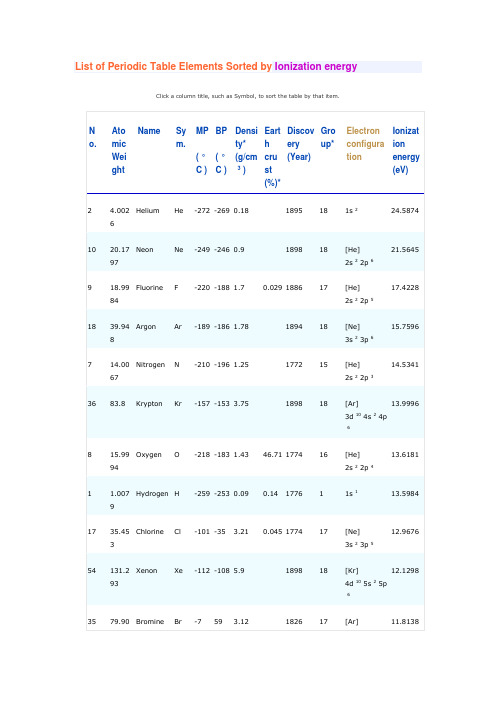
List of Periodic Table Elements Sorted by Ionization energyClick a column title, such as Symbol, to sort the table by that item.Abbreviations and Definitions:No. - Atomic NumberMP - melting pointBP - boiling point* Density of elements with boiling points below 0°C is given in g/l* Earth crust composition average values are from a report by FW Clarke and HS Washington, 1924. Elemental composition of crustal rocks differ between different localities ( see article ).* Group: There are only 18 groups in the periodic table that constitute the columns of the table. Lanthanoids and Actinoids are numbered as 101 and 102 to separate them in sorting by group.Atomic number: The number of protons in an atom. Each element is uniquely defined by its atomic number.Atomic mass: The mass of an atom is primarily determined by the number of protons and neutrons in its nucleus. Atomic mass is measured in Atomic Mass Units (amu) which are scaled relative to carbon, 12 C, that is taken as a standard element with an atomic mass of 12. This isotope of carbon has 6 protons and 6 neutrons. Thus, each proton and neutron has a mass of about 1 amu.Isotope: Atoms of the same element with the same atomic number, but different number of neutrons. Isotope of an element is defined by the sum of the number of protons and neutrons in its nucleus. Elements have more than one isotope with varying numbers of neutrons. For example, there are two common isotopes of carbon, 12 C and 13 C which have 6 and 7 neutrons respectively. The abundances of different isotopes of elements vary in nature depending on the source ofmaterials. For relative abundances of isotopes in nature see reference on Isotopic Composition of the Elements .Atomic weight: Atomic weight values represent weighted average of the masses of all naturally occurring isotopes of an element.The values shown here are based on the IUPAC Commission determinations ( Pure Appl. Chem. 73:667-683, 2001 ). The elements marked with an asterisk have no stable nuclides. For these elements the weight value shown represents the mass number of the longest-lived isotope of the element.Electron configuration: The distribution of electrons according to the energy sublevels (subshells) in uncharged atoms. The noble gas shown in square brackets (eg [He]), marks that all the subshells associated with that element are fully occupied by electrons.For further information see another web site .Ionization energy (IE): The energy required to remove the outermost electron from an atom or a positive ion in its ground level.The table lists only the first IE in eV units. To convert to kJ/mol multiply by 96.4869. Reference: NIST Reference Table on Ground levels and ionization energies for the neutral atoms . IE decreases going down a column of the periodic table, and increases from left to right in a row. Thus, alkali metals have the lowest IE in a period and Rare gases have the highest.∙List of Periodic Table Elements in Hebrew∙Evolution of the Universe and Origin of the Elem ents∙Atomic Reference Data for Electronic Structure Calculations∙Multilingual Dictionary and Etymology of the Periodic Table Elements。
电离能的变化规律

电离能的变化规律
电离能的变化规律是:随着核电荷数的递增,元素的第一电离能呈现周期性变化。
总体上金属元素第一电离能较小非金属元素第一电离能较大。
同周期元素第一电离能从左到右有增大的趋势。
所以同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。
同一周期内元素的第一电离能在总体增大的趋势中有些曲折。
当外围电子在能量相等的轨道上形成全空(p0,d0,fo)、半满(p3,d5,f7)或全满(p6,d10,f14)结构时,原子的能量较低,元素的第一电离能较大。
元素的逐级电离能

元素的逐级电离能元素的逐级电离能是指一个原子在依次失去其外层电子的过程中所需的能量。
每个元素都有一系列的电离能,而每一级电离能都比前一级电离能高。
这是由于失去了一个外层电子后,原子的电荷增加,核吸引力对剩余的电子产生的作用力增大,因此需要更多的能量来移除下一个电子。
电离能是衡量一个原子的稳定性的重要指标。
原子的电离能越高,说明其电子结构更稳定,对电子的束缚力更强,反之则说明其电子结构相对不稳定。
在元素周期表中,电离能通常从左上角到右下角逐渐增加。
这是由于原子的核电荷数随着元素的原子序数的增加而增加,而电子的层数则相对稳定,所以电离能呈现出逐级增加的趋势。
在第一周期的元素中,电离能较低,因为它们只有一个电子,而且这个电子处在最外层。
当这个电子被移除时,原子的电子结构变得相对稳定,所以电离能较低。
然而,随着元素周期表的向下移动,原子的尺寸增大,电子层数增多。
在同一周期中,电离能随着原子序数的增加而逐渐增加。
这是由于原子的核电荷增加,对外层电子的束缚力增大。
电离能的逐级增加也可以解释为元素化学性质的变化。
具有较低电离能的元素更容易失去电子,形成正离子,而具有较高电离能的元素更难失去电子,更倾向于接受电子,形成负离子。
电离能的大小还可以用于解释元素的原子半径的变化。
电离能越高,原子的半径越小,因为电子更加紧密地围绕在核周围。
而电离能越低,原子的半径越大,因为电子离核的距离更远。
总的来说,元素的逐级电离能是元素的一个重要性质,它反映了原子的稳定性和电子结构的特点。
通过电离能的逐级增加,我们可以了解元素的化学性质、原子半径的变化以及元素的周期性规律。
这些知识对于理解元素周期表和化学反应有着重要的意义。
元素周期表中的电子亲和能与电离能

元素周期表中的电子亲和能与电离能电子亲和能和电离能是元素周期表中两个重要的物理性质。
它们揭示了元素原子内电子行为的特点。
本文将对电子亲和能和电离能进行详细的解释和探讨。
1. 电子亲和能电子亲和能是指一个原子吸收一个电子形成阴离子时释放的能量。
电子亲和能的正负值表示了原子对外层电子的吸引或排斥程度。
如果电子亲和能为正值,则说明原子对电子的吸引程度较强,易于形成阴离子;反之,如果电子亲和能为负值,则说明原子对电子的吸引程度较弱,不易形成阴离子。
电子亲和能与元素的位置和原子结构有关。
在周期表中,从左至右,原子序数逐渐增加,电子亲和能一般呈现增大的趋势。
这是因为原子核的正电荷不断增加,对外层电子的吸引力也逐渐增强。
然而,也有一些特殊的情况,如氧气和氟气的电子亲和能比氮气的高,这是因为氧气和氟气的外层电子排布更加稳定,易于接受一个电子形成负离子。
2. 电离能电离能是指一个原子失去一个外层电子形成正离子时所需的能量。
电离能的大小表示了原子对外层电子的束缚程度。
一般而言,电离能随着原子序数的增加而增大。
电离能可以分为第一电离能、第二电离能等。
第一电离能定义为原子失去一个外层电子形成正离子的能量,而第二电离能则指的是从一价正离子中再失去一个外层电子形成二价正离子的能量。
元素的电离能受到多种因素的影响,其中最重要的是原子半径和电子层数。
原子半径越小,电子云与原子核之间的静电作用越强,电离能也就越大。
而电子层数越靠外,原子核对外层电子的吸引力越小,电离能也随之减小。
3. 电子亲和能与电离能的关系电子亲和能与电离能有着密切的联系。
电子亲和能大的元素一般电离能也较大,因为原子对电子的吸引力越强,原子失去电子的难度也就越大。
反之,电子亲和能小的元素通常电离能也较小,因为原子对电子的吸引力相对较弱,电子离开原子的难度较小。
然而,电子亲和能和电离能并不完全相同,还存在一些例外情况。
例如,在周期表的第一周期中,氢的电子亲和能和电离能都很小,这是因为氢原子只有一个电子,其外层电子相对较远离原子核,对电子的吸引力较弱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
常见元素的电离能
电离能是指在气态下,从一个原子或离子中移除一个电子所需的能量。
它是描述元素化学性质的重要指标之一。
本文将介绍几个常见元素的电离能。
1. 氢(H)元素的电离能
氢元素的电离能非常低,是所有元素中最低的之一。
它只需要13.6电子伏特的能量就能够将一个氢原子的电子从基态(n=1)释放出来。
这个能量称为氢的第一电离能。
随后,氢的电离能逐渐增加,第二电离能是3.4电子伏特,第三电离能是1.51电子伏特,以此类推。
2. 碱金属元素的电离能
碱金属元素的电离能相对较低,与氢元素相比也较低。
对于钾(K)元素来说,它的第一电离能是4.34电子伏特,而第二电离能则是31.6电子伏特。
这意味着,钾元素中的第二个电子需要比第一个电子更大的能量来移除。
3. 碱土金属元素的电离能
碱土金属元素的电离能相对较高,比碱金属元素要高一些。
以钙(Ca)元素为例,它的第一电离能是6.11电子伏特,第二电离能是11.9电子伏特,第三电离能是50.9电子伏特。
可以看出,钙元素的电离能明显高于碱金属元素。
4. 半金属元素的电离能
半金属元素的电离能介于金属和非金属之间。
以硅(Si)元素为例,它的第一电离能是8.15电子伏特,第二电离能是16.3电子伏特。
硅元素具备金属和非金属的某些特性,因此其电离能也表现出中等的数值。
5. 非金属元素的电离能
非金属元素的电离能通常较高,要比金属元素高得多。
以氧(O)元素为例,它的第一电离能高达13.6电子伏特,比氢元素的
电离能大得多。
其他非金属元素如氮、氟等,在第一电离能方面也具有较高的数值。
总结
常见元素的电离能呈现出多种情况。
一般来说,金属元素的电离能相对较低,非金属元素的电离能相对较高,而半金属元素则介于两者之间。
电离能的大小直接影响元素的化学性质和反应能力,对于理解元素行为和化学反应具有重要意义。
以上是对常见元素电离能的简要介绍,希望对您有所帮助。
