天然气化工工艺学 第04章 甲醇和二甲醚合成
年产10万吨甲醇合成二甲醚工艺设计

年产10万吨甲醇合成二甲醚工艺设计1. 引言甲醇是一种重要的化工原料,在许多工业领域都有广泛的应用,比如作为燃料、溶剂和合成其他化学品的中间体。
而二甲醚(DME)是一种重要的替代燃料和清洁能源,在汽车和家庭用品等方面具有潜在应用价值。
为了满足市场需求,在本文中,我们将设计一种工艺,以每年产出10万吨的甲醇,并利用甲醇合成二甲醚。
2. 工艺图下图展示了年产10万吨甲醇合成二甲醚的工艺图:工艺图工艺图3. 工艺步骤3.1 甲醇生产首先,我们需要生产甲醇。
这可以通过对天然气进行蒸汽重整反应来实现。
该反应将天然气中的甲烷转化为一氧化碳和氢气。
然后,将一氧化碳和氢气在催化剂的存在下进行合成反应,生成甲醇。
3.2 甲醇净化生产的甲醇需要经过净化步骤,以去除杂质。
这包括使用吸附剂和分离技术,如蒸馏和结晶,将甲醇中的杂质去除,提高甲醇的纯度。
3.3 甲醇合成二甲醚在甲醇净化后,我们将进行甲醇合成二甲醚的反应。
该反应将甲醇与催化剂一起加热,生成二甲醚。
这是一个可逆反应,所以我们需要对反应条件进行控制,以提高二甲醚的产率。
3.4 二甲醚净化生产的二甲醚需要经过净化步骤。
这包括使用分离技术,如蒸馏和结晶,将二甲醚中的杂质去除,提高二甲醚的纯度。
4. 工艺参数为了实现年产10万吨甲醇合成二甲醚的目标,我们需要考虑以下工艺参数:•甲醇生产装置的产能•甲醇净化装置的效率•甲醇合成二甲醚反应的温度和压力•甲醇合成二甲醚反应的催化剂选择和用量•二甲醚净化装置的效率这些参数将直接影响到工艺的效果和产量。
5. 结论通过设计合理的工艺步骤和参数,我们可以实现每年产10万吨甲醇合成二甲醚的目标。
这有望满足市场需求,并为清洁能源领域做出贡献。
然而,需要注意的是,实际生产中可能会受到许多因素的影响,包括原材料供应、设备故障等等。
因此,需要进行全面的工艺设计和风险评估,以确保工艺的可行性和稳定性。
参考文献•Smith, J. M., Van Ness, H. C., & Abbott, M. M. (2005). Introduction to Chemical Engineering Thermodynamics (7th ed.). McGraw-Hill.。
二甲醚生产工艺

二甲醚生产工艺二甲醚是一种无色、无味的液体,化学式为 CH3OCH3,是一种重要的有机化学品。
它具有很高的燃烧热值,被广泛应用于化工领域。
下面我们来介绍一下二甲醚的生产工艺。
目前,二甲醚的主要生产工艺是通过甲醇脱水制备而成。
其具体的生产过程如下:首先,将甲醇加入至醇解器中,然后加入一定量的硫酸作为酸催化剂。
醇解器采用浸没式加热,在适宜的温度下进行反应。
甲醇与硫酸反应生成甲基甲醚,反应方程式为:CH3OH + H2SO4 → CH3OCH3 + H2O其中,甲醇为脱水剂,而硫酸则起催化剂的作用,加快反应速率。
随着反应的进行,甲基甲醚会沉淀形成液相和固相两个分离层。
液相中的甲基甲醚通过分离装置进行分离,然后经过净化处理,去除其中的杂质和有害物质。
固相中的硫酸则需要进行再生利用。
接下来,对液相中的甲基甲醚进行精馏操作,将其中含有的杂质分离出来,以提高二甲醚的纯度。
精馏塔通常采用连续操作,通过控制温度和压力来实现分馏。
分馏过程中,高纯度的二甲醚会在顶部的冷凝器中凝结成液体,然后被收集起来,而杂质则会在底部的渣油中积聚。
最后,经过精馏处理后得到的二甲醚为产品,可以通过灌装或其他方式包装出厂。
产生的废气和废水通过处理设备进行处理,以减少对环境的影响。
二甲醚的生产工艺需要一定的设备和化学药剂的投入,同时也需要进行精确的操作和控制。
在生产过程中,要注意安全生产,避免发生事故和意外,确保工作人员的人身安全。
总结起来,二甲醚的生产工艺主要包括甲醇脱水反应、分离和净化处理、精馏操作等步骤。
通过这些步骤,可以得到高纯度的二甲醚产品。
生产过程中需要考虑资源利用和环境保护等因素,以实现可持续发展。
二甲醚的生产方法有一步法和二步法
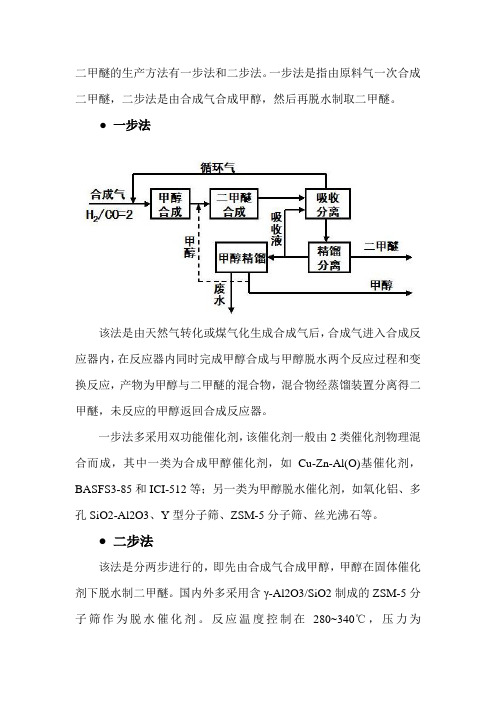
二甲醚的生产方法有一步法和二步法。
一步法是指由原料气一次合成二甲醚,二步法是由合成气合成甲醇,然后再脱水制取二甲醚。
● 一步法该法是由天然气转化或煤气化生成合成气后,合成气进入合成反应器内,在反应器内同时完成甲醇合成与甲醇脱水两个反应过程和变换反应,产物为甲醇与二甲醚的混合物,混合物经蒸馏装置分离得二甲醚,未反应的甲醇返回合成反应器。
一步法多采用双功能催化剂,该催化剂一般由2类催化剂物理混合而成,其中一类为合成甲醇催化剂,如Cu-Zn-Al(O)基催化剂,BASFS3-85和ICI-512等;另一类为甲醇脱水催化剂,如氧化铝、多孔SiO2-Al2O3、Y型分子筛、ZSM-5分子筛、丝光沸石等。
● 二步法该法是分两步进行的,即先由合成气合成甲醇,甲醇在固体催化剂下脱水制二甲醚。
国内外多采用含γ-Al2O3/SiO2制成的ZSM-5分子筛作为脱水催化剂。
反应温度控制在280~340℃,压力为0.5-0.8MPa。
甲醇的单程转化率在70-85%之间,二甲醚的选择性大于98%。
一步法合成二甲醚没有甲醇合成的中间过程,与两步法相比,其工艺流程简单、设备少、投资小、操作费用低,从而使二甲醚生产成本得到降低,经济效益得到提高。
因此,一步法合成二甲醚是国内外开发的热点。
国外开发的有代表性的一步法工艺有:丹麦Topsφe工艺、美国Air Products工艺和日本NKK工艺。
二步法合成二甲醚是目前国内外二甲醚生产的主要工艺,该法以精甲醇为原料,脱水反应副产物少,二甲醚纯度达99.9%,工艺成熟,装置适应性广,后处理简单,可直接建在甲醇生产厂,也可建在其它公用设施好的非甲醇生产厂。
但该法要经过甲醇合成、甲醇精馏、甲醇脱水和二甲醚精馏等工艺,流程较长,因而设备投资较大。
但目前国外公布的大型二甲醚建设项目绝大多数采用两步法工艺技术,说明两步法有较强的综合竞争力。
甲醇制造二甲醚(DME)

甲醇制二甲醚(DME)摘要:综述了二甲醚的性质、用途、生产方法及使用二甲醚时候的注意事项。
关键词:二甲醚化工产品合成气一步法甲醇液相法甲醇气相法一、产品说明1、二甲醚的基本概况二甲醚别名:甲醚英文名称:methyl ether;dimethyl ether;DMECAS编号:115-10-6分子式:C2H6O结构式:CH3—O—CH3二甲醚又称甲醚,简称DME。
二甲醚在常压下是一种无色气体或压缩液体,具有轻微醚香味。
相对密度(20℃)0.666,熔点-141.5℃,沸点-24.9℃,室温下蒸气压约为0.5MPa,与石油液化气(LPG)相似。
溶于水及醇、乙醚、丙酮、氯仿等多种有机溶剂。
易燃,在燃烧时火焰略带光亮,燃烧热(气态)为1455kJ/mol。
常温下DME具有惰性,不易自动氧化,无腐蚀、无致癌性,但在辐射或加热条件下可分解成甲烷、乙烷、甲醛等。
二甲醚是醚的同系物,但与用作麻醉剂的乙醚不一样,毒性极低;能溶解各种化学物质;由于其具有易压缩、冷凝、气化及与许多极性或非极性溶剂互溶特性,广泛用于气雾制品喷射剂、氟利昂替代制冷剂、溶剂等,另外也可用于化学品合成,用途比较广泛。
2 生产原理2.1 生产方法简介目前国内外二甲醚生产方法主要有合成气一步法和甲醇法。
甲醇法又分为甲醇气相法和甲醇液相法。
合成气一步法的工业化技术尚未成熟,理由是: ①现有的技术未经装置检验;②即使按现有技术,其生产成本也高于甲醇气相法2.2 反应方程式甲醇液相法:甲醇脱水反应在液相、常压或微正压、130 ~130 ℃下进行。
其化学反应式如下:2CH3OH =H3COCH3 +H2O甲醇气相法:催化剂为ZSM分子筛、磷酸铝或γ2Al2O3。
甲醇脱水反应的化学反应式如下。
主反应:2CH3OH =H3COCH3 +H2O主要副反应:CH3OH =CO + 2H2H3 COCH3 =CH4 +H2 +COCO +H2O =CO2 +H23 工艺过程及流程图3.1工艺过程甲醇液相法甲醇液相法由硫酸法发展而来,而硫酸法生产二甲醚工艺是硫酸法生产硫酸二甲酯生产流程中的前半段生产工艺。
甲醇气相脱水制二甲醚的基本原理实用PPT文档
温度升高,平衡常 数减小,甲醇平衡
转化率降低
甲单醇击气此相处脱编水辑制母二版甲标醚题的样基式本原理 二、反应速率
本征动力学
rM=5.50× 1010× e122867RT yM2(1-yD yw/Kp yM2 )
宏观动力学
rM=1.59322× 105× e/RTP23y(1-yD yw/ Kp yM2 )
Page 2
甲醇单气击相此处脱编水辑制母二版甲标醚题样的式基本原理
三、影响甲醇转化率的因素
C2CHH3O31OC.HH3质C量CHH4空+4+2速HH22与O++C甲OC 醇转化率的关系
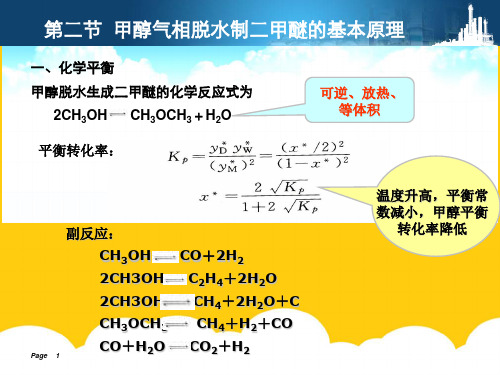
甲醇脱水生成二甲醚的化学反应式为
2.反应温度与甲醇转化率的关系 2甲2C温2甲二5甲二C甲 5第第甲233C12甲e甲二/CCCC00. . . .HHO醇度醇、醇、醇二二醇醇醇、××HHHH33+R质反反反气 升 气 反 气 反 气节 节 气 气 气 反333OO311TH应应应量OOOO00CCP相高相应相应相 相相相应2112HHHHHH温压压空甲甲O脱,脱速脱速脱 脱脱脱速00333度力力速××醇醇y水平水率水率水 水水水率(ee与与与与气气1衡制制制制 制制制CC11CCC-甲甲甲甲相相2222常二二二二 二二二CCHHOHH22y醇醇醇醇脱脱HH442数甲甲甲甲 甲甲甲88D44+ +44+66转转转转水水++醚减醚醚醚 醚醚醚y++7722H化化化化制制w22RR的小的的的 的的的HHHH2HH/TT率率率率二二2222基,基基基 基基基22OO++K的的的的甲甲OO本甲本本本 本本本p+ +CC关关关关醚醚原醇原原原 原原原yOOCC系系系系的的M理平理理理 理理理2基基衡)本本转原原化理理率降低
单第击二此处节编甲辑母醇版气标相题脱样水式制二甲醚的基本原理
甲醇制二甲醚

甲醇制二甲醚的生产工艺及催化剂的研究摘要:二甲醚应用广泛,主要用于气雾剂、溶剂和燃料。
作为氟里昂的替代产品,对大气臭氧层没有破坏,还可作为冷冻剂、萃取剂等。
可作为民用燃料代替天然气、液化石油气、人工煤气。
作为车用燃料可以解决我国石油紧张和汽车尾气排放带来的环境污染问题。
二甲醚碳烟排放和微粒排放几乎为零,没有加速烟尘,一氧化碳和醛类有害物质排放都低于世界上最严格的美国加州排放标准。
以至于甲醇制二甲醚的生产工艺及催化剂的研究成为了工业发展的要求。
关键词:甲醇二甲醚气相脱水法催化剂目前,世界上主要有4个致力于研究二甲醚特性及应用的组织,分别是国际二甲醚协会(IDA)、日本二甲醚论坛(JDF)、韩国二甲醚论坛(KDF)、中国二甲醚协会(CDA)。
2006年,日本二甲醚论坛首度发行了二甲醚使用手册,详细介绍了二甲醚的相关知识和发展历程。
2010年9月2日,国家质量监督检验检疫总局、国家标准化管理委员会联合批准发布国家标准GB 25035—2010《城镇燃气用二甲醚》,并自2011年7月1日起实施。
该标准严格规定了二甲醚的质量,使得二甲醚的应用有章可循。
国家标准《液化二甲醚气瓶》、国家标准《液化二甲醚气瓶阀》、国家标准《家用二甲醚燃气灶具》、行业标准《耐二甲醚密封材料》、行业标准《瓶装液化二甲醚调压器》等也正在编制中。
相关标准规范的不断完善,对推广二甲醚作为城镇燃气发挥了重要作用。
[1]1 生产工艺研究甲醇气相脱水法,是目前国内外使用最多的生产二甲醚工业方法,化学反应如下:主要副反应:2CH3OH=H3COCH3+H2OCH3OH=CO+2H2H 3COCH3=CH4+H2+COCO+H2O=CO2+H22CH3OH=C2H6+2H2O主要生产工艺过程为:甲醇经气化与反应器出来的反应产物换热后,进入二甲醚反应器进行气相催化脱水反应,反应产物经换热后,用循环水冷却冷凝。
反应条件为 0.5~1.8MPa、230℃~400℃,催化剂为 ZSM分子筛、磷酸铝或γ-Al2O3,冷却冷凝后的物料进行气液分离,气相送洗涤塔用甲醇或甲醇-水溶液吸收回收二甲醚,液相的粗二甲醚送精馏系统分离。
1.《天然气化工工艺学》习题、指导与训练2016.10.09讲解

1. 《天然气化工工艺学》习题、指导与训练要求:① 考核范围:系统掌握利用教材、讲义核心内容;② 注重训练:独立完成和理解本作业与训练-1,注重理解,提高解决实际问题的能力; ③ 公平竞争:考核结果取决于你自己的努力; ④ 教师关注:考核质量和及格率两大问题! ⑤ F = A*30% + B*70% + C* 0%)总结与训练-1 §1.0 天然气的组成与性质1. 天然气是由多种可燃和不可燃的气体组成的混合气体, 其中烃类气体主要成分为CH 4,其次为C 2H 6、C 3H 8等;非烃类气体通常为CO 2、CO 、N 2、H 2、H 2S 、H 2O 及微量惰性气体He 、Ar 等。
2. 1m 3(mol )天然气完全燃烧所放出的热量称为天然气的体积(摩尔)热值,可燃气热值分类:高热值(水蒸气冷却为冷凝水状态)和低热值(水蒸气为蒸汽状态) 。
3. 可燃物摩尔高热值与摩尔低热值的关系为蒸发焓)(22OH O H Hn LHV HHV ∆⋅+= 4. 甲烷、乙烷、丙烷的低热值(LHV) LHV(CH 4) > LHV (C 2H 6) > LHV(C 3H 8)。
5. 计算天然气的爆炸极限为5-15 v%。
其含义为若低于5 v%或者高于15 v%,则会因为天然气在空气中的含量不足或者过剩而不会发生爆炸。
6. CH 3OH 的爆炸极限为5.5% ~ 44 v% (6% ~ 36.5%)。
7. C 3+烃小于100mL(l)/m 3 (g)的天然气俗称贫气;而C 3+烃大于100mL(l)/m 3 (g)天然气俗称富气。
8. C 5+烃小于10mL(l)/m 3 (g)的天然气俗称干气;而C 5+烃小于10mL(l)/m 3 (g)的天然气俗称湿气。
§2 天然气净化1. 天然气中的硫化物主要是以H 2S 的形式存在,同时还可能有一些有机硫化物,如硫醇和硫醚等。
2.天然气脱硫工艺主要采用是醇胺法和砜胺法,其中醇胺法属于化学溶剂法,而砜胺法为主的化学-物理溶剂法。
天然气化工工艺学 第04章 甲醇和二甲醚合成

《天然气化工工艺学》第4章
甲醇的性质
③ 甲醇与硝酸作用生成硝酸甲酯
CH3OH HNO3 CH3 NO3 H2O
(4.1.10)
(5) 甲醇氯化
CH3OH Cl2 H2 CH3Cl HCl H2O
《天然气化工工艺学》第4章
4.1.3 甲醇合成反应热力学
表4.1 不同温度压力下CO合成甲醇的平衡常数值
温度 /℃ 200 250 300 350 400 450 500 压 力 /atm 50 3.780×10-2 3.075×10-3 3.938×10-4 6.759×10-5 1.482×10-5 4.003×10-6 1.282×10-6 100 6.043×10-2 4.516×10-3 5.235×10-4 8.342×10-5 1.758×10-5 4.657×10-6 1.470×10-6 150 9.293×10-2 6.416×10-3 6.907×10-4 1.013×10-4 2.019×10-5 5.205×10-6 1.593×10-6 200 1.230×10-1 8.578×10-3 8.778×10-4 1.202×10-4 2.324×10-5 5.655×10-6 1.742×10-6 250 1.617×10-1 1.072×10-2 1.026×10-3 1.387×10-4 2.539×10-5 6.630×10-6 1.952×10-6 300 2.023×10-1 1.297×10-2 1.211×10-3 1.586×10-4 2.905×10-5 7.025×10-6 2.072×10-6
y CO y H2O y CO2 y H2
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(4.1.6)
① 甲醇与甲酸反应生成甲酸甲酯
CH 3OH HCOOH HCOOCH 3 H2O
(4.1.7)
② 甲醇与硫酸作用生成硫酸氢甲酯、硫酸二甲酯
CH 3OH H2SO4 CH 3HSO 4 H2O
(4.1.8)
2CH 3OH H2SO4 (CH 3 )2SO 4 2H2O
(4.1.9)
表4.1 不同温度压力下CO合成甲醇的平衡常数值
温度
压 力 /atm
/℃
50
100
150
200
250
300
200 3.780×10-2 6.043×10-2 9.293×10-2 1.230×10-1 1.617×10-1 2.023×10-1 250 3.075×10-3 4.516×10-3 6.416×10-3 8.578×10-3 1.072×10-2 1.297×10-2 300 3.938×10-4 5.235×10-4 6.907×10-4 8.778×10-4 1.026×10-3 1.211×10-3 350 6.759×10-5 8.342×10-5 1.013×10-4 1.202×10-4 1.387×10-4 1.586×10-4 400 1.482×10-5 1.758×10-5 2.019×10-5 2.324×10-5 2.539×10-5 2.905×10-5 450 4.003×10-6 4.657×10-6 5.205×10-6 5.655×10-6 6.630×10-6 7.025×10-6 500 1.282×10-6 1.470×10-6 1.593×10-6 1.742×10-6 1.952×10-6 2.072×10-6
(4.1.23)
(2) CO2 3H2 CH3OH (g) H2O(g) r H (2) 49.5kJ mol (4.1.24)
(3) CO2 H2 CO H2O(g) r H (3) 41.2kJ mol
(4.1.25)
r H (1) r H (2) r H (3)
合成甲醇属于体积减小的放热反应,从反应平衡角度, 低温和高压均有利于甲醇生成。副产物有烃、醇、醛、醚、 酸和酯等化合物。
《天然气化工工艺学》第4章
4.1.3 甲醇合成反应热力学
这三个反应中,只有两个是独立的,上述三个反应的平
衡常数KP
p2 H2
1 p2
yCH 3OH
yCO
y2 H2
(4.1.33)
Kp2
pCH3OH pH2O pCO2 p3H2
1 p2
yCH3OH yH2o
具有醇类的典型反应;因含有甲基,所以又能进行甲基 化反应。
《天然气化工工艺学》第4章
4.1.1 甲醇的性质
(1)甲醇氧化制甲醛,进一步氧化制甲酸。制甲醛条件, 温度600~700℃,催化剂:沸石银、铜、五氧化二钒
CH 3OH 0.5O2 HCHO H2O
(4.1.1)
HCHO 1/ 2O2 HCOOH
(4.1.5)
《天然气化工工艺学》第4章
甲醇的性质
(3) 甲醇羰基化。甲醇与一氧化碳250℃、50~70MPa 条件下,通过碘化钴催化剂,或者在180℃、3~4MPa件 下,通过铑的羰基化合物催化剂,以碘甲烷为助催化剂,
合成醋酸。
CH 3OH CO CH 3COOH
(4) 甲醇酯化,生成各种酯类化合物。
(4.1.2)
(2)甲醇氨化,制甲胺。甲醇与氨混合,在370~420℃、 5.0~20.0MPa条件下,以活性氧化铝为催化剂
CH 3OH NH3 CH 3NH 2 H2O
(4.1.3)
2CH 3OH NH3 (CH 3)2 NH 2H2O
(4.1.4)
3CH 3OH NH 3 (CH 3 )3 N 3H2O
《天然气化工工艺学》第4章
甲醇的性质
③ 甲醇与硝酸作用生成硝酸甲酯
CH 3OH HNO 3 CH 3NO3 H2O
(4.1.10)
(5) 甲醇氯化
CH 3OH Cl 2 H2 CH 3Cl HCl H2O CH 3Cl Cl 2 CH 2Cl 2 HCl
CH 3Cl 2 Cl 2 CHCl 3 HCl
4 甲醇/DME及其衍生物
4.1 甲醇合成 4.2 醋酸 4.3 碳酸二甲酯 4.4 二甲醚合成
• 甲醇制二甲醚 • 合成气直接制二甲醚
《天然气化工工艺学》第4章
4.1 甲 醇
分子式CH3OH,相对分子质量32.04,常压沸点64.7℃, 常温常压下是无色透明、略带乙醇香味的挥发性液体。甲醇 与水互溶,在汽油中有较大溶解度。甲醇有毒,易燃烧,爆 炸极限为6.0~36.5% (体积分数)。
(4.1.16)
(4.1.17) (4.1.18) (4.1.19)
(4.1.20) (4.1.21)
《天然气化工工艺学》第4章
4.1.2 甲醇合成反应原理
在一定温度、压力下,CO、CO2和H2在固相铜催化剂 上进行反应可合成甲醇,主要化学反应为:
(1) CO 2H2 CH3OH (g) r H (1) 90.8kJ mol
(8) 甲醇与苯反应生成甲苯
CH 3OH C6H6 C6H5CH 3 H2O
(9) 与光气反应
CH 3OH COCl 2 CH 3OCOCl HCl
CH 3OH CH 3OCOCl (CH 3O)2 CO HCl
(10) 甲醇与二硫化碳反应 ,再与硝酸反应
4CH 3OH CS2 2(CH 3)2S CO 2 2H2O 3(CH3)2 S 2HNO3 3(CH3)2 SO 2NO H2O
yCO 2
y3 H2
(4.1.34)
K p3
pCO pH2O pCO2 pH2
yCO yH2O yCO2 yH2
(4.1.35)
K p1 K p2 K p3
(4.1.36)
式中,pi为i组分的分压,atm;yi为i组分的体积分率;p
为反应体系的总压,atm。
《天然气化工工艺学》第4章
4.1.3 甲醇合成反应热力学
CH 3Cl 3 Cl 2 CCl 4 HCl
(6) 甲醇与氢氧化钠反应
CH 3OH NaOH CH 3ONa H2O
(4.1.11) (4.1.12) (4.1.13) (4.1.14)
(4.1.15)
《天然气化工工艺学》第4章
甲醇的性质
(7) 甲醇的脱水
2CH 3OH (CH 3)2 O H2O
