高三化学高考总复习限时作业19燃烧热、中和热、能源
高中化学专题1.2燃烧热、能源练习(含解析)新人教版选修4

1。
2 中和热、燃烧热、能源1.下列叙述正确的是A.电能是二次能源B.水力是二次能源C.天然气是二次能源D.水煤气是一次能源【答案】A【解析】电能是二次能源,A项正确;水力是一次能源,B项错误;天然气是一次能源,C项错误;水煤气是二次能源,D项错误.16.“海上风电,如东是真正的全国领先”。
下列有关说法正确的是①风能其实是太阳能的一种转换形式②风能和水能、太阳能等都是可再生能源③风力发电由风能转换为机械能,再转化为电能④在未来多能源时期,氢能、生物质能等的核心仍是化学反应A.①②③④ B.②③④ C.①②③ D.①②④【答案】A【解析】①风能是太阳能的一种转换形式,正确;②风能和水能、太阳能等都是可再生能源,正确;③风力发电由风能转换为机械能,再转化为电能,正确;④在未来多能源时期,氢能、生物质能等的核心仍是化学反应,正确;故选项A符合题意。
2.含20.0gNaOH的稀溶液与稀盐酸反应,放出28。
7kJ的热量,表示该反应中和热的热化学方程式正确的是()A.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=28.7 kJ·mol-1B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-28.7 kJ·mol-1C.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=57.4 kJ·mol-1D.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57。
4 kJ·mol-1【答案】D【解析】根据上述分析可知,A。
反应放热,焓变的符号应为“—"、数值与化学计量数不对应,A项错误;B. 焓变的数值与化学计量数不对应,B项错误;C。
反应放热焓变的符号应为“-”,C项错误;D. NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);ΔH=-57。
4 kJ/mol,D项正确.3.已知中和热的数值是57。
北京高三化学一轮复习 燃烧热、中和热、能源(学案及强化训练)
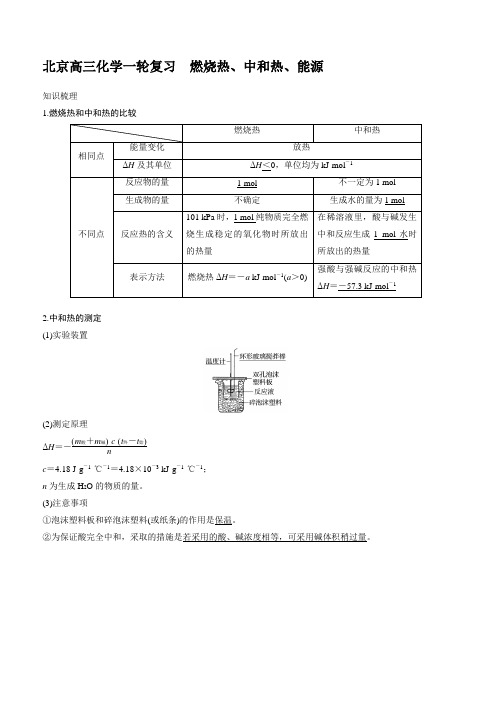
北京高三化学一轮复习燃烧热、中和热、能源知识梳理1.燃烧热和中和热的比较2.中和热的测定(1)实验装置(2)测定原理ΔH=-(m酸+m碱)·c·(t终-t始)nc=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1;n为生成H2O的物质的量。
(3)注意事项①泡沫塑料板和碎泡沫塑料(或纸条)的作用是保温。
②为保证酸完全中和,采取的措施是若采用的酸、碱浓度相等,可采用碱体积稍过量。
3.能源 (1)能源分类(2)解决能源问题的措施①提高能源的利用效率:a.改善开采、运输、加工等各个环节;b.科学控制燃烧反应,使燃料充分燃烧。
②开发新能源:开发资源丰富、可以再生、没有污染或污染很小的新能源。
深度思考1.表示燃烧热时,要完全燃烧生成稳定的氧化物,其含义是什么?答案 物质中下列元素完全转变成对应的稳定氧化物,如C →CO 2(g),H →H 2O(l),S →SO 2(g)等。
2.怎样用环形玻璃搅拌棒搅拌溶液,能不能用金属(如铁、铜等)搅拌棒代替?答案 上下搅拌,使溶液混合均匀;金属导热性能好会导致热量的散失,所以不能用金属代替。
强化训练1.(2018·宜昌期中)下列热化学方程式中ΔH 的数值表示可燃物燃烧热的是( ) A.CO(g)+12O 2(g)===CO 2(g)ΔH =-283 kJ·mol -1B.CH 4(g)+2O 2(g)===CO 2(g)+2H 2O(g)ΔH =-802.3 kJ·mol -1C.2H 2(g)+O 2(g)===2H 2O(l)ΔH =-571.6 kJ·mol -1D.H 2(g)+Cl 2(g)===2HCl(g)ΔH =-184.6 kJ·mol -1答案 A2.(2019·九江高三模拟)25 ℃、101 kPa 时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ·mol -1,辛烷的燃烧热为5 518 kJ·mol -1。
高三化学一轮复习 燃烧热、中和热、能源(学案)

高三化学一轮复习燃烧热、中和热、能源(学案)基础知识梳理1.燃烧热(1)概念在101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
燃烧热的单位一般用kJ-mol-1表示。
燃烧热的限定词有恒压(101kPa时)、可燃物的物质的量(1mol)、完全燃烧、寇定的氧化物等,其中的“完全燃烧”,是指物质中下列元素完全转变成对应的氧化物:C-CO2(g),H-H2OD,S-SO2®等。
(2)表示的意义:例如C的燃烧热H为一393.5kJ-mol-1,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
⑶书写热化学方程式:燃烧热是以1mol纯物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以燃烧1mol物质为标准来配平其余物质的化学计量数。
例如:CH/l)+25O<g)===8CO<g)+9H,O(l)H=一5518kJ-mol-1,即CH,8的燃烧热H为一5518kJ-mol-1。
8182222818(4)燃烧热的计算:可燃物完全燃烧放出的热量的计算方法为Q=nn(可燃物)X1H I。
放式中:Q放为可燃物燃烧反应放出的热量;n为可燃物的物质的量;H为可燃物的燃烧热。
2.中和热⑴概念:在稀溶液中,强酸跟强碱发生中和反应生成1mol液态H2O时的反应热叫中和热。
(2)注意几个限定词:①稀溶液;②产物是1mol液态H2O;③用离子方程式可表示为OH-(aq)+H+(aq)===H2O(l)H=-57.3kJ-mol」。
3.中和热的测定(1)实验装置(2)实验说明①中和热的测定实验中,NaOH 溶液的浓度稍大于盐酸的浓度是确保HCl 反应完全。
若采用的酸、碱浓度相等,可采用碱体积稍过量的方法达到这个目的。
②中和热的计算公式-酸+“产•■缜一,.mol .i③实验中若用弱酸(或弱碱)代替强酸(或强碱),因弱酸(或弱碱)电离出H +(或OH -)需要吸收热量,故测定的中和热的数值小于57.3kJ-mol -i ;若用浓硫酸与强碱反应测定反应热,因浓硫酸稀释要放热,故测定的反应热的数值大于57.3kJ.mol -1。
高三化学一轮复习 中和热、燃烧热问题专题复习

2020届高三化学一轮复习中和热、燃烧热问题专题复习1.(2019·合肥高三月考)下列说法正确的是()A.任何化学反应都伴随着能量的变化B.升高温度或加入催化剂,可以改变化学反应的反应热C.化学反应中的能量变化都是以热量的形式体现D.2CO(g)+O2(g)===2CO2(g)ΔH<0,则56gCO和32gO2所具有的总能量小于88gCO2 所具有的总能量2.下列说法正确的是()A.已知CO(g)的燃烧热:ΔH=-283.0kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=-566.0kJ·mol-1B.已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=-57.3kJ·mol-1,则含40.0gNaOH 的稀溶液与稀醋酸完全中和,放出57.3kJ的热量C.已知2C(s)+2O2(g)===2CO2(g)ΔH=a;2C(s)+O2(g)===2CO(g)ΔH=b,则a>bD.已知C(石墨,s)===C(金刚石,s)ΔH>0,则石墨比金刚石稳定3.美国研究人员将CO和O附着在一种钌催化剂表面,用激光脉冲将其加热到2000K,成功观察到CO与O形成化学键生成CO2的全过程。
下列说法不正确的是()A.CO2属于酸性氧化物B.CO与O形成化学键的过程中放出能量C.催化剂可以改变该反应的焓变D.CO与O形成化学键的过程中有电子转移4.某实验小组学生用50 mL 0.50 mol·L-1的盐酸与50 mL 0.50 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量计算反应热。
下列说法正确的是()A.如图条件下实验过程中没有热量损失B.图中实验装置缺少环形玻璃搅拌棒C.烧杯间填满碎纸片的作用是固定小烧杯D.若改用60mL0.50mol·L-1盐酸跟60mL0.50mol·L-1的NaOH溶液进行反应,所放出热量相等5.有关氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:2H2(g)+O2(g)===2H2O(l)ΔH=-571.6kJ·mol-12CO(g)+O2(g)===2CO2(g)ΔH=-566kJ·mol-12C8H18(l)+25O2(g)===16CO2(g)+18H2O(l)ΔH=-11036kJ·mol-1CH4(g)+2O2(g)===CO2(g)+2H2O(l)ΔH=-890.3kJ·mol-1下列说法正确的是()A.1molC8H18(g)完全燃烧释放出的热量等于5518kJB.相同质量的H2、CO、CH4完全燃烧时,放出热量最少的是CH4C.一氧化碳的燃烧热为566kJ·mol-1D.甲烷燃烧释放出445.15kJ热量时,转移4mol电子6.下列有关热化学方程式的叙述正确的是()A.含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH=+57.3kJ·mol-1(g)+O2(g)2SO3(g)ΔH=-196.64kJ·mol-1,则将2molSO2和1molO2充B.已知2SO入密闭容器中充分反应放出196.4kJ热量C.已知2H2(g)+O2(g)===2H2O(g)ΔH=-483.6kJ·mol-1,则H2的燃烧热为241.8kJ·mol-1D.已知2C(s)+2O2(g)===2CO2(g)ΔH1,2C(s)+O2(g)===2CO(g)ΔH2,则ΔH1<ΔH27.(2019·银川高三月考)在一定条件下,S8(s)和O2(g)发生反应依次转化为SO2(g)和SO3(g)(已知:2SO2+2SO3),反应过程中的能量关系如图所示(图中的ΔH表示生成1mol产物的数据)。
2021年高考化学专题复习练习卷:燃烧热与中和热能源练习卷

燃烧热与中和热能源练习卷1.甲醇的燃烧热数值为726.51 kJ·mol-1。
以下热化学方程式书写正确的选项是A.CH4O+32O2===CO2+2H2O ΔH=-726.51 kJ·mol-1B.CH4O(l)+32O2(g)===CO2(g)+2H2O(g) ΔH=-726.51 kJ·mol-1C.2CH4O(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=+1 453.12 kJ·mol-1D.CH4O(l)+32O2(g)===CO2(g)+2H2O(l) ΔH=-726.51 kJ·mol-12.以下热化学方程式中△H的值能表示可燃物的燃烧热的是A.H2(g)+Cl2(g)2HCl(g) △H=-184.6 kJ/molB.CH4(g)+2O2(g)CO2(g)+2H2O(g) △H=-802.3 kJ/molC.2H2(g)+O2(g)2H2O(l) △H=-571.6 kJ/molD.CO(g)+12O2(g)CO2(g) △H=-283 kJ/mol3.在测定中和反响反响热的实验中,以下表达错误的选项是A.向小烧杯中参加盐酸,测量的温度为盐酸的起始温度B.实验中可使酸或碱略过量C.向小烧杯中加碱液时,碱液的温度应与酸的温度一样D.可以用氢氧化钾代替氢氧化钠,浓硫酸代替盐酸4.以下说法中,正确的选项是A.S(s)+32O2(g)===SO3(g) ΔH=-315 kJ·mol-1(燃烧热)(ΔH的数值正确)B.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1(中和热)(ΔH的数值正确) C.H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,那么H2SO4和Ba(OH)2反响的反响热ΔH=2×( -57.3)kJ·mol-1学&科*网D.燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+12O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,那么CH3OH(g)的燃烧热为192.9 kJ·mol-15.以下根据热化学方程式得出的结论正确的选项是A.假设2H2(g)+O2(g)2H2O(g)ΔH=−483.6 kJ·mol-1,那么H2燃烧热为241.8 kJ·mol-1B.假设C(石墨,s)C(金刚石,s) ΔH>0,那么石墨比金刚石稳定C.NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l)ΔH=−57.4 kJ·mol−1,那么20.0g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量D.2C(s)+2O2(g)2CO2(g) ΔH1;2C(s)+O2(g)2CO(g)ΔH2,那么ΔH1>ΔH26.人类将在几十年内逐渐由“碳素燃料文明时代〞过渡至“太阳能文明时代〞(包括风能、生物质能等太阳能转换形态),届时人们将适应“低碳经济〞和“低碳生活〞。
燃烧热、能源 、中和热

实验中实验数据怎样处理? 怎样计算本实验的中和热
实验原理: Q=mc△t Q : 中和反应放出的热量 m: 反应混合液的质量 c: 混合液的比热容 常用4.18J· (g· ℃) △t: 反应前后的温度差
三、实验步骤
1.在大烧杯底部垫泡沫塑料(或纸条),使放 入的小烧杯杯口与大烧杯杯口相平。然后再在 大、小烧杯之间填满碎泡沫塑料(或纸条), 大烧杯上用泡沫塑料板(或硬纸板)作盖板, 在板中间开两个小孔,正好使温度计和环形玻 璃搅拌棒通过,如下图所示。 答案: .两杯口相平,可使盖板把杯口尽量盖严,从 大、小烧杯放置时,为何要 而减少热量损失;填碎纸条的作用是为了达到保温 使两杯口相平?填碎纸条的 隔热、减少实验过程中热量损失的目的。若换用隔 作用是什么?对此装置,你 热、密封性能更好的装置(如保温杯)会使实验结 有何更好的建议? 果更准确。
●实验目的
测定强酸与强碱反应的反应热
●学习重点
中和反应反应热的测定原理 和方法。
●实验用品
大烧杯(500 mL)、小烧杯(100 mL) 温度计、量筒(50 mL)两个、泡沫塑料 或纸条、泡沫塑料板或硬纸板(中心有两个 小孔)、环形玻璃搅拌棒。 0.50 mol/L 盐酸、0.55 mol/L NaOH溶液
讨论下列问题
1.本实验中若把50 mL 0.50 mol/L的盐酸改为50 mL 0.50 mol/L醋酸,所测结果是否会有所变化?为什 么? 2.若改用100 mL 0.50 mol/L的盐酸和100 mL 0.55 mol/L的NaOH溶液,所测中和热的数值是否约为本 实验结果的二倍(假定各步操作没有失误)? 答案:1.会有所变化。因为醋酸为弱电解质,其电 离时要吸热,故将使测得结果偏小。 2.否。因中和热是指酸与碱发生中和反应生成1 mol H2O时放出的热量,其数值与反应物的量的多 少无关,故所测结果应基本和本次实验结果相同 (若所有操作都准确无误,且无热量损失,则二 者结果相同)。
燃烧热与中和热 能源2022年高考化学一轮复习过考点(解析版)

考点30 燃烧热与中和热能源一、中和反应与中和热1.中和反应中和反应即酸和碱相互作用生成盐和水的反应,其实质是酸电离产生的H+和碱电离产生的OH-结合生成难电离的水。
强酸、强碱之间的中和反应一般都可用离子方程式H++OH-===H2O表示。
2.中和热(1)概念:在稀溶液中,酸跟碱发生中和反应生成mol H2O时的反应热(即所放出的热量)。
(2)表示方法:H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3 kJ/mol。
3.中和热与中和反应的反应热辨析(1)中和热指中和反应每生成1 mol H2O时的反应热,与强酸、强碱的类别无关。
任何中和反应的中和热都相同。
但是不同的中和反应,其反应热可能不同。
(2)有弱酸或弱碱参加的中和反应,其中和热的数值都小于57.3,这是因为反应时弱酸或弱碱发生电离需要吸收热量。
二、中和热的测定实验1.实验方法解析某些化学反应的反应热可以用实验方法测得,用来测量反应热的仪器称为“量热器”,测量操作是:将反应器置于充满水的绝热容器中,当反应放热时,其热量即传入水中,根据水的质量、比热和水温的变化求出反应所放出的热量。
2.实验过程体验【实验用品】仪器:大烧杯(500 mL)、小烧杯(100 mL)、温度计、量筒(50 mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
试剂:0.50 mol/L盐酸、0.55 mol/L NaOH溶液。
【实验方案】1.实验步骤(1)设计装置如图。
(2)用一个量筒量取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。
并将温度计上的酸用水冲洗干净。
(3)用另一个量筒量取50 mL 0.55 mol/L的NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
(4)把套有盖板的和,放入小烧杯中的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯,盖好盖板,用轻轻搅动,测量混合溶液的,记入下表。
化学反应与能量考点四燃烧热、中和热与能源

【要点解读】1.燃烧热(1)概念:在101 kPa时,1_mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。
燃烧热的单位一般用kJ·mol-1表示.燃烧热的限定词有恒压(101 kPa时)、可燃物的物质的量(1 mol)、完全燃烧、稳定的氧化物等,其中的“完全燃烧”,是指物质中下列元素完全转变成对应的氧化物:C→CO2(g),H→H2O(l),S→SO2(g)等。
(2)表示的意义:例如C的燃烧热为393.5 kJ·mol-1,表示在101 kPa 时,1 mol C完全燃烧放出393。
5 kJ的热量。
(3)书写热化学方程式:燃烧热是以1 mol物质完全燃烧所放出的热量来定义的,因此在书写它的热化学方程式时,应以燃烧1 mol 物质为标准来配平其余物质的化学计量数。
例如:C8H18(l)+错误!O2(g)===8CO2(g)+9H2O(l)ΔH=-5 518 kJ·mol -1,即C8H18的燃烧热为5 518 kJ·mol-1。
(4)燃烧热的计算:可燃物完全燃烧放出的热量的计算方法为Q放=n(可燃物)×ΔH式中:Q放为可燃物燃烧反应放出的热量;n为可燃物的物质的量;ΔH 为可燃物的燃烧热。
2.中和热(1)概念:在稀溶液中,强酸跟强碱发生中和反应生成1_mol_液态H2O时的反应热叫中和热.(2)注意几个限定词:①稀溶液;②产物是1 mol液态H2O;③用离子方程式可表示为OH-(aq)+H+(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。
(3)中和热的测定①测定原理ΔH=-错误!c=4.18 J·g-1·℃-1=4。
18×10-3kJ·g-1·℃-1;n为生成H2O的物质的量。
②装置如图(在横线上填出仪器的名称)3.能源(1)化石燃料①种类:煤、石油、天然气.②特点:蕴藏量有限,属于不可再生能源。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2010高考总复习化学限时作业:燃烧热、中和热、能源一、选择题(本题10小题,每题5分,共50分。
每题只有一个正确选项) 1.新的替代能源主要包括( )①核能 ②柴草 ③焦炭 ④太阳能 ⑤氢能 ⑥液化石油气 ⑦水煤气 ⑧天然气 A.②③⑥⑦ B.①④⑤ C.③⑥⑦⑧ D.①②④ 答案:B2.氢能是一种应用前景非常诱人的新能源,但目前仍处在研究、试验阶段,还未能进入实用阶段,其主要原因是( )A.氢气燃烧对环境影响的评价问题尚无定论B.氢气的制备耗能巨大,廉价制氢技术尚未成熟C.氢气贮存、运输等安全技术问题尚未完全解决D.氢气燃烧放出的热量低于相同质量的矿物燃料,经济效益欠佳 答案:B3.生物质能是绿色植物通过叶绿素将太阳能转化为化学能而贮存在生物质内部的能量,一直是人类赖以生存的重要能源,江苏亦是全国唯一以利用生物质能为主的省份。
下列有关说法不正确的是( )A.农村通过杂草和动物的粪便发酵制沼气,沼气的主要成分是甲烷B.苏北五市推广使用乙醇汽油,乙醇可由富含淀粉的谷物发酵产生C.用油料作物生产的生物柴油成分与从石油中提取的柴油成分相同D.开发生物质能有利于环境保护和经济可持续发展 答案:C4.25 ℃、101 kPa 下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol -1,285.8kJ·mol -1,890.3 kJ·mol -1,2 800 kJ·mol -1,则下列热化学方程式正确的是( ) A.C(s)+)(212g O ====CO(g) ΔH=-393.5 kJ·mol -1B.2H 2(g)+O 2(g) ====2H 2O(g)ΔH=+571.6 kJ·mol -1C.CH 4(g)+2O 2(g) ====CO 2(g)+2H 2O(g)ΔH=-890.3 kJ·mol -1D.)(3)(2126126g O g O H C ====3CO 2(g)+3H 2O(l) ΔH=-1 400 kJ·mol -1解析:燃烧热指1 mol 燃料燃烧生成稳定化合物时放出热量,且产物H 2O 以液态形式存在。
答案:D5.(2009山东聊城统考)下列说法或表示方法正确的是( ) A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多 B.由C (石墨)C (金刚石) ΔH=+1.9 kJ·mol -1可知,金刚石比石墨稳定C.在101 kPa 时,2 g H 2完全燃烧生成液态水,放出285.8 kJ 热量,则H 2燃烧的热化学方程式表示为:2H 2(g)+O 2(g)2H 2O(l) ΔH=-571.6 kJ·mol -1D.在稀溶液中,H +(aq)+OH -(aq)====H 2O(l)ΔH=-57.3 kJ·mol -1,若将含0.5 mol H 2SO 4的浓硫酸与含1 mol NaOH 的溶液混合,放出的热量大于57.3 kJ解析:硫固体燃烧可以看做先吸热变为硫蒸气,然后硫蒸气再完全燃烧,故硫蒸气燃烧放热多,A 项错误;由C (石墨)C (金刚石)为吸热过程,故石墨的内能低于金刚石的内能,石墨比金刚石稳定,B 项错误;C 项中燃烧热的热化学方程式为:H 2(g)+)(212g O ====H 2O(l) ΔH=-285.8 kJ·mol -1,C 项错误。
答案:D6.(2009山东淄博期中)在101 kPa 和25 ℃时,有关反应的热化学方程式如下: C(s)+)(212g O ====CO(g) ΔH 1=-110.5 kJ·mol -1H 2(g)+)(212g O ====H 2O(g) ΔH 2=-241.7 kJ·mol -1H 2(g)+)(212g O ====H 2O(l) ΔH 3=-285.8 kJ·mol -1下列说法正确的是( )A.C(s)+H 2O(g)====CO(g)+H 2(g) ΔH=-131.2 kJ·mol -1B.H 2燃烧热的热化学方程式为:2H 2(g )+O 2(g )2H 2O (l ) ΔH=-571.6 kJ·mol -1C.2H 2O(g)====2H 2(g)+O 2(g) ΔH=-483.4 kJ·mol -1D.H 2O(g)=H 2O(l) ΔH=-44.1 kJ·mol -1解析:A 项ΔH=+131.2 kJ·mol -1,故错误;B 项燃烧热应是1 mol 物质燃烧,故错误;C项ΔH=+483.4 kJ·mo l -1,故错误;D 项正确。
答案:D7.为了测定酸碱反应的中和热,计算时至少需要的数据是( )①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量 ⑤生成水的物质的量 ⑥反应前后温度变化 ⑦操作所需的时间A.①②③⑥B.①③④⑤C.③④⑤⑥D.全部解析:要准确答好这个问题需要把中和反应的反应热的测定原理搞清楚。
从测定反应热公式:Q=-mc(T 2-T 1)可以看出此时需要知道③④⑥;然后换算成中和热,也就是生成1 mol 水时的反应热,又需要知道⑤,但是实际操作中可以利用①②计算得出生成水的物质的量。
所以选择C 。
答案:C8.含Ba (OH )21 mol 的稀溶液与足量稀盐酸反应,放出114.6 kJ 的热量,表示该反应中和热的热化学方程式正确的是( )A.Ba(OH)2(aq)+2HCl(aq)====BaCl 2(aq)+2H 2O(l) ΔH=-114.6 kJ·mol -1B.Ba(OH)2(aq)+2HCl(aq) ====BaCl 2(aq)+2H 2O(l) ΔH=+114.6 kJ·mol -1C.)()()(212aq HCl aq OH Ba +====)1()(2122O H aq BaCl + ΔH=-57.3 kJ·mol -1 D. )()()(212aq HCl aq OH Ba +====)1()(2122O H aq BaCl + ΔH=+57.3 kJ·mol -1解析:明确中和热的定义是:生成1 mol 水时的反应热,题目中生成2 mol 水放出热量114.6 kJ ,则中和热ΔH 为:-57.3 kJ·mol -1。
答案:C9.在25 ℃、101 kPa 下,1 g 甲醇燃烧生成CO 2和液态水时放热22.68 kJ,下列热化学方程式正确的是( ) A.CH 3OH(l)+)(232g O ====CO 2(g)+2H 2O(l) ΔH=+725.8 kJ·mol -1B.2CH 3OH(l)+3O 2(g)====2CO 2(g)+4H 2O(l)ΔH=-1 452 kJ·mol -1C.2CH 3OH(l)+3O 2(g)====2CO 2(g)+4H 2O(l)ΔH=-725.8 kJ·mol -1D.2CH 3OH(l)+3O 2(g)====2CO 2(g)+4H 2O(l)ΔH=+1 452 kJ·mol -1解析:燃烧1 g 甲醇放出22.68 kJ 热量,故1 mol 甲醇燃烧放出725.8 kJ 热量,故B 正确。
答案:B10.在298 K 、1.01×105Pa 下,12 g 石墨在24 g 氧气中燃烧至反应物完全消耗,测得放出x kJ(x >0)的热量。
已知在该条件下,1 mol 石墨完全燃烧放出y kJ(y >0)的热量。
则石墨与氧气反应生成CO 的热化学方程式表达正确的是( )A.C (石墨,s )+)(212g O ====CO(g) ΔH=-y kJ·mol -1 B.C (石墨,s )+)(212g O ====CO(g) ΔH=-x kJ·mol -1C.C (石墨,s )+)(212g O ====CO(g) ΔH=-(2x-y) kJ·mol -1D.2C (石墨,s )+O 2(g)====2CO(g) ΔH=-(2x-y) kJ·mol -1解析:由题意可得石墨不完全燃烧时的反应为4C(s)+3O 2(g)点燃2CO (g )+2CO 2(g ),4mol 石墨燃烧放出4x kJ 热量,同时生成2 mol CO 2和2 mol CO ;完全燃烧时C(s)+O 2(g)点燃CO 2(g) 1 mol 石墨燃烧放出y kJ 热量,故生成2 mol CO 时放出热量为(4x-2y ) kJ ,C 正确。
答案:C二、非选择题(本题3小题,共50分)11.(16分)某学生利用50 mL 0.50 mol·L -1的盐酸与50 mL 0.55 mol·L -1的NaOH 溶液在如下图所示的装置中进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。
回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃用品是__________。
(2)烧杯间填满碎纸条的作用是__________。
(3)该同学所用的装置,你认为合理吗?说明你的观点。
依据你的看法,有几点说几点,不一定全部回答。
①________________________________________________________________________。
②________________________________________________________________________。
③________________________________________________________________________。
④________________________________________________________________________。
(4)在实验过程中,该同学没有找到缺少的那一件用品,就用细铜丝自己做了一个,你认为可以吗?阐明你的观点______________________________________________________________。
(5)实验中改用60 mL 0.50 mol·L -1的盐酸跟50 mL 0.55 mol·L -1的NaOH 溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热_________ (填“相等”或“不相等”),简述理由:__________________。
