高考化学培优(含解析)之铁及其化合物推断题附答案解析
高考化学培优(含解析)之铁及其化合物推断题含答案解析

高考化学培优(含解析)之铁及其化合物推断题含答案解析一、铁及其化合物1.某强酸性溶液 X 中可能含有 Fe2+、Fe3+、Al3+、Ba2+、NH4+、CO32-、NO3-、SO42-、SiO32-中的若干种,现取 X 溶液进行连续实验,实验过程及产物如图所示。
实验过程中有一种气体为红棕色。
根据以上信息,回答下列问题:(1)由强酸性条件即可判断 X 溶液中肯定不存在的离子有_____。
(2)溶液 X 中关于硝酸根离子的判断,正确的是_____(填编号,下同)。
a.一定含有 b.一定不含有 c.可能含有(3)气体 F 的电子式为_____,化合物 I 中含有的化学键类型有_____。
(4)转化①的离子方程式为_____。
转化⑦的离子方程式为_________。
(5)对不能确定是否存在的离子,可以另取 X 溶液,加入下列溶液中的一种,根据现象即可判断,该试剂最好是_____。
①NaOH 溶液②KSCN 溶液③氯水和 KSCN 的混合溶液④pH 试纸⑤KMnO4溶液【答案】CO32-、SiO32- b 共价键和离子键 3Fe2+ +4H+ +NO3-= 3Fe3++NO↑ +2H2O AlO2-+2H2O+CO2===HCO3-+Al(OH) 3↓②【解析】【分析】某强酸性溶液X中一定含有氢离子,一定不含CO32-、SiO32-,加过量的硝酸钡溶液,产生白色沉淀C是硫酸钡,一定含有SO42-,一定不含Ba2+,产生气体A一定是亚铁离子和硝酸根离子、氢离子发生氧化还原反应得到的NO,所以一定含有Fe2+,一定不含NO3-,NO 遇到氧气转化为气体D为二氧化氮,二氧化氮与水、氧气反应生成溶液E为硝酸溶液,溶液B中加入过量氢氧化钠生成气体F,F为氨气,则原溶液中一定含有NH4+,氨气和硝酸溶液反应生成I为硝酸铵,溶液H中通入过量二氧化碳产生沉淀K和溶液L,沉淀K一定为氢氧化铝,原溶液中一定含有Al3+,L是NaHCO3,溶液B中生成的有铁离子,所以沉淀G是Fe(OH)3,溶于盐酸得到J为氯化铁溶液,但原溶液中不一定含有Fe3+。
高考化学培优(含解析)之铁及其化合物推断题含答案

高考化学培优(含解析)之铁及其化合物推断题含答案一、铁及其化合物1.纳米Fe3O4在生物医学和催化剂载体等领域应用前景光明。
其制备流程如下:已知:锌单质溶于强碱生成ZnO22-;Zn(OH)2既能溶于强酸又能溶于强碱。
请回答下列问题:(l)用NaOH溶液处理废旧锌铁皮的作用有___。
A.去除油污B.溶解镀锌层C.去除铁锈D.钝化(2)步骤②生成Zn(OH)2沉淀的离子方程式为____,用离子方程式结合文字说明该步骤pH 不能过小的原因____。
调节pH的最佳方法是向溶液中通入____(填化学式)。
(3)步骤④反应的离子方程式为_____;为确保纳米Fe3O4粒子的纯度,应调整原溶液中Fe2+与所加H2O2的物质的量之比为_______。
(4)步骤⑤制得Fe3O4纳米粒子的过程,需要在无氧环境下进行,说明理由__________;T 业生产中可采取___________措施提供无氧环境。
(5)步骤⑤ _______(填“能”或“不能”)用减压过滤(抽滤)得到纳米Fe3O4粒子?理由是___________。
【答案】AB ZnO22-+2H+=Zn(OH)2↓加入酸是为了使ZnO22-转化为Zn(OH)2沉淀,但加入酸不能过多,要防止发生Zn(OH)2+2H+=Zn2++2H2O,降低ZnO产量 CO22Fe2++H2O2+2H+=2Fe3++2H2O 3:1 防止Fe2+[或Fe(OH)2]被氧化持续通入N₂不能纳米粒子太小,抽滤时容易透过滤纸【解析】【分析】根据流程图及已知信息分析得:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A加稀硫酸使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过过滤、洗涤、干燥,灼烧得到ZnO,不溶物Fe 中加入稀盐酸,反应生成氯化亚铁,加入适量H2O2,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入NaOH,并通入氮气排除氧气,加热分解,生成四氧化三铁胶体粒子,据此分析解答。
高考化学培优(含解析)之铁及其化合物推断题附详细答案

高考化学培优(含解析)之铁及其化合物推断题附详细答案一、铁及其化合物1.某淡黄色固体A (仅含三种元素,式量小于160)可用于制药,为探究其组成和性质,设计并完成如下实验:已知:①上述流程中所涉及的反应都充分进行。
②B 、C 、D 均为常见气体。
相同情况下气体B 的密度大气体C 。
③黑色固体E 溶于盐酸后滴加KSCN ,无明显现象,加适量氯水后,溶液变红。
请问答:(1)写出气体B 的电子式__,固体A 的化学式是__。
(2)黑色固体E 与足量浓硝酸反应的离子反应方程式是__。
【答案】FeC 2O 4 3FeO + 10H + + NO 3- = NO + 3Fe 3+ + 5H 2O 【解析】【分析】B 、C 、D 均为常见气体说明D 单质为氧气,物质的量为1m 3.2g n=0.1mol M 32g mol-==⋅,相同情况下气体B 的密度大气体C 则说明B 为二氧化碳,B 与过氧化钠反应,则C 为一氧化碳,气体物质的量为1m V 8.96L n==0.4mol V 22.4L mol -=⋅由于生成0.1mol 氧气,根据2CO 2 + 2Na 2O 2 = 2Na 2CO 3 + O 2,因此二氧化碳的物质的量为0.2mol ,CO 物质的量为0.2mol ,黑色固体E 溶于盐酸后滴加KSCN ,无明显现象,说明无铁离子,加适量氯水后,溶液变红,说明原物质为FeO ,则m(FeO) = 28.8g−0.2mol×28 g∙mol −1− 0.2mol×44 g∙mol −1 = 14.4g ,则FeO 物质的量1m 14.4g n=0.2mol M 71g mol-==⋅,因此n(Fe): n(C): n(O) = 0.2mol:(0.2mol+0.2mol):(0.2mol+0.2mol+0.2mol×2) =1:2:4,则化学式为FeC 2O 4。
【详解】⑴气体B 为二氧化碳,其电子式,根据上面分析得到固体A 的化学式是FeC 2O 4;故答案为:;FeC 2O 4。
高考化学综合题专练∶铁及其化合物推断题附答案解析
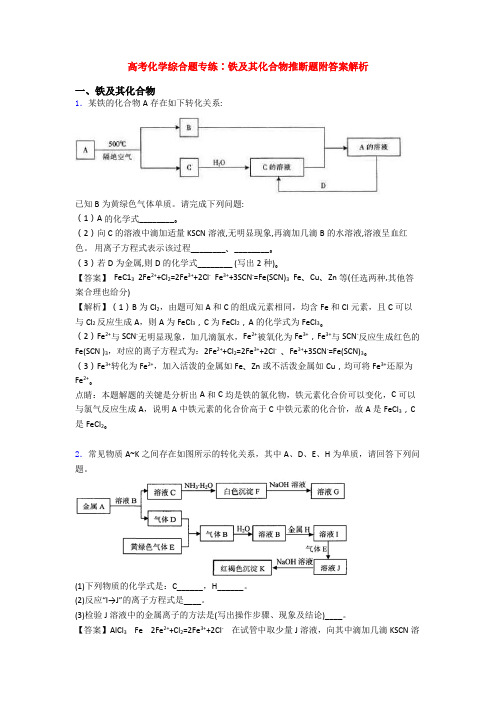
高考化学综合题专练∶铁及其化合物推断题附答案解析一、铁及其化合物1.某铁的化合物A存在如下转化关系:已知B为黄绿色气体单质。
请完成下列问题:(1)A的化学式________。
(2)向C的溶液中滴加适量KSCN溶液,无明显现象,再滴加几滴B的水溶液,溶液呈血红色。
用离子方程式表示该过程________、________。
(3)若D为金属,则D的化学式________ (写出2种)。
【答案】 FeC13 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 Fe、Cu、Zn等(任选两种,其他答案合理也给分)【解析】(1)B为Cl2,由题可知A和C的组成元素相同,均含Fe和Cl元素,且C可以与Cl2反应生成A,则A为FeCl3,C为FeCl2,A的化学式为FeCl3。
(2)Fe2+与SCN-无明显现象,加几滴氯水,Fe2+被氧化为Fe3+,Fe3+与SCN-反应生成红色的Fe(SCN )3,对应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3。
(3)Fe3+转化为Fe2+,加入活泼的金属如Fe、Zn或不活泼金属如Cu,均可将Fe3+还原为Fe2+。
点睛:本题解题的关键是分析出A和C均是铁的氯化物,铁元素化合价可以变化,C可以与氯气反应生成A,说明A中铁元素的化合价高于C中铁元素的化合价,故A是FeCl3,C 是FeCl2。
2.常见物质A~K之间存在如图所示的转化关系,其中A、D、E、H为单质,请回答下列问题。
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
【答案】AlCl3 Fe 2Fe2++Cl2=2Fe3++2Cl-在试管中取少量J溶液,向其中滴加几滴KSCN溶液,振荡,若溶液变为红色,则说明J溶液含有Fe3+【解析】【分析】溶液C与氨水反应生成白色沉淀F,白色沉淀F与氢氧化钠溶液反应生成溶液G,说明G 为NaAlO2,F为Al(OH)3,金属A与溶液B反应生成气体D,金属A为Al,气体D和黄绿色气体E(Cl2)反应生成气体B,气体B溶于水,溶液B与金属H反应生成溶液I,根据后面红褐色沉淀,得到金属H为Fe,则B为HCl,溶液C为AlCl3,则D为H2,溶液I为FeCl2,溶液J为FeCl3,K为Fe(OH)3。
化学铁及其化合物推断题的专项培优练习题(含答案)

化学铁及其化合物推断题的专项培优练习题(含答案)一、铁及其化合物1.某铁的化合物A存在如下转化关系:已知B为黄绿色气体单质。
请完成下列问题:(1)A的化学式________。
(2)向C的溶液中滴加适量KSCN溶液,无明显现象,再滴加几滴B的水溶液,溶液呈血红色。
用离子方程式表示该过程________、________。
(3)若D为金属,则D的化学式________ (写出2种)。
【答案】 FeC13 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 Fe、Cu、Zn等(任选两种,其他答案合理也给分)【解析】(1)B为Cl2,由题可知A和C的组成元素相同,均含Fe和Cl元素,且C可以与Cl2反应生成A,则A为FeCl3,C为FeCl2,A的化学式为FeCl3。
(2)Fe2+与SCN-无明显现象,加几滴氯水,Fe2+被氧化为Fe3+,Fe3+与SCN-反应生成红色的Fe(SCN )3,对应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3。
(3)Fe3+转化为Fe2+,加入活泼的金属如Fe、Zn或不活泼金属如Cu,均可将Fe3+还原为Fe2+。
点睛:本题解题的关键是分析出A和C均是铁的氯化物,铁元素化合价可以变化,C可以与氯气反应生成A,说明A中铁元素的化合价高于C中铁元素的化合价,故A是FeCl3,C 是FeCl2。
2.下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。
已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
请回答下列问题:(1)A在B中燃烧的现象是__________________________________________。
(2)D+E→B的反应中,被氧化与被还原的物质的物质的量比是_________________________。
高考化学铁及其化合物推断题(大题培优)附答案解析

高考化学铁及其化合物推断题(大题培优)附答案解析一、铁及其化合物1.现有金属单质A、B、C、I和气体甲、乙、丙及物质D、E、F、G、H。
其中B是地壳中含量最多的金属。
它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:(1)写出下列物质的化学式:C__________、H_________。
(2)写出反应③的化学方程式:___________________。
写出反应⑦的化学方程式:___________________。
写出反应⑥的离子方程式___________________。
【答案】Fe Fe(OH)3 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 2FeCl3+Cu=2FeCl2+CuCl2Fe3++3OH﹣=Fe(OH)3↓【解析】【分析】金属单质A焰色反应为黄色,故A为Na,与水反应生成NaOH与氢气,则D为NaOH,气体甲为H2;B是地壳中含量最多的金属,氢氧化钠与金属B反应生成氢气,故金属B为Al。
黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸。
氢氧化钠与物质G反应生成红褐色沉淀H是Fe(OH)3,故物质G中含有Fe3+,金属C与盐酸反应生成F,F与氯气反应生成G,可知金属C为Fe,物质F为FeCl2,物质G为FeCl3,红色金属I为Cu。
【详解】(1)根据分析可知,C为Fe,H为Fe(OH)3。
(2)根据分析可知,反应③是Al和NaOH溶液反应生成H2,化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;反应⑦是FeCl3溶液和Cu反应,化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2;G为FeCl3,和NaOH反应的离子方程式为:Fe3++3OH﹣=Fe(OH)3↓。
2.下列物质A-F是我们熟悉的单质或化合物,其中A、B均是常见的金属,且B的合金用量最大;E在常温下是黄绿色气体;适当的条件下,它们之间可以发生如图所示的转化。
高考化学铁及其化合物推断题-经典压轴题及答案解析

【答案】Cl2+2OH-=Cl-+ClO-+H2OFe2+、Br-铁粉BrO3-+5Br-+6H+=3Br2+3H2OBr2理由:SO2+Br2+2H2O=2HBr+H2SO4方案:用CCl4萃取颜色很浅的溶液,观察溶液下层是否呈棕红色稀硫酸
【解析】
【分析】
【详解】
(1)海水中溴元素以Br-存在,从海水中提取溴单质,要用Cl2氧化溴离子得到,但海水呈碱性,若不酸化,就会发生反应:Cl2+2OH-=Cl-+ClO-+H2O,影响溴的提取;
(2)①将溴蒸气的残留的Cl2脱去,可利用氯气有强的氧化性,要加入能与Cl2反应,但不能与Br2反应的物质,如Fe2+、Br-;
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免___(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是____。
②溶液失去脱氯作用后,补加FeBr2或加入____,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3-和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为____。
(1)下列物质的化学式是:C______,H______。
(2)反应“I→J”的离子方程式是____。
(3)检验J溶液中的金属离子的方法是(写出操作步骤、现象及结论)____。
【答案】AlCl3Fe2Fe2++Cl2=2Fe3++2Cl-在试管中取少量J溶液,向其中滴加几滴KSCN溶液,振荡,若溶液变为红色,则说明J溶液含有Fe3+
高考化学铁及其化合物推断题(大题培优)及答案

高考化学铁及其化合物推断题(大题培优)及答案一、铁及其化合物1.纳米Fe3O4在生物医学和催化剂载体等领域应用前景光明。
其制备流程如下:已知:锌单质溶于强碱生成ZnO22-;Zn(OH)2既能溶于强酸又能溶于强碱。
请回答下列问题:(l)用NaOH溶液处理废旧锌铁皮的作用有___。
A.去除油污B.溶解镀锌层C.去除铁锈D.钝化(2)步骤②生成Zn(OH)2沉淀的离子方程式为____,用离子方程式结合文字说明该步骤pH 不能过小的原因____。
调节pH的最佳方法是向溶液中通入____(填化学式)。
(3)步骤④反应的离子方程式为_____;为确保纳米Fe3O4粒子的纯度,应调整原溶液中Fe2+与所加H2O2的物质的量之比为_______。
(4)步骤⑤制得Fe3O4纳米粒子的过程,需要在无氧环境下进行,说明理由__________;T 业生产中可采取___________措施提供无氧环境。
(5)步骤⑤ _______(填“能”或“不能”)用减压过滤(抽滤)得到纳米Fe3O4粒子?理由是___________。
【答案】AB ZnO22-+2H+=Zn(OH)2↓加入酸是为了使ZnO22-转化为Zn(OH)2沉淀,但加入酸不能过多,要防止发生Zn(OH)2+2H+=Zn2++2H2O,降低ZnO产量 CO22Fe2++H2O2+2H+=2Fe3++2H2O 3:1 防止Fe2+[或Fe(OH)2]被氧化持续通入N₂不能纳米粒子太小,抽滤时容易透过滤纸【解析】【分析】根据流程图及已知信息分析得:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A加稀硫酸使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过过滤、洗涤、干燥,灼烧得到ZnO,不溶物Fe 中加入稀盐酸,反应生成氯化亚铁,加入适量H2O2,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入NaOH,并通入氮气排除氧气,加热分解,生成四氧化三铁胶体粒子,据此分析解答。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学培优(含解析)之铁及其化合物推断题附答案解析一、铁及其化合物1.某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物)制备NiO并回收金属资源的流程如下所示:已知:相关数据如表1和表2所示表1部分难溶电解质的溶度积常数(25℃)物质K sp物质K spFe(OH)3 4.0×10-38CuS 6.3×10-34Fe(OH)2 1.8×10-16ZnS 1.6×10-24Al(OH)3 1.0×10-33NiS 3.2×10-18Ni(OH)2 2.0×10-15表2 原料价格表物质价格/(元•吨-1)漂液(含25.2%NaClO)450双氧水(含30%H2O2)2400烧碱(含98%NaOH)2100纯碱(含99.5%Na2CO3)600请回答下列问题:(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6mol •L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M ,当导线中流过2 mol 电子时,理论上负极质量减少__________g 。
充电时的阳极反应式为_______________________________________________。
【答案】除去废料中的有机物;使部分金属单质转化为氧化物 漂液 节约成本,不影响后续操作 2Fe 2++ClO -+2H +=2 Fe 3++Cl -+H 2O 5 Na 2CO 3 NiCO 3+H 2ONi(OH)2+CO 2↑ 2 Ni(OH)2+OH --e -=NiOOH +H 2O【解析】【分析】铁触媒废料焙烧,可以将部分金属单质转化为金属氧化物以及使有机物燃烧而除去,焙烧后固体和硫酸反应生成硫酸盐;再将Fe 2+氧化成Fe 3+,氧化剂选择漂液(因为漂液价格低廉,且不影响后续实验)。
然后调节pH 使Fe 3+、Al 3+一起转化为氢氧化物沉淀而除去。
滤液1中还有Zn 2+、Cu 2+以及Ni 2+,加入NiS ,可以除去Zn 2+、Cu 2+。
滤液2中有镍离子,同样的道理,在沉淀Ni 2+的时候,选择碳酸钠,它的价格也是比较低,加入碳酸钠后得到碳酸镍;碳酸镍加水煮沸会转化成Ni (OH )2,最后Ni (OH )2灼烧分解,就可以得到氧化镍。
【详解】(1)焙烧可以使部分金属单质变成金属氧化物,并且能够使有机物燃烧并除去。
所以“焙烧”的目的为:除去废料中的有机物;使部分金属单质转化为氧化物;(2)应选择氧化剂使亚铁离子氧化成铁离子,氧化剂包括了漂液和双氧水,但是双氧水的价格更贵,所以选择漂液;选择漂液的理由就是漂液成本更低,而且生成NaCl 也不影响后续操作。
(3)漂液中含有NaClO ,将Fe 2+氧化成Fe 3+,ClO -被还原成Cl -,反应的离子方程式为2+-+-3+22Fe +ClO +2H =Cl +2Fe +H O ;(4)Fe (OH )3和Al (OH )3类型相同,Fe(OH)3 的K sp 比Al(OH)3小,为了使它们完全沉淀,用Al(OH)3的K sp 进行计算,-33-143+3--33--933-6--910Kw 10[Al(OH)]=c(Al )(OH =10c(OH pH=-lg()=-lg()=510c(OH )10sp K c ),,,则pH 至少为5;(5)需要选择沉淀Ni 2+的沉淀剂,NaOH 的价格更贵,所以选择Na 2CO 3,根据题意,加入Na 2CO 3时,生成的滤渣2为NiCO 3,NiCO 3加水煮沸转化成Ni (OH )2,加水煮沸的方程式为NiCO 3+H 2O ΔNi (OH )2+CO 2↑。
(6)镍氢电池放电时负极的是MH ,在反应中MH 变成了M ,失去质量为H 的质量,负极反应式为MH-e -+OH -=M+H 2O ,转移2mol ,负极质量减少2g ;充电时阳极发生氧化反应,化合价升高,Ni(OH)2变成NiOOH ,电极反应式为:Ni(OH)2+OH --e -=NiOOH +H 2O 。
【点睛】(2)中因为是工业流程,所以在选择原料的时候,不仅要考虑它会不会带来杂质,还需考虑经济成本,比如在此题中都选择了经济成本较低的原料。
(4)计算pH的时候,氢氧化铁和氢氧化铝都可以计算,但是要完全沉淀,选择pH较大的那个。
2.室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体。
在合适反应条件下,它们可以按下面框图进行反应;E是无色溶液,F是淡绿色溶液。
B和C反应发出苍白色火焰。
请回答:(1)A是__________,B是__________,C是__________(请填写化学式);(2)反应①的化学方程式______________________________;(3)反应③的离子方程式______________________________;(4)反应④的离子方程式______________________________。
【答案】Fe Cl2 H2 2Fe+3Cl22FeCl3 Fe+2H+=Fe2++H2↑ 2Fe2++Cl2=2Fe3++2Cl-【解析】【分析】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体,B是氯气,B和C反应发出苍白色火焰,C是氢气,E是氯化氢。
F是淡绿色溶液,F溶液中含有亚铁离子,所以A是铁,F是氯化亚铁,D是氯化铁,据以上分析解答。
【详解】室温下,A是常见的金属单质、单质B是黄绿色气体、单质C是无色气体,B是氯气,B和C反应发出苍白色火焰,C是氢气,E是氯化氢。
F是淡绿色溶液,F溶液中含有亚铁离子,所以A是铁,F是氯化亚铁,D是氯化铁,(1)根据以上分析可知A、B、C分别是Fe、Cl2、H2;(2)反应①为铁与氯气反应生成氯化铁,化学方程式为2Fe+3Cl22FeCl3;(3)反应③为铁与盐酸反应生成氯化亚铁和氢气,离子方程式为Fe+2H+=Fe2++H2↑;(4)反应④为氯化亚铁与氯气反应生成氯化铁,离子方程式为2Fe2++Cl2=2Fe3++2Cl-。
3.钠、铝、铁是三种重要的金属。
请回答:(1)钠元素的金属性比铝___(填“强”或“弱”)。
三种金属对应的氢氧化物中,具有两性的物质是__(填化学式)。
(2)将一小块金属钠投入水中,发生反应的离子方程式为__;可观察到的实验现象是__(填序号)。
A.钠沉到水底 B.钠熔成小球C.小球四处游动 D.钠无变化(3)Fe与Cl2在一定条件下反应,所得产物的化学式是__。
将该产物溶于水配成溶液,分装在两支试管中。
请回答:①若向其中一支试管中滴加KSCN溶液,则溶液变成___色。
②向另一支试管中滴加NaOH溶液,反应的离子方程式是___。
(4)Na2O2可作为呼吸面具中的供氧剂,其供氧时主要反应的化学方程式为:__。
(5)在AlCl3溶液中逐滴加入NaOH溶液至过量,观察到的现象是___。
【答案】强 Al(OH)3 2Na+2H2O=2Na++2OH-+H2↑ BC FeCl3红 Fe3++3OH-=Fe(OH)3↓ 2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑先生成白色沉淀,然后白色沉淀消失【解析】【分析】(1)金属钠与铝处于同周期,金属性逐渐减弱,最高价氧化物对应的水化物碱性逐渐减弱;(2)金属钠与水反应,生成氢氧化钠和氢气;由于钠的密度小于水的密度,因此钠浮在水面上;反应放热,因此钠熔化成光亮的小球;反应放出气体,因此钠四处游动;最终金属钠完全溶解;(3)Fe在Cl2燃烧,生成FeCl3,将FeCl3溶于水后,溶液中存在大量的Fe3+,滴加KSCN溶液后,溶液变为血红色;滴加氢氧化钠溶液后生成红褐色沉淀;(4)Na2O2可作为呼吸面具中的供氧剂,可与CO2和H2O反应;(5)在AlCl3溶液中逐滴加入NaOH溶液,生成白色沉淀Al(OH)3,当NaOH溶液过量时,沉淀逐渐溶解,最终完全消失。
【详解】(1)钠元素的金属性比铝强;钠、铝、铁三种金属对应的氢氧化物中具有两性的物质是Al(OH)3;(2)钠和冷水反应,生成氢氧化钠和氢气,离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;由于钠的密度小于水的密度,因此钠浮在水面上;反应放热,因此钠熔化成光亮的小球;反应放出气体,因此钠四处游动;最终金属钠完全溶解,因此金属钠与水反应的实验中,可观察到的实验现象是钠熔成小球、小球四处游动,答案选BC;(3)Fe在Cl2燃烧,生成FeCl3,将FeCl3溶于水后,溶液中存在大量的Fe3+,滴加KSCN溶液后,溶液变为血红色;滴加氢氧化钠溶液后生成红褐色沉淀,离子方程式为:Fe3++3OH-=Fe(OH)3↓;(4)Na2O2可作为呼吸面具中的供氧剂,可与CO2和H2O反应,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑;(5)在AlCl3溶液中逐滴加入NaOH溶液,生成白色沉淀Al(OH)3,当NaOH溶液过量时,沉淀逐渐溶解,最终完全消失。
4.粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。
进行如下实验:①取适量A进行铝热反应,产物中有单质B生成;②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;④用KSCN溶液检验时,溶液D不变色。
请填空:(1)①中引发铝热反应的实验操作是___________,产物中的单质B是________。
(2)②中所发生的各反应的化学方程式是___________。
(3)③中所发生的各反应的离子方程式是___________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为________,c(Fe2+)为________。
