第九章 羰基化合物
有机化学 第9章 醛、酮、醌

O CH3-C-CH3
酮式
OH CH3-C=CH2
烯醇式
碱和酸都可以促使烯醇化,原因如下: 碱促进烯醇化的理由:碱可以夺取α-H,而产生碳负离子
O B: + H-CH2-C-CH3
O 碳负离子 -CH2-C-CH3
3、氧化
醛和酮最主要的区别是对氧化剂的敏感性。因为醛中羰 基的碳上连有氢,所以醛很容易被氧化为相应的羧酸。而酮 则不易被氧化。因此用此性质可区别醛酮,常用弱的氧化剂 如托伦试剂(硝酸银的氨溶液),Ag+即可将醛氧化为羧酸, 本身被还原为金属银Ag。P:164页
OH-
RCHO + Ag+ 托伦试剂
Ag + RCOO- 银镜反应
由于生成复杂的氧化产物,酮氧化一般没有合成意义。 但环己酮氧化是工业上生产己二酸的方法。
O KCrO4 + H2SO4 HOOCCH2CH2CH2CH2COOH
环己酮
己二酸
4、烃基上的反应
(1)α-H的活性 与羰基相邻的碳(α-C)上的氢叫α-H,由于羰基中氧
原子的电负性较强,使得α-C上电子密度有所降低,从而 使α-H与分子中其它碳原子上的氢相比,酸性有所增强, 即具有一定的活性。
6、酮还有一种命名法:根据羰基所连的两个烃基而命名, 简单在前,复杂在后,最后加一酮字。如:
O C-CH3
苯乙酮 甲基苯基酮
O CH3-C-CH2CH3
丁酮 甲基乙基酮
物理性质
醛、酮分子间不能形成氢键,没有缔 合作用,但由于极性较强, 因此沸点比相 应(或分子量相近的)醇低,比相应的烷 烃和醚高。
羰基化合物

1470.88 1359.50
1517.34
1336.49 1286.76
1421.07 1382.92
1109.70
1211.76 1170.42
1071.53 1007.27
838.89 799.97
534.94
678.70 642.60
567.56
455.35 428.75
1000
500
酰卤
▪ 配位化学中,羰基化合物指一类含有一氧化碳作为配体的化合物。 见金属羰基化合物。
▪ 无机化学中,羰基化合物可以指一类含有C=O键的化合物。如二 氧化碳,硫化羰等。
2.羰基类化合物的谱图解析
▪ 2.1羰基化合物在红外IR的吸收特点 ▪
C=O的伸缩振动出现在1850~1660cm-1范围内,常成为红外 谱图中最强的吸收,且在该范围内其他吸收带干扰的可能性较小。
80
70
Transmittance [%]
60
50
CH2变形振 动
C-Cl伸缩振动 (1000~910,峰 形宽大)
CH2对称伸缩 振动(2850)
C=O伸缩振 动(1800)
1801.98
2925,CH2反 对称伸缩振动
2854.46
3500
3000
2500
2000
1500
Wavenumber cm-1
C-O-C伸缩振动:1250 ~ 1000cm-1,有张力环酐移到 910cm-1附近。
邻苯二甲酸酐
3500
Transmittance [%]
40
50
60
70
80
90 100
3603.19
3070.70 3093.33 2930.92
第九章 C β-二羰基化合物

CH3COCHCOOC2H5 CH2Cl2 CH2 CH3COCHCOOC2H5
CH3COCH2CH2CH2COCH3
2,6-庚二酮
CH3COCHCOOC2H5 I2 - + 2[CH3COCHCOOC2H5] Na -2NaI CH3COCHCOOC2H5 ①稀OH -,②H+,③Δ CH3COCH2CH2COCH3
O H COOC2H5
用于制备五元和六元环β-酮酸酯
O O H2SO4 CH2 C CH2 CH3 C CH2 C OC2H5 + C2H5OH O C O
乙酰乙酸乙酯的工业制法
(2)乙酰乙酸乙酯的性质 (甲)酮式分解
CH3COCH2COOC2H5 5%NaOH
H+
CH3COCH2COO
-
CH3COCH3
-OC H 2 5 CH3COOC2H5
COOC2H5 COOC2H5
COOC2H5 CH3COCH2COOC2H5 + C2H5OH COCH2COOC2H5
可否得到一个主产物?
分子内Claisen 酯缩合(Dieckmann缩合)
CH2CH2COOC2H5 CH2CH2COOC2H5
① NaOC2H5,苯,80℃ ② H+,80%
酮式分解
2,5-己二酮
CH3COCH2COOC2H5
+
NaH
+
[CH3COCHCOOC2H5]- Na+ + H2
C6H5COCl CH3COCHCOOC2H5 COC6H5
[CH3COCHCOOC2H5]- Na+
①稀OH -,②H+,③Δ 酮式分解
CH3COCH2COC6H5
第九章 醛和酮

C
CH3 C O
CH3 + Br2
H+
CH3 C O
CH2Br + HBr C
α -溴丙酮
将次卤酸钠的碱性溶液与醛或酮作用生成卤仿的反 应称为卤仿反应。其通式表示如下:
C R C O CH3 + 3NaOX (X2 + NaOH)
NaOI NaOI
CH3 C O
ONa + CHX3 + 2H2O C
O C CH2CH3
Zn Hg , HCl
CH2CH2CH3 C
由于反应是在酸性介质中进行的,因此,羰基化合 物中含有对酸敏感的基团(如醇羟基、碳碳双键等)时, 不能用此法还原。
(4)沃尔夫—凯惜纳—黄鸣龙还原
先让醛或酮与氢氧化钠、肼(H2N―NH2)的水 溶液和高沸点的醇(例如二甘醇)一起加热,醛 和酮首先生成腙,再蒸出水和过量的腙,继续 升温回流,使腙分解放出氮气,此时羰基转变 成了亚甲基。例如:
H2 Pt
CH3CH2CH2OH CH3 CH OH CH3 C
H2 Pt
选择性不强
C CH3CH CHCHO
H2 Ni
CH3CH2CH2CH2OH
C
(2)金属氢化物还原
金属氢化物如氢化铝锂(LiAlH4)、硼氢化 钠(NaBH4)是还原羰基常用的试剂。
CH3CH CHCHO
NaBH4
异丙醇铝
CH3CH CHCH2OH
2 HCHO
浓NaOH
HCOONa + CH3OH
第九章 醛和酮
第一节 醛和酮的结构、分类及 命名
第二节 醛和酮的物理性质 第三节 醛和酮的化学性质 第四节 重要的醛和酮
第九章醛和酮亲核加成反应

第九章 醛和酮 亲核加成反应第一节 结构、命名和物理性质一、醛和酮的定义醛和酮都是分子中含有羰基(碳氧双键)的化合物,因此又统称为羰基化合物。
羰基与一个烃基相连的化合物称为醛(甲醛与两个氢相连),与两个烃基相连的称为酮。
CO R'CR O HCR(H)O羰基 醛 酮二、醛和酮结构羰基是醛、酮的特征官能团。
羰基碳原子是sp 2杂化的,即碳原子以三个sp 2轨道与其它三个原子的轨道重叠形成三个σ键,碳原子上未参加杂化的p 轨道与氧原子上的p 轨道侧面重叠形成一个π键。
由于氧原子的电负性比碳原子大,故碳氧双键电子云偏向于氧原子,使氧原子带负电荷(δ-),而碳原子带正电荷(δ+),易被亲核试剂进攻发生亲核加成反应;由于羰基的吸电子作用,羰基的α-H 活性增强,表现出α-H 的酸性,进而发生羟醛缩合,卤代等反应。
此外,醛、酮还可以发生氧化、还原反应及其它一些反应。
醛、酮的结构与化学性质关系如下:CH R'H (H)R羰基的还原反应羰基的亲核加成反应醛的氧化反应H 的反应三、醛和酮的分类和命名(一)分类醛和酮根据烃基结构类型,可分为脂肪和芳香醛、酮;根据烃基的饱和程度,又分为饱和与不饱和醛、酮;根据羰基的数目,还分为一元、二元和多元醛、酮。
(二)命名 1.普通命名法结构简单的醛、酮,可采用普通命名法命名。
醛按分子中含有的碳原子数称为“某醛”,芳基作为取代基;酮则根据羰基所连的两个烃基来命名,简单的烃基放前,复杂的烃基在后,最后加“酮”字来命名。
2.系统命名法结构复杂的醛、酮主要采用系统命名法。
即选择含有羰基的最长碳链为主链,从距羰基最近的一端编号,由于醛基总是位于碳链的一端,不用标明醛基的位次,但酮的羰基位于碳链中间,位次必须标明。
将取代基的位次和名称放在母体名称前。
芳香烃基总是作为取代基。
多元醛、酮命名时,应选取含羰基尽可能多的碳链为主链,注明羰基的位置和数目。
不饱和醛、酮,应选择连有羰基和不饱和键在内的最长碳链做主链,并使羰基编号最小。
9-羰基化合物-ok

(4)迁移基团在迁移过程中构型保持不变。
Et C t-Bu H CH3 OH C=N
H2SO4
O
乙醚
Et C -NH-CCH3 t-Bu H
*3E 贝克曼重排反应的应用
应用1:制备酰胺、羧酸、胺。 应用2:测定酮肟的几何构型(根据反式迁移)。
NH 2
HOOC
NO2
+
+ H2N-Z, -H
HO H C-N-Z
H
+
H2O
+
H
C----N-Z
C=N-Z + H2O + H+
反应需在弱酸性的条件下进行
应用
提纯醛酮
C=O + H2N-Z
鉴别醛酮
重结晶 稀酸
C=N-Z
H2N-NH-C6H5
苯肼
C=O
H2N-OH
羟胺
H2N-NH2
肼
O H2N-NH-C6H3(NO2)2 H2N-NHCNH2
第一节 醛酮的命名 一 普通命名法
醛按氧化后生成的羧酸命名,酮看作是甲酮的衍生物。
CH3CH2CHO
CH2=CHCHO
丙醛
丙烯醛
O CH3CCH2CH3
甲基乙基甲酮 (甲乙酮)
醛
CH3CHCH2CHO CH3
αβγδ… 标记取代基位臵。 γ
CH=CHCHO
CH3OCH2CH2CH2CHO
CN C OH
-羟腈(或-氰醇) H+ H2O
CH3 CH3
COOH C OH
-H2O
CH2=C-COOH CH3 ,-不饱和酸
-羟基酸
醌(quinone)总称为羰基化合物
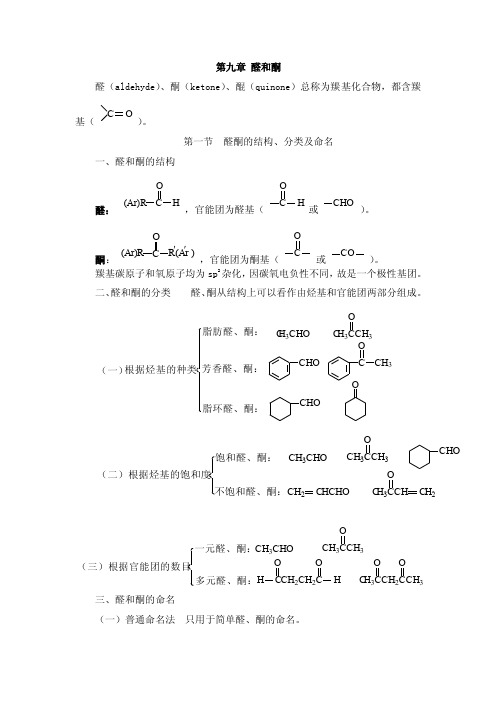
第九章醛和酮醛(aldehyde)、酮(ketone)、醌(quinone)总称为羰基化合物,都含羰基(C O)。
第一节醛酮的结构、分类及命名一、醛和酮的结构醛:R CO(Ar)H,官能团为醛基(C HO或CHO)。
酮:COR′(Ar )′R(Ar),官能团为酮基(CO或CO)。
羰基碳原子和氧原子均为sp2杂化,因碳氧电负性不同,故是一个极性基团。
二、醛和酮的分类醛、酮从结构上可以看作由烃基和官能团两部分组成。
(一)芳香醛、酮:OC CH3CHO脂肪醛、酮:C H3CHO C H3CCH3O脂环醛、酮:CHOO根据烃基的种类(二)根据烃基的饱和度饱和醛、酮:不饱和醛、酮:CHOCH3CHO CH3CCH3OCH2 C HCHO C H3CCH C H2O(三)根据官能团的数目CH3CHO一元醛、酮:多元醛、酮:H CCH2CH2C H C H3CCH2CCH3O OCH3CCH3OOO三、醛和酮的命名(一)普通命名法只用于简单醛、酮的命名。
1.脂肪醛:根据分子中所含的碳原子数称为某醛。
2.脂肪酮:按羰基所连烃基的由小到大称为某(基)某(基)(甲)酮;烃基相同,则称为二某酮,但“二”字不能省略。
3.芳香族醛、酮:以脂肪醛、酮为母体,将苯环看作取代基。
CH 3CHCHO C H 3CCH 3 C H 3CH 2CCH 3二甲酮甲乙酮O异丁醛甲基乙烯基酮CH 3CCH C H 2OOCH 3(二)系统命名法 1.脂肪族醛、酮的命名(1)选主链:选含羰基的最长碳链为主链,称为“某醛”或“某酮”。
(2)编号:醛的编号从醛基碳开始;酮的编号近酮基端,若酮基在中间则近支链一端。
另外,还可以用α、β、γ等编号,与羰基直接相连的碳为α位。
(3)写名称:将取代基的位次、数目、名称写在母体名称之前。
对于酮要标明酮基的位置(醛基的位置不必标出)。
命名不饱和脂肪醛、酮时,要选既含羰基又含不饱和键的最长碳链为主链,近羰基端编号,称为某烯(炔)醛或某烯(炔)酮,分别标明不饱和键及酮基的位置。
有机化学第九章__羰基化合物(三改)---《有机化学》人卫药学5版倪沛洲

第九章 羰基化合物碳原子以双键和氧原子相连 的官能团称羰基(carbonyl )。
有机分子中含有羰基的化合物称作羰基化合物(carbonyl compounds )。
羰基碳与一个烃基和一个氢相连的化合物称作醛(aldehyde,甲醛中的羰基碳与两个氢相连);羰基碳与两个烃基相连的化合物称作酮(ketone )。
C H HO C RHO 甲醛formaldehyde醛aldehy de酮k etoneC R R O1羧酸及其衍生物分子中也含有羰基,但它们与醛、酮的性质相差较大,将在第十一章二、四和第十二章二、三中另外讨论。
本章只讨论醛、酮。
一、结构和命名(一)结构醛、酮分子中的羰基碳以双键与氧结合,其成键情况与乙烯有些相似。
碳原子是sp 2杂化,三个sp 2杂化轨道处于一个平面内,其中一个杂化轨道与氧形成σ键。
碳原子上的p 轨道与氧的p 轨道彼此重叠形成π键,并与三个σ键所构成的平面垂直,因此,羰基的碳氧双键是由一个σ键和一个π键组成的,如图9-1(a )所示。
图9-1 羰基的结构示意图由于氧的电负性比碳大,成键处的电子云并不是均匀地分布在碳氧之间,而是偏向于氧,氧带部分负电荷(δ-),而碳带部分正电荷(δ+),所以,羰基是一个极性基团。
参见图9-1(b ),(c )。
这一点,从羰基化合物的偶极矩也可以反映出来。
例如:C O ( )R C H O 可简写作 R CHO 。
δ(b) 羰基的极性C O H 3CHC O H 3CCH 3×-30μm=9.4910C C 109.49=mμ-30×(二)命名1.普通命名法 简单醛、酮可采用普通命名法。
分子中含有芳环的醛则将芳基作为取代基,例如:苯基丙醛CH 3CH 2CHO丙醛propanalCHO苯(基)甲醛benzaldehy deCH CHO CH 3-phenylpropanal-22酮则按羰基所连接的两个烃基的名称来命名。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-H以正离子离解下来的能力称为-H的活性或-H的酸性。
判断-H活性的方法: pKa值 同位素交换的速率
影响-H活性的因素: Y的吸电子能力。 -H 周围的空间环境。 负碳离子的稳定性。
与格氏试剂的加成
HCHO R M gX
R
C H 2O H OH
R
CHO O
R
M gX
R
CH
R
OH R R M gX R C R R
R
C
羰基与N亲核体的加成
氨及其衍生物 NH3 ,NH2R NHR2
与氨及伯胺的加成
Schiff’s base的生成
HO H CH3CH-NH
亲核加成
CH3CH=O + NH3
C H 3O H H 2S O 4
C H 2= C C O O C H 3 CH3
与炔化钠的加成
R-CC-Na+ +
NH3(液)
C =O
C C ONa CR
H2O
C C OH
CR
或乙醚
炔醇
OH
CH3
(CH3)2C-C CR
H+
CH2=C-CCR
H2 / 催
CH3
CH2=C-CH=CHR
制备共轭双烯
H2N-NH2
肼
C =O
O
H2N-OH
羟胺
H2N-NH-C6H5
苯肼
H2N-NH-C6H3(NO2)2 H 2 N -N H C NH 2
2,4-二硝基苯肼 氨基脲
(产物:肟)(产物:腙) (产物:苯腙)
(产物:缩氨脲)
保护羰基
A B C =O
+ H2NR
A B C =N R
参与反应
稀酸
A' B' C =O
应用
O C H 3C H 2C C H 3 HCN
增长碳链方法之一
OH C H 3C H 2C C N CH3
浓 H 2S O 4
C H 3C H = C C O O H CH3
O CH3 C C H 3 + N aC N
H 2S O 4 1 0 o -2 0 o C
OH CH3 C CN CH3
CH3 C=O CH3
CH3 CH3 OH C S O 3N a
+
HCN
OH C CN
+ NaCN
CH3 CH3
与硫醇的反应
* 1 硫醇的制备 RX + NaSH RSH + NaX * 2 硫醇的一个重要性质-形成缩硫醛、缩硫酮
R R C=O
+
HS HS
H+
R C R
S S
Ni-H2 R
CH2 R
Semicarbazone
酸催化
C =O + H
+
+
C =O H
H 2 N- Z , -H
+
HO H C -N -Z
+
H
+
H 2O
H
C ----N -Z
C =N -Z + H 2 O + H
+
反应需在弱酸的条件下进行。为什么不能用强酸?
应用
提纯醛酮
C=O
鉴别醛酮
重结晶 稀酸
C = N -Z
+ H2N-Z
-OH溶液
CH 3 CH 3
CN C O-
H 2O
CH 3 CH 3
CN C OH
-羟腈(或-氰醇)
H+ H2 O
CH 3 CH 3
COOH C OH
-H2O
CH2=C-COOH CH3 ,-不饱和酸
-羟基酸
某 些 醛 酮 与 HCN反 应 的 平 衡 常 数 K 化合物 C H 3C H O C 6H 5C H O p -C H 3 C 6 H 4 C H O p -N O 2 C 6 H 4 C H O K 很大 210 32 1420 化合物 C H 3 C O C H (C H 3 ) 2 C 6H 5C O C H 3 C 6H 5C O C 6H 5 K 38 0 .8 很小
2
(100%) (~58%)
(CH3)2C=O + HOH
CCl3-CH=O + HOH
(CH3)2C(OH)
2
(0 %)
三氯乙醛水合物 (安眠药)
CCl3CH(OH)2
有吸电子基团可以形成稳定水合物。 水合物在酸性介质中不稳定。
与ROH的加成
半缩醛(酮)、缩醛(酮)的生成
CH3CH=O + CH3CH2OH
BrCH2CH2
O
CH3CH2CCLi
O
CH3CH2CCCH2CH
2
H3O
+
O
CH3CH2CCCH2CH2CHO + HOCH2CH2OH
羰基与S亲核体的加成
与NaHSO3的加成
与硫醇(RSH)的加成
与亚硫酸氢钠的反应
反应式
R H C=O
+
R N aH SO 3 C H
OH S O 3N a
C H 3C H C C H 3 CH3
4-氧代戊醛 4-Oxopentanal
3-烯丙基-2,4-戊二酮 3-Allyl-2,4-pentanedione
O
O
O CH O
CH2
CH
C
CH3
环己酮 Cyclohexanone
2-氧代环己基甲醛 2-Oxocyclohexyl carbaldehyde
HO OH O
半缩醛
HCl
HO
CH3OH
OCH3 O
缩醛
与酮反应
C H 3C H 2 C H 3C H 2 C = O + C H 3O H H
+
半缩酮
C H 3C H 2 C H 3C H 2
+
OCH3 C OH OCH3 C OCH3
C H 3O H , H
C H 3C H 2 C H 3C H 2
-H2O -H2O
CH3CH=NH
HO H 亲核加成 CH3CH=O + RNH2 CH3CH-NR
亚胺
CH3CH=NR
亚胺 西佛碱
西佛碱一般是不稳定的,但是当碳氮双键与苯 环共轭时,产物是稳定的。
HO CHO + H 2N
H
CH-N
C H =N
+ H 2O
西佛碱用酸水解可以生成原来的醛和 酮,所以可以利用此反应来保护醛基。 与仲胺反应的产物是什么? 与叔胺呢?
C =O
Nu C OH
+ H
+
[
+ C =O H
+ C -O H
]
:N u H
(2)醛、酮的反应活性
R H
C =O
>
R R'
Ar
C =O
>
C =O
R'
羰基周围的空间拥挤程度对反应活性的影响极大
H C R O
-
Nu
R'
Nu C O
-
R
随R基的体积增大和给电 子能力增加,羰基活性降 低;
O R C H (R ) > A r
O C H (R )
试比较下列化合物发生亲核加成反应 的活性大小
O 2N A
CHO
CH3 B
CHO C
CHO
常见的亲核试剂按照亲核的中 心原子不同可分为 C、 N、 O、S等亲核体
举例说明
羰基与C亲核体的成
NaCN或 HCN
炔化钠
格氏试剂
与HCN的加成 (碱催化)
(CH3)2C=O + HCN
-活泼H的反应 (1)烯醇化 (2) -卤代(卤仿反应) (3)醇醛缩合反应
,-不饱和醛酮
C
H
C=C–C=O
(1)碳碳双键的亲电加成
醛的氧化
(2)碳氧双键的亲核加成
(3)迈克尔加成
(一)亲核加成反应
(1)反应机理
碱催化的 反应机理
Nu:
-
Nu C O
-
C =O
H
+
Nu C OH
酸催化的 反应机理
(二)命名
1. 普通命名法
醛按氧化后生成的羧酸命名,酮看作是甲酮的衍生物。
CH3CH2CHO
CH2=CHCHO
丙醛
丙烯醛
O CH 3 CC H 2 C H 3
甲基乙基酮(甲 乙酮)
醛
C H 3C H C H 2C H O CH3
αβγδ… 标记取代基位置。 γ
C H =C H C H O
第二节 物理性质
沸点: 羰基具有偶极矩,增加了分子间的吸引力, 沸点比相应相对分子质量的烷烃高,但比醇低。 水溶性:醛酮的氧原子可以与水形成氢键,因此低 级醛酮能与水混溶。
第三节
化学反应
(一)亲核加成反应
(二)α-活泼氢引起的反应
(三)氧化和还原反应 (四)其它反应
醛酮的结构与反应性
亲核加成
O C H
反应特点:
1 碱性有利于反应,但反应不能在强碱性条 件下 进行。碱性将引发另外的反应。 能发生此反应的羰基化合物 所有的醛、甲基酮、八个碳以下的环酮
2
例如:
O HO HCN CN
1
2
O C C H 2C H 3
HCN
n o re a c tio n
OH
3
HCN CHO
