物理化学第二章3
物理化学知识点(全)
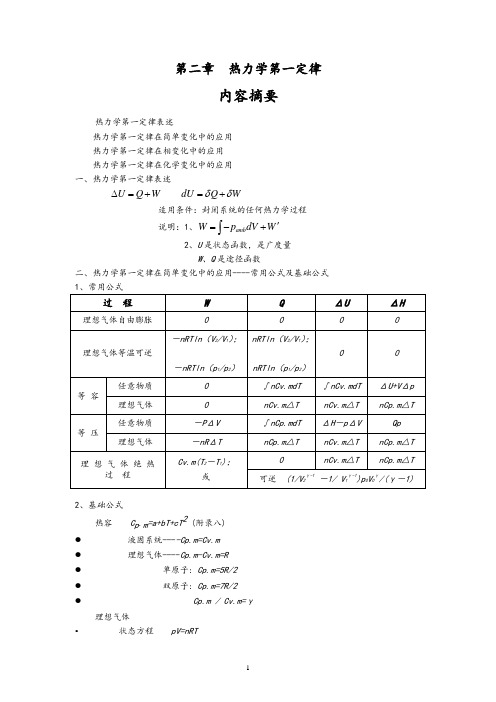
第二章热力学第一定律内容摘要热力学第一定律表述热力学第一定律在简单变化中的应用 热力学第一定律在相变化中的应用 热力学第一定律在化学变化中的应用 一、热力学第一定律表述U Q W ∆=+ dU Q W δδ=+适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+⎰2、U 是状态函数,是广度量W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 过 程WQΔUΔH理想气体自由膨胀理想气体等温可逆-nRTln (V 2/V 1); -nRTln (p 1/p 2) nRTln (V 2/V 1);nRTln (p 1/p 2)0 0等 容任意物质0 ∫nCv.mdT ∫nCv.mdT ΔU+V Δp 理想气体 0 nCv.m △T nCv.m △T nCp.m △T 等 压任意物质-P ΔV ∫nCp.mdT ΔH -p ΔV Qp 理想气体-nR ΔT nCp.m △TnCv.m △T nCp.m △T 理 想 气 体 绝 热过 程 Cv.m(T 2-T 1);或nCv.m △TnCp.m △T可逆 (1/V 2γ-1-1/ V 1γ-1)p 0V 0γ/(γ-1)2、基础公式热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ理想气体• 状态方程 pV=nRT• 过程方程 恒温:1122p V p V = • 恒压: 1122//V T V T = • 恒容: 1122/ / p T p T =• 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--=111122 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程1、 可逆相变化 Q p =n Δ相变H m W = -p ΔV无气体存在: W = 0有气体相,只需考虑气体,且视为理想气体ΔU = n Δ相变H m - p ΔV2、相变焓基础数据及相互关系 Δ冷凝H m (T) = -Δ蒸发H m (T)Δ凝固H m (T) = -Δ熔化H m (T) Δ凝华H m (T) = -Δ升华H m (T)(有关手册提供的通常为可逆相变焓)3、不可逆相变化 Δ相变H m (T 2) = Δ相变H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆;2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤;3.除可逆相变化,其余步骤均为简单变化计算.4.逐步计算后加和。
物理化学第二章

卡诺热机工作原理
高低温热源 脱离高低温热源
p A
绝 热 压 缩
D
高温热源T2
等温膨胀
低温热源T1 等温压缩
B
绝 热 膨 胀
C
V
p
A (p1V1)
U=0, Q2=-W1=RT2ln(V2/V1)
Q=0 W4= U=CV(T2-T1)
D (p4V4)
B (p2V2)
Q=0 W2= U=CV(T1-T2)
• 化学变化及自然界发生的一切过 程进行的方向及其限度
• 第二定律是决定自然界发展方向 的根本规律
水的流动
• 水自发流动的方向:
• 从地势高的地方流向低的地方 • 自发从低处流向高处是不可能的
• 水从长江源头流至东海,损失了势能, 放出了热能。
• 1m3水从沱沱河(5000m)流到崇明岛(0m): • 热量=势能=5×107J=13.9度电能
• 常见的热机如: 汽车, 飞机, 轮船, 火力发电机等等.
• 卡诺设计了一种理想热机-卡诺热机, 此热机在高温 热源和等温热源间工作, 其工作介质是理想气体, 整 个循环过程均不存在摩擦力, 卡诺热机的循环由两个 绝热过程和两个等温过程组成.
• 卡诺证明了在相同两热源间工作的热机, 以卡诺热机 的效率为最大, 其它任何热机的效率不可能超过卡诺 热机.
• 欲长江黄河的水倒流,除非能将损失的 热量收集起来,使之全部转化为功,并 还给河水。实际上这是作不到的。
热的传递
• 长江三峡工程可将水的势能转化成清 洁的电能,每年可节约5000万吨煤。
• 三峡的电能归根到底来源于何处?
•
太阳
• 阳光普照大地,给地球送来了 光和热。
• 热:因温差而传递的能量
物理化学第二章总结

第二章 主要公式及适用条件热力学第一定律dU = δQ + δW 或 ∆U = Q + W一.体积功WdV p W amb -=⎰或 dV p W amb -=δ 适用于任何系统、任何过程的体积功的计算。
1.自由膨胀过程(向真空膨胀): W = 02.恒外压过程: )(12V V p W amb --=3.恒容过程:4. 恒压过程: )(12V V p W --= 一定量理想气体恒压过程 T nR W ∆-=5.一定量理想气体恒温可逆过程:1221lnln p p nRT V V nRT W ==6.一定量理想气体绝热可逆过程W = ΔU = n C v.m (T 2-T 1) 或)11(1111211----=γγγγV V V p W(其中 γ = C p.m / C v.m 称为绝热指数 也称热容商。
)7.恒温恒压相变过程: W = - p (V β-V α )若β相为理想气体: W = - p V g = -nRT8.恒温恒压化学反应;且气体视为理想气体W = - R T(g ) (式中为反应计量系数,反应物为“-”,产物为“+”。
)二.热容热容定义 C = Q / ΔT = δQ / d TC v. m = δQ v / d T = (әU m / әT )vC p. m =δQ p / d T = (әH m /әT )p对理想气体 C p.m – C v.m = R单原子分子 C v.m = 3R /2 , C p.m = 5R / 2双原子分子 C v.m = 5R/2, C p.m =7R /2多原子分子 C v.m = 3 R , C p.m = 4 R三. 热1.封闭体系无非体积功恒容变温过程:dT nC Q T T m V V ⎰=21, 若常数=m V C ,,则)(12,T T nC Q m V V -=2.封闭体系无非体积功恒压变温过程: dT nC Q T T m p V ⎰=21,若常数=m p C ,,则)(12,T T nC Q m p p -=3.绝热过程及理想气体自由膨胀过程:Q = 04.恒温恒压无非体积功的相变过程:Q p = n ΔH m5.恒温恒压与恒温恒容化学反应 Q p 与Q v 关系:Q p –Q v = Δr H – Δr U = R T Δn或Q p.m –Q v.m = Δr H m – Δr U m = R T四.热力学能(内能):ΔU = Q + W1.一定量理想气体恒温过程或隔离体系任何过程 ΔU = 02.封闭体系无非体积功恒容变化或一定量理想气体任何过程dT nC U T T m V ⎰=∆21, 3.绝热过程:ΔU = W (Q =0)五.焓:定义: H = U + p V1. 封闭体系任何过程ΔH = ΔU + Δ(p V ) = ΔU + (p 2V 2 – p 2V 2 )2.封闭体系无非体积功的恒压变化或一定量理想气体任何状态变化过程dT nC H T T m p ⎰=∆21, 3.一定量理想气体恒温、实际气体节流膨胀及恒压无非体积功的绝热化学反应过程 ΔH = 0 。
物化上册第二章

• 焓的基本特征:状态函数; 绝对值未知;广度量。 • 单位: J 或 kJ。
• 焓变 H
微变 dH
积分式 H = U + (pV)
2.3.4 关系式 QV =U, Qp=H 的意义
• 应用 测定、计算U 和H 的热力学数据。
•热不是状态函数,而QV =U,Qp =H,表明
状态函数:从各方面确定系统状态的这些宏观量都称为状 态函数,如:温度、压力、体积 、质量、密度、组成等。 • 始态——系统变化前的(宏观)状态。 • 终态——系统变化后的(宏观)状态。
7
状态函数特点: ①状态函数与系统的状态相联系,当系统处于一定 状态时,系统的各状态函数有确定的值; ②系统的状态函数之间是相互联系的,如pV=nRT; ③系统由始态变到终态,状态函数的改变量只与变 化的始态和终态有关,与变化的途径无关。
13
2.1.4 功和热
系统和环境之间能量交换的方式有功、热、辐射。
1.热
系统和环境之间由于温度不同而传递的能量称为热, 用符号Q表示。 热力学规定:系统吸热,Q>0;系统放热,Q<0。
热不是系统本身具有的性质,因而不是状态函数, 不具有全微 分性质。系统经历了一过程后, 才能与环境交换热量; 无过程就无热量传
化学热力学 简介
热力学:研究系统变化过程中能量转化规律 (热和其它形式能量)的一门科学。(研究对象的宏观
性质,大量分子的集合体,只反映它们的平均行为,所得结论具有统计
意义,而不是个别分子的行为,不涉及物质微观结构,用宏观的研究方 法,以实验事实为基础)
化学热力学:把热力学的理论、规律以及研究方法用之 于研究化学现象就产生了化学热力学。化学热力学解决化
2.2.2 焦耳实验
大学物理化学 第二章 热力学第一定律3

373.15K , 101.325 KPa Δ vapHm H 2O ( L ) H 2O( g ) Δ vapHm
Q 蒸发=ΔvapHm(373.15K)=40.637 KJ· -1 mol
2. H m (T) 与温度T的关系
H m (T) f T, P
注:气体近似为理想气体
Q2= △H2 = ΔvapHm(373K)=40.64KJ △U2= Q 2+ W2 W20Pa 外(Vg-VL)=-PVg =-P 100℃ 恒温
101325Pa =37.5 KJ =- 100℃ 100℃nRT =-3.10 KJ 1 mol 玻璃泡 途径1 与途径2 具有相同的始末态 向真空 H O(g) △H1 = △H2= 40.64KJ △U1=△U2=37.5KJ 2
蒸发
101325Pa
101325Pa Vm(g) Vm(l)
100℃ 饱和液体 饱和蒸气 100℃
例:1 mol 100℃、 101325Pa的水密封在玻璃泡内,置于 恒温100℃的刚性真空箱中后敲碎,蒸发为100 ℃、 101325Pa的水蒸汽,计算整个过程的Q、W、△U、 △H 。已知100℃水的蒸发焓为40.64KJ。
§2-8反应热效应
热力学规定:反应在等温反应过程中放出或吸收 的热量称为该反应的热效应。 化学反应中常见有: 恒压反应热 QP=△rH
恒容反应热 QV=△rU
恒压反应热 QP=△rH ,可通过求算反应过程的焓变
△rH 得到反应的恒压热效应。
一 化学反应进度(extent of reaction) 1.反应计量式 一个化学反应方程式 aA+dD = gG+hH ,不仅表达了参加反应的 物质种类,也说明了发生1mol反应(1单位反应)时, 参加反应的每一种物质 B 的变化量。 按物理化学的习惯,将其表示为【末态-始态】
物理化学第二章3-1

1 3 但若写作: N 2 g H 2 g NH 3 g 2 2
1 3 则, ν N 2 , ν H 2 , ν NH 3 1 2 2
2. 反应进度 :
例2.6.1 在100 °C的恒温槽中有一容积恒定为 50 dm3 的真 空容器,容器内底部有一小玻璃瓶,瓶中有液体水 50 g。 现将 小瓶打破,水蒸发至平衡态,求过程的Q,W,U及H。 已知:100 °C时水的饱和蒸气压为101.325 kPa,在此条 件下水H2O的摩尔蒸发焓为40.668 kJ · -1 。 mol 解:由容器容积及100 °C下 水的饱和蒸气压,可求出蒸 发的水的物质的量为: pV n RT 101.325 103 50 10 3 mol 8.3145 373.15 1.633 mol
1 3 而对于另一种写法的反应: N 2 g H 2 g NH 3 g 2 2
= n(N2)/ (N2)= -1mol/(-0.5) = 2 mol; 所以,当提到反应进度时,必须要指明它对应于哪一个化 学反应方程式。
3. 摩尔反应焓
定义:
反应焓: 在一定的温度压力下,化学反应产物的焓与反应 物的焓之差。符号: r H
W3=ΔU3 =-5406 J ΔH3 =-9010 J Q3=0
T2=174.7K
§2.6 相变焓
相的定义: 系统内性质完全相同的均匀部分称为相。 相与相之间在指定条件下有明显的界面,在界面上宏观性质 的改变是飞跃式的。 气体:不论有多少种气体混合,只有一个气相。 液体:按其互溶程度可以组成一相、两相或三相共存。 固体:一般有一种固体便有一个相。两种固体粉末无论混合 得多么均匀,仍是两个相(固体溶液除外,它是单相) 例如:某种固体盐与其饱和水溶液及水蒸气共存,系统共有 气、液、固三相。
物理化学 02章_热力学第一定律(三)
因为 所以
p1V1 p2V2 K
p2V2 p1V1 nR(T2 T1) W= 1 1
绝热功的求算 (2)绝热状态变化过程的功
W U CV dT
T1
T2
= CV (T2 T1)
(设CV 与T 无关)
因为计算过程中未引入其它限制条件,所以
该公式适用于定组成封闭系统的一般绝热过程, 不一定是可逆过程。
Th
D(p4 ,V4 , TC )
C (p3 ,V3 , TC )
环境对系统所作的功如
O
Tc
DA曲线下的面积所示。
a
d
b
c
V
Carnot 循环
过程4:绝热可逆压缩
p
A(p1 ,V1 , Th ) B(p2 ,V2 , Th )
D( p4 ,V4 , TC ) A( p1,V1, Th )
Th
D(p4 ,V4 , TC )
表示经节流过程后,气体温度随压 力的变化率。
J-T是系统的强度性质。因为节流过程的 dp 0 ,
所以当:
J-T >0 J-T <0 J-T =0
经节流膨胀后,气体温度降低。 经节流膨胀后,气体温度升高。 经节流膨胀后,气体温度不变。
转化温度(inversion temperature)
Qc ' Tc W Th Tc
式中W表示环境对系统所作的功。
热泵
热泵的工作原理与致冷机相仿。
把热量从低温物体传到高温物体,使高温物体
温度更高。
热泵的工作效率等于:向高温物体输送的热与
电动机所做的功的比值。
热泵与致冷机的工作物质是氨、溴化锂(氟
物理化学各章小结
第一章 气体本章小结1.理想气体状态方程 pV =nRT pV m =RT pV =(m /M ) RT气体的密度 ρ =m /V =pM /(RT ) 2. 道尔顿分压定律 B p p =∑B B n RTp V =BB p x p= B B p x p = 3. 实际气体的液化和临界点实际气体在临界温度以下通过加压可以被液化。
理想气体则不能。
临界温度T c 是实际气体能被液化的最高温度,在临界温度时使气体液化所需要的最小压力叫临界压力p c 。
在描述实际气体液化的p -V 图上,临界温度和临界压力所对应的点称为临界点。
0cT p V ∂⎛⎫= ⎪∂⎝⎭ 220cT p V ⎛⎫∂= ⎪∂⎝⎭ 临界温度和临界压力时所对应的体积称为临界摩尔体积V m,c 。
临界温度、临界压力和临界摩尔体积统称为临界参数,各种实际气体的临界参数可以在各类物理化学数据手册中查得。
4. 实际气体的范德华方程范德华研究了实际气体与理想气体产生偏差的两个因素-分子本身占有体积和分子间存在作用力,由此引入两个校正项,得适用于1mol 气体的范德华方程为()2m m a p V b RT V ⎛⎫+-= ⎪⎝⎭适用于n mol 气体的范德华方程为()22an p V nb nRT V ⎛⎫+-= ⎪⎝⎭公式中的a 和b 称为范德华常数,可以通过气体的临界参数计算2227,648c c ccR T RT a b p p == 符合范德华方程的气体称为范德华气体,范德华气体的玻意尔温度为,00B m B T p pV a T p Rb →⎛⎫∂=⇒=⎪∂⎝⎭5. 压缩因子与压缩因子图m pV pV Z RT nRT ==Z 称为压缩因子,Z >1,气体较难压缩,Z <1,气体较易压缩,Z =1,还原为理想气体。
Z 值可由对比温度(/c T T τ=)和对比压力(/c p p π=)通过压缩因子图查得。
查得Z 值后可用上述方程求算实际气体的p -V -T 。
物理化学第二章
(2.2.1) )
对一微小变化
dS ≡
δ QR
T
(2.2.2) )
2.2.2 熵函数
对一可逆循环
∫ dS ≡ ∫
δQR
T
=0
(2.2.2) )
熵的定义式。 式(2.2.1)和(2.2.2)均为熵的定义式。 ) )均为熵的定义式 注意: 注意: 1) 熵是体系的状态函数。 是体系的状态函数 状态函数。 2) 熵与热温商不能混淆。Q/T的数值与过程有关, 热温商不能混淆 不能混淆。 的数值与过程有关, 的数值与过程有关 式中T 为环境温度。 式中 为环境温度 。 只有在可逆过程中两者才 发生联系。 为体系温度。 发生联系。 S = Q 可逆过程 的T 为体系温度。 ∆
2.2.4 熵增加原理 实际体系: 实际体系: —— 体系 环境 = 大孤立体系 体系+环境
环境视为无限大,其微小变化可当作可逆过程: 环境视为无限大,其微小变化可当作可逆过程: 可当作可逆过程
dS 环 = −
δQ
T环
dS −
δQ
T环
= dS 体系 + dS 环境 = dS 孤立 ≥ 0
>0 自发,不可逆 自发, =0 平衡,可逆 平衡,
δQ可逆
T
dS −
−
δQ实际
T
≥0
δQ实际
T环
≥0 或
dS −
δQ
T环
≥0
> 0 不可逆过程 = 0 可逆过程 < 0 不可能发生
δQ
T环 )→ II ≥ 0 I
或
∆S I → II − ∑ (
I
II
——克劳修斯不等式 克劳修斯不等式
2.2 热力学第二定律
【3】第二章 水的物理化学处理方法(3)
除盐
H+型阳离子交换柱 OH-型阳离子交换柱
6、离子交换法在处理工业废水中的应用
离子交换法近年来被广泛地应用于回收工业废 水中的有用物质和去除有毒物质。
【1】处理含铬废水 含铬废水是一种常见的废水,主要含有以 CrO42-和 Cr2O72-形态存在的六价铬以及少量的以Cr3+形态存在的 三价铬。经预处理后,可用阳树脂去除三价铬离子和其 他阳离子,用阴树脂去除六价铬离子,并可回收铬酸, 实现废水在生产中的循环使用。
再生剂的选择
• 强酸性阳离子交换树脂可用HCl或H2SO4等强酸及
NaCl、Na2SO4等再生。
• 弱酸性阳离子树脂可以用HCl、H2SO4等再生。
• 强碱性阴离子交换树脂可用NaOH等类强碱及NaCl
再生,
• 弱碱性阴离子树脂可以用NaOH、Na2CO3、
NaHCO3等再生。
5、离子交换法在给水处理中的应用
环 境 工 程 学
第二章 水的物理化学处理方法
水中的杂质:ห้องสมุดไป่ตู้
粗大颗粒物质:格栅、筛网、沉砂 按颗粒的大小 悬浮物质和胶体物质:沉淀、混凝 溶解性物质
第二章 水的物理化学处理方法
第三节 水中溶解物质的去除
一、水的软化和除盐
二、离子交换法
三、吸附法
四、膜分离技术
第三节 水中溶解物质的去除
天然水体 阳离子 阴离子 溶解气体 Ca2+、Mg2+、Na+、K+ CO32-、HCO3- 、SO42-、ClO2、CO2
3、水质对树脂交换能力的影响
1)悬浮物和油脂
• 废水中的悬浮物会堵塞树脂孔隙,油脂会包住树 脂颗粒,都会使交换能力下降。因此当这些物质 含量较多时,应进行预处理。预处理的方法有过 滤、吸附等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(
T p
)S
(
V S
)
p
S
p
(V )T (T )V
(4) dG SdT Vdp
(
S p
)T
(
V T
)
p
利用该关系式可将实验可测偏微商来代替那些不易直
接测定的偏微商。
31
上一内容 下一内容 回主目录
返回
2.7 热力学函数的一些重要关系式
(
T V
)S
(
p S
)V
(
T p
)S
(
V S
)
p
S (V )T
热力学第一定律导出了热力学能这个状态函 数,为了处理热化学中的问题,又定义了焓。
热力学第二定律导出了熵这个状态函数, 但用熵作为判据时,体系必须是孤立体系, 也就是说必须同时考虑体系和环境的熵变, 这很不方便。
通常反应总是在等温、等压或等温、等 容条件下进行,有必要引入新的热力学函数, 利用体系自身状态函数的变化,来判断自发 变化的方向和限度。
上一内容 下一内容 回主目录
返回
2.6 赫姆霍茨自由能和吉布斯自由能
•熵判据 •亥姆霍兹自由能判据 •吉布斯自由能判据
上一内容 下一内容 回主目录
返回
2.6 赫姆霍茨自由能和吉布斯自由能
1.对非孤立系统:
S
Q ,
T
S
Q
T
,
S
Q ,
T
表示不可逆; 表示不能进行; 表示平衡或可逆;
上一内容 下一内容 回主目录
(G)T , p,W ' 0 0, (G)T , p,W ' 0 0, (G)T , p,W ' 0 0,
表示自发; 表示不可能进行; 表示平衡;
上一内容 下一内容 回主目录
返回
2.6 赫姆霍茨自由能和吉布斯自由能
1.对于不同真实条件,用不同状态函数进行判断,
例如: H2O 373K , p ,l H2O 373K , p ,g
反之,1mol Cu与Zn SO4反应后, 系统的G= 210kJ, 即系统吉氏自 由能的增加了210kJ,则环境至少要作出210kJ的有效功,才能使 系统吉氏自由能的增加210kJ 。若环境作了211kJ的有效功,则系 统的吉氏自由能也只能增加210kJ。
若环境作了209kJ的有效功,而使系统的吉氏自由能的增加了 210kJ,这是不可能的。
返回
2.6 赫姆霍茨自由能和吉布斯自由能
即:1) 等温过程中,封闭体系对外所作的最大功等于 体系亥姆霍兹自由能的减少值,因此A可以表 示等温条件下体系的作功本领,所以把A 称为 功函(work function)。
2) 等温、等容、可逆过程中,体系对外所作的最 大非膨胀功等于体系亥姆霍兹自由能的减少值。
由第一、第二定律联合公式
dU - TdS We + W’
{< =
不可逆 可逆
}
dU
-TdS
+pdV
W’
{
< =
不可逆 可逆
}
因T,p 不变 d(U -TS + pV ) W’ {<=不 可可 逆逆 }
12
上一内容 下一内容 回主目录
返回
2.6 赫姆霍茨自由能和吉布斯自由能
定义 G U+pV-TS =H-TS =A+pV
2. 亥姆霍茨(Helmholtz)函数,又称功函
(Helmholtz Function, Helmholtz Free Energy)
等温过程
dU - TdS = d(U-TS) We + W’ {
< =
不可逆 可逆
}
定义:Helmholtz函数 AU-TS (也可用F表示)
记广义功 WT = We + W’
返回
2.6 赫姆霍茨自由能和吉布斯自由能
亥姆霍茨函数判据: 在等温、等容且W′=0时,只能自发 地向A 减小的方向进行, 直到ΔAT,V=0 时, 体系达到平衡
(ΔA)T,V < 0 (ΔA)T,V= 0
不可逆,自发过程 可逆,平衡
(ΔA)T,V > 0
不可能发生的过程
10
上一内容 下一内容 回主目录
返回
2.7 热力学函数的一些重要关系式
(1) dU TdS pdV 依据热力学第一定律有
dU = Qr+ W体 = Qr -pdV
根据热力学第二定律有 从而得到联合公式
dS δ Qr T
dU = TdS - pdV
(2) dH TdS Vdp
因为 H U pV
dH dU pdV Vdp
dA
WT
{
< =
不可可逆逆}
上一内容 下一内容 回主目录
H.von Helmh6oltz
返回
2.6 赫姆霍茨自由能和吉布斯自由能
等温可逆过程中体系所作的功(WT)在数 值上等于体系亥姆霍茨函数A的减少(绝对值), 所以把A称为功函。体系在等温过程中作的最 大功等于亥姆霍茨自由能A的减少(绝对值)。
能自发地向G 减小的方向进行, 直到ΔGT,p=0 时, 体系达到平衡。
(ΔG)T,P < 0
不可逆,自发过程
(ΔG)T,P= 0
可逆,平衡
(ΔG)T,P > 0
不可能发生的过程
15
上一内容 下一内容 回主目录
返回
2.6 赫姆霍茨自由能和吉布斯自由能
例如298K,pө时,1mol Zn与CuSO4反应后, 系统的G = –210kJ, 即系统吉氏自由能的减少了210kJ,则最多可以作出210kJ的有效 功,绝不能作出211 kJ的有效功来,但可以作小于210kJ的有重要关系式
热力学函数是状态函数,数学上具有全微分性质,
将上述关系式用到四个基本 公式中,就得到Maxwell关系式:
(1) dU TdS pdV (2) dH TdS Vdp (3) dA SdT pdV
( M y
)x
N ( x )y
( VT
)S
(
p S
)V
因为 G H TS
dG dH TdS SdT
dH TdS Vdp
所以 dG SdT Vdp
27
上一内容 下一内容 回主目录
返回
2.7 热力学函数的一些重要关系式
封闭体系的热力学基本方程
dU = TdS- pdV
dH = TdS + Vdp
dA = -SdT- pdV
dG = -SdT + Vdp
3 Maxwell 关系式
全微分的性质
设函数 z 的独立变量为x,y, z具有全微分性质
z z(x, y)
dz
(
z x
)
y
dx
(
z y
)
x
dy
Mdx
Ndy
M 和N也是 x,y 的函数
( M y
)x
2z , xy
(
N x
)
y
2 z xy
所以
M N ( y )x ( x )y
30
上一内容 下一内容 回主目录
(3) dA SdT pdV
(4) dG SdT Vdp
T
(
U S
)V
(
H S
)
p
p
(
U V
)S
(
A V
)T
从公式(2),(4)导出
V
(
H p
)S
(
G p
)T
从公式(3),(4)导出
A
G
S (T )V ( T ) p
29
上一内容 下一内容 回主目录
返回
2.7 热力学函数的一些重要关系式
上一内容 下一内容 回主目录
返回
2.6 赫姆霍茨自由能和吉布斯自由能
对等温、等容过程,dT=0, dV=0 (We=0), 则
dA W’
{
< =
不可逆 可逆
}
W’-最大有效功
可逆过程中,在定温定容条件下,系统 亥姆霍茨自由能的减少等于系统所做的最大 有用功(绝对值)
8
上一内容 下一内容 回主目录
The second law of thermodynamics
上一内容 下一内容 回主目录
返回
第二章:热力学第二定律
2.1 自然界过程的方向与限 度
2.2 热力学第二定律 2.3 卡诺循环与卡诺定律 2.4 熵 2.5 熵变求算
2.6 赫姆霍茨自由能和吉 布斯自由能
2.7 热化学函数的一些重 要关系式
若实际在等温、等压下发生,G=0,是可逆过程; 如果pe=0(真空蒸发),则要用S进行判断。 2.不可逆过程的逆过程不是不能进行,但必须借助 外力,即指不能自发进行。
3. 虽然亥姆霍兹函数是在等温等容条件下导出的, 但并不只有等温定容变化才有A,其它任意条件下 的A不再是系统所能做的最大有效功。
上一内容 下一内容 回主目录
dU TdS pdV
所以 dH TdS Vdp 26
上一内容 下一内容 回主目录
返回
2.7 热力学函数的一些重要关系式
(3) dA SdT pdV
因为 A U TS dA dU TdS SdT dU TdS pdV
所以 dA SdT pdV
(4) dG SdT Vdp
返回
2.6 赫姆霍茨自由能和吉布斯自由能
对等温、等容,无其它功的过程,则
dA 0
{
< =
不可可逆逆}
亥姆霍茨自由能减少原理:无其它功的封闭 体系,在等温等容的条件下,体系的亥姆霍 茨自由能在可逆过程中保持不变;在不可逆 过程中总是减少,减少到A最小时体系达到 平衡状态 。
